第3章 物质在水溶液中的行为 同步检测(含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第3章 物质在水溶液中的行为 同步检测(含解析)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 449.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 10:45:47 | ||
图片预览




文档简介
第3章 物质在水溶液中的行为 同步检测
一、单选题
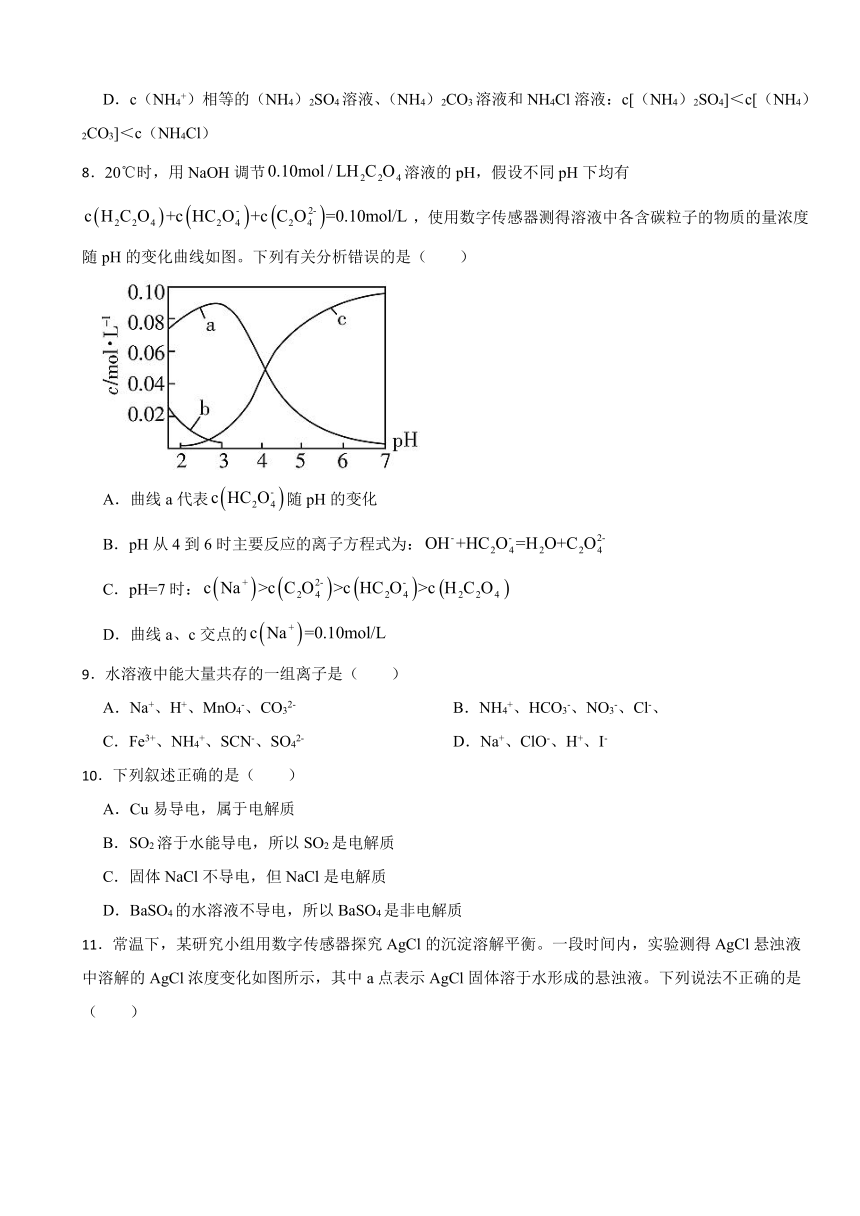
1.已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、、三种微粒的物质的量分数与溶液pH的关系如图所示。下列说法错误的是( )
A.向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
B.pH=4.2时,溶液中
C.在NaHSeO3溶液中,存在
D.常温下,亚硒酸的电离平衡常数Ka1=10-1.2
2.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的溶液中:Al3+、Cu2+、 、Cl-
B.中性溶液中:Al3+、 、Cl-、S2-
C.c(OH-)< 的溶液中:Na+、Ca2+、ClO-、
D.1mol·L-1的KNO3溶液中:H+、Fe2+、SCN-、
3.天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知K(CaCO3)=10-8.7,某溶洞水体中lgc(X)(X为HCO 、CO 或Ca2+)与pH变化的关系如下图所示。下列说法错误的是( )
A.曲线②代表CO
B.H2CO3的第二级电离常数为10-10.3
C.a=-4.35,b=-2.75
D.pH=10.3时,c(Ca2+)=10-7.6 mol·L-1
4.在透明溶液中能大量共存的一组离子是( )
A. 、Ba2+、Br-、 B.Cl-、S2-、Fe2+、H+
C.Na+、H+、 、 D.K+、Na+、 、
5.在25℃时,某NH4Cl溶液的pH为4,下列说法中正确的是( )
①溶液中c(H+) > c(OH-) 且 c(H+)·c(OH-)=1×10-14 ;
② 由水电离出的 c(H+)约为1×10-10 mol/L;
③ 溶液中c(Cl-) > c(NH4+) > c(H+) > c(OH-)
A.①② B.①③ C.②③ D.①②③
6.电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )
A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
B.常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者
D.常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸
7.下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB﹣)>c(H2B)>c(B2﹣)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA﹣)+c(OH﹣)+c(A2﹣)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
8.20℃时,用NaOH调节溶液的pH,假设不同pH下均有,使用数字传感器测得溶液中各含碳粒子的物质的量浓度随pH的变化曲线如图。下列有关分析错误的是( )
A.曲线a代表随pH的变化
B.pH从4到6时主要反应的离子方程式为:
C.pH=7时:
D.曲线a、c交点的
9.水溶液中能大量共存的一组离子是( )
A.Na+、H+、MnO4-、CO32- B.NH4+、HCO3-、NO3-、Cl-、
C.Fe3+、NH4+、SCN-、SO42- D.Na+、ClO-、H+、I-
10.下列叙述正确的是( )
A.Cu易导电,属于电解质
B.SO2溶于水能导电,所以SO2是电解质
C.固体NaCl不导电,但NaCl是电解质
D.BaSO4的水溶液不导电,所以BaSO4是非电解质
11.常温下,某研究小组用数字传感器探究AgCl的沉淀溶解平衡。一段时间内,实验测得AgCl悬浊液中溶解的AgCl浓度变化如图所示,其中a点表示AgCl固体溶于水形成的悬浊液。下列说法不正确的是( )
A.a点悬浊液中存在沉淀溶解平衡
B.图中b点可能滴加了溶液
C.图中c点后有黄色沉淀生成
D.由图可知:
12.25℃时,向1L 0.01的溶液中滴加盐酸或NaOH溶液,溶液中、、的对数值()与pH的关系如图所示。下列说法错误的是( )
A.适当升高温度﹐L点会右移
B.M点时,
C.随pH增加,先增大后减小
D.N点时,则溶液中
13.下列关于各图像的解释或结论正确的是( )
A.图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
B.图乙表示2SO2(g)+O2(g) 2SO3(g) △H<0的平衡常数K与温度和压强的关系
C.图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点
D.图丁表示反应 2SO2+O2 2SO3,t1 时刻降低温度符合图示变化
14.某溶液中可能存在Fe3+、Fe2+、I-、HCO3-、Cl-、NO3—六种离子中的几种。进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深。
据此可以推断,该溶液中一定大量存在的阴离子是( )
A.I- B.HCO3— C.Cl- D.NO3—
15.下列说法错误的是( )
A. 的溶液不一定呈碱性
B.中和pH和体积均相等的氨水、 溶液,所需 的物质的量相同
C.相同温度下,pH相等的盐酸、 溶液中, 相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则
16.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是 ( )
A.SiO2 B.Na2O C.FeCl2 D.AlCl3
二、综合题
17.
(1)氨气极易溶于水,氨气与水反应的化学方程式为 ;氨水显碱性的原因是 (用离子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水
B.纯水
C.少量浓硫酸
D.少量NaOH固体
E.少量Al2(SO4)3固体
①能使c(OH-)减少、c( )增大的是 (填字母,下同)。
②能使c(OH-)增大、c( )减少的是 。
③能使c(OH-)和c( )都增大的是 。
④能使c(OH-)和c( )都减少的是 。
18.I.人类能够有效利用氮气的主要途径是合成氨,生产化学肥料等。
完成下列填空:
(1)氮原子核外电子排布式为 ,其最外层有 种运动状态不同的电子;氮气的电子式为 ;氨气分子的空间构型是 。
(2)工业上常用醋酸亚铜氨溶液来吸收含有大量N2的高炉气体系中的CO,从而实现CO和N2的分离,反应的化学方程式如下:CH3COOCu(NH3)2 (aq) + CO(g) CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K= ;欲使K值变大,可采取的措施是 。
吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的适当处理措施有
(选填序号)。
a.适当升高温度
b.适当降低温度
c.增大压强
d.减小压强
(3)消除NH3对水体污染的重要方法是在一定条件下向水体中加入适量NaOH,这样能使NH3的脱除率增大,试用平衡移动原理解释其原因 。
(4)某研究小组用200mL 1.5mol/L K2CO3溶液吸收了3.36L 的CO2(标准状况)形成富液,碳酸钾溶液吸收CO2的离子反应方程式为 ,该富液中的溶质是 (填化学式),各离子的浓度关系正确的是 。
a.c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
b.3c(K+)=4 c(CO32-)+4 c(HCO3-)+4c(H2CO3)
c.c(K+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
19.CoCl2 6H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Mn(OH)2
开始沉淀 2.7 7.6 7.6 4.0 7.7
完全沉淀 3.7 9.6 9.2 5.2 9.8
③CoCl2 6H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为 。
(2)向浸出液中加入适量NaClO3目的是 。
(3)“加Na2CO3调pH至a”,a= ;过滤所得沉淀的主要成分为 (填化学式)。
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是 ,使用该萃取剂的最佳pH范围是 (填选项字母)
A.5.0﹣5.5 B.4.0﹣4.5 C.3.0﹣3.5 D.2.0﹣2.5
(5)实验操作“操作1”为 、 、过滤和减压烘干;制得的CoCl2 6H2O在烘干时需减压烘干的原因是 。
20.纯碱是重要化工产品,侯氏制碱法是由我国著名化学家侯德榜所创立,打破了欧美对制碱业的垄断。其简化工艺流程如下图:
回答下列问题:
(1)高温下“水煤气变换”可制取合成氨的原料气体 (填化学式);沉淀池中反应的化学方程式为 ,该反应是否符合复分解反应发生的条件? (填“是”或“否”)
(2)流程中的操作为 ;“副产品”为 (填化学式)。
(3)流程中可循环利用的物质有 。
(4)产品中可能混有杂质,设计实验检验 。
21.电镀废水、废渣的处理和综合利用体现了绿色化学的思想。
(1)Ⅰ.含铬电镀废水的处理可采用以下方法:
电解法。往废水中加入适量氯化钠,以铁为电极进行电解,电解过程中,阳极的电极反应式为 。
(2)沉淀法。含铬废水中存在平衡:Cr2O72-+H2O
2CrO42-+2H+.往废水中加入BaCl2,铬元素转化为铬酸钡(BaCrO4)沉淀,此过程中,还应加入NaOH,理由是 。
(3)Ⅱ.某工厂利用富含镍(Ni)的电镀废渣(含有Cu、Zn、Fe、Cr等杂质)制备NiSO4·6H2O.其生产流程如图所示
步骤①中加入H2SO4酸浸,Ni的浸取率随温度的升高如图所示,请你解释浸取率先上升后下降的原因: 。
(4)溶液C中溶质的主要成分是 。
(5)步骤②所用的Na2S的浓溶液有臭鸡蛋气味,配制该溶液的方法是 。
(6)请写出步骤⑤主要反应的离子方程式: 。
答案解析部分
1.【答案】C
【解析】【解答】A.向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中,加入的NaOH中和了溶液中的氢离子,促进了水的电离程度一直增大,A不符合题意;
B.由图知,pH=4.2时,溶液中HSeO和SeO的浓度相等,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(HSeO)+2c(SeO),B不符合题意;
C.,故在NaHSeO3溶液中,HSeO的电离程度大于水解程度,则c(SeO)>c(H2SeO3) ,C符合题意;
D.根据电离方程式知,,当pH=1.2时,HSeO和H2SeO3的浓度相等,因此Ka1=10-1.2,D不符合题意;
故答案为:C。
【分析】A.酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离;
B.根据电荷守恒分析;
D.根据计算。
2.【答案】A
【解析】【解答】A.澄清透明的溶液中:Al3+、Cu2+、 、Cl-之间及与所在环境中的微粒之间,都不发生反应,它们能大量共存,A符合题意;
B.Al3+、S2-在水溶液中能发生双水解反应,生成Al(OH)3沉淀和H2S气体,B不符合题意;
C.c(OH-)< 的溶液中,c(H+)> ,溶液呈酸性,ClO-会转化为HClO,不能大量存在,C不符合题意;
D.1mol·L-1的KNO3溶液中:H+、Fe2+、 会发生氧化还原反应,D不符合题意;
故答案为:A。
【分析】依据离子之间不反应生成气体、沉淀、弱电解质或络合物或发生氧化还原反应、双水解反应的就能共存,以此解答该题。
3.【答案】C
【解析】【解答】A.根据分析,曲线②代表CO ,故A说法符合题意;
B.电离平衡常数只受温度的影响,曲线①和②交点代表此时c(CO )= c(HCO ),即Ka2=c(H+)=10-10.3,故B说法符合题意;
C.曲线②和曲线③交点,说明c(CO )= c(Ca2+),根据Ksp= c(Ca2+)·c(CO ),推出c(CO )= =10-4.35,即a=-4.35,根据电离平衡常数Ka2= ,解得c(HCO )=10-2.65,即b=-2.65,故C说法不符合题意;
D.pH=10.3时,c(CO )=10-1.1mol/L,根据Ksp= c(Ca2+)·c(CO ),c(Ca2+)=10-7.6mol/L,故D说法符合题意;
故答案为C。
【分析】A.根据图象可知,横坐标代表pH,随着pH增大,碱性增强,c(HCO )、c(CO )增大,先生成,再生成,曲线①代表,曲线②代表,因为碳酸钙是难溶物,因此,随着c(CO )增大,溶液中c(Ca2+)减小,推出曲线③代表Ca2+,据此分析作答即可。
B.选择曲线①和②交点,利用Ka2= 计算。
C.选择曲线②和曲线③交点,根据Ksp= c(Ca2+)·c(CO )和Ka2= 计算
D.根据Ksp= c(Ca2+)·c(CO )计算。
4.【答案】D
【解析】【解答】A.Ba2+、 反应生成碳酸钡沉淀,不能大量共存,A与题意不符;
B.S2-、H+反应生成硫化氢气体,亚铁离子与硫离子生成硫化亚铁,不能大量共存,B与题意不符;
C.H+、 反应生成二氧化碳气体,不能大量共存,C与题意不符;
D.K+、Na+、 、 之间不反应,能大量共存,D符合题意;
故答案为D。
【分析】根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此解答该题。
5.【答案】B
【解析】【解答】①25℃时,某NH4Cl溶液的pH为4,则溶液中c(H+)>c(OH-),温度不变,水的离子积常数不变,所以c(H+)×c(OH-)=1×10-14,①符合题意;
②强酸弱碱盐溶液中氢离子为水电离出的氢离子,氯化铵为强酸弱碱盐,所以溶液中水电离出的氢离子浓度为1×10-4mol/L,②不符合题意;
③溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)>c(NH4+),盐类水解程度较小,所以c(NH4+)>c(H+),则溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),③符合题意;
综上,上述说法正确的是①③,B符合题意;
故答案为:B
【分析】①NH4Cl溶液中存在NH4+的水解,任何溶液中都存在c(H+)×c(OH-)=Kw;
②NH4Cl溶液中的H+都来自于水电离产生;
③结合溶液中NH4+的水解和H2O的电离分析离子浓度大小关系;
6.【答案】C
【解析】【解答】A.Na2CO3、NaHCO3的水溶液中都存在的离子有:Na+、CO32-、HCO3-、H+、OH-,其所含离子种类相同,A不符合题意;
B.两溶液混合后,所得为CH3COONa溶液,溶液中CH3COO-水解,使得溶液显碱性,故可得关系式:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B不符合题意;
C.NH4HSO4溶液中的H+会抑制NH4+的水解,故NH4HSO4溶液中c(NH4+)较大,C符合题意;
D.常温下,水电离产生的c(H+)=10-7 mol·L-1,某溶液中由水电离出的c(H+)=10-5 mol·L-1>10-7 mol·L-1,说明水的电离受到促进,则该溶液应为含有弱碱阳离子的溶液,D不符合题意;
故答案为:C
【分析】A.根据Na2CO3、NaHCO3的电离水解分析;
B.混合后所得溶液为CH3COONa,根据CH3COO-的水解分析;
C.根据NH4+的水解程度进行分析;
D.根据影响水电离因素进行分析;
7.【答案】D
【解析】【解答】解:A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合得到醋酸、氯化钠和少量HCl,溶液中离子浓度大小为c(Cl﹣)>c(Na+)>c(H+)>c(OH﹣),故A错误;
B.0.1 mol/L pH为4的NaHB溶液中HB﹣离子电离大于其水解,微粒浓度大小为:c(HB﹣)>c(B2﹣)>c(H2B),故B错误;
C.在NaHA溶液中一定存在电荷守恒:c(Na+)+c(H+)=c(HA﹣)+c(OH﹣)+2c(A2﹣),故C错误;
D.铵根离子水解,(NH4)2SO4中含有2个铵根离子,所以铵根离子浓度最大,(NH4)2 CO3中含有2个铵根离子,碳酸根离子和铵根离子相互促进水解,NH4Cl是强酸弱碱盐,铵根离子能水解但较弱,所以当它们物质的量浓度相同时,c(NH4+)大小顺序为c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl),所以如果c(NH4+)相同,电离出铵根离子浓度越多的其物质的量浓度越小,所以当c(NH4+)相同时,物质的量浓度由大到小的顺序为c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl),故D正确;
故选D.
【分析】A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合得到醋酸、氯化钠和少量HCl;
B.0.1 mol/L pH为4的NaHB溶液中HB﹣离子电离大于其水解;
C.在NaHA溶液中一定有电荷守恒,阴阳离子所带电荷总数相同;
D.氢离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,电离出铵根离子浓度越多的其物质的量浓度越小,据此判断.
8.【答案】D
【解析】【解答】A.曲线a的浓度变化先增大后减小,代表浓度随pH的变化,A不符合题意;
B.从图象可知pH从4到6,主要发生的反应是转化为,离子方程式为:OH- += H2O +,故B不符合题意;
C.pH = 7时c(OH )=c(H+),根据电荷守恒和溶液呈中性可得: +2=c(Na+),则 > >c(H2C2O4),C不符合题意;
D.在曲线a、c交界点有:等于c(H2C2O4),c(H+)+c(Na+)=c(OH-)+2+ = c(OH-)+0.1+ - c(H2C2O4),所以c(H+)+c(H2C2O4) +c(Na+)=c(OH-)++0.1,若c(Na+)=0.1mol/L,则溶液中溶质为NaHC2O4,电离大于水解,则大于c(H2C2O4),所以要使等于c(H2C2O4),则氢氧化钠用量要减少,即c(Na+)<0.1mol/L,D符合题意;
故答案为:D。
【分析】在解答水解和电离图像问题时应该注意下列几点:1、横轴坐标和纵坐标含有;2、曲线斜率或者趋势;3、曲线上特殊点,如起点、终点、交点和拐点等;4.充分利用质量守恒和电荷守恒等。
9.【答案】B
【解析】【解答】A.H+与CO32-要发生离子反应,生成水和CO2,不能大量共存,故A不符合题意;
B.NH4+、HCO3-、NO3-、Cl-在同一溶液中彼此间不发生离子反应,可大量共存,故B符合题意;
C.Fe3+与SCN-能发生离子反应,得到红色溶液,故C不符合题意;
D.ClO-与H+发生离子反应生成弱酸HClO,不能大量共存,故D不符合题意;
答案为B。
【分析】根据离子反应发生的条件进行判断即可。
10.【答案】C
【解析】【解答】A.Cu为单质,因此既不是电解质,也不是非电解质,A不符合题意;
B.SO2溶于水的过程中发生反应:SO2+H2O=H2SO3,起导电作用的是H2SO3,而不是SO2,因此SO2属于非电解质,B不符合题意;
C.固体NaCl中不存在可自由移动的离子,因此固体NaCl不导电,但NaCl的水溶液可导电,且NaCl属于化合物,因此NaCl为电解质,C符合题意;
D.BaSO4的水溶液中几乎不含可自由移动的离子,因此BaSO4溶液不导电,但熔融状态的BaSO4含有可自由移动的离子,能导电,因此BaSO4属于电解质,D不符合题意;
故答案为:C
【分析】此题是对电解质、非电解质定义的考查,结合电解质、非电解质的概念进行分析即可。电解质是指在水溶液或熔融状态下能导电的化合物;非电解质是指在水溶液和熔融状态下都不能导电的化合物。
11.【答案】D
【解析】【解答】A.AgCl的悬浊液中存在沉淀溶解平衡:AgCl(s)
Ag+(aq)+Cl-(aq),A不符合题意;
B.Ksp(AgCl)=c(Ag+)·c(Cl-),b点后溶解的AgCl变少,说明b点后AgCl沉淀溶解平衡逆向移动,故b点滴加的可能是硝酸银溶液,B不符合题意;
C.c点滴加KI溶液后,氯离子浓度升高然后达到一个比起始时略高的值,则说明此时溶液中银离子浓度减小,而部分银离子转化为碘化银沉淀,因此c点后有黄色沉淀生成,C不符合题意;
D.由C选项的分析,c点后产生了碘化银,故应有
,D符合题意;
故答案为:D。
【分析】A.难溶物中存在沉淀溶解平衡:AgCl(s)
Ag+(aq)+Cl-(aq)。注意化学式或离子之后要表明状态。
B.由图可知,b点之后溶解的AgCl变少,说明沉淀溶解平衡逆向移动。加入AgNO3溶液,会使c(Ag+)增大,利于平衡逆向移动。
C.c点之后溶解的AgCl变多,说明沉淀溶解平衡正向移动。加入KI溶液,I-会与Ag+结合生成AgI黄色沉淀,使得c(Ag+)减小,利于平衡右移。
D.根据C项分析,AgI比AgCl的溶解度小,说明Ksp(AgCl)>Ksp(Agl)。
12.【答案】A
【解析】【解答】A. , L点时,=,则,电离吸热,适当升高温度﹐促进电离,电离平衡常数增大,则增大、pH减小,L点会左移,A符合题意;
B. M点时,=,, ,,按定义,则,B不符合题意;
C. 随pH增加,,温度不变则KW、Ka1均不变,反应过程中先增大、后减小,则先增大后减小,C不符合题意;
D. 溶液呈电中性,,,N点时,则,则,原溶液为1L 0.01的溶液,由物质守恒知,溶液中,D不符合题意;
故答案为:A。
【分析】H2A溶液中滴加NaOH溶液,先生成HA-后生成A2-, 不断减小, 先增大后减小, 不断增大,则曲线a为的变化,曲线b为的变化,曲线c为的变化,据此解答。
13.【答案】D
【解析】【解答】A.醋酸是弱酸,部分电离,pH=3的醋酸溶液比pH=11的NaOH溶液浓度大的多,a点时二者等体积反应,醋酸过量,溶液呈酸性,A不符合题意;
B.平衡常数K只与温度有关,和压强无关,B不符合题意;
C.增大氢气的浓度,提高氮气的转化率,所以随H2起始体积分数增大,N2的转化率增大,即a点N2的转化率小于b点,C不符合题意;
D.降低体系温度,正逆反应速率都减小,平衡向正反应方向移动,与图象相符,D符合题意;
故答案为:D
【分析】A.pH=3的醋酸和pH=11的NaOH等体积混合后,溶液显酸性;
B.结合温度、压强对平衡移动的影响分析;
C.结合浓度对平衡移动的影响分析;
D.结合温度对反应速率的影响分析;
14.【答案】D
【解析】【解答】①取少量溶液滴加KSCN溶液,溶液呈血红色,一定含Fe3+;则I-、HCO3-与其反应,一定不能存在;②另取少量原溶液滴加盐酸,溶液的棕黄色加深,则含Fe2+、NO3-,在酸性条件下发生氧化还原反应使Fe3+浓度增大,即一定含Fe3+、Fe2+、NO3-,一定不含I-、HCO3-,可能含Cl-,则溶液里一定含有的阴离子为NO3-,故答案为D。
故答案为:D。
【分析】硝酸能够将二价铁氧化成三价。
15.【答案】B
【解析】【解答】A. 温度影响水的电离,则pH>7的溶液不一定呈碱性;溶液酸碱性与溶液中氢离子、氢氧根离子浓度有关,当c(H+)B.pH相同的氨水和 溶液,氨水的浓度更大,所以中和pH和体积均相等的氨水、 溶液,氨水所需 的物质的量更大,故B符合题意;
C.pH相同说明两种溶液中c(H+)相同,相同温度下Kw相同,Kw= c(H+)·c(OH-),溶液中氢离子浓度相同说明氢氧根浓度相同,故C不符合题意;
D. 氨水和盐酸反应后的溶液中存在电荷守恒:c(OH-)+c(Cl-)=c(H+)+c(NH4+),溶液呈中性则c(H+)=c(OH-),所以 ,故D不符合题意;
故答案为B。
【分析】A.考查溶液的酸碱性,需要考虑温度
B.氨水是弱电解质,氢氧化钠是强电解质
C.PH相同,氢离子离子浓度相同
D.根据电荷守恒,显中性即可求出
16.【答案】D
【解析】【解答】A.加入二氧化硅,不反应,故A不符合题意
B.加入氧化钠,与水反应生成氢氧化钠,则氢氧根与碳酸氢根反应结合钡离子生成碳酸钡沉淀, 但无气体生成,故不符合题意
C.既无沉淀生成,又无气体生成,故C不符合题意
D.铝离子和碳酸氢根发生双水解,故既有沉淀生成又有气体生成,故D符合题意
故答案为:D
【分析】Al3++3HCO3-=3CO2+Al(OH)3,故既有沉淀又有气体
17.【答案】(1)NH3+H2O NH3·H2O;NH3·H2O +OH-
(2)CE;D;A;B
【解析】【解答】(1)氨气与水反应生成NH3·H2O,方程式为NH3+H2O NH3·H2O;NH3·H2O为弱电解质,可电离出OH-,溶液呈碱性,电离方程式为NH3·H2O NH4++OH-。
(2)氨水中存在电离平衡:NH3·H2O NH4++OH-,则①若使c(OH-)减少、c(NH4+)增大可加入与OH-反应的微粒,如硫酸中的H+能中和OH-,硫酸铝溶液中Al3+与OH-生成Al(OH)3沉淀,使电离平衡右移,c(NH4+)增大,
故答案为:CE;②若c(OH-)增大、c(NH4+)减少,可加入碱,如NaOH,
故答案为:D;③加入浓氨水,可使c(OH-)和c(NH4+)都增大,
故答案为:A;④稀释促进电离,溶液体积增加的更多,能使c(OH-)和c(NH4+)都减少,
故答案为:B。
【分析】此题考查弱电解质的电离的影响因素,根据化学平衡的影响来类别进行判断。电离方程式的书写时注意强弱电解质的判断。
18.【答案】(1)1s22s22p3;5;;三角锥型
(2)[c(CH3COOCu(NH3)2·CO)]/[c(CO)]·[c(CH3COOCu(NH3)2)];降低温度;ad
(3)氨气在水中存在如下平衡:NH3+H2O NH3 H2O NH4++OH﹣,当加入NaOH后,c(OH﹣)浓度增大,平衡逆向移动,故有利于氨的脱除II.为实现CO2减排,合成氨工厂采用苯菲尔法脱碳。该方法是用碳酸钾溶液为吸收剂捕集混合气中的CO2得到富液,再高温加热富液使之分解释放出CO2 ,正常情况下再生的二氧化碳气体体积分数可达98.5%以上。
(4)CO32-+ CO2 + H2O → 2HCO3-;KHCO3和K2CO3;a b
【解析】【解答】(1)氮原子核外电子数为7,基态原子核外电子排布为1s22s22p3;其最外层有5种运动状态不同的电子;氮气的电子式为 ;氨气分子中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3杂化,其空间构型是三角锥型;
(2)反应CH3COOCu(NH3)2 (aq) + CO(g) CH3COOCu(NH3)2·CO(aq) + Q(Q>0),的化学平衡常数表达式K=[c(CH3COOCu(NH3)2·CO)]/[c(CO)]·[c(CH3COOCu(NH3)2)];该反应为放热反应,升高温度平衡逆向移动,K值变小,故欲使K值变大,可采取的措施是降低温度;反应CH3COOCu(NH3)2 (aq) + CO(g) CH3COOCu(NH3)2·CO(aq) + Q(Q>0)是气体体积缩小的放热反应, a.适当升高温度平衡向吸热反应方向进行,则升温平衡逆向进行,可以重新生成醋酸亚铜氨,故符合题意;
b.适当降低温度平衡向放热反应方向进行,不能重新生成醋酸亚铜氨,故不符合题意;
c.增大压强平衡向气体体积减小的方向进行,不能重新生成醋酸亚铜氨,故不符合题意;
d.减小压强平衡向气体体积增大的方向进行,可以重新生成醋酸亚铜氨,故符合题意。
故答案为:ad;
(3)消除NH3对水体污染的重要方法是在一定条件下向水体中加入适量NaOH,氨气在水中存在如下平衡:NH3+H2O NH3 H2O NH4++OH﹣,当加入NaOH后,c(OH﹣)浓度增大,平衡逆向移动,故有利于氨的脱除,使NH3的脱除率增大;
(4)碳酸钾溶液吸收CO2生成碳酸氢钾,反应的离子反应方程式为CO32-+ CO2 + H2O = 2HCO3-,富液中的溶质是KHCO3和K2CO3,a.根据电荷守恒有c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-),故符合题意;
b.200mL 1.5mol/L K2CO3溶液吸收了3.36L 的CO2(标准状况),n(K+)=0.2L 1.5mol/L 2=0.6mol,c(C)=0.3mol+0.15mol=0.45mol,根据物料守恒有3c(K+)=4 c(CO32-)+4 c(HCO3-)+4c(H2CO3),故符合题意;
c.根据反应可知,溶质为KHCO3和K2CO3,水解是微弱的,则c(K+)>c(HCO3-)>c(CO32-) >c(OH-)>c(H+),故不符合题意。
故答案为:a b。
【分析】(2)根据化学平衡常数的定义书写表达式,根据反应方程式的特点分析影响化学平衡移动的条件即可。
19.【答案】(1)Fe2O3+Na2SO3+4HCl=2FeCl2+Na2SO4+2H2O
(2)将Fe2+氧化为Fe3+,易于除去铁元素
(3)5.2;Fe(OH)3、Al(OH)3
(4)除去溶液中的Mn2+;C
(5)蒸发浓缩;冷却结晶;降低烘干温度,防止产品分解
【解析】【解答】含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,然后过滤,向滤液中加入萃取剂,将锰离子萃取,调节溶液PH在3.0—3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,萃取后的溶液中主要含有CoCl2,为得到CoCl2 6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品。(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为Fe2O3+Na2SO3+4HCl=2FeCl2+Na2SO4+2H2O;(2)向浸出液中加入适量NaClO3目的是将Fe2+氧化为Fe3+,易于除去铁元素;(3) “加Na2CO3调pH至a”,a=5.2,保证铝离子沉淀完全,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以沉淀成分为:Fe(OH)3、Al(OH)3;(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;故答案为:除去溶液中的Mn2+;C ;(5)实验操作“操作1”为蒸发浓缩、冷却结晶、过滤和减压烘干;根据CoCl2 6H2O的组成分析,造成产品中CoCl2 6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大或结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。
【分析】(1)氧化铁和亚硫酸钠在盐酸的条件下反应生成氯化亚铁、硫酸钠和水;
(2)根据铁离子和亚铁离子生成沉淀的条件可知,将亚铁离子氧化为铁离子更方便除去铁元素,所以氯酸钠的作用是将亚铁离子氧化为铁离子;
(3)根据氢氧化铝沉淀的pH环境可知,需要将pH调至5.2才可以将铝离子全部沉淀,此时得到的沉淀还有氢氧化铁;
(4)向滤液中加入萃取剂的目的是除去锰离子,此时pH在3.0~3.5之间;
(5)将溶液讲过萃取操作时候要进行的操作有蒸发浓缩、冷却结晶;制得的CoCl2 6H2O在烘干时需减压烘干的原因是可以降低烘干温度,防止产品分解。
20.【答案】(1);;是
(2)过滤;
(3)、分离出副产品后的母液(或或或)
(4)取少量产品于试管中,加入足量稀酸化,再加入少量溶液,有白色沉淀,则含有;无白色沉淀,则不含。
【解析】【解答】(1)工艺流程第一步是一氧化碳和高温水蒸气反应生成二氧化碳和氢气,可以制合成氨的原料气,第三步氨气先通入沉淀池中饱和食盐水,再通入二氧化碳,生成碳酸氢钠固体和氯化铵,反应方程式为,该反应有反应物相互交换成分,并有固体析出,符合复分解反应的条件,故答案为;,是;
(2)流程中的操作为过滤;“副产品”为,故答案为过滤 ;
(3)从流程中可知,二氧化碳可循环利用,分离出副产品后的母液可循环利用,答案为、分离出副产品后的母液(或或或);
(4)产品中可能混有杂质,设计实验检验氯化钠是否存在。取少量产品于试管中,加入足量稀酸化,再加入少量溶液,有白色沉淀,则含有;无白色沉淀,则不含。故答案为取少量产品于试管中,加入足量稀酸化,再加入少量溶液,有白色沉淀,则含有;无白色沉淀,则不含。
【分析】流程第一步是一氧化碳和高温水蒸气反应生成二氧化碳和氢气,然后分离,第二步氢气与氮气反应合成氨气,第三步氨气先通入饱和食盐水,再通入二氧化碳,生成碳酸氢钠固体和氯化铵,第四步,过滤,对碳酸氢钠进行煅烧分解生成碳酸钠。
21.【答案】(1)Fe-2e-=Fe2+
(2)中和H+,促使上述平衡右移,产生BaCrO4沉淀
(3)温度升高,反应速率加快,浸取率上升;到一定程度后,升高温度,促进Ni2+水解,浸取率反而下降
(4)Na2SO4
(5)将Na2S固体溶于浓NaOH溶液中,加水稀释至所需的浓度
(6)Ni2++ CO32-=NiCO3↓
【解析】【解答】Ⅰ.(1)以铁为电极进行电解氯化钠溶液,阳极是铁失电子生成亚铁离子,阳极反应式为Fe-2e-=Fe2+;(2)加入NaOH可以中和H+,促使上述平衡右移,产生BaCrO4沉淀;Ⅱ.(3)温度升高,反应速率加快,浸取率上升;到一定程度后,升高温度,促进Ni2+水解,浸取率反而会下降;(4)根据流程图可知,溶液C中主要的阳离子是Na+、主要的阴离子是SO42-,所以主要成分是Na2SO4;(5)Na2S易水解,配制该溶液的方法是:将Na2S固体溶于浓NaOH溶液中,加水稀释至所需的浓度;(6)步骤⑤是硫酸镍与碳酸钠反应生成NiCO3沉淀和硫酸钠,反应离子方程式是Ni2++ CO32-=NiCO3↓。
【分析】Ⅰ.(1)以铁为电极进行电解氯化钠溶液,阳极是铁失电子生成亚铁离子;(2)加入NaOH中和氢离子,可以使Cr2O72-+H2O 2CrO42-+2H+平衡正向移动;Ⅱ.(3)温度升高,反应速率加快;到一定程度后,升高温度,促进Ni2+水解;(4)根据流程图,溶液C中的阳离子是Na+、阴离子是SO42-;(5)Na2S的浓溶液有臭鸡蛋气味,说明Na2S易水解,配制该溶液时要抑制其水解;(6)步骤⑤是硫酸镍与碳酸钠反应生成NiCO3沉淀和硫酸钠。
一、单选题
1.已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、、三种微粒的物质的量分数与溶液pH的关系如图所示。下列说法错误的是( )
A.向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
B.pH=4.2时,溶液中
C.在NaHSeO3溶液中,存在
D.常温下,亚硒酸的电离平衡常数Ka1=10-1.2
2.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的溶液中:Al3+、Cu2+、 、Cl-
B.中性溶液中:Al3+、 、Cl-、S2-
C.c(OH-)< 的溶液中:Na+、Ca2+、ClO-、
D.1mol·L-1的KNO3溶液中:H+、Fe2+、SCN-、
3.天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知K(CaCO3)=10-8.7,某溶洞水体中lgc(X)(X为HCO 、CO 或Ca2+)与pH变化的关系如下图所示。下列说法错误的是( )
A.曲线②代表CO
B.H2CO3的第二级电离常数为10-10.3
C.a=-4.35,b=-2.75
D.pH=10.3时,c(Ca2+)=10-7.6 mol·L-1
4.在透明溶液中能大量共存的一组离子是( )
A. 、Ba2+、Br-、 B.Cl-、S2-、Fe2+、H+
C.Na+、H+、 、 D.K+、Na+、 、
5.在25℃时,某NH4Cl溶液的pH为4,下列说法中正确的是( )
①溶液中c(H+) > c(OH-) 且 c(H+)·c(OH-)=1×10-14 ;
② 由水电离出的 c(H+)约为1×10-10 mol/L;
③ 溶液中c(Cl-) > c(NH4+) > c(H+) > c(OH-)
A.①② B.①③ C.②③ D.①②③
6.电解质溶液有许多奇妙之处,你只有深入思考,才能体会到它的乐趣。下列关于电解质溶液的叙述中正确的是( )
A.Na2CO3、NaHCO3两种盐溶液中,离子种类不相同
B.常温下,1 mol·L-1的CH3COOH溶液与1 mol·L-1的NaOH溶液等体积混合后,所得混合液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH4+)前者小于后者
D.常温下,某溶液中由水电离出的c(H+)=10-5 mol·L-1,则此溶液可能是盐酸
7.下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB﹣)>c(H2B)>c(B2﹣)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA﹣)+c(OH﹣)+c(A2﹣)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
8.20℃时,用NaOH调节溶液的pH,假设不同pH下均有,使用数字传感器测得溶液中各含碳粒子的物质的量浓度随pH的变化曲线如图。下列有关分析错误的是( )
A.曲线a代表随pH的变化
B.pH从4到6时主要反应的离子方程式为:
C.pH=7时:
D.曲线a、c交点的
9.水溶液中能大量共存的一组离子是( )
A.Na+、H+、MnO4-、CO32- B.NH4+、HCO3-、NO3-、Cl-、
C.Fe3+、NH4+、SCN-、SO42- D.Na+、ClO-、H+、I-
10.下列叙述正确的是( )
A.Cu易导电,属于电解质
B.SO2溶于水能导电,所以SO2是电解质
C.固体NaCl不导电,但NaCl是电解质
D.BaSO4的水溶液不导电,所以BaSO4是非电解质
11.常温下,某研究小组用数字传感器探究AgCl的沉淀溶解平衡。一段时间内,实验测得AgCl悬浊液中溶解的AgCl浓度变化如图所示,其中a点表示AgCl固体溶于水形成的悬浊液。下列说法不正确的是( )
A.a点悬浊液中存在沉淀溶解平衡
B.图中b点可能滴加了溶液
C.图中c点后有黄色沉淀生成
D.由图可知:
12.25℃时,向1L 0.01的溶液中滴加盐酸或NaOH溶液,溶液中、、的对数值()与pH的关系如图所示。下列说法错误的是( )
A.适当升高温度﹐L点会右移
B.M点时,
C.随pH增加,先增大后减小
D.N点时,则溶液中
13.下列关于各图像的解释或结论正确的是( )
A.图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
B.图乙表示2SO2(g)+O2(g) 2SO3(g) △H<0的平衡常数K与温度和压强的关系
C.图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点
D.图丁表示反应 2SO2+O2 2SO3,t1 时刻降低温度符合图示变化
14.某溶液中可能存在Fe3+、Fe2+、I-、HCO3-、Cl-、NO3—六种离子中的几种。进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深。
据此可以推断,该溶液中一定大量存在的阴离子是( )
A.I- B.HCO3— C.Cl- D.NO3—
15.下列说法错误的是( )
A. 的溶液不一定呈碱性
B.中和pH和体积均相等的氨水、 溶液,所需 的物质的量相同
C.相同温度下,pH相等的盐酸、 溶液中, 相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则
16.某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是 ( )
A.SiO2 B.Na2O C.FeCl2 D.AlCl3
二、综合题
17.
(1)氨气极易溶于水,氨气与水反应的化学方程式为 ;氨水显碱性的原因是 (用离子方程式表示)。
(2)在6份0.01 mol·L-1的氨水中分别加入下列物质:
A.浓氨水
B.纯水
C.少量浓硫酸
D.少量NaOH固体
E.少量Al2(SO4)3固体
①能使c(OH-)减少、c( )增大的是 (填字母,下同)。
②能使c(OH-)增大、c( )减少的是 。
③能使c(OH-)和c( )都增大的是 。
④能使c(OH-)和c( )都减少的是 。
18.I.人类能够有效利用氮气的主要途径是合成氨,生产化学肥料等。
完成下列填空:
(1)氮原子核外电子排布式为 ,其最外层有 种运动状态不同的电子;氮气的电子式为 ;氨气分子的空间构型是 。
(2)工业上常用醋酸亚铜氨溶液来吸收含有大量N2的高炉气体系中的CO,从而实现CO和N2的分离,反应的化学方程式如下:CH3COOCu(NH3)2 (aq) + CO(g) CH3COOCu(NH3)2·CO(aq) + Q(Q>0),该反应的化学平衡常数表达式K= ;欲使K值变大,可采取的措施是 。
吸收CO后的溶液经过适当处理又可以重新生成醋酸亚铜氨,可采取的适当处理措施有
(选填序号)。
a.适当升高温度
b.适当降低温度
c.增大压强
d.减小压强
(3)消除NH3对水体污染的重要方法是在一定条件下向水体中加入适量NaOH,这样能使NH3的脱除率增大,试用平衡移动原理解释其原因 。
(4)某研究小组用200mL 1.5mol/L K2CO3溶液吸收了3.36L 的CO2(标准状况)形成富液,碳酸钾溶液吸收CO2的离子反应方程式为 ,该富液中的溶质是 (填化学式),各离子的浓度关系正确的是 。
a.c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-)
b.3c(K+)=4 c(CO32-)+4 c(HCO3-)+4c(H2CO3)
c.c(K+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
19.CoCl2 6H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物 Fe(OH)3 Fe(OH)2 Co(OH)2 Al(OH)3 Mn(OH)2
开始沉淀 2.7 7.6 7.6 4.0 7.7
完全沉淀 3.7 9.6 9.2 5.2 9.8
③CoCl2 6H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为 。
(2)向浸出液中加入适量NaClO3目的是 。
(3)“加Na2CO3调pH至a”,a= ;过滤所得沉淀的主要成分为 (填化学式)。
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是 ,使用该萃取剂的最佳pH范围是 (填选项字母)
A.5.0﹣5.5 B.4.0﹣4.5 C.3.0﹣3.5 D.2.0﹣2.5
(5)实验操作“操作1”为 、 、过滤和减压烘干;制得的CoCl2 6H2O在烘干时需减压烘干的原因是 。
20.纯碱是重要化工产品,侯氏制碱法是由我国著名化学家侯德榜所创立,打破了欧美对制碱业的垄断。其简化工艺流程如下图:
回答下列问题:
(1)高温下“水煤气变换”可制取合成氨的原料气体 (填化学式);沉淀池中反应的化学方程式为 ,该反应是否符合复分解反应发生的条件? (填“是”或“否”)
(2)流程中的操作为 ;“副产品”为 (填化学式)。
(3)流程中可循环利用的物质有 。
(4)产品中可能混有杂质,设计实验检验 。
21.电镀废水、废渣的处理和综合利用体现了绿色化学的思想。
(1)Ⅰ.含铬电镀废水的处理可采用以下方法:
电解法。往废水中加入适量氯化钠,以铁为电极进行电解,电解过程中,阳极的电极反应式为 。
(2)沉淀法。含铬废水中存在平衡:Cr2O72-+H2O
2CrO42-+2H+.往废水中加入BaCl2,铬元素转化为铬酸钡(BaCrO4)沉淀,此过程中,还应加入NaOH,理由是 。
(3)Ⅱ.某工厂利用富含镍(Ni)的电镀废渣(含有Cu、Zn、Fe、Cr等杂质)制备NiSO4·6H2O.其生产流程如图所示
步骤①中加入H2SO4酸浸,Ni的浸取率随温度的升高如图所示,请你解释浸取率先上升后下降的原因: 。
(4)溶液C中溶质的主要成分是 。
(5)步骤②所用的Na2S的浓溶液有臭鸡蛋气味,配制该溶液的方法是 。
(6)请写出步骤⑤主要反应的离子方程式: 。
答案解析部分
1.【答案】C
【解析】【解答】A.向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中,加入的NaOH中和了溶液中的氢离子,促进了水的电离程度一直增大,A不符合题意;
B.由图知,pH=4.2时,溶液中HSeO和SeO的浓度相等,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(HSeO)+2c(SeO),B不符合题意;
C.,故在NaHSeO3溶液中,HSeO的电离程度大于水解程度,则c(SeO)>c(H2SeO3) ,C符合题意;
D.根据电离方程式知,,当pH=1.2时,HSeO和H2SeO3的浓度相等,因此Ka1=10-1.2,D不符合题意;
故答案为:C。
【分析】A.酸或碱抑制水的电离,含有弱离子的盐水解促进水的电离;
B.根据电荷守恒分析;
D.根据计算。
2.【答案】A
【解析】【解答】A.澄清透明的溶液中:Al3+、Cu2+、 、Cl-之间及与所在环境中的微粒之间,都不发生反应,它们能大量共存,A符合题意;
B.Al3+、S2-在水溶液中能发生双水解反应,生成Al(OH)3沉淀和H2S气体,B不符合题意;
C.c(OH-)< 的溶液中,c(H+)> ,溶液呈酸性,ClO-会转化为HClO,不能大量存在,C不符合题意;
D.1mol·L-1的KNO3溶液中:H+、Fe2+、 会发生氧化还原反应,D不符合题意;
故答案为:A。
【分析】依据离子之间不反应生成气体、沉淀、弱电解质或络合物或发生氧化还原反应、双水解反应的就能共存,以此解答该题。
3.【答案】C
【解析】【解答】A.根据分析,曲线②代表CO ,故A说法符合题意;
B.电离平衡常数只受温度的影响,曲线①和②交点代表此时c(CO )= c(HCO ),即Ka2=c(H+)=10-10.3,故B说法符合题意;
C.曲线②和曲线③交点,说明c(CO )= c(Ca2+),根据Ksp= c(Ca2+)·c(CO ),推出c(CO )= =10-4.35,即a=-4.35,根据电离平衡常数Ka2= ,解得c(HCO )=10-2.65,即b=-2.65,故C说法不符合题意;
D.pH=10.3时,c(CO )=10-1.1mol/L,根据Ksp= c(Ca2+)·c(CO ),c(Ca2+)=10-7.6mol/L,故D说法符合题意;
故答案为C。
【分析】A.根据图象可知,横坐标代表pH,随着pH增大,碱性增强,c(HCO )、c(CO )增大,先生成,再生成,曲线①代表,曲线②代表,因为碳酸钙是难溶物,因此,随着c(CO )增大,溶液中c(Ca2+)减小,推出曲线③代表Ca2+,据此分析作答即可。
B.选择曲线①和②交点,利用Ka2= 计算。
C.选择曲线②和曲线③交点,根据Ksp= c(Ca2+)·c(CO )和Ka2= 计算
D.根据Ksp= c(Ca2+)·c(CO )计算。
4.【答案】D
【解析】【解答】A.Ba2+、 反应生成碳酸钡沉淀,不能大量共存,A与题意不符;
B.S2-、H+反应生成硫化氢气体,亚铁离子与硫离子生成硫化亚铁,不能大量共存,B与题意不符;
C.H+、 反应生成二氧化碳气体,不能大量共存,C与题意不符;
D.K+、Na+、 、 之间不反应,能大量共存,D符合题意;
故答案为D。
【分析】根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此解答该题。
5.【答案】B
【解析】【解答】①25℃时,某NH4Cl溶液的pH为4,则溶液中c(H+)>c(OH-),温度不变,水的离子积常数不变,所以c(H+)×c(OH-)=1×10-14,①符合题意;
②强酸弱碱盐溶液中氢离子为水电离出的氢离子,氯化铵为强酸弱碱盐,所以溶液中水电离出的氢离子浓度为1×10-4mol/L,②不符合题意;
③溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)>c(NH4+),盐类水解程度较小,所以c(NH4+)>c(H+),则溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),③符合题意;
综上,上述说法正确的是①③,B符合题意;
故答案为:B
【分析】①NH4Cl溶液中存在NH4+的水解,任何溶液中都存在c(H+)×c(OH-)=Kw;
②NH4Cl溶液中的H+都来自于水电离产生;
③结合溶液中NH4+的水解和H2O的电离分析离子浓度大小关系;
6.【答案】C
【解析】【解答】A.Na2CO3、NaHCO3的水溶液中都存在的离子有:Na+、CO32-、HCO3-、H+、OH-,其所含离子种类相同,A不符合题意;
B.两溶液混合后,所得为CH3COONa溶液,溶液中CH3COO-水解,使得溶液显碱性,故可得关系式:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B不符合题意;
C.NH4HSO4溶液中的H+会抑制NH4+的水解,故NH4HSO4溶液中c(NH4+)较大,C符合题意;
D.常温下,水电离产生的c(H+)=10-7 mol·L-1,某溶液中由水电离出的c(H+)=10-5 mol·L-1>10-7 mol·L-1,说明水的电离受到促进,则该溶液应为含有弱碱阳离子的溶液,D不符合题意;
故答案为:C
【分析】A.根据Na2CO3、NaHCO3的电离水解分析;
B.混合后所得溶液为CH3COONa,根据CH3COO-的水解分析;
C.根据NH4+的水解程度进行分析;
D.根据影响水电离因素进行分析;
7.【答案】D
【解析】【解答】解:A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合得到醋酸、氯化钠和少量HCl,溶液中离子浓度大小为c(Cl﹣)>c(Na+)>c(H+)>c(OH﹣),故A错误;
B.0.1 mol/L pH为4的NaHB溶液中HB﹣离子电离大于其水解,微粒浓度大小为:c(HB﹣)>c(B2﹣)>c(H2B),故B错误;
C.在NaHA溶液中一定存在电荷守恒:c(Na+)+c(H+)=c(HA﹣)+c(OH﹣)+2c(A2﹣),故C错误;
D.铵根离子水解,(NH4)2SO4中含有2个铵根离子,所以铵根离子浓度最大,(NH4)2 CO3中含有2个铵根离子,碳酸根离子和铵根离子相互促进水解,NH4Cl是强酸弱碱盐,铵根离子能水解但较弱,所以当它们物质的量浓度相同时,c(NH4+)大小顺序为c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl),所以如果c(NH4+)相同,电离出铵根离子浓度越多的其物质的量浓度越小,所以当c(NH4+)相同时,物质的量浓度由大到小的顺序为c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl),故D正确;
故选D.
【分析】A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合得到醋酸、氯化钠和少量HCl;
B.0.1 mol/L pH为4的NaHB溶液中HB﹣离子电离大于其水解;
C.在NaHA溶液中一定有电荷守恒,阴阳离子所带电荷总数相同;
D.氢离子抑制铵根离子水解,碳酸根离子促进铵根离子水解,电离出铵根离子浓度越多的其物质的量浓度越小,据此判断.
8.【答案】D
【解析】【解答】A.曲线a的浓度变化先增大后减小,代表浓度随pH的变化,A不符合题意;
B.从图象可知pH从4到6,主要发生的反应是转化为,离子方程式为:OH- += H2O +,故B不符合题意;
C.pH = 7时c(OH )=c(H+),根据电荷守恒和溶液呈中性可得: +2=c(Na+),则
D.在曲线a、c交界点有:等于c(H2C2O4),c(H+)+c(Na+)=c(OH-)+2+ = c(OH-)+0.1+ - c(H2C2O4),所以c(H+)+c(H2C2O4) +c(Na+)=c(OH-)++0.1,若c(Na+)=0.1mol/L,则溶液中溶质为NaHC2O4,电离大于水解,则大于c(H2C2O4),所以要使等于c(H2C2O4),则氢氧化钠用量要减少,即c(Na+)<0.1mol/L,D符合题意;
故答案为:D。
【分析】在解答水解和电离图像问题时应该注意下列几点:1、横轴坐标和纵坐标含有;2、曲线斜率或者趋势;3、曲线上特殊点,如起点、终点、交点和拐点等;4.充分利用质量守恒和电荷守恒等。
9.【答案】B
【解析】【解答】A.H+与CO32-要发生离子反应,生成水和CO2,不能大量共存,故A不符合题意;
B.NH4+、HCO3-、NO3-、Cl-在同一溶液中彼此间不发生离子反应,可大量共存,故B符合题意;
C.Fe3+与SCN-能发生离子反应,得到红色溶液,故C不符合题意;
D.ClO-与H+发生离子反应生成弱酸HClO,不能大量共存,故D不符合题意;
答案为B。
【分析】根据离子反应发生的条件进行判断即可。
10.【答案】C
【解析】【解答】A.Cu为单质,因此既不是电解质,也不是非电解质,A不符合题意;
B.SO2溶于水的过程中发生反应:SO2+H2O=H2SO3,起导电作用的是H2SO3,而不是SO2,因此SO2属于非电解质,B不符合题意;
C.固体NaCl中不存在可自由移动的离子,因此固体NaCl不导电,但NaCl的水溶液可导电,且NaCl属于化合物,因此NaCl为电解质,C符合题意;
D.BaSO4的水溶液中几乎不含可自由移动的离子,因此BaSO4溶液不导电,但熔融状态的BaSO4含有可自由移动的离子,能导电,因此BaSO4属于电解质,D不符合题意;
故答案为:C
【分析】此题是对电解质、非电解质定义的考查,结合电解质、非电解质的概念进行分析即可。电解质是指在水溶液或熔融状态下能导电的化合物;非电解质是指在水溶液和熔融状态下都不能导电的化合物。
11.【答案】D
【解析】【解答】A.AgCl的悬浊液中存在沉淀溶解平衡:AgCl(s)
Ag+(aq)+Cl-(aq),A不符合题意;
B.Ksp(AgCl)=c(Ag+)·c(Cl-),b点后溶解的AgCl变少,说明b点后AgCl沉淀溶解平衡逆向移动,故b点滴加的可能是硝酸银溶液,B不符合题意;
C.c点滴加KI溶液后,氯离子浓度升高然后达到一个比起始时略高的值,则说明此时溶液中银离子浓度减小,而部分银离子转化为碘化银沉淀,因此c点后有黄色沉淀生成,C不符合题意;
D.由C选项的分析,c点后产生了碘化银,故应有
,D符合题意;
故答案为:D。
【分析】A.难溶物中存在沉淀溶解平衡:AgCl(s)
Ag+(aq)+Cl-(aq)。注意化学式或离子之后要表明状态。
B.由图可知,b点之后溶解的AgCl变少,说明沉淀溶解平衡逆向移动。加入AgNO3溶液,会使c(Ag+)增大,利于平衡逆向移动。
C.c点之后溶解的AgCl变多,说明沉淀溶解平衡正向移动。加入KI溶液,I-会与Ag+结合生成AgI黄色沉淀,使得c(Ag+)减小,利于平衡右移。
D.根据C项分析,AgI比AgCl的溶解度小,说明Ksp(AgCl)>Ksp(Agl)。
12.【答案】A
【解析】【解答】A. , L点时,=,则,电离吸热,适当升高温度﹐促进电离,电离平衡常数增大,则增大、pH减小,L点会左移,A符合题意;
B. M点时,=,, ,,按定义,则,B不符合题意;
C. 随pH增加,,温度不变则KW、Ka1均不变,反应过程中先增大、后减小,则先增大后减小,C不符合题意;
D. 溶液呈电中性,,,N点时,则,则,原溶液为1L 0.01的溶液,由物质守恒知,溶液中,D不符合题意;
故答案为:A。
【分析】H2A溶液中滴加NaOH溶液,先生成HA-后生成A2-, 不断减小, 先增大后减小, 不断增大,则曲线a为的变化,曲线b为的变化,曲线c为的变化,据此解答。
13.【答案】D
【解析】【解答】A.醋酸是弱酸,部分电离,pH=3的醋酸溶液比pH=11的NaOH溶液浓度大的多,a点时二者等体积反应,醋酸过量,溶液呈酸性,A不符合题意;
B.平衡常数K只与温度有关,和压强无关,B不符合题意;
C.增大氢气的浓度,提高氮气的转化率,所以随H2起始体积分数增大,N2的转化率增大,即a点N2的转化率小于b点,C不符合题意;
D.降低体系温度,正逆反应速率都减小,平衡向正反应方向移动,与图象相符,D符合题意;
故答案为:D
【分析】A.pH=3的醋酸和pH=11的NaOH等体积混合后,溶液显酸性;
B.结合温度、压强对平衡移动的影响分析;
C.结合浓度对平衡移动的影响分析;
D.结合温度对反应速率的影响分析;
14.【答案】D
【解析】【解答】①取少量溶液滴加KSCN溶液,溶液呈血红色,一定含Fe3+;则I-、HCO3-与其反应,一定不能存在;②另取少量原溶液滴加盐酸,溶液的棕黄色加深,则含Fe2+、NO3-,在酸性条件下发生氧化还原反应使Fe3+浓度增大,即一定含Fe3+、Fe2+、NO3-,一定不含I-、HCO3-,可能含Cl-,则溶液里一定含有的阴离子为NO3-,故答案为D。
故答案为:D。
【分析】硝酸能够将二价铁氧化成三价。
15.【答案】B
【解析】【解答】A. 温度影响水的电离,则pH>7的溶液不一定呈碱性;溶液酸碱性与溶液中氢离子、氢氧根离子浓度有关,当c(H+)
C.pH相同说明两种溶液中c(H+)相同,相同温度下Kw相同,Kw= c(H+)·c(OH-),溶液中氢离子浓度相同说明氢氧根浓度相同,故C不符合题意;
D. 氨水和盐酸反应后的溶液中存在电荷守恒:c(OH-)+c(Cl-)=c(H+)+c(NH4+),溶液呈中性则c(H+)=c(OH-),所以 ,故D不符合题意;
故答案为B。
【分析】A.考查溶液的酸碱性,需要考虑温度
B.氨水是弱电解质,氢氧化钠是强电解质
C.PH相同,氢离子离子浓度相同
D.根据电荷守恒,显中性即可求出
16.【答案】D
【解析】【解答】A.加入二氧化硅,不反应,故A不符合题意
B.加入氧化钠,与水反应生成氢氧化钠,则氢氧根与碳酸氢根反应结合钡离子生成碳酸钡沉淀, 但无气体生成,故不符合题意
C.既无沉淀生成,又无气体生成,故C不符合题意
D.铝离子和碳酸氢根发生双水解,故既有沉淀生成又有气体生成,故D符合题意
故答案为:D
【分析】Al3++3HCO3-=3CO2+Al(OH)3,故既有沉淀又有气体
17.【答案】(1)NH3+H2O NH3·H2O;NH3·H2O +OH-
(2)CE;D;A;B
【解析】【解答】(1)氨气与水反应生成NH3·H2O,方程式为NH3+H2O NH3·H2O;NH3·H2O为弱电解质,可电离出OH-,溶液呈碱性,电离方程式为NH3·H2O NH4++OH-。
(2)氨水中存在电离平衡:NH3·H2O NH4++OH-,则①若使c(OH-)减少、c(NH4+)增大可加入与OH-反应的微粒,如硫酸中的H+能中和OH-,硫酸铝溶液中Al3+与OH-生成Al(OH)3沉淀,使电离平衡右移,c(NH4+)增大,
故答案为:CE;②若c(OH-)增大、c(NH4+)减少,可加入碱,如NaOH,
故答案为:D;③加入浓氨水,可使c(OH-)和c(NH4+)都增大,
故答案为:A;④稀释促进电离,溶液体积增加的更多,能使c(OH-)和c(NH4+)都减少,
故答案为:B。
【分析】此题考查弱电解质的电离的影响因素,根据化学平衡的影响来类别进行判断。电离方程式的书写时注意强弱电解质的判断。
18.【答案】(1)1s22s22p3;5;;三角锥型
(2)[c(CH3COOCu(NH3)2·CO)]/[c(CO)]·[c(CH3COOCu(NH3)2)];降低温度;ad
(3)氨气在水中存在如下平衡:NH3+H2O NH3 H2O NH4++OH﹣,当加入NaOH后,c(OH﹣)浓度增大,平衡逆向移动,故有利于氨的脱除II.为实现CO2减排,合成氨工厂采用苯菲尔法脱碳。该方法是用碳酸钾溶液为吸收剂捕集混合气中的CO2得到富液,再高温加热富液使之分解释放出CO2 ,正常情况下再生的二氧化碳气体体积分数可达98.5%以上。
(4)CO32-+ CO2 + H2O → 2HCO3-;KHCO3和K2CO3;a b
【解析】【解答】(1)氮原子核外电子数为7,基态原子核外电子排布为1s22s22p3;其最外层有5种运动状态不同的电子;氮气的电子式为 ;氨气分子中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3杂化,其空间构型是三角锥型;
(2)反应CH3COOCu(NH3)2 (aq) + CO(g) CH3COOCu(NH3)2·CO(aq) + Q(Q>0),的化学平衡常数表达式K=[c(CH3COOCu(NH3)2·CO)]/[c(CO)]·[c(CH3COOCu(NH3)2)];该反应为放热反应,升高温度平衡逆向移动,K值变小,故欲使K值变大,可采取的措施是降低温度;反应CH3COOCu(NH3)2 (aq) + CO(g) CH3COOCu(NH3)2·CO(aq) + Q(Q>0)是气体体积缩小的放热反应, a.适当升高温度平衡向吸热反应方向进行,则升温平衡逆向进行,可以重新生成醋酸亚铜氨,故符合题意;
b.适当降低温度平衡向放热反应方向进行,不能重新生成醋酸亚铜氨,故不符合题意;
c.增大压强平衡向气体体积减小的方向进行,不能重新生成醋酸亚铜氨,故不符合题意;
d.减小压强平衡向气体体积增大的方向进行,可以重新生成醋酸亚铜氨,故符合题意。
故答案为:ad;
(3)消除NH3对水体污染的重要方法是在一定条件下向水体中加入适量NaOH,氨气在水中存在如下平衡:NH3+H2O NH3 H2O NH4++OH﹣,当加入NaOH后,c(OH﹣)浓度增大,平衡逆向移动,故有利于氨的脱除,使NH3的脱除率增大;
(4)碳酸钾溶液吸收CO2生成碳酸氢钾,反应的离子反应方程式为CO32-+ CO2 + H2O = 2HCO3-,富液中的溶质是KHCO3和K2CO3,a.根据电荷守恒有c(K+) + c(H+) = 2c(CO32-) +c(HCO3-) +c(OH-),故符合题意;
b.200mL 1.5mol/L K2CO3溶液吸收了3.36L 的CO2(标准状况),n(K+)=0.2L 1.5mol/L 2=0.6mol,c(C)=0.3mol+0.15mol=0.45mol,根据物料守恒有3c(K+)=4 c(CO32-)+4 c(HCO3-)+4c(H2CO3),故符合题意;
c.根据反应可知,溶质为KHCO3和K2CO3,水解是微弱的,则c(K+)>c(HCO3-)>c(CO32-) >c(OH-)>c(H+),故不符合题意。
故答案为:a b。
【分析】(2)根据化学平衡常数的定义书写表达式,根据反应方程式的特点分析影响化学平衡移动的条件即可。
19.【答案】(1)Fe2O3+Na2SO3+4HCl=2FeCl2+Na2SO4+2H2O
(2)将Fe2+氧化为Fe3+,易于除去铁元素
(3)5.2;Fe(OH)3、Al(OH)3
(4)除去溶液中的Mn2+;C
(5)蒸发浓缩;冷却结晶;降低烘干温度,防止产品分解
【解析】【解答】含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,然后过滤,向滤液中加入萃取剂,将锰离子萃取,调节溶液PH在3.0—3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,萃取后的溶液中主要含有CoCl2,为得到CoCl2 6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品。(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为Fe2O3+Na2SO3+4HCl=2FeCl2+Na2SO4+2H2O;(2)向浸出液中加入适量NaClO3目的是将Fe2+氧化为Fe3+,易于除去铁元素;(3) “加Na2CO3调pH至a”,a=5.2,保证铝离子沉淀完全,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以沉淀成分为:Fe(OH)3、Al(OH)3;(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;故答案为:除去溶液中的Mn2+;C ;(5)实验操作“操作1”为蒸发浓缩、冷却结晶、过滤和减压烘干;根据CoCl2 6H2O的组成分析,造成产品中CoCl2 6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大或结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。
【分析】(1)氧化铁和亚硫酸钠在盐酸的条件下反应生成氯化亚铁、硫酸钠和水;
(2)根据铁离子和亚铁离子生成沉淀的条件可知,将亚铁离子氧化为铁离子更方便除去铁元素,所以氯酸钠的作用是将亚铁离子氧化为铁离子;
(3)根据氢氧化铝沉淀的pH环境可知,需要将pH调至5.2才可以将铝离子全部沉淀,此时得到的沉淀还有氢氧化铁;
(4)向滤液中加入萃取剂的目的是除去锰离子,此时pH在3.0~3.5之间;
(5)将溶液讲过萃取操作时候要进行的操作有蒸发浓缩、冷却结晶;制得的CoCl2 6H2O在烘干时需减压烘干的原因是可以降低烘干温度,防止产品分解。
20.【答案】(1);;是
(2)过滤;
(3)、分离出副产品后的母液(或或或)
(4)取少量产品于试管中,加入足量稀酸化,再加入少量溶液,有白色沉淀,则含有;无白色沉淀,则不含。
【解析】【解答】(1)工艺流程第一步是一氧化碳和高温水蒸气反应生成二氧化碳和氢气,可以制合成氨的原料气,第三步氨气先通入沉淀池中饱和食盐水,再通入二氧化碳,生成碳酸氢钠固体和氯化铵,反应方程式为,该反应有反应物相互交换成分,并有固体析出,符合复分解反应的条件,故答案为;,是;
(2)流程中的操作为过滤;“副产品”为,故答案为过滤 ;
(3)从流程中可知,二氧化碳可循环利用,分离出副产品后的母液可循环利用,答案为、分离出副产品后的母液(或或或);
(4)产品中可能混有杂质,设计实验检验氯化钠是否存在。取少量产品于试管中,加入足量稀酸化,再加入少量溶液,有白色沉淀,则含有;无白色沉淀,则不含。故答案为取少量产品于试管中,加入足量稀酸化,再加入少量溶液,有白色沉淀,则含有;无白色沉淀,则不含。
【分析】流程第一步是一氧化碳和高温水蒸气反应生成二氧化碳和氢气,然后分离,第二步氢气与氮气反应合成氨气,第三步氨气先通入饱和食盐水,再通入二氧化碳,生成碳酸氢钠固体和氯化铵,第四步,过滤,对碳酸氢钠进行煅烧分解生成碳酸钠。
21.【答案】(1)Fe-2e-=Fe2+
(2)中和H+,促使上述平衡右移,产生BaCrO4沉淀
(3)温度升高,反应速率加快,浸取率上升;到一定程度后,升高温度,促进Ni2+水解,浸取率反而下降
(4)Na2SO4
(5)将Na2S固体溶于浓NaOH溶液中,加水稀释至所需的浓度
(6)Ni2++ CO32-=NiCO3↓
【解析】【解答】Ⅰ.(1)以铁为电极进行电解氯化钠溶液,阳极是铁失电子生成亚铁离子,阳极反应式为Fe-2e-=Fe2+;(2)加入NaOH可以中和H+,促使上述平衡右移,产生BaCrO4沉淀;Ⅱ.(3)温度升高,反应速率加快,浸取率上升;到一定程度后,升高温度,促进Ni2+水解,浸取率反而会下降;(4)根据流程图可知,溶液C中主要的阳离子是Na+、主要的阴离子是SO42-,所以主要成分是Na2SO4;(5)Na2S易水解,配制该溶液的方法是:将Na2S固体溶于浓NaOH溶液中,加水稀释至所需的浓度;(6)步骤⑤是硫酸镍与碳酸钠反应生成NiCO3沉淀和硫酸钠,反应离子方程式是Ni2++ CO32-=NiCO3↓。
【分析】Ⅰ.(1)以铁为电极进行电解氯化钠溶液,阳极是铁失电子生成亚铁离子;(2)加入NaOH中和氢离子,可以使Cr2O72-+H2O 2CrO42-+2H+平衡正向移动;Ⅱ.(3)温度升高,反应速率加快;到一定程度后,升高温度,促进Ni2+水解;(4)根据流程图,溶液C中的阳离子是Na+、阴离子是SO42-;(5)Na2S的浓溶液有臭鸡蛋气味,说明Na2S易水解,配制该溶液时要抑制其水解;(6)步骤⑤是硫酸镍与碳酸钠反应生成NiCO3沉淀和硫酸钠。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
