2.2.3 离子反应的应用 课件 (共22张PPT)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2.3 离子反应的应用 课件 (共22张PPT)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
第二章 元素与物质世界
第2节 电解质的电离 离子反应
课时3 离子反应的应用
【教学目标】
1. 能利用离子反应解决离子检验问题
2. 能设计实验方案进行物质的制备和分离,提纯和鉴定
【重点难点】
1. 离子检验与推断
2. 物质的除杂和分离,提纯和鉴定
【教学手段】
多媒体辅助教学(课件+教参实验视频)
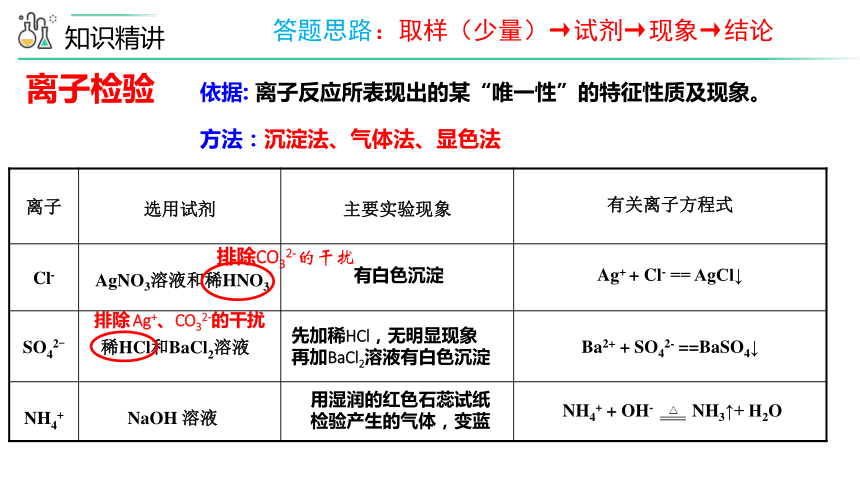
离子 选用试剂 主要实验现象
有关离子方程式
Cl- AgNO3溶液和稀HNO3
SO42- 稀HCl和BaCl2溶液
NH4+ NaOH 溶液
有白色沉淀
先加稀HCl,无明显现象
再加BaCl2溶液有白色沉淀
用湿润的红色石蕊试纸检验产生的气体,变蓝
Ag+ + Cl- == AgCl↓
Ba2+ + SO42- ==BaSO4↓
NH4+ + OH- NH3↑+ H2O
离子检验
依据: 离子反应所表现出的某“唯一性”的特征性质及现象。
方法:沉淀法、气体法、显色法
排除 Ag+、CO32-的干扰
排除CO32-的干扰
答题思路:取样(少量)→试剂→现象→结论
CO32-检验:
取少量试样于试管中,加入CaCl2(或BaCl2)溶液,产生白色沉淀,过滤,
向沉淀中加稀HCl,产生无色无味且能使澄清石灰水变浑浊的气体,证明还有CO32-,反之则不含CO32-。
课 堂 检 测
某同学怀疑溶液中有 ,设计了几种方案进行检验,以下操作是否正确,说明理由。
2、离子推断
离子推断题将离子共存、离子检验设定在一个可能的离子组中,要求通过多重推断,确定某些离子肯定存在,某些离子肯定不存在,某些离子不能确定是否存在.
解题思路:
→根据实验操作和反应现象,判断一定含有的离子
→根据能否共存,判断一定不含的离子
→根据电荷守恒,判断还含有的离子或可能含有的离子
3、物质的分离与提纯
食盐的精制
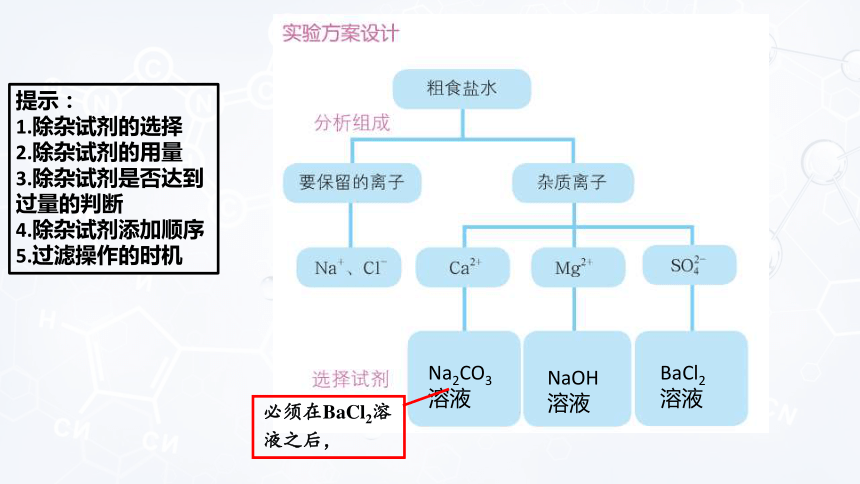
氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,并以它们为原料生产一系列化工产品。氯碱工业的主要原料是粗食盐。粗食盐中除了含有难溶性杂质外,还含有钙盐、镁盐等可溶性杂质。在氯碱工业中,这些可溶性杂质不但会增加生产能耗,还会带来安全隐患。因此,氯碱工业的一道重要工序是除去粗食盐水中的杂质。
实验目的
从粗食盐水中除去Ca2+、Mg2+、SO42+。
实验用品
粗食盐水,稀盐酸,稀硫酸,NaOH溶液,Ba(OH)2溶液,Na2CO3溶液,BaCl2溶液;
烧杯,漏斗,玻璃棒,表面皿, pH试纸,滤纸,试管,胶头滴管,铁架台(带铁圈)。
活动探究
利用离子反应原理进行除杂提纯是生产生活中常用的手段,如沉淀法、气体法、置换法等。粗盐提纯、饮用水净化应用了离子反应原理。
Na2CO3
溶液
NaOH
溶液
BaCl2
溶液
提示:
1.除杂试剂的选择
2.除杂试剂的用量
3.除杂试剂是否达到过量的判断
4.除杂试剂添加顺序
5.过滤操作的时机
必须在BaCl2溶
液之后,
Na+
Cl-
Ca2+
Mg2+
SO42-
总结:只要BaCl2溶液在Na2CO3溶液之前加就行,因为要用过量的CO32-除去过量的Ba2+,而盐酸HCl 必须在过滤后加入。
所用试剂及实验操作 实验现象 解释和结论
1.向粗食盐水中滴加过量的BaCl2溶液。 2.继续滴加过量的NaOH溶液。 3.继续滴加过量的碳酸钠溶液。 4.过滤。 5.向滤液中滴加稀盐酸至溶液呈中性。
实验方案实施
白色沉淀生成
白色沉淀生成
白色沉淀生成
除去SO42-
除去Mg2+
除去Ca2+、过量的Ba2+
除去BaSO4、Mg(OH)2、CaCO3沉淀
除去过量的OH-、CO32-
1. 如何确定除去杂质过程中试剂的添加顺序
2. 如何检验杂质离子是否去除干净?
⑴不能引入新的杂质,如果不得不引入新的杂质,一定要再利用其它试剂把新引入的杂质除去;
⑵为了保证除尽杂质,加入的除杂试剂一般应有所过量.一般在叙述时应该有这样的语言:“加入某物质至不再沉淀”或“加入某物质至不再产生气体为止”,这样的话一般意味着加入的除杂试剂适量或略有过量。
向上层清液中继续滴加原先的沉淀剂,如有浑浊出现则未沉淀完全,否则已经沉淀完全。
离子反应的应用
1.离子检验(Cl- 、SO42- CO32- )
2.离子推断(离子共存与离子检验的应用)
3.物质的分离与提纯(粗盐的提纯)
分离和提纯的三个必须和四个原则:
①加试剂必须过量。
②过量试剂必须除去。
③除杂顺序必须合理
(2)四个原则:
(1)三个必须
课 堂 检 测
B
D
课 后 作 业
试卷:课时评价作业检测
练习册:蓝色同步 创新大课堂
下 课~
第二章 元素与物质世界
第2节 电解质的电离 离子反应
课时3 离子反应的应用
【教学目标】
1. 能利用离子反应解决离子检验问题
2. 能设计实验方案进行物质的制备和分离,提纯和鉴定
【重点难点】
1. 离子检验与推断
2. 物质的除杂和分离,提纯和鉴定
【教学手段】
多媒体辅助教学(课件+教参实验视频)
离子 选用试剂 主要实验现象
有关离子方程式
Cl- AgNO3溶液和稀HNO3
SO42- 稀HCl和BaCl2溶液
NH4+ NaOH 溶液
有白色沉淀
先加稀HCl,无明显现象
再加BaCl2溶液有白色沉淀
用湿润的红色石蕊试纸检验产生的气体,变蓝
Ag+ + Cl- == AgCl↓
Ba2+ + SO42- ==BaSO4↓
NH4+ + OH- NH3↑+ H2O
离子检验
依据: 离子反应所表现出的某“唯一性”的特征性质及现象。
方法:沉淀法、气体法、显色法
排除 Ag+、CO32-的干扰
排除CO32-的干扰
答题思路:取样(少量)→试剂→现象→结论
CO32-检验:
取少量试样于试管中,加入CaCl2(或BaCl2)溶液,产生白色沉淀,过滤,
向沉淀中加稀HCl,产生无色无味且能使澄清石灰水变浑浊的气体,证明还有CO32-,反之则不含CO32-。
课 堂 检 测
某同学怀疑溶液中有 ,设计了几种方案进行检验,以下操作是否正确,说明理由。
2、离子推断
离子推断题将离子共存、离子检验设定在一个可能的离子组中,要求通过多重推断,确定某些离子肯定存在,某些离子肯定不存在,某些离子不能确定是否存在.
解题思路:
→根据实验操作和反应现象,判断一定含有的离子
→根据能否共存,判断一定不含的离子
→根据电荷守恒,判断还含有的离子或可能含有的离子
3、物质的分离与提纯
食盐的精制
氯碱工业通过电解饱和食盐水制得烧碱、氢气和氯气,并以它们为原料生产一系列化工产品。氯碱工业的主要原料是粗食盐。粗食盐中除了含有难溶性杂质外,还含有钙盐、镁盐等可溶性杂质。在氯碱工业中,这些可溶性杂质不但会增加生产能耗,还会带来安全隐患。因此,氯碱工业的一道重要工序是除去粗食盐水中的杂质。
实验目的
从粗食盐水中除去Ca2+、Mg2+、SO42+。
实验用品
粗食盐水,稀盐酸,稀硫酸,NaOH溶液,Ba(OH)2溶液,Na2CO3溶液,BaCl2溶液;
烧杯,漏斗,玻璃棒,表面皿, pH试纸,滤纸,试管,胶头滴管,铁架台(带铁圈)。
活动探究
利用离子反应原理进行除杂提纯是生产生活中常用的手段,如沉淀法、气体法、置换法等。粗盐提纯、饮用水净化应用了离子反应原理。
Na2CO3
溶液
NaOH
溶液
BaCl2
溶液
提示:
1.除杂试剂的选择
2.除杂试剂的用量
3.除杂试剂是否达到过量的判断
4.除杂试剂添加顺序
5.过滤操作的时机
必须在BaCl2溶
液之后,
Na+
Cl-
Ca2+
Mg2+
SO42-
总结:只要BaCl2溶液在Na2CO3溶液之前加就行,因为要用过量的CO32-除去过量的Ba2+,而盐酸HCl 必须在过滤后加入。
所用试剂及实验操作 实验现象 解释和结论
1.向粗食盐水中滴加过量的BaCl2溶液。 2.继续滴加过量的NaOH溶液。 3.继续滴加过量的碳酸钠溶液。 4.过滤。 5.向滤液中滴加稀盐酸至溶液呈中性。
实验方案实施
白色沉淀生成
白色沉淀生成
白色沉淀生成
除去SO42-
除去Mg2+
除去Ca2+、过量的Ba2+
除去BaSO4、Mg(OH)2、CaCO3沉淀
除去过量的OH-、CO32-
1. 如何确定除去杂质过程中试剂的添加顺序
2. 如何检验杂质离子是否去除干净?
⑴不能引入新的杂质,如果不得不引入新的杂质,一定要再利用其它试剂把新引入的杂质除去;
⑵为了保证除尽杂质,加入的除杂试剂一般应有所过量.一般在叙述时应该有这样的语言:“加入某物质至不再沉淀”或“加入某物质至不再产生气体为止”,这样的话一般意味着加入的除杂试剂适量或略有过量。
向上层清液中继续滴加原先的沉淀剂,如有浑浊出现则未沉淀完全,否则已经沉淀完全。
离子反应的应用
1.离子检验(Cl- 、SO42- CO32- )
2.离子推断(离子共存与离子检验的应用)
3.物质的分离与提纯(粗盐的提纯)
分离和提纯的三个必须和四个原则:
①加试剂必须过量。
②过量试剂必须除去。
③除杂顺序必须合理
(2)四个原则:
(1)三个必须
课 堂 检 测
B
D
课 后 作 业
试卷:课时评价作业检测
练习册:蓝色同步 创新大课堂
下 课~
