2023-2024学年山东省泰安市岱岳区九年级(上)期中化学试卷(无答案)
文档属性
| 名称 | 2023-2024学年山东省泰安市岱岳区九年级(上)期中化学试卷(无答案) |  | |
| 格式 | doc | ||
| 文件大小 | 305.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 20:58:24 | ||
图片预览


文档简介
2023-2024学年山东省泰安市岱岳区九年级(上)期中化学试卷
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.(2分)下列过程主要发生化学变化的是( )
A.氯化钠溶于水
B.用降温结晶从硝酸钾饱和溶液中提取硝酸钾固体
C.盐酸挥发
D.氢氧化钠露置于空气中变质
2.(2分)生活中的下列物质放入水中,能形成溶液的是( )
A.植物油 B.面粉 C.食盐 D.泥沙
3.(2分)溶液广泛应用于生产、生活。下列说法不正确的是( )
A.洗涤剂去油污的原理是乳化
B.均一、稳定的液体不一定是溶液
C.溶液一定是无色透明的液体
D.溶液中的溶质可以是固体、液体或气体
4.(2分)某固体M中加入一定量水后,红墨水向左移动,则固体M可能是下列哪种物质( )
A.氢氧化钠 B.硝酸铵 C.氯化钠 D.氧化钙
5.(2分)如图为鉴别饱和的氢氧化钙溶液与氢氧化钠溶液(分别编号为A、B),下列说法正确的是( )
A.若观察到A试管中出现白色浑浊,则为氢氧化钠
B.若观察到A试管中出现白色浑浊,则发生了化学变化
C.若观察到A试管中出现白色浑浊,则该物质的溶解度随温度升高而减小
D.若观察到B试管中无明显现象,则为氢氧化钙
6.(2分)能证实A物质的溶液是20℃时的饱和溶液的事实是( )
A.降温到10℃有A晶体析出
B.蒸发掉10克水,有A晶体析出
C.加热到30℃时,再加A物质能继续溶解
D.20℃时,向上述溶液中加入少量A晶体,溶液质量不变
7.(2分)下列关于溶解度的说法中,正确的是( )
A.溶解度曲线上的任意一点,都表示该物质该温度的饱和溶液
B.固体物质的溶解度都随温度的升高而增大
C.一切物质的溶解度只受温度的影响,不受其它因素的影响
D.搅拌能增大物质的溶解度
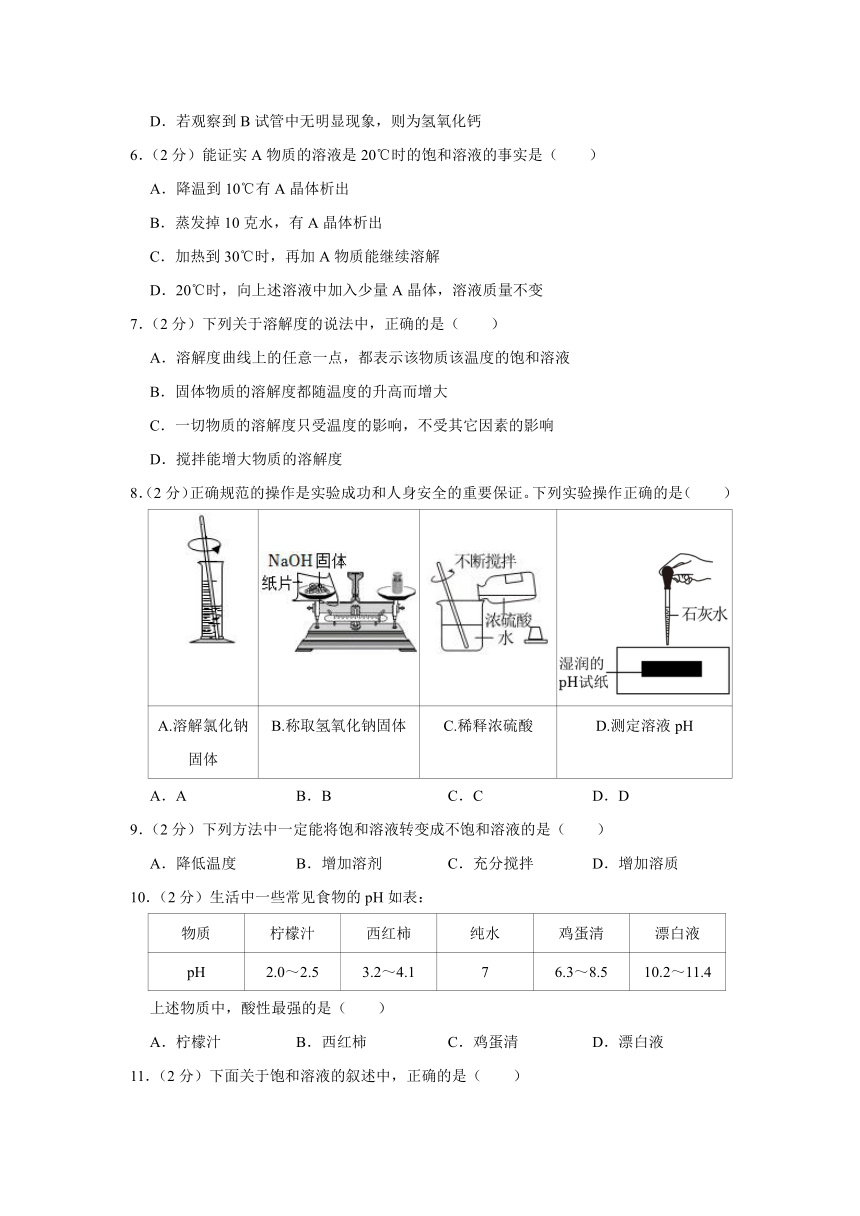
8.(2分)正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是( )
A.溶解氯化钠固体 B.称取氢氧化钠固体 C.稀释浓硫酸 D.测定溶液pH
A.A B.B C.C D.D
9.(2分)下列方法中一定能将饱和溶液转变成不饱和溶液的是( )
A.降低温度 B.增加溶剂 C.充分搅拌 D.增加溶质
10.(2分)生活中一些常见食物的pH如表:
物质 柠檬汁 西红柿 纯水 鸡蛋清 漂白液
pH 2.0~2.5 3.2~4.1 7 6.3~8.5 10.2~11.4
上述物质中,酸性最强的是( )
A.柠檬汁 B.西红柿 C.鸡蛋清 D.漂白液
11.(2分)下面关于饱和溶液的叙述中,正确的是( )
A.饱和溶液一定是浓溶液
B.饱和溶液一定是指不能溶解任何溶质的溶液
C.饱和溶液转化为不饱和溶液后溶液的质量一定增大
D.一定温度下析出晶体后的溶液一定是该溶质的饱和溶液
12.(2分)逻辑推理是一种重要的化学思维方法。下列推理正确的是( )
A.稀盐酸和稀硫酸具有相似的化学性质,因为它们的溶液中含有相同的氢离子
B.碱溶液能使无色酚酞试液变红,则能使无色酚酞试液变红的一定是碱溶液
C.中和反应一定有盐和水生成,有盐和水生成的反应一定是中和反应
D.氢氧化钠溶液能使无色酚酞试液变红,则氢氧化铜也能使无色酚酞试液变红
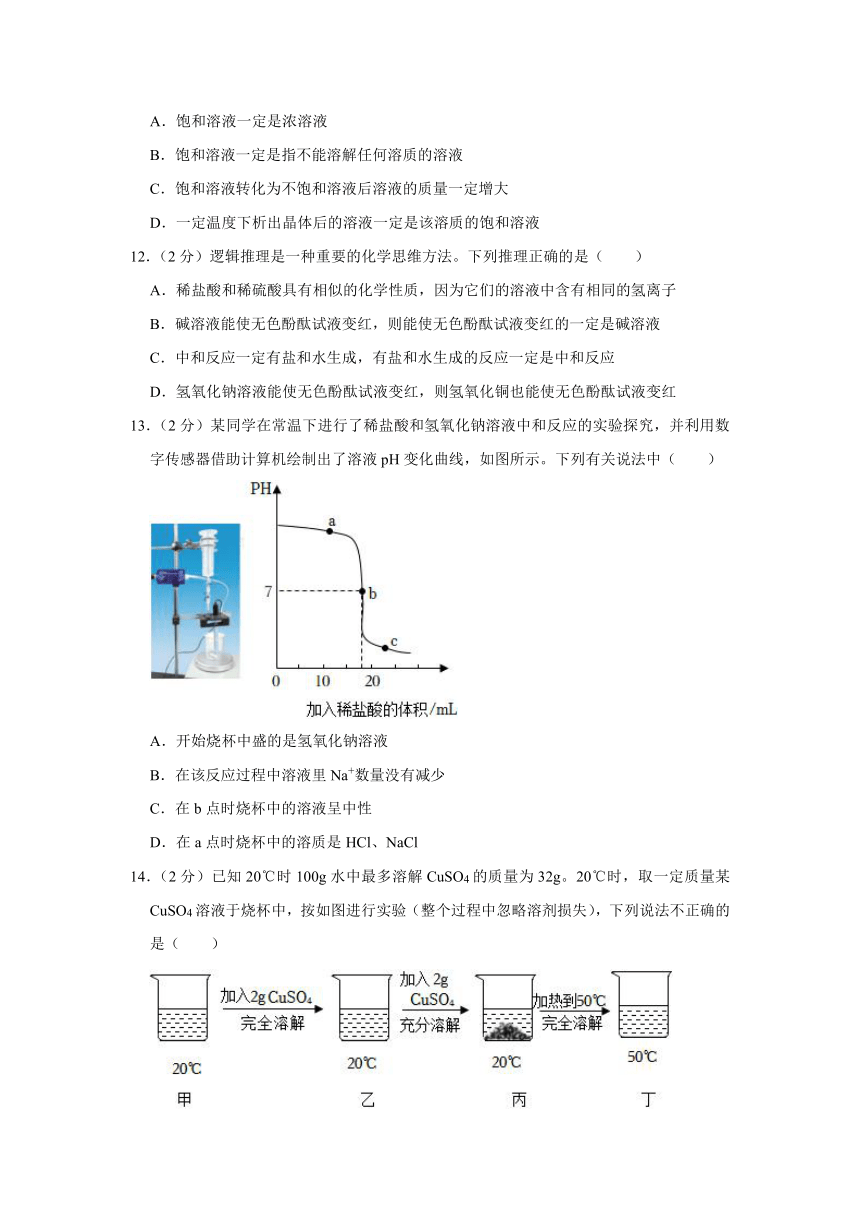
13.(2分)某同学在常温下进行了稀盐酸和氢氧化钠溶液中和反应的实验探究,并利用数字传感器借助计算机绘制出了溶液pH变化曲线,如图所示。下列有关说法中( )
A.开始烧杯中盛的是氢氧化钠溶液
B.在该反应过程中溶液里Na+数量没有减少
C.在b点时烧杯中的溶液呈中性
D.在a点时烧杯中的溶质是HCl、NaCl
14.(2分)已知20℃时100g水中最多溶解CuSO4的质量为32g。20℃时,取一定质量某CuSO4溶液于烧杯中,按如图进行实验(整个过程中忽略溶剂损失),下列说法不正确的是( )
A.溶液中溶质质量分数的大小关系为丁>丙>甲
B.丙中溶液溶质与溶剂的质量比为8:25
C.丁溶液一定是饱和溶液
D.50℃时CuSO4的最大溶解量比20℃时的大
15.(2分)下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗涤石油产品中的残余硫酸
②用碳酸钙作补钙剂
③用熟石灰改良酸性土壤
④用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒
A.①③④ B.①②③④ C.②③ D.①②
16.(2分)下列关于酸、碱、盐、氧化物分类完全正确的是( )
酸 碱 盐 氧化物
A 硫酸 氢氧化钠 氢氧化钾 干冰
B 硝酸 氢氧化钙 氯化钠 氧化铁
C 盐酸 硫酸铜 氯化铜 一氧化碳
D 碳酸 氢氧化钡 碳酸钙 氯酸钾
A.A B.B C.C D.D
17.(2分)下列变化不能通过一步反应就实现的是( )
A.H2SO4→H2O B.Fe2O3→FeSO4
C.Na2CO3→CaCO3 D.CaO→Ca(OH)2
18.(2分)下列物质露置于空气中,没有发生化学变化而质量增大的是( )
A.熟石灰 B.浓盐酸 C.浓硫酸 D.氢氧化钠
19.(2分)化学无处不在,如图所示是物质间发生化学反应时的颜色变化,其中X是( )
A.稀盐酸 B.稀硫酸
C.硫酸钠溶液 D.氯化钠溶液
20.(2分)下列图像分别对应四个变化过程,不能正确反映对应变化关系的是( )
A.浓盐酸敞口放置于空气中 B.浓硫酸敞口放置于空气中 C.向酸溶液中不断加水稀释 D.向碱溶液中不断加水稀释
A.A B.B C.C D.D
二、填空题(本题包括3小题,共24分)
21.(7分)从下列物质中,选择正确答案的序号填在相应的空格里:
①稀硫酸②生石灰③浓盐酸④烧碱⑤熟石灰⑥浓硫酸⑦碳酸钠溶液
(1)腐蚀性很强,工业上常用于造纸、肥皂的是 。
(2)一种重要的化工原料,常用于金属除锈的是 。
(3)可用于二氧化碳气体干燥剂的是 。
(4)打开瓶塞形成白雾的是 。
(5)微溶于水,其水溶液俗称石灰水的是 。
(6)可用于食品包装袋中干燥剂的是 。
(7)可与硫酸反应的盐溶液 。
22.(9分)A、B、C三种固体物质的溶解度曲线如图所示。请回答下列问题。
(1)写出p点的意义, 。
(2)t2℃时,A、B、C三种物质的溶解度由大到小的顺序为 。
(3)t2℃时,30gA物质溶于50g水中,形成 g饱和溶液。
(4)将C物质的不饱和溶液转化为饱和溶液,可采用的方法是 (写出一种方法即可)。
(5)将t1℃时等质量的A、B、C三种物质的饱和溶液分别升温到t2℃(忽略水分的蒸发),所得溶液的质量大小关系是 (用“>”、“<”或“=”表示)。
23.(8分)白醋是我们日常生活中常用的调味品,白醋中含有3%﹣5%的醋酸(化学式:CH3COOH)。醋酸可以通过粮食发酵酿造制得。常温下,纯的醋酸是无色有强烈刺激性酸味的液体,易溶于水和酒精,具有酸的通性,醋酸与氢氧化钠溶液反应的化学方程式为:CH3COOH+NaOH═CH3COONa+H2O。
(1)醋酸溶液解离出的阳离子是 。醋酸溶液的pH (填“>”“=”或“<”)7;写出一条醋酸的物理性质 。
(2)烧水壶中水垢的主要成分是碳酸钙和氢氧化镁,加入适量醋酸浸泡可以有效除去水垢,写出发生反应的一个化学方程式 。
(3)可以用澄清石灰水检验醋酸除水垢时生成的气体,请写出其反应的化学方程式 。
三、实验探究题(本题包括2小题,共26分)
24.(11分)如图为配制100g溶质质量分数为5%的氯化钠溶液的示意图。
请回答下列问题:
(1)用如图所示的序号表示正确配制该溶液的操作顺序为 。
(2)仪器a的名称为 。
(3)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向右盘,应 。
A.增加适量氯化钠固体
B.减少适量氯化钠固体
C.调节平衡螺母
(4)溶解时用玻璃棒搅拌,其目的是 。
(5)在配制中用 (填“50mL或者“100mL)量筒,量取水时若仰视读数,则会导致配得溶液的溶质质量分数的 (选填“偏大”或“偏小”)。
(6)若用溶质质量分数为10%的氯化钠溶液配制100g溶质质量分数为5%的氯化钠溶液,则需要10%的溶液质量为 。
25.(15分)学习化学开启了我们认识物质之旅。某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
【探究一】氢氧化钠的化学性质
如图1所示,同学们用氢氧化钠溶液进行了系列实验,请分析并回答下列问题:
(1)A试管中观察到的现象是 。
(2)B试管中观察到的现象是 ,写出B试管中化学方程式 。
(3)D试管中无明显现象,为了证明D中已发生化学反应,向该试管中再加入 ,观察到有 产生。写出二氧化碳与氢氧化钠发生反应的化学方程式 。
【探究二】C试管中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应
(4)同学们设计如图2实验,观察到明显现象,请写出步骤Ⅰ中所加试剂 。从微观上分析,氢氧化钠和稀盐酸反应的实质是 。
(5)写出G试管中溶质 (用化学式表示)。下列物质加入G试管中一定能出现明显现象的是 。
A.锌
B.氧化铁
C.碳酸钙
D.澄清石灰水
四、计算题(本题包括2小题,共10分)
26.(4分)过氧化氢(H2O2)既是工业上的重要的氧化剂,又是常用的医用消毒剂。
(1)配制500g溶质质量分数为6%的过氧化氢溶液,该溶液中溶质为 g。
(2)若要将此溶液稀释为4%,则需要加入水 g。
27.(6分)硫酸亚铁在工农业生产中有重要作用。在实验室里,某化学兴趣小组利用稀硫酸和废铁屑制取硫酸亚铁,该实验过程测得数据如图所示。请回答:
(1)反应结束时,生成氢气的质量为 g。
(2)计算所用稀硫酸溶质的质量分数(写出计算过程)。
一、选择题(本题包括20小题,每小题2分,共40分。每小题只有一个选项符合题意)
1.(2分)下列过程主要发生化学变化的是( )
A.氯化钠溶于水
B.用降温结晶从硝酸钾饱和溶液中提取硝酸钾固体
C.盐酸挥发
D.氢氧化钠露置于空气中变质
2.(2分)生活中的下列物质放入水中,能形成溶液的是( )
A.植物油 B.面粉 C.食盐 D.泥沙
3.(2分)溶液广泛应用于生产、生活。下列说法不正确的是( )
A.洗涤剂去油污的原理是乳化
B.均一、稳定的液体不一定是溶液
C.溶液一定是无色透明的液体
D.溶液中的溶质可以是固体、液体或气体
4.(2分)某固体M中加入一定量水后,红墨水向左移动,则固体M可能是下列哪种物质( )
A.氢氧化钠 B.硝酸铵 C.氯化钠 D.氧化钙
5.(2分)如图为鉴别饱和的氢氧化钙溶液与氢氧化钠溶液(分别编号为A、B),下列说法正确的是( )
A.若观察到A试管中出现白色浑浊,则为氢氧化钠
B.若观察到A试管中出现白色浑浊,则发生了化学变化
C.若观察到A试管中出现白色浑浊,则该物质的溶解度随温度升高而减小
D.若观察到B试管中无明显现象,则为氢氧化钙
6.(2分)能证实A物质的溶液是20℃时的饱和溶液的事实是( )
A.降温到10℃有A晶体析出
B.蒸发掉10克水,有A晶体析出
C.加热到30℃时,再加A物质能继续溶解
D.20℃时,向上述溶液中加入少量A晶体,溶液质量不变
7.(2分)下列关于溶解度的说法中,正确的是( )
A.溶解度曲线上的任意一点,都表示该物质该温度的饱和溶液
B.固体物质的溶解度都随温度的升高而增大
C.一切物质的溶解度只受温度的影响,不受其它因素的影响
D.搅拌能增大物质的溶解度
8.(2分)正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是( )
A.溶解氯化钠固体 B.称取氢氧化钠固体 C.稀释浓硫酸 D.测定溶液pH
A.A B.B C.C D.D
9.(2分)下列方法中一定能将饱和溶液转变成不饱和溶液的是( )
A.降低温度 B.增加溶剂 C.充分搅拌 D.增加溶质
10.(2分)生活中一些常见食物的pH如表:
物质 柠檬汁 西红柿 纯水 鸡蛋清 漂白液
pH 2.0~2.5 3.2~4.1 7 6.3~8.5 10.2~11.4
上述物质中,酸性最强的是( )
A.柠檬汁 B.西红柿 C.鸡蛋清 D.漂白液
11.(2分)下面关于饱和溶液的叙述中,正确的是( )
A.饱和溶液一定是浓溶液
B.饱和溶液一定是指不能溶解任何溶质的溶液
C.饱和溶液转化为不饱和溶液后溶液的质量一定增大
D.一定温度下析出晶体后的溶液一定是该溶质的饱和溶液
12.(2分)逻辑推理是一种重要的化学思维方法。下列推理正确的是( )
A.稀盐酸和稀硫酸具有相似的化学性质,因为它们的溶液中含有相同的氢离子
B.碱溶液能使无色酚酞试液变红,则能使无色酚酞试液变红的一定是碱溶液
C.中和反应一定有盐和水生成,有盐和水生成的反应一定是中和反应
D.氢氧化钠溶液能使无色酚酞试液变红,则氢氧化铜也能使无色酚酞试液变红
13.(2分)某同学在常温下进行了稀盐酸和氢氧化钠溶液中和反应的实验探究,并利用数字传感器借助计算机绘制出了溶液pH变化曲线,如图所示。下列有关说法中( )
A.开始烧杯中盛的是氢氧化钠溶液
B.在该反应过程中溶液里Na+数量没有减少
C.在b点时烧杯中的溶液呈中性
D.在a点时烧杯中的溶质是HCl、NaCl
14.(2分)已知20℃时100g水中最多溶解CuSO4的质量为32g。20℃时,取一定质量某CuSO4溶液于烧杯中,按如图进行实验(整个过程中忽略溶剂损失),下列说法不正确的是( )
A.溶液中溶质质量分数的大小关系为丁>丙>甲
B.丙中溶液溶质与溶剂的质量比为8:25
C.丁溶液一定是饱和溶液
D.50℃时CuSO4的最大溶解量比20℃时的大
15.(2分)下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液洗涤石油产品中的残余硫酸
②用碳酸钙作补钙剂
③用熟石灰改良酸性土壤
④用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒
A.①③④ B.①②③④ C.②③ D.①②
16.(2分)下列关于酸、碱、盐、氧化物分类完全正确的是( )
酸 碱 盐 氧化物
A 硫酸 氢氧化钠 氢氧化钾 干冰
B 硝酸 氢氧化钙 氯化钠 氧化铁
C 盐酸 硫酸铜 氯化铜 一氧化碳
D 碳酸 氢氧化钡 碳酸钙 氯酸钾
A.A B.B C.C D.D
17.(2分)下列变化不能通过一步反应就实现的是( )
A.H2SO4→H2O B.Fe2O3→FeSO4
C.Na2CO3→CaCO3 D.CaO→Ca(OH)2
18.(2分)下列物质露置于空气中,没有发生化学变化而质量增大的是( )
A.熟石灰 B.浓盐酸 C.浓硫酸 D.氢氧化钠
19.(2分)化学无处不在,如图所示是物质间发生化学反应时的颜色变化,其中X是( )
A.稀盐酸 B.稀硫酸
C.硫酸钠溶液 D.氯化钠溶液
20.(2分)下列图像分别对应四个变化过程,不能正确反映对应变化关系的是( )
A.浓盐酸敞口放置于空气中 B.浓硫酸敞口放置于空气中 C.向酸溶液中不断加水稀释 D.向碱溶液中不断加水稀释
A.A B.B C.C D.D
二、填空题(本题包括3小题,共24分)
21.(7分)从下列物质中,选择正确答案的序号填在相应的空格里:
①稀硫酸②生石灰③浓盐酸④烧碱⑤熟石灰⑥浓硫酸⑦碳酸钠溶液
(1)腐蚀性很强,工业上常用于造纸、肥皂的是 。
(2)一种重要的化工原料,常用于金属除锈的是 。
(3)可用于二氧化碳气体干燥剂的是 。
(4)打开瓶塞形成白雾的是 。
(5)微溶于水,其水溶液俗称石灰水的是 。
(6)可用于食品包装袋中干燥剂的是 。
(7)可与硫酸反应的盐溶液 。
22.(9分)A、B、C三种固体物质的溶解度曲线如图所示。请回答下列问题。
(1)写出p点的意义, 。
(2)t2℃时,A、B、C三种物质的溶解度由大到小的顺序为 。
(3)t2℃时,30gA物质溶于50g水中,形成 g饱和溶液。
(4)将C物质的不饱和溶液转化为饱和溶液,可采用的方法是 (写出一种方法即可)。
(5)将t1℃时等质量的A、B、C三种物质的饱和溶液分别升温到t2℃(忽略水分的蒸发),所得溶液的质量大小关系是 (用“>”、“<”或“=”表示)。
23.(8分)白醋是我们日常生活中常用的调味品,白醋中含有3%﹣5%的醋酸(化学式:CH3COOH)。醋酸可以通过粮食发酵酿造制得。常温下,纯的醋酸是无色有强烈刺激性酸味的液体,易溶于水和酒精,具有酸的通性,醋酸与氢氧化钠溶液反应的化学方程式为:CH3COOH+NaOH═CH3COONa+H2O。
(1)醋酸溶液解离出的阳离子是 。醋酸溶液的pH (填“>”“=”或“<”)7;写出一条醋酸的物理性质 。
(2)烧水壶中水垢的主要成分是碳酸钙和氢氧化镁,加入适量醋酸浸泡可以有效除去水垢,写出发生反应的一个化学方程式 。
(3)可以用澄清石灰水检验醋酸除水垢时生成的气体,请写出其反应的化学方程式 。
三、实验探究题(本题包括2小题,共26分)
24.(11分)如图为配制100g溶质质量分数为5%的氯化钠溶液的示意图。
请回答下列问题:
(1)用如图所示的序号表示正确配制该溶液的操作顺序为 。
(2)仪器a的名称为 。
(3)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向右盘,应 。
A.增加适量氯化钠固体
B.减少适量氯化钠固体
C.调节平衡螺母
(4)溶解时用玻璃棒搅拌,其目的是 。
(5)在配制中用 (填“50mL或者“100mL)量筒,量取水时若仰视读数,则会导致配得溶液的溶质质量分数的 (选填“偏大”或“偏小”)。
(6)若用溶质质量分数为10%的氯化钠溶液配制100g溶质质量分数为5%的氯化钠溶液,则需要10%的溶液质量为 。
25.(15分)学习化学开启了我们认识物质之旅。某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
【探究一】氢氧化钠的化学性质
如图1所示,同学们用氢氧化钠溶液进行了系列实验,请分析并回答下列问题:
(1)A试管中观察到的现象是 。
(2)B试管中观察到的现象是 ,写出B试管中化学方程式 。
(3)D试管中无明显现象,为了证明D中已发生化学反应,向该试管中再加入 ,观察到有 产生。写出二氧化碳与氢氧化钠发生反应的化学方程式 。
【探究二】C试管中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应
(4)同学们设计如图2实验,观察到明显现象,请写出步骤Ⅰ中所加试剂 。从微观上分析,氢氧化钠和稀盐酸反应的实质是 。
(5)写出G试管中溶质 (用化学式表示)。下列物质加入G试管中一定能出现明显现象的是 。
A.锌
B.氧化铁
C.碳酸钙
D.澄清石灰水
四、计算题(本题包括2小题,共10分)
26.(4分)过氧化氢(H2O2)既是工业上的重要的氧化剂,又是常用的医用消毒剂。
(1)配制500g溶质质量分数为6%的过氧化氢溶液,该溶液中溶质为 g。
(2)若要将此溶液稀释为4%,则需要加入水 g。
27.(6分)硫酸亚铁在工农业生产中有重要作用。在实验室里,某化学兴趣小组利用稀硫酸和废铁屑制取硫酸亚铁,该实验过程测得数据如图所示。请回答:
(1)反应结束时,生成氢气的质量为 g。
(2)计算所用稀硫酸溶质的质量分数(写出计算过程)。
同课章节目录
