专题 化学平衡常数和转化率(共42张PPT)
文档属性
| 名称 | 专题 化学平衡常数和转化率(共42张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 22:32:52 | ||
图片预览










文档简介
(共42张PPT)
专题 化学平衡常数和转化率
考题统计
化学平衡常数和转化率:
湖北卷(2023),山东卷(2023、2022、2021、2020),湖南卷(2023、2022、2021),广东卷(2022、2021),海南卷(2022、2021),河北卷(2022、2021),天津卷(2021、2020),重庆卷(2022、2021),北京卷(2021、2020),全国新课标卷(2023)
聚焦核心要点
要点1化学平衡常数及应用
课标指引:1.认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义。 2.能书写平衡常数表达式,能进行平衡常数的简单计算。
1.高考常考的三种化学平衡常数[以反应mA(g)+nB(g) pC(g)+qD(g)为例]
2.结合化学方程式计算平衡常数
(1)同一可逆反应中,K(正)·K(逆)=1,其中K(正)表示正反应平衡常数,K(逆)表示逆反应平衡常数。
(2)若两个可逆反应的方程式相加,得到总反应方程式,如反应①+反应②=反应③,则总反应的平衡常数等于各分步反应的平衡常数之积,则有K3=K1·K2。
(3)若两个可逆反应的方程式相减,得到总反应方程式,如反应①-反应②=反应③,则总反应的平衡常数等于各分步反应的平衡常数之商,则有
要点2转化率和产率的计算
课标指引:1.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。 2.能进行转化率、产率的简单计算。
1.掌握常考的四种计算关系
变化量可以是物质的量或物质的量浓度
计算理论产量时,要注意过量计算
2.掌握常用的两个定量关系
易错辨析
1.减小反应物的浓度,平衡逆向移动,化学平衡常数减小。( )
2.化学平衡常数表达式中应含有参加反应的所有物质。( )
3.化学平衡常数能体现可逆反应进行的程度。( )
4.平衡常数发生变化,化学平衡必定发生移动。( )
×
K值只受温度影响,与物质的浓度、压强变化无关。
×
固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中。
√
K值越大,反应进行的程度越大。
√
平衡常数发生变化,说明温度发生改变,故化学平衡必定发生移动。
精研核心命题
命题点1化学平衡常数及计算
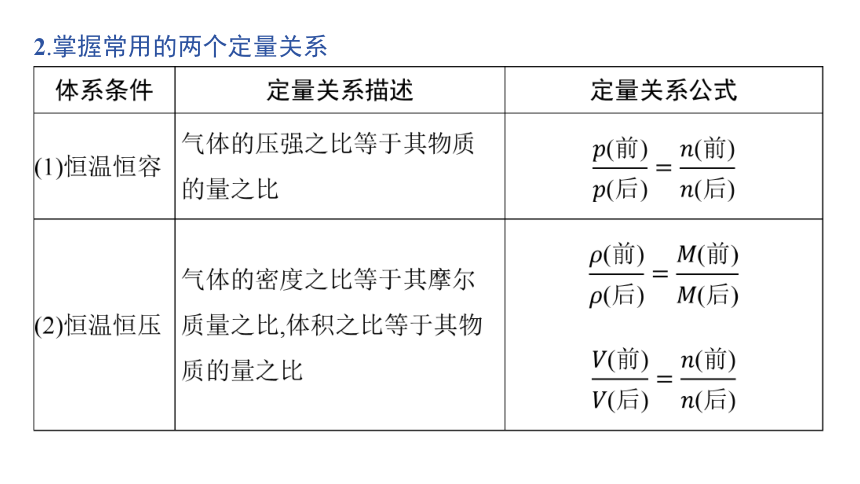
典例1 (2023·全国新课标卷,29节选)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。
在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为
图1
图2
(1)图中压强由小到大的顺序为 ,判断的依据是
。
(2)进料组成中含有惰性气体Ar的图是 。
(3)图2中,当p2=20 MPa、 =0.20时,氮气的转化率α= 。该温度时,反应 H2(g) NH3(g)的平衡常数Kp= (MPa)-1 (化为最简式)。
p1该反应是气体体积减小的反应,相同温度下,增大压强,平衡正向移动,氨的摩尔分数增大
图2
33.33%
解析 (1)合成氨的反应为气体体积减小的反应,同一温度下,增大压强,平衡向生成氨的方向移动,氨的摩尔分数增大,故图中压强p1(2)混有Ar的混合气中,N2、H2含量降低,Ar起到“稀释”作用,均不利于合成NH3,同温、同压下,NH3的摩尔分数减小,因此图2符合题意。
(3)设起始时N2的物质的量为0.25 mol,H2的物质的量为0.75 mol,反应达平衡时N2的转化量为x mol,根据题意列出三段式:
开始/mol 0.25 0.75 0
转化/mol x 3x 2x
平衡/mol 0.25-x 0.75-3x 2x
变式演练(2023·天津十二区重点校联考)利用反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH<0可实现由CO2向C2H4的转化。在恒压密闭容器中,起始充入2 mol CO2(g)和6 mol H2(g)发生反应,该反应在
不同的温度下达到平衡时,各组分的体积分数随
温度的变化如图所示。
(1)图中表示CO2的体积分数随温度变化的曲线是
(填字母,从曲线“k”“l”“m”或“n”中选择)。
(2)A、B、C三点对应的化学平衡常数分别为
l
KA、KB、KC,则三者从大到小的排列顺序为 。
(3)C点反应达到平衡后,若平衡时总压为p,则平衡常数Kp= (列出计算式,以分压表示,气体分压=总压×气体的物质的量分数)。
KB>KA>KC
解析 (1)该反应是放热反应,升高温度,平衡逆向移动,则H2的体积分数随温度升高而增大,C2H4的体积分数随温度的升高而减小。起始充入2 mol CO2(g)和6 mol H2(g),反应中CO2和H2的转化量之比为1∶3,故过程中CO2和H2的体积分数之比也为1∶3,C2H4和H2O的体积分数之比为1∶4,结合图示可知表示H2和C2H4的体积分数随温度变化的曲线分别为k、n,表示CO2的体积分数随温度变化的曲线是l。
(2)升高温度,平衡逆向移动,则化学平衡常数减小,A、B、C三点对应的化学平衡常数从大到小的顺序为KB>KA>KC。
(3)C点温度为357 ℃,反应达到平衡时:设CO2转化了2x mol,根据三段式:
2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
起始/mol 2 6 0 0
转化/mol 2x 6x x 4x
平衡/mol 2-2x 6-6x x 4x
由题图可知,357 ℃时反应达平衡后,CO2和H2O的体积分数相等,2-2x=4x,解得x=容器中气体的总物质的量为(2-2x+6-6x+x+4x) mol=(8-3x) mol=7 mol,若平衡时总压为p,则
【思维建模】
计算压强平衡常数(Kp)的思维模型
在化学平衡体系中,用各气体物质的平衡分压替代平衡浓度计算的平衡常数叫压强平衡常数(Kp),计算步骤如下:
命题点2平衡转化率和平衡浓度的计算
典例2 (2022·海南卷,16节选)已知:CO2(g)+4H2(g) 2H2O(g)+CH4(g)的平衡常数(K)与反应温度(t)之间的关系如图所示。
某研究小组模拟该反应,温度t下,向容积为10 L的抽空的密闭容器中通入0.1 mol CO2和0.4 mol H2,反应平衡后测得容器中n(CH4)=0.05 mol,则CO2的转化率为 ,反应温度t约为
℃。
50%
660
解析 反应平衡后测得容器中n(CH4)=0.05 mol,列出“三段式”如下:
CO2(g)+4H2(g) 2H2O(g) + CH4(g)
起始/mol 0.1 0.4 0 0
转化/mol 0.05 0.2 0.1 0.05
平衡/mol 0.05 0.2 0.1 0.05
变式演练(2023·北京朝阳区一模)向容积为1 L的密闭容器中充入一定量CH3OH(g),发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH<0。
编号 起始物质的量/mol 平衡物质的量/mol CH3OH(g) CH3OCH3(g) H2O(g)
Ⅰ T1 0.4 0.16 0.16
Ⅱ T2 0.2 0.09 0.09
下列说法不正确的是( )
A.T1>T2
B.T1 ℃,该反应的平衡常数K=4
C.Ⅱ中存在:c(CH3OH)+2c(CH3OCH3)=0.2 mol·L-1
D.T1 ℃时,向该容器中充入物质的量均为0.2 mol的3种气体,反应将逆向进行
D
解析 结合表中数据列出T1 ℃温度时“三段式”:
2CH3OH(g) CH3OCH3(g)+H2O(g)
起始/mol 0.4 0 0
转化/mol 0.32 0.16 0.16
平衡/mol 0.08 0.16 0.16
训练分层落实
练真题·明考向
1.(2022·重庆卷)两种酸式碳酸盐的分解反应如下,某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s) NH3(g)+H2O(g)+CO2(g) p1=3.6×104 Pa
反应2:2NaHCO3(s) Na2CO3(s)+H2O(g)+CO2(g) p2=4×103 Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是( )
A.反应2的平衡常数为4×106 Pa2
B.通入NH3,再次平衡后,总压强增大
C.平衡后总压强为4.36×105 Pa
D.缩小容积,再次平衡后总压强不变
B
2.(2022·湖南卷,16节选)在一定温度下,向容积固定的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4 kJ·mol-1
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
(1)下列说法正确的是 。
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数可能大于
D.将炭块粉碎,可加快反应速率
BD
(2)反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 mol。此时,整个体系 (填“吸收”或“放出”)热量 kJ,反应Ⅰ的平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
吸收
31.2
0.02 MPa
解析 (2)反应平衡时,H2O(g)的转化率为50%,则消耗H2O(g)的物质的量为
1 mol×50%=0.5 mol。CO的物质的量为0.1 mol,据O原子守恒可知,n(CO2)=
0.2 mol,生成0.2 mol CO2时消耗0.2 mol CO,故反应Ⅰ实际生成0.3 mol CO。据热化学方程式可知,生成0.3 mol CO要吸收热量39.42 kJ,生成0.2 mol CO2要放出热量8.22 kJ,此时整个体系吸收热量为39.42 kJ-8.22 kJ=31.2 kJ。
由H原子守恒可知,平衡时n(H2)=0.5 mol,n(CO)=0.1 mol,n(CO2)=0.2 mol,n(H2O)=0.5 mol,则平衡时气体的总物质的量为0.5 mol+0.1 mol+0.2 mol+
0.5 mol=1.3 mol。在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,则平衡体系的总压为0.2 MPa×1.3=0.26 MPa,故反应Ⅰ的平衡常数
练易错·避陷阱
3.(2023·北京丰台区一模)下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是( )
化学反应 平衡常数 温度 973 K 1 173 K
①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1 K1 1.47 2.15
②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2 K2 2.38 1.67
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3 K3 a b
A.1 173 K时,反应①起始c(CO2)=0.6 mol·L-1,平衡时c(CO2)约为0.4 mol·L-1
B.反应②是吸热反应,ΔH2>0
C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动
D.相同温度下,K3= ;ΔH3=ΔH2-ΔH1
D
解析 1 173 K时,反应①起始c(CO2)=0.6 mol·L-1,设CO2的转化量为x mol·L-1,列出三段式:
Fe(s)+CO2(g) FeO(s)+CO(g)
起始/(mol·L-1) 0.6 0
转化/(mol·L-1) x x
平衡/(mol·L-1) 0.6-x x
4.(2023·广东深圳一模)恒容密闭容器中,n mol CO2与3n mol H2在不同温度下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是( )
A.该反应的平衡常数随温度升高而增大
B.曲线Y表示c(C2H4)随温度的变化关系
C.提高投料比[n(CO2)∶n(H2)],可提高H2的平衡转化率
D.其他条件不变,2n mol CO2与6n mol H2在T1 ℃下反应,达到平衡时c(H2)C
解析 由题图可知,温度升高,H2的平衡浓度增大,说明平衡逆向移动,则该反应为放热反应,平衡常数随温度升高而减小,A错误;结合反应可知,Δc(C2H4)为Δc(H2O)的 ,则曲线Y表示c(H2O)随温度的变化关系,B错误;提高投料比[n(CO2)∶n(H2)],平衡正向移动,H2的平衡转化率增大,C正确;其他条件不变,2n mol CO2与6n mol H2在T1 ℃下反应,相当于增大压强,该反应是气体体积减小的反应,平衡正向移动,H2的浓度减小,当然仍大于n mol CO2与3n mol H2在T1 ℃下发生反应时H2的平衡浓度,D错误。
练预测·押考向
5.氨气去除NO的反应原理为4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH<0,反应速率与浓度之间存在如下关系:v(正)=k(正)·c4(NH3)·c6(NO), v(逆)=k(逆)·c5(N2)·c6(H2O),k(正)、k(逆)为速率常数,只受温度影响。350 ℃时,在2 L恒容密闭容器中,通入0.45 mol NH3(g)和0.6 mol NO(g)发生反应,保持温度不变,5 min后反应达平衡,NO的转化率为50%。下列说法正确的是( )
A.用NH3表示的化学反应速率为0.06 mol·L-1·min-1
B.350 ℃时,该反应的平衡常数为0.5
C.其他条件不变,往反应后的容器中再通入0.45 mol NH3(g)和0.6 mol NO(g),重新达平衡时NO的体积分数减小
D.当温度改变为T ℃时,若k(正)=k(逆),则T<350
D
解析 由题意可列如下三段式:
4NH3(g)+6NO(g) 5N2(g)+6H2O(g)
起始/mol 0.45 0.6 0 0
转化/mol 0.2 0.3 0.25 0.3
平衡/mol 0.25 0.3 0.25 0.3
6.我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]制备三甲胺[N(CH3)3],反应方程式如下:(CH3)2NCHO(g)+2H2(g) N(CH3)3(g)+H2O(g) ΔH=-144 kJ·mol-1。向容积相等的Ⅰ、Ⅱ两个恒容密闭容器中分别充入1 mol DMF(g)和2 mol H2(g)发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
(1)容器Ⅰ中为 (填“绝热”或“恒温”)过程,判断的依据是 。
(2)若该反应是在恒温恒容的密闭容器中发生,以下能说明该反应达到化学平衡状态的是 (填字母)。
A.混合气体的密度不再发生改变
B.反应容器中H2的质量分数不变
C.2v正(H2)=v逆(H2O)
D.平均相对分子质量不变
E.该反应的焓变,即ΔH不变
(3)n点时反应的平衡常数Kp= kPa-1(提示:用分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
绝热
容器Ⅰ中的压强比容器Ⅱ中的压强大
BD
0.562 5
解析 (1)该反应是放热反应,若容器绝热,则反应过程中温度升高,不利于平衡正向移动;又知该反应的正反应是气体体积减小的反应,容器的压强大于恒温容器中平衡时的压强,题图中容器Ⅰ中的压强比容器Ⅱ中的压强大,则容器Ⅰ中为绝热过程。
(2)该反应中气体总质量和总体积都不变,则混合气体的密度是定值,不能说明反应达到平衡,A错误;反应容器中H2的质量分数不变,其浓度不变,则该反应达到平衡,B正确;达到平衡时,v正(H2)=2v逆(H2O),C错误;该反应中气体平均相对分子质量增大,当混合气体平均相对分子质量不变时,则反应达到平衡,D正确;该反应的焓变是定值,ΔH不变,不能判断反应是否平衡,E错误。③n点反应达到平衡,此时体系压强为36 kPa,起始压强是48 kPa,设(CH3)2NCHO的转化量为x mol,根据已知条件列出三段式:
(CH3)2NCHO(g) + 2H2(g) N(CH3)3(g)+H2O(g)
起始/mol 1 2 0 0
转化/mol x 2x x x
平衡/mol 1-x 2-2x x x
专题 化学平衡常数和转化率
考题统计
化学平衡常数和转化率:
湖北卷(2023),山东卷(2023、2022、2021、2020),湖南卷(2023、2022、2021),广东卷(2022、2021),海南卷(2022、2021),河北卷(2022、2021),天津卷(2021、2020),重庆卷(2022、2021),北京卷(2021、2020),全国新课标卷(2023)
聚焦核心要点
要点1化学平衡常数及应用
课标指引:1.认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义。 2.能书写平衡常数表达式,能进行平衡常数的简单计算。
1.高考常考的三种化学平衡常数[以反应mA(g)+nB(g) pC(g)+qD(g)为例]
2.结合化学方程式计算平衡常数
(1)同一可逆反应中,K(正)·K(逆)=1,其中K(正)表示正反应平衡常数,K(逆)表示逆反应平衡常数。
(2)若两个可逆反应的方程式相加,得到总反应方程式,如反应①+反应②=反应③,则总反应的平衡常数等于各分步反应的平衡常数之积,则有K3=K1·K2。
(3)若两个可逆反应的方程式相减,得到总反应方程式,如反应①-反应②=反应③,则总反应的平衡常数等于各分步反应的平衡常数之商,则有
要点2转化率和产率的计算
课标指引:1.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。 2.能进行转化率、产率的简单计算。
1.掌握常考的四种计算关系
变化量可以是物质的量或物质的量浓度
计算理论产量时,要注意过量计算
2.掌握常用的两个定量关系
易错辨析
1.减小反应物的浓度,平衡逆向移动,化学平衡常数减小。( )
2.化学平衡常数表达式中应含有参加反应的所有物质。( )
3.化学平衡常数能体现可逆反应进行的程度。( )
4.平衡常数发生变化,化学平衡必定发生移动。( )
×
K值只受温度影响,与物质的浓度、压强变化无关。
×
固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中。
√
K值越大,反应进行的程度越大。
√
平衡常数发生变化,说明温度发生改变,故化学平衡必定发生移动。
精研核心命题
命题点1化学平衡常数及计算
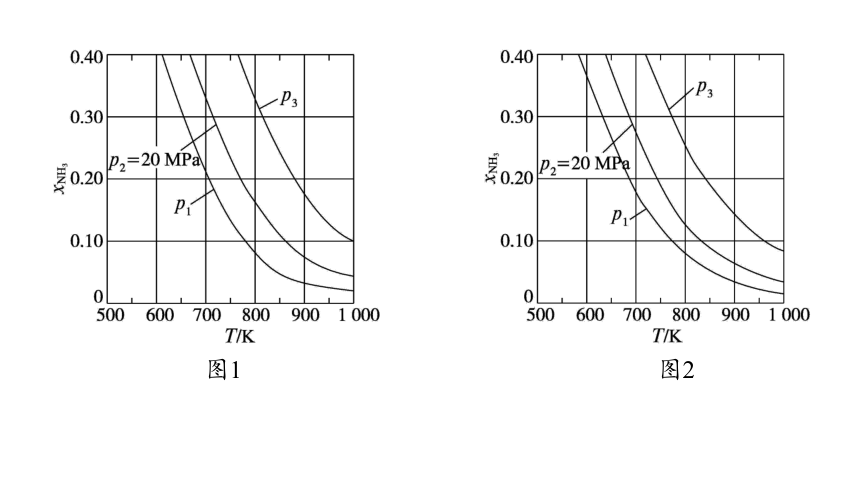
典例1 (2023·全国新课标卷,29节选)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。
在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为
图1
图2
(1)图中压强由小到大的顺序为 ,判断的依据是
。
(2)进料组成中含有惰性气体Ar的图是 。
(3)图2中,当p2=20 MPa、 =0.20时,氮气的转化率α= 。该温度时,反应 H2(g) NH3(g)的平衡常数Kp= (MPa)-1 (化为最简式)。
p1
图2
33.33%
解析 (1)合成氨的反应为气体体积减小的反应,同一温度下,增大压强,平衡向生成氨的方向移动,氨的摩尔分数增大,故图中压强p1
(3)设起始时N2的物质的量为0.25 mol,H2的物质的量为0.75 mol,反应达平衡时N2的转化量为x mol,根据题意列出三段式:
开始/mol 0.25 0.75 0
转化/mol x 3x 2x
平衡/mol 0.25-x 0.75-3x 2x
变式演练(2023·天津十二区重点校联考)利用反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH<0可实现由CO2向C2H4的转化。在恒压密闭容器中,起始充入2 mol CO2(g)和6 mol H2(g)发生反应,该反应在
不同的温度下达到平衡时,各组分的体积分数随
温度的变化如图所示。
(1)图中表示CO2的体积分数随温度变化的曲线是
(填字母,从曲线“k”“l”“m”或“n”中选择)。
(2)A、B、C三点对应的化学平衡常数分别为
l
KA、KB、KC,则三者从大到小的排列顺序为 。
(3)C点反应达到平衡后,若平衡时总压为p,则平衡常数Kp= (列出计算式,以分压表示,气体分压=总压×气体的物质的量分数)。
KB>KA>KC
解析 (1)该反应是放热反应,升高温度,平衡逆向移动,则H2的体积分数随温度升高而增大,C2H4的体积分数随温度的升高而减小。起始充入2 mol CO2(g)和6 mol H2(g),反应中CO2和H2的转化量之比为1∶3,故过程中CO2和H2的体积分数之比也为1∶3,C2H4和H2O的体积分数之比为1∶4,结合图示可知表示H2和C2H4的体积分数随温度变化的曲线分别为k、n,表示CO2的体积分数随温度变化的曲线是l。
(2)升高温度,平衡逆向移动,则化学平衡常数减小,A、B、C三点对应的化学平衡常数从大到小的顺序为KB>KA>KC。
(3)C点温度为357 ℃,反应达到平衡时:设CO2转化了2x mol,根据三段式:
2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
起始/mol 2 6 0 0
转化/mol 2x 6x x 4x
平衡/mol 2-2x 6-6x x 4x
由题图可知,357 ℃时反应达平衡后,CO2和H2O的体积分数相等,2-2x=4x,解得x=容器中气体的总物质的量为(2-2x+6-6x+x+4x) mol=(8-3x) mol=7 mol,若平衡时总压为p,则
【思维建模】
计算压强平衡常数(Kp)的思维模型
在化学平衡体系中,用各气体物质的平衡分压替代平衡浓度计算的平衡常数叫压强平衡常数(Kp),计算步骤如下:
命题点2平衡转化率和平衡浓度的计算
典例2 (2022·海南卷,16节选)已知:CO2(g)+4H2(g) 2H2O(g)+CH4(g)的平衡常数(K)与反应温度(t)之间的关系如图所示。
某研究小组模拟该反应,温度t下,向容积为10 L的抽空的密闭容器中通入0.1 mol CO2和0.4 mol H2,反应平衡后测得容器中n(CH4)=0.05 mol,则CO2的转化率为 ,反应温度t约为
℃。
50%
660
解析 反应平衡后测得容器中n(CH4)=0.05 mol,列出“三段式”如下:
CO2(g)+4H2(g) 2H2O(g) + CH4(g)
起始/mol 0.1 0.4 0 0
转化/mol 0.05 0.2 0.1 0.05
平衡/mol 0.05 0.2 0.1 0.05
变式演练(2023·北京朝阳区一模)向容积为1 L的密闭容器中充入一定量CH3OH(g),发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH<0。
编号 起始物质的量/mol 平衡物质的量/mol CH3OH(g) CH3OCH3(g) H2O(g)
Ⅰ T1 0.4 0.16 0.16
Ⅱ T2 0.2 0.09 0.09
下列说法不正确的是( )
A.T1>T2
B.T1 ℃,该反应的平衡常数K=4
C.Ⅱ中存在:c(CH3OH)+2c(CH3OCH3)=0.2 mol·L-1
D.T1 ℃时,向该容器中充入物质的量均为0.2 mol的3种气体,反应将逆向进行
D
解析 结合表中数据列出T1 ℃温度时“三段式”:
2CH3OH(g) CH3OCH3(g)+H2O(g)
起始/mol 0.4 0 0
转化/mol 0.32 0.16 0.16
平衡/mol 0.08 0.16 0.16
训练分层落实
练真题·明考向
1.(2022·重庆卷)两种酸式碳酸盐的分解反应如下,某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s) NH3(g)+H2O(g)+CO2(g) p1=3.6×104 Pa
反应2:2NaHCO3(s) Na2CO3(s)+H2O(g)+CO2(g) p2=4×103 Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是( )
A.反应2的平衡常数为4×106 Pa2
B.通入NH3,再次平衡后,总压强增大
C.平衡后总压强为4.36×105 Pa
D.缩小容积,再次平衡后总压强不变
B
2.(2022·湖南卷,16节选)在一定温度下,向容积固定的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4 kJ·mol-1
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
(1)下列说法正确的是 。
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数可能大于
D.将炭块粉碎,可加快反应速率
BD
(2)反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 mol。此时,整个体系 (填“吸收”或“放出”)热量 kJ,反应Ⅰ的平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
吸收
31.2
0.02 MPa
解析 (2)反应平衡时,H2O(g)的转化率为50%,则消耗H2O(g)的物质的量为
1 mol×50%=0.5 mol。CO的物质的量为0.1 mol,据O原子守恒可知,n(CO2)=
0.2 mol,生成0.2 mol CO2时消耗0.2 mol CO,故反应Ⅰ实际生成0.3 mol CO。据热化学方程式可知,生成0.3 mol CO要吸收热量39.42 kJ,生成0.2 mol CO2要放出热量8.22 kJ,此时整个体系吸收热量为39.42 kJ-8.22 kJ=31.2 kJ。
由H原子守恒可知,平衡时n(H2)=0.5 mol,n(CO)=0.1 mol,n(CO2)=0.2 mol,n(H2O)=0.5 mol,则平衡时气体的总物质的量为0.5 mol+0.1 mol+0.2 mol+
0.5 mol=1.3 mol。在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,则平衡体系的总压为0.2 MPa×1.3=0.26 MPa,故反应Ⅰ的平衡常数
练易错·避陷阱
3.(2023·北京丰台区一模)下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是( )
化学反应 平衡常数 温度 973 K 1 173 K
①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1 K1 1.47 2.15
②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2 K2 2.38 1.67
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3 K3 a b
A.1 173 K时,反应①起始c(CO2)=0.6 mol·L-1,平衡时c(CO2)约为0.4 mol·L-1
B.反应②是吸热反应,ΔH2>0
C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动
D.相同温度下,K3= ;ΔH3=ΔH2-ΔH1
D
解析 1 173 K时,反应①起始c(CO2)=0.6 mol·L-1,设CO2的转化量为x mol·L-1,列出三段式:
Fe(s)+CO2(g) FeO(s)+CO(g)
起始/(mol·L-1) 0.6 0
转化/(mol·L-1) x x
平衡/(mol·L-1) 0.6-x x
4.(2023·广东深圳一模)恒容密闭容器中,n mol CO2与3n mol H2在不同温度下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g),达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是( )
A.该反应的平衡常数随温度升高而增大
B.曲线Y表示c(C2H4)随温度的变化关系
C.提高投料比[n(CO2)∶n(H2)],可提高H2的平衡转化率
D.其他条件不变,2n mol CO2与6n mol H2在T1 ℃下反应,达到平衡时c(H2)
解析 由题图可知,温度升高,H2的平衡浓度增大,说明平衡逆向移动,则该反应为放热反应,平衡常数随温度升高而减小,A错误;结合反应可知,Δc(C2H4)为Δc(H2O)的 ,则曲线Y表示c(H2O)随温度的变化关系,B错误;提高投料比[n(CO2)∶n(H2)],平衡正向移动,H2的平衡转化率增大,C正确;其他条件不变,2n mol CO2与6n mol H2在T1 ℃下反应,相当于增大压强,该反应是气体体积减小的反应,平衡正向移动,H2的浓度减小,当然仍大于n mol CO2与3n mol H2在T1 ℃下发生反应时H2的平衡浓度,D错误。
练预测·押考向
5.氨气去除NO的反应原理为4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH<0,反应速率与浓度之间存在如下关系:v(正)=k(正)·c4(NH3)·c6(NO), v(逆)=k(逆)·c5(N2)·c6(H2O),k(正)、k(逆)为速率常数,只受温度影响。350 ℃时,在2 L恒容密闭容器中,通入0.45 mol NH3(g)和0.6 mol NO(g)发生反应,保持温度不变,5 min后反应达平衡,NO的转化率为50%。下列说法正确的是( )
A.用NH3表示的化学反应速率为0.06 mol·L-1·min-1
B.350 ℃时,该反应的平衡常数为0.5
C.其他条件不变,往反应后的容器中再通入0.45 mol NH3(g)和0.6 mol NO(g),重新达平衡时NO的体积分数减小
D.当温度改变为T ℃时,若k(正)=k(逆),则T<350
D
解析 由题意可列如下三段式:
4NH3(g)+6NO(g) 5N2(g)+6H2O(g)
起始/mol 0.45 0.6 0 0
转化/mol 0.2 0.3 0.25 0.3
平衡/mol 0.25 0.3 0.25 0.3
6.我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]制备三甲胺[N(CH3)3],反应方程式如下:(CH3)2NCHO(g)+2H2(g) N(CH3)3(g)+H2O(g) ΔH=-144 kJ·mol-1。向容积相等的Ⅰ、Ⅱ两个恒容密闭容器中分别充入1 mol DMF(g)和2 mol H2(g)发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
(1)容器Ⅰ中为 (填“绝热”或“恒温”)过程,判断的依据是 。
(2)若该反应是在恒温恒容的密闭容器中发生,以下能说明该反应达到化学平衡状态的是 (填字母)。
A.混合气体的密度不再发生改变
B.反应容器中H2的质量分数不变
C.2v正(H2)=v逆(H2O)
D.平均相对分子质量不变
E.该反应的焓变,即ΔH不变
(3)n点时反应的平衡常数Kp= kPa-1(提示:用分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
绝热
容器Ⅰ中的压强比容器Ⅱ中的压强大
BD
0.562 5
解析 (1)该反应是放热反应,若容器绝热,则反应过程中温度升高,不利于平衡正向移动;又知该反应的正反应是气体体积减小的反应,容器的压强大于恒温容器中平衡时的压强,题图中容器Ⅰ中的压强比容器Ⅱ中的压强大,则容器Ⅰ中为绝热过程。
(2)该反应中气体总质量和总体积都不变,则混合气体的密度是定值,不能说明反应达到平衡,A错误;反应容器中H2的质量分数不变,其浓度不变,则该反应达到平衡,B正确;达到平衡时,v正(H2)=2v逆(H2O),C错误;该反应中气体平均相对分子质量增大,当混合气体平均相对分子质量不变时,则反应达到平衡,D正确;该反应的焓变是定值,ΔH不变,不能判断反应是否平衡,E错误。③n点反应达到平衡,此时体系压强为36 kPa,起始压强是48 kPa,设(CH3)2NCHO的转化量为x mol,根据已知条件列出三段式:
(CH3)2NCHO(g) + 2H2(g) N(CH3)3(g)+H2O(g)
起始/mol 1 2 0 0
转化/mol x 2x x x
平衡/mol 1-x 2-2x x x
同课章节目录
