专题 化学反应原理综合题 课件(共31张PPT)
文档属性
| 名称 | 专题 化学反应原理综合题 课件(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 22:36:44 | ||
图片预览










文档简介
(共31张PPT)
专题 化学反应原理综合题
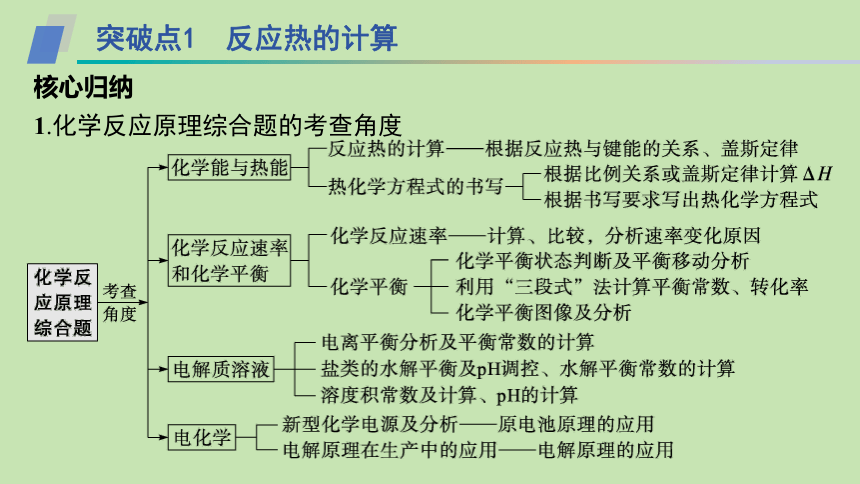
高考指引:近几年,全国及各省市化学试题都考查了化学反应原理综合题,大多以工业生产、环境保护等为命题载体,考查点主要集中在反应热的计算和盖斯定律的应用、化学平衡图像及分析、化学平衡的计算、电化学及应用等,侧重考查考生的“理解与辨析能力”“分析与推测能力”“归纳与论证能力”等关键能力。
突破点1 反应热的计算
核心归纳
1.化学反应原理综合题的考查角度
2.利用盖斯定律计算反应热的思维模型
3.利用键能(或活化能)计算反应热
(1)反应热ΔH=反应物的总键能-生成物的总键能。
(2)反应热ΔH=Ea(正反应)-Ea(逆反应)(Ea代表活化能)。
真题感悟
1.(2022·海南卷,16节选)某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:CO2(g)+4H2(g) 2H2O(g)+CH4(g)。
已知:电解液态水制备1 mol O2(g),电解反应的ΔH=+572 kJ·mol-1。由此计算H2(g)的燃烧热(焓)ΔH= kJ·mol-1。
-286
解析 根据题意,写出电解反应的热化学方程式:2H2O(l) ══ 2H2(g)+O2(g) ΔH=+572 kJ·mol-1,据此可得热化学方程式:2H2(g)+O2(g) ══ 2H2O(l) ΔH=-572 kJ·mol-1,结合燃烧热的概念推知,H2(g)的燃烧热(焓)
ΔH=-572 kJ·mol-1× =-286 kJ·mol-1。
2.(2021·江苏卷,18节选)CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ:CH4(g)+CO2(g) ══ 2CO(g)+2H2(g) ΔH=+246.5 kJ·mol-1
反应Ⅱ:H2(g)+CO2(g) ══ CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
反应Ⅲ:2CO(g) ══ CO2(g)+C(s) ΔH=-172.5 kJ·mol-1
在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g) ══ 4CO(g)+8H2(g)的ΔH= 。
+657.1 kJ·mol-1
解析 分析已知热化学方程式,根据盖斯定律,由反应Ⅰ×3-Ⅱ×2可得反应3CH4(g)+CO2(g)+2H2O(g) ══ 4CO(g)+8H2(g),则有ΔH=(+246.5 kJ·mol-1) ×3-(+41.2 kJ·mol-1)×2=+657.1 kJ·mol-1。
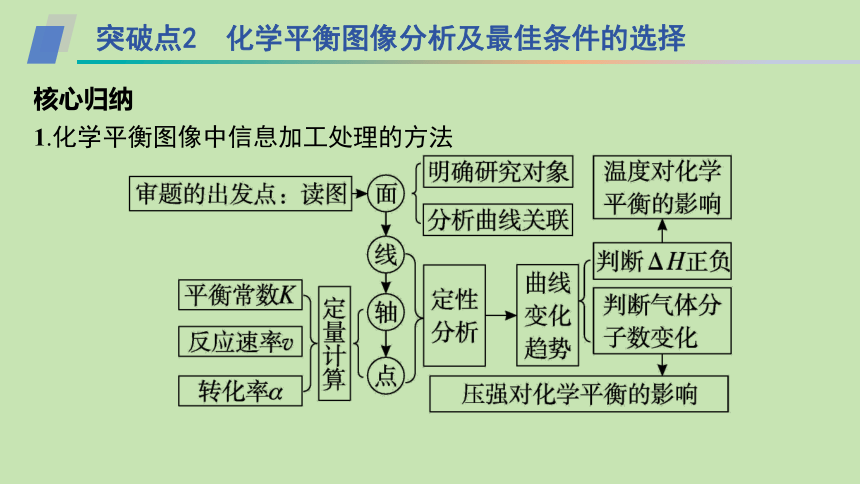
突破点2 化学平衡图像分析及最佳条件的选择
核心归纳
1.化学平衡图像中信息加工处理的方法
2.化学平衡移动的定性分析与定量计算
3.化工生产中最佳反应条件的选择
化工生产中反应条件的选择,除应考虑反应速率、反应限度等反应本身的因素外,还必须考虑生产成本,如动力设备要求、原料和能量的充分利用等。
条件 原则
从化学反应速率分析 既不能过快,又不能太慢
从化学反应限度分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析 如设备承受高温、高压能力等
从催化剂的使用活性分析 注意温度对催化剂活性的限制
真题感悟
3.(2022·湖北卷,19节选)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-H2O”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(ΔT)随时间(t)的变化曲线,如图所示。
实验编号 反应物组成
a 0.20 g CaO粉末 5.0 mL H2O
b 0.15 g Al粉 5.0 mL H2O
c 0.15 g Al粉 5.0 mL饱和石灰水
d 0.15 g Al粉 5.0 mL石灰乳
e 0.15 g Al粉 0.20 g CaO粉末
5.0 mL H2O
ΔT-t的变化曲线
回答下列问题:
(1)实验a中,4 min后ΔT基本不变,原因是
。
(2)实验b中,ΔT的变化说明Al粉与H2O在该条件下 (填“反应”或“不反应”)。实验c中,前3 min的ΔT有变化,其原因是 ;3 min后ΔT基本不变,其原因是 微粒的量有限。
生成的Ca(OH)2覆盖在CaO的表面,阻止反应进行
不反应
Al和溶液中的OH-发生了反应
OH-
突破点3 有关化学平衡的计算
核心归纳
1.计算化学平衡常数和转化率的思维模型
2.速率常数(k)与平衡常数(K)之间的关系
(1)建立关系的依据是达到平衡状态时,v(正)=v(逆)。
(2)T ℃时,可逆反应:aA(g)+bB(g) gG(g)+hH(g), v(正)=k(正)ca(A)·cb(B),v(逆)=k(逆)cg(G)·ch(H)。达到平衡状态时v(正)=v(逆),则有k(正)ca(A)·cb(B)=k(逆)cg(G)·ch(H),故化学平衡常数
真题感悟
4.(2023·湖北卷,19节选)纳米碗C40H10是一种奇特的碗状共轭体系。
(1)1 200 K时,假定体系内只有反应C40H12(g) C40H10(g)+H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平
衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
两个反应的化学键变化相似,使得ΔH数值相近,ln K的斜率取决于ΔH,所以两条线几乎平行
解析 (1)起始C40H12为整体1,平衡转化率为α,列出三段式:
C40H12(g) C40H10(g)+H2(g)
起始: 1 0 0
转化: α α α
平衡: 1-α α α
(2)因两个反应的化学键变化相似,使得ΔH数值相近,ln K的斜率取决于ΔH,所以两条线几乎平行。
5.(2022·广东卷,19节选)K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
25 ℃时,0.10 mol·L-1 K2Cr2O7溶液中
随pH的变化关系如图。当pH=9.0时,设
的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为
=0.10;计算溶液中 的平衡浓度 (结果保留两位有效数字)。
6.0×10-4 mol·L-1
突破点4 电极反应式的书写及计算
核心归纳
1.书写电极反应式的思维模型
2.电化学装置图的分析方法
(1)判断物质类别:箭头一般指向生成物;箭尾一般指向反应物;
(2)判断方向:电子、离子、电流;
(3)判断电极反应:靠近电极的箭头曲线;
(4)判断物质进出:箭头曲线指向装置——进物质;箭头曲线背离装置——出物质。
3.电化学计算的方法
真题感悟
6.(2022·重庆卷,17节选)反应CO(g)+H2O(g) CO2(g)+H2(g)在工业上有重要应用,该反应可采用电化学方法实现,反应装置如图所示。
(1)固体电解质采用 (填“氧离子导体”或“质子导体”)。
(2)阴极的电极反应式为 。
(3)同温同压下,相同时间内,若进口Ⅰ处n(CO)∶n(H2O)=a∶b,出口Ⅰ处气
体体积为进口Ⅰ处的y倍,则CO的转化率为 (用a、b、y表示)。
氧离子导体
H2O+2e- ══ H2+O2-
解析 (2)电解时,阴极发生还原反应,电极反应式为H2O+2e- ══ H2+O2-。
(3)根据题给信息,列出三段式:
CO(g)+H2O(g) CO2(g)+H2(g)
起始/mol a b 0 0
转化/mol x x x x
平衡/mol a-x b-x x x
出口Ⅰ处气体为CO2,其物质的量为x mol,进口Ⅰ处的气体物质的量为
(a+b) mol,则x=(a+b)y,CO的转化率为
7.(2022·河北卷,16节选)氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)氢氧燃料电池中氢气在 (填“正”或“负”)极发生反应。
(2)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为 。
负
CnH2n+2+(3n+1)O2--(6n+2)e- ══ nCO2↑+(n+1)H2O
解析 (2)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2在负极发生氧化反应生成CO2和H2O。
考向预测演练
(2023·辽宁辽阳一模)化学链燃烧(CLC)是利用载氧体(OC)将空气中的氧传输至燃料的新技术,CLC原理如图所示。
已知:①Cu2Fe2O3(s)+O2(g) Cu2Fe2O5(s) ΔH1<0
②2C4H10(g)+13Cu2Fe2O5(s) 13Cu2Fe2O3(s)+8CO2(g)+10H2O(g) ΔH2<0
回答下列问题:
(1)C4H10(g)+O2(g)4CO2(g)+5H2O(g) ΔH= (用含ΔH1、ΔH2的代数式表示)。相对传统的燃烧方式,化学链燃烧的优点是 ,有助于实现碳达峰、碳中和目标。
(2)在密闭容器中加入足量的Cu2Fe2O5(s)、C4H10(g)和N2(g),在总压强保持96.8 kPa不变的条件下,仅发生反应②,测得在不同温度下C4H10的平衡转化率与起始投料比
的关系如图所示。
便于回收纯净的CO2
①其他条件不变,x的值增大,C4H10的平衡转化率减小的原因是
。
②T1 (填“>”“<”或“=”)T2。
③T2 ℃时,该反应的平衡常数Kp= (只列计算式,不带单位,提示:分压=总压×气体物质的量分数)。
(3)一定温度下,在恒压密闭容器中充入足量的Cu2Fe2O5(s)、C4H10(g),仅发生反应②,达到平衡后,再充入少量C4H10(g),平衡 (填“正向”“逆向”或“不”)移动,再次达到平衡时,丁烷的平衡转化率 (填“增大”“减小”或“不变”)。
正反应是气体分子数增大的反应,总压强一定,随着x增大,N2分压减小,参与反应的气体分压增大,平衡向逆反应方向移动,C4H10的平衡转化率减小
>
正向
不变
2C4H10(g)+13Cu2Fe2O5(s) 13Cu2Fe2O3(s)+8CO2(g)+10H2O(g)
起始量/mol 4 0 0
变化量/mol 2.4 9.6 12
平衡量/mol 1.6 9.6 12
则平衡时气体总物质的量为1.6 mol+9.6 mol+12 mol+1 mol=24.2 mol,故
(3)一定温度下,在恒压密闭容器中充入足量的Cu2Fe2O5(s)、C4H10(g),仅发生反应②,达到平衡后,再充入少量C4H10(g),平衡正向移动,再次达到平衡时,反应在恒压密闭条件下进行,反应物一边只有丁烷一种气体,达等效平衡,丁烷的平衡转化率不变。
专题 化学反应原理综合题
高考指引:近几年,全国及各省市化学试题都考查了化学反应原理综合题,大多以工业生产、环境保护等为命题载体,考查点主要集中在反应热的计算和盖斯定律的应用、化学平衡图像及分析、化学平衡的计算、电化学及应用等,侧重考查考生的“理解与辨析能力”“分析与推测能力”“归纳与论证能力”等关键能力。
突破点1 反应热的计算
核心归纳
1.化学反应原理综合题的考查角度
2.利用盖斯定律计算反应热的思维模型
3.利用键能(或活化能)计算反应热
(1)反应热ΔH=反应物的总键能-生成物的总键能。
(2)反应热ΔH=Ea(正反应)-Ea(逆反应)(Ea代表活化能)。
真题感悟
1.(2022·海南卷,16节选)某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:CO2(g)+4H2(g) 2H2O(g)+CH4(g)。
已知:电解液态水制备1 mol O2(g),电解反应的ΔH=+572 kJ·mol-1。由此计算H2(g)的燃烧热(焓)ΔH= kJ·mol-1。
-286
解析 根据题意,写出电解反应的热化学方程式:2H2O(l) ══ 2H2(g)+O2(g) ΔH=+572 kJ·mol-1,据此可得热化学方程式:2H2(g)+O2(g) ══ 2H2O(l) ΔH=-572 kJ·mol-1,结合燃烧热的概念推知,H2(g)的燃烧热(焓)
ΔH=-572 kJ·mol-1× =-286 kJ·mol-1。
2.(2021·江苏卷,18节选)CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ:CH4(g)+CO2(g) ══ 2CO(g)+2H2(g) ΔH=+246.5 kJ·mol-1
反应Ⅱ:H2(g)+CO2(g) ══ CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
反应Ⅲ:2CO(g) ══ CO2(g)+C(s) ΔH=-172.5 kJ·mol-1
在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g) ══ 4CO(g)+8H2(g)的ΔH= 。
+657.1 kJ·mol-1
解析 分析已知热化学方程式,根据盖斯定律,由反应Ⅰ×3-Ⅱ×2可得反应3CH4(g)+CO2(g)+2H2O(g) ══ 4CO(g)+8H2(g),则有ΔH=(+246.5 kJ·mol-1) ×3-(+41.2 kJ·mol-1)×2=+657.1 kJ·mol-1。
突破点2 化学平衡图像分析及最佳条件的选择
核心归纳
1.化学平衡图像中信息加工处理的方法
2.化学平衡移动的定性分析与定量计算
3.化工生产中最佳反应条件的选择
化工生产中反应条件的选择,除应考虑反应速率、反应限度等反应本身的因素外,还必须考虑生产成本,如动力设备要求、原料和能量的充分利用等。
条件 原则
从化学反应速率分析 既不能过快,又不能太慢
从化学反应限度分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析 如设备承受高温、高压能力等
从催化剂的使用活性分析 注意温度对催化剂活性的限制
真题感悟
3.(2022·湖北卷,19节选)自发热材料在生活中的应用日益广泛。某实验小组为探究“CaO-Al-H2O”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值(ΔT)随时间(t)的变化曲线,如图所示。
实验编号 反应物组成
a 0.20 g CaO粉末 5.0 mL H2O
b 0.15 g Al粉 5.0 mL H2O
c 0.15 g Al粉 5.0 mL饱和石灰水
d 0.15 g Al粉 5.0 mL石灰乳
e 0.15 g Al粉 0.20 g CaO粉末
5.0 mL H2O
ΔT-t的变化曲线
回答下列问题:
(1)实验a中,4 min后ΔT基本不变,原因是
。
(2)实验b中,ΔT的变化说明Al粉与H2O在该条件下 (填“反应”或“不反应”)。实验c中,前3 min的ΔT有变化,其原因是 ;3 min后ΔT基本不变,其原因是 微粒的量有限。
生成的Ca(OH)2覆盖在CaO的表面,阻止反应进行
不反应
Al和溶液中的OH-发生了反应
OH-
突破点3 有关化学平衡的计算
核心归纳
1.计算化学平衡常数和转化率的思维模型
2.速率常数(k)与平衡常数(K)之间的关系
(1)建立关系的依据是达到平衡状态时,v(正)=v(逆)。
(2)T ℃时,可逆反应:aA(g)+bB(g) gG(g)+hH(g), v(正)=k(正)ca(A)·cb(B),v(逆)=k(逆)cg(G)·ch(H)。达到平衡状态时v(正)=v(逆),则有k(正)ca(A)·cb(B)=k(逆)cg(G)·ch(H),故化学平衡常数
真题感悟
4.(2023·湖北卷,19节选)纳米碗C40H10是一种奇特的碗状共轭体系。
(1)1 200 K时,假定体系内只有反应C40H12(g) C40H10(g)+H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平
衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
两个反应的化学键变化相似,使得ΔH数值相近,ln K的斜率取决于ΔH,所以两条线几乎平行
解析 (1)起始C40H12为整体1,平衡转化率为α,列出三段式:
C40H12(g) C40H10(g)+H2(g)
起始: 1 0 0
转化: α α α
平衡: 1-α α α
(2)因两个反应的化学键变化相似,使得ΔH数值相近,ln K的斜率取决于ΔH,所以两条线几乎平行。
5.(2022·广东卷,19节选)K2Cr2O7溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
25 ℃时,0.10 mol·L-1 K2Cr2O7溶液中
随pH的变化关系如图。当pH=9.0时,设
的平衡浓度分别为x、y、z mol·L-1,则x、y、z之间的关系式为
=0.10;计算溶液中 的平衡浓度 (结果保留两位有效数字)。
6.0×10-4 mol·L-1
突破点4 电极反应式的书写及计算
核心归纳
1.书写电极反应式的思维模型
2.电化学装置图的分析方法
(1)判断物质类别:箭头一般指向生成物;箭尾一般指向反应物;
(2)判断方向:电子、离子、电流;
(3)判断电极反应:靠近电极的箭头曲线;
(4)判断物质进出:箭头曲线指向装置——进物质;箭头曲线背离装置——出物质。
3.电化学计算的方法
真题感悟
6.(2022·重庆卷,17节选)反应CO(g)+H2O(g) CO2(g)+H2(g)在工业上有重要应用,该反应可采用电化学方法实现,反应装置如图所示。
(1)固体电解质采用 (填“氧离子导体”或“质子导体”)。
(2)阴极的电极反应式为 。
(3)同温同压下,相同时间内,若进口Ⅰ处n(CO)∶n(H2O)=a∶b,出口Ⅰ处气
体体积为进口Ⅰ处的y倍,则CO的转化率为 (用a、b、y表示)。
氧离子导体
H2O+2e- ══ H2+O2-
解析 (2)电解时,阴极发生还原反应,电极反应式为H2O+2e- ══ H2+O2-。
(3)根据题给信息,列出三段式:
CO(g)+H2O(g) CO2(g)+H2(g)
起始/mol a b 0 0
转化/mol x x x x
平衡/mol a-x b-x x x
出口Ⅰ处气体为CO2,其物质的量为x mol,进口Ⅰ处的气体物质的量为
(a+b) mol,则x=(a+b)y,CO的转化率为
7.(2022·河北卷,16节选)氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)氢氧燃料电池中氢气在 (填“正”或“负”)极发生反应。
(2)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为 。
负
CnH2n+2+(3n+1)O2--(6n+2)e- ══ nCO2↑+(n+1)H2O
解析 (2)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2在负极发生氧化反应生成CO2和H2O。
考向预测演练
(2023·辽宁辽阳一模)化学链燃烧(CLC)是利用载氧体(OC)将空气中的氧传输至燃料的新技术,CLC原理如图所示。
已知:①Cu2Fe2O3(s)+O2(g) Cu2Fe2O5(s) ΔH1<0
②2C4H10(g)+13Cu2Fe2O5(s) 13Cu2Fe2O3(s)+8CO2(g)+10H2O(g) ΔH2<0
回答下列问题:
(1)C4H10(g)+O2(g)4CO2(g)+5H2O(g) ΔH= (用含ΔH1、ΔH2的代数式表示)。相对传统的燃烧方式,化学链燃烧的优点是 ,有助于实现碳达峰、碳中和目标。
(2)在密闭容器中加入足量的Cu2Fe2O5(s)、C4H10(g)和N2(g),在总压强保持96.8 kPa不变的条件下,仅发生反应②,测得在不同温度下C4H10的平衡转化率与起始投料比
的关系如图所示。
便于回收纯净的CO2
①其他条件不变,x的值增大,C4H10的平衡转化率减小的原因是
。
②T1 (填“>”“<”或“=”)T2。
③T2 ℃时,该反应的平衡常数Kp= (只列计算式,不带单位,提示:分压=总压×气体物质的量分数)。
(3)一定温度下,在恒压密闭容器中充入足量的Cu2Fe2O5(s)、C4H10(g),仅发生反应②,达到平衡后,再充入少量C4H10(g),平衡 (填“正向”“逆向”或“不”)移动,再次达到平衡时,丁烷的平衡转化率 (填“增大”“减小”或“不变”)。
正反应是气体分子数增大的反应,总压强一定,随着x增大,N2分压减小,参与反应的气体分压增大,平衡向逆反应方向移动,C4H10的平衡转化率减小
>
正向
不变
2C4H10(g)+13Cu2Fe2O5(s) 13Cu2Fe2O3(s)+8CO2(g)+10H2O(g)
起始量/mol 4 0 0
变化量/mol 2.4 9.6 12
平衡量/mol 1.6 9.6 12
则平衡时气体总物质的量为1.6 mol+9.6 mol+12 mol+1 mol=24.2 mol,故
(3)一定温度下,在恒压密闭容器中充入足量的Cu2Fe2O5(s)、C4H10(g),仅发生反应②,达到平衡后,再充入少量C4H10(g),平衡正向移动,再次达到平衡时,反应在恒压密闭条件下进行,反应物一边只有丁烷一种气体,达等效平衡,丁烷的平衡转化率不变。
同课章节目录
