专题 化学反应速率与化学平衡----基础巩固练(共31张PPT)
文档属性
| 名称 | 专题 化学反应速率与化学平衡----基础巩固练(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 22:38:25 | ||
图片预览









文档简介
(共31张PPT)
专题 化学反应速率与化学平衡
----基础巩固练
基础巩固练
1.(2023·北京西城区一模)探究影响H2O2分解速率的因素,实验方案如图所示。
下列说法不正确的是( )
A.对比①②,可探究FeCl3溶液对H2O2分解速率的影响
B.对比②③④,可探究温度对H2O2分解速率的影响
C.若用MnO2固体代替FeCl3溶液,反应速率不变
D.H2O2易溶于水,主要是由于H2O2与H2O分子之间能形成氢键
C
解析 MnO2和Fe3+都能催化H2O2的分解反应,但不同催化剂的催化效果不同,故反应速率不同,C错误。
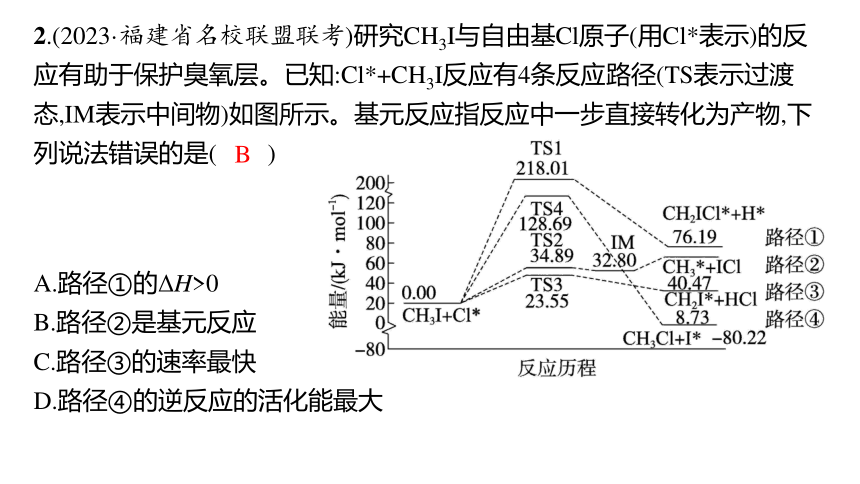
2.(2023·福建省名校联盟联考)研究CH3I与自由基Cl原子(用Cl*表示)的反应有助于保护臭氧层。已知:Cl*+CH3I反应有4条反应路径(TS表示过渡态,IM表示中间物)如图所示。基元反应指反应中一步直接转化为产物,下列说法错误的是( )
A.路径①的ΔH>0
B.路径②是基元反应
C.路径③的速率最快
D.路径④的逆反应的活化能最大
B
解析 路径②所示反应中有中间产物生成,没有一步直接转化为产物,不是基元反应,B错误。
3.(2023·安徽淮北一模)一定温度下,在密闭容器中发生反应: BaSO4(s)+4H2(g) BaS(s)+4H2O(g) ΔH>0。下列说法正确的是( )
A.在恒容条件下,向平衡体系中充入惰性气体,平衡不移动
B.在恒压条件下,向平衡体系中加入H2,BaSO4的转化率不变
C.混合气体的物质的量不再发生变化可说明反应达到平衡
D.该反应在任何温度下都能自发进行
A
解析 在恒容条件下,向平衡体系中充入惰性气体,反应体系中各物质的浓度不变,平衡不移动,A正确;在恒压条件下,向平衡体系中加入H2,平衡正向移动,BaSO4的转化率变大,B错误;该反应是反应前后气体总体积不变的反应,故混合气体的物质的量不变不能说明反应达到平衡,C错误;该反应的ΔH>0、ΔS=0,由于反应吸热,并非在任何温度下都能自发进行,D错误。
4.(2023·辽宁葫芦岛一模)活性炭基材料烟气脱硝技术备受当前研究者关注,其反应原理为C(s)+2NO(g) CO2(g)+N2(g) ΔH>0。下列说法不正确的是( )
A.增大压强,平衡向脱硝方向移动
B.上述脱硝反应平衡常数
C.若恒容体系内密度恒定不变,反应达到了平衡
D.每处理标准状况下2.24 L NO,转移电子0.2 mol
A
解析 该反应反应前后气体体积不变,改变压强,不影响平衡状态,A错误。
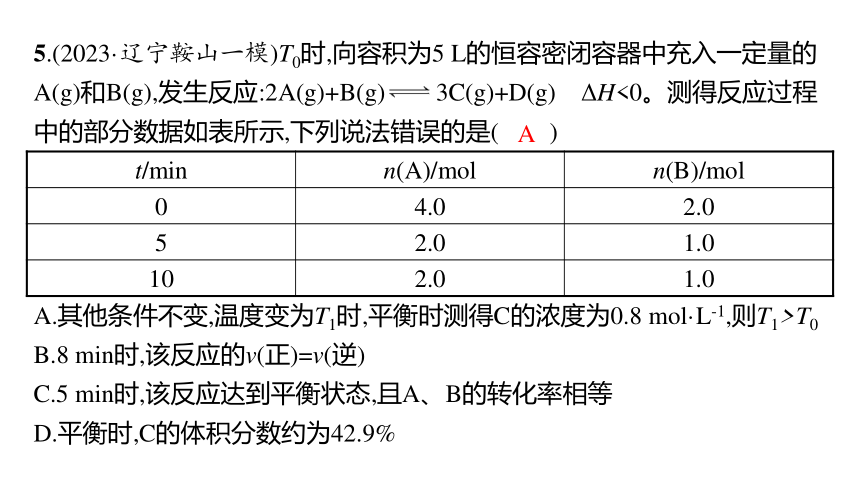
5.(2023·辽宁鞍山一模)T0时,向容积为5 L的恒容密闭容器中充入一定量的A(g)和B(g),发生反应:2A(g)+B(g) 3C(g)+D(g) ΔH<0。测得反应过程中的部分数据如表所示,下列说法错误的是( )
t/min n(A)/mol n(B)/mol
0 4.0 2.0
5 2.0 1.0
10 2.0 1.0
A.其他条件不变,温度变为T1时,平衡时测得C的浓度为0.8 mol·L-1,则T1>T0
B.8 min时,该反应的v(正)=v(逆)
C.5 min时,该反应达到平衡状态,且A、B的转化率相等
D.平衡时,C的体积分数约为42.9%
A
解析 升高温度,平衡逆向移动,根据图表数据,T0时达到平衡,消耗1 mol B,则生成3 mol C,C的浓度为0.6 mol·L-1,其他条件不变,温度变为T1时,平衡时测得C的浓度为0.8 mol·L-1,说明平衡正向移动,则T1 2A(g)+B(g) 3C(g)+D(g)
初始/mol 4 2 0 0
转化/mol 2 1 3 1
平衡/mol 2 1 3 1
则平衡时,C的体积分数约为 ×100%≈42.9%,D正确。
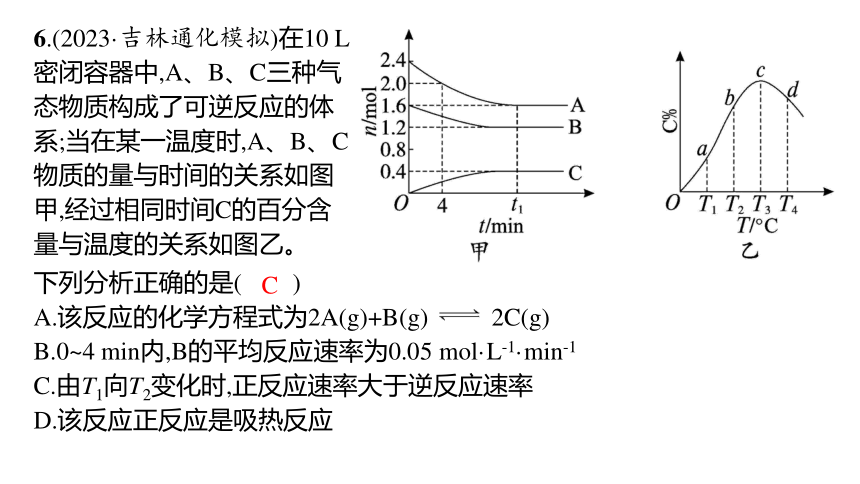
6.(2023·吉林通化模拟)在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图甲,经过相同时间C的百分含量与温度的关系如图乙。
下列分析正确的是( )
A.该反应的化学方程式为2A(g)+B(g) 2C(g)
B.0~4 min内,B的平均反应速率为0.05 mol·L-1·min-1
C.由T1向T2变化时,正反应速率大于逆反应速率
D.该反应正反应是吸热反应
C
解析 由题图可知,该反应是可逆反应,A、B、C的物质的量变化量之比=(2.4-1.6)∶(1.6-1.2)∶(0.4-0)=2∶1∶1,故该反应的化学方程式为2A(g)+B(g) C(g),A错误;0~4 min时,A减少(2.4-2.0) mol,则有
v(B)= =0.005 mol·L-1·min-1,B错误;由T1向T2变化时,C的百分含量
增大,平衡正向进行,故正反应速率大于逆反应速率,C正确;T3时反应达到平衡,T3之后,升高温度,平衡逆向移动,逆反应是吸热反应,则正反应是放热反应,D错误。
7.(2023·安徽省鼎尖名校联考)CO2的有效利用对发展碳循环经济产生了巨大的影响。其中利用CO2和H2,在一定条件下合成乙醇的反应为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH。向2 L刚性不可变容器中充入1 mol CO2和3 mol H2,单位时间内测得CO2的转化率随温度变化关系如图所示。下列说法正确的是( )
A.上述反应的ΔH>0
B.混合气体的密度保持不变时,说明该反应达
平衡状态
C.c点平衡后,向容器中再充入等量原反应气体,
达新平衡时,CO2的转化率增大
D.反应从开始到a点需时5 min,5 min内用H2表示的反应速率为0.3 mol·L-1·min-1
C
解析 根据题图知,b点之前,单位时间内,随着温度的升高,速率加快,所以二氧化碳的转化率增大,但b点之后,温度升高,不利于平衡正向移动,导致二氧化碳的平衡转化率降低,则该反应为放热反应,ΔH<0,A错误;2 L刚性不可变容器中发生反应,气体的总质量不变,容器的容积不变,气体的密度始终不变,不能判断是否达到平衡状态,B错误;c点平衡后,向容器中再充入等量原反应气体,等效于增大压强,则会使平衡正向移动,达新平衡时,CO2的转化率增大,C正确;a点时CO2的转化率为50%,则转化的CO2为0.5 mol,转化的H2为0.5 mol×3=1.5 mol,则有v(H2)=0.15 mol·L-1·min-1,D错误。
8.(2023·河南省豫南地区联考)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃时SiHCl3的转化率随时间变化的结果如图所示。
下列叙述不正确的是( )
A.该反应为吸热反应
B.反应速率大小:v(a)>v(b)
C.70 ℃时,平衡常数K≈0.02
D.增大压强,可以提高SiHCl3的平衡
转化率,缩短达平衡的时间
D
解析 升高温度,SiHCl3的平衡转化率增大,则该反应为吸热反应,A正确;a、b两点的浓度相同,a点的温度大于b点,则反应速率大小:v(a)>v(b),B正确;70 ℃时,达到平衡SiHCl3的平衡转化率为22%,设起始c(SiHCl3)=1 mol·L-1,利用“三段式”计算:
2SiHCl3(g) SiH2Cl2(g)+SiCl4(g)
起始浓度/(mol·L-1) 1 0 0
转化浓度/(mol·L-1) 0.22 0.11 0.11
平衡浓度/(mol·L-1) 0.78 0.11 0.11
则平衡常数 ,C正确;增大压强,平衡不移动,不能提高SiHCl3的平衡转化率,D错误。
9.(2023·广东广州一模)向密闭容器中充入S2Cl2、Cl2和SCl2,发生反应S2Cl2(g)+Cl2(g) 2SCl2(g),S2Cl2与SCl2的初始消耗速率(v)与温度(T)的关系如图所示(图中A、B点处于平衡状态),下列说法不正确的是( )
A.a为v(SCl2)随温度的变化曲线
B.该反应的ΔH<0
C.200 ℃下反应一段时间,S2Cl2的物质的
量增多
D.反应达到平衡后向体系中充入氮气,
平衡不移动
C
解析 化学反应速率与反应的系数成正比,由化学方程式可知,平衡时S2Cl2与SCl2的反应速率为1∶2,结合图像可知,图中A、B点处于平衡状态,则正逆反应速率相等,a为v(SCl2)随温度的变化曲线,A正确;随着温度升高,SCl2的消耗速率更大,反应逆向进行,则正反应为放热反应,ΔH<0,B正确;题图中A、B点处于平衡状态,200 ℃下反应没有达到平衡,此时逆反应速率小于正反应速率,反应正向进行,故反应一段时间,S2Cl2的物质的量减小,C错误;反应达到平衡后向体系中充入氮气,不影响反应中各物质的浓度,平衡不移动,D正确。
10.(2023·河北省名校联盟联考)T ℃时,将2.0 mol A(g)和2.0 mol B(g)充入容积为1 L的密闭容器中,在一定条件下发生反应:A(g)+B(g) 2C(g)+D(s) ΔH<0;t时刻反应达到平衡时,C(g)为2.0 mol。下列说法正确的是( )
A.t时刻反应达到平衡时,A(g)的体积分数为20%
B.T ℃时,该反应的化学平衡常数为K=8.0
C.t时刻反应达到平衡后,缩小容器的容积,平衡逆向移动
D.T ℃时,若将A(g)、B(g)各1.0 mol充入同样容器,平衡后,A的转化率α(A)为50%
D
11.(2023·天津市第一中学二模)一定条件下,CO2(g)+3H2(g) H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1;向2 L恒容恒温密闭容器中充入1 mol CO2和2.8 mol H2反应,图中过程Ⅰ、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是( )
A.m点:v(正)>v(逆)
B.活化能:过程Ⅱ>过程Ⅰ
C.n点时该反应的平衡常数K=50
D.过程Ⅰ,t2时刻改变的反应条件可能是升高温度
C
解析 m点CO2的转化率不是最大,反应向正反应方向进行,则有v(正)>v(逆),A正确;过程Ⅰ先达到平衡状态,说明反应速率快,因此活化能:过程Ⅱ>过程Ⅰ,B正确;n点时CO2的转化率为80%,列出“三段式”:
CO2(g) + 3H2(g) H2O(g) + CH3OH(g)
则该反应的平衡常数 ,C错误;过程Ⅰ,t2时刻转化率降低,说明反应向逆反应方向进行,由于正反应放热,改变的反应条件可能是升高温度,D正确。
12.(2023·湖北襄阳一模)在160 ℃、200 ℃条件下,分别向两个容积为2 L的刚性容器中充入2 mol CO和2 mol N2O,发生反应: CO(g)+N2O(g) CO2(g)+N2(g) ΔH<0。实验测得两容器中CO或N2的物质的量随时间的变化关系如图所示。下列说法正确的是( )
A.当容器中混合气体的密度不随时间变化时,
该反应达到平衡状态
B.ac段N2的平均反应速率为0.10 mol·L-1·min-1
C.逆反应速率:c>b>d
D.160 ℃时,该反应的平衡常数Kp=9
D
解析 该反应前后气体的物质的量不变,恒温恒容时,容器的压强保持不变,故当容器中混合气体的密度不随时间变化时,不能说明该反应达到平衡状态,A错误;ac段N2的平均反应速率为
=0.05 mol·L-1·min-1,B错误;随着反应的进行,N2的物质的量增大,CO的物质的量减小,故ac曲线表示N2的物质的量随时间的变化,bd曲线表示CO的物质的量随时间的变化,由图中可知ac先达到平衡,说明ac对应的温度更高,故逆反应速率c>d,由d点生成物浓度高于b点,故逆反应速率d>b,因此逆反应速率:c>d>b,C错误;bd曲线对应温度为160 ℃,由题图中数据可知160 ℃时,d点达到平衡,平衡时CO的物质的量为0.5 mol,列出“三段式”分析:
CO(g)+N2O(g) CO2(g)+N2(g)
起始量/mol 2 2 0 0
转化量/mol 1.5 1.5 1.5 1.5
平衡量/mol 0.5 0.5 1.5 1.5
13.(2023·福建师大附中一模)工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1:C4H10(g,正丁烷) CH4(g)+C3H6(g) ΔH1
反应2:C4H10(g,正丁烷) C2H6(g)+C2H4(g) ΔH2
已知几种共价键的键能如下表:
共价键 C—H C=C C—C
键能/(kJ·mol-1) 413 614 347
(1)根据上述数据估算,ΔH1= kJ·mol-1。
+80
(2)正丁烷和异丁烷之间转化的能量变化如图所示。
图1
①正丁烷气体转化成异丁烷气体的热化学方程式为
。 ②下列有关催化剂的叙述错误的
是 (填字母)。
A.能改变反应途径 B.能降低反应焓变
C.能加快反应速率 D.能增大平衡常数
C4H10(g,正丁烷) C4H10(g,异丁烷)
ΔH=-7 kJ·mol-1
BD
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图所示。
图2
①p1、p2、p3由小到大的顺序为
。
②随着温度升高,三种不同压强下正丁烷的平衡
转化率趋向相等,原因是______________________
。
p1随着温度升高,压强对
平衡的影响逐渐减小,平衡转化率主要由温度决定
(4)在一定温度下,向恒容密闭容器中投入正丁烷,同时发生反应1和反应2,测得部分物质的浓度与时间的关系如图,平衡时压强为17a kPa。
图3
①7 min时改变的条件可能是 (填字母)。
A.增大压强
B.增大正丁烷的浓度
C.加入催化剂
②该温度下,反应1的平衡常数Kp= kPa。
(提示:组分分压=总压×体积分数)
B
3a
解析 (1)根据键能计算反应热,ΔH1=(347×2-614) kJ·mol-1=+80 kJ·mol-1。
(2)②催化剂参与化学反应,改变了反应途径,A正确;反应热与产物、反应物的相对能量有关,催化剂同等程度降低正、逆反应活化能,不改变反应热,B错误;催化剂能够加快反应速率,C正确;催化剂同倍数改变正、逆反应速率,平衡不移动,平衡常数不变,D错误。
(3)①正反应是气体分子数增大的反应,减小压强,平衡向正反应方向移动,正丁烷的平衡转化率增大,则p1②压强与温度对正丁烷的平衡转化率都有影响,且结果相反,随着温度升高,平衡转化率最终相同,说明压强对平衡的影响逐渐减小,平衡转化率主要由温度决定。
(4)①增大压强,即缩小容器容积,瞬时CH4浓度增大,随后CH4浓度减小,A错误;增大正丁烷的浓度,平衡向正反应方向移动,CH4浓度增大,B正确;加入催化剂,平衡不移动,甲烷的浓度不变,C错误。②根据题图3,同时发生反应1和反应2,平衡时生成了0.3 mol·L-1的CH4,消耗了0.7 mol·L-1的C4H10,说明反应2生成了0.4 mol·L-1的C2H6,平衡体系中各组分的浓度分别是c(CH4)=c(C3H6)=0.3 mol·L-1,c(C2H6)=c(C2H4)=0.4 mol·L-1,
专题 化学反应速率与化学平衡
----基础巩固练
基础巩固练
1.(2023·北京西城区一模)探究影响H2O2分解速率的因素,实验方案如图所示。
下列说法不正确的是( )
A.对比①②,可探究FeCl3溶液对H2O2分解速率的影响
B.对比②③④,可探究温度对H2O2分解速率的影响
C.若用MnO2固体代替FeCl3溶液,反应速率不变
D.H2O2易溶于水,主要是由于H2O2与H2O分子之间能形成氢键
C
解析 MnO2和Fe3+都能催化H2O2的分解反应,但不同催化剂的催化效果不同,故反应速率不同,C错误。
2.(2023·福建省名校联盟联考)研究CH3I与自由基Cl原子(用Cl*表示)的反应有助于保护臭氧层。已知:Cl*+CH3I反应有4条反应路径(TS表示过渡态,IM表示中间物)如图所示。基元反应指反应中一步直接转化为产物,下列说法错误的是( )
A.路径①的ΔH>0
B.路径②是基元反应
C.路径③的速率最快
D.路径④的逆反应的活化能最大
B
解析 路径②所示反应中有中间产物生成,没有一步直接转化为产物,不是基元反应,B错误。
3.(2023·安徽淮北一模)一定温度下,在密闭容器中发生反应: BaSO4(s)+4H2(g) BaS(s)+4H2O(g) ΔH>0。下列说法正确的是( )
A.在恒容条件下,向平衡体系中充入惰性气体,平衡不移动
B.在恒压条件下,向平衡体系中加入H2,BaSO4的转化率不变
C.混合气体的物质的量不再发生变化可说明反应达到平衡
D.该反应在任何温度下都能自发进行
A
解析 在恒容条件下,向平衡体系中充入惰性气体,反应体系中各物质的浓度不变,平衡不移动,A正确;在恒压条件下,向平衡体系中加入H2,平衡正向移动,BaSO4的转化率变大,B错误;该反应是反应前后气体总体积不变的反应,故混合气体的物质的量不变不能说明反应达到平衡,C错误;该反应的ΔH>0、ΔS=0,由于反应吸热,并非在任何温度下都能自发进行,D错误。
4.(2023·辽宁葫芦岛一模)活性炭基材料烟气脱硝技术备受当前研究者关注,其反应原理为C(s)+2NO(g) CO2(g)+N2(g) ΔH>0。下列说法不正确的是( )
A.增大压强,平衡向脱硝方向移动
B.上述脱硝反应平衡常数
C.若恒容体系内密度恒定不变,反应达到了平衡
D.每处理标准状况下2.24 L NO,转移电子0.2 mol
A
解析 该反应反应前后气体体积不变,改变压强,不影响平衡状态,A错误。
5.(2023·辽宁鞍山一模)T0时,向容积为5 L的恒容密闭容器中充入一定量的A(g)和B(g),发生反应:2A(g)+B(g) 3C(g)+D(g) ΔH<0。测得反应过程中的部分数据如表所示,下列说法错误的是( )
t/min n(A)/mol n(B)/mol
0 4.0 2.0
5 2.0 1.0
10 2.0 1.0
A.其他条件不变,温度变为T1时,平衡时测得C的浓度为0.8 mol·L-1,则T1>T0
B.8 min时,该反应的v(正)=v(逆)
C.5 min时,该反应达到平衡状态,且A、B的转化率相等
D.平衡时,C的体积分数约为42.9%
A
解析 升高温度,平衡逆向移动,根据图表数据,T0时达到平衡,消耗1 mol B,则生成3 mol C,C的浓度为0.6 mol·L-1,其他条件不变,温度变为T1时,平衡时测得C的浓度为0.8 mol·L-1,说明平衡正向移动,则T1
初始/mol 4 2 0 0
转化/mol 2 1 3 1
平衡/mol 2 1 3 1
则平衡时,C的体积分数约为 ×100%≈42.9%,D正确。
6.(2023·吉林通化模拟)在10 L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系;当在某一温度时,A、B、C物质的量与时间的关系如图甲,经过相同时间C的百分含量与温度的关系如图乙。
下列分析正确的是( )
A.该反应的化学方程式为2A(g)+B(g) 2C(g)
B.0~4 min内,B的平均反应速率为0.05 mol·L-1·min-1
C.由T1向T2变化时,正反应速率大于逆反应速率
D.该反应正反应是吸热反应
C
解析 由题图可知,该反应是可逆反应,A、B、C的物质的量变化量之比=(2.4-1.6)∶(1.6-1.2)∶(0.4-0)=2∶1∶1,故该反应的化学方程式为2A(g)+B(g) C(g),A错误;0~4 min时,A减少(2.4-2.0) mol,则有
v(B)= =0.005 mol·L-1·min-1,B错误;由T1向T2变化时,C的百分含量
增大,平衡正向进行,故正反应速率大于逆反应速率,C正确;T3时反应达到平衡,T3之后,升高温度,平衡逆向移动,逆反应是吸热反应,则正反应是放热反应,D错误。
7.(2023·安徽省鼎尖名校联考)CO2的有效利用对发展碳循环经济产生了巨大的影响。其中利用CO2和H2,在一定条件下合成乙醇的反应为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) ΔH。向2 L刚性不可变容器中充入1 mol CO2和3 mol H2,单位时间内测得CO2的转化率随温度变化关系如图所示。下列说法正确的是( )
A.上述反应的ΔH>0
B.混合气体的密度保持不变时,说明该反应达
平衡状态
C.c点平衡后,向容器中再充入等量原反应气体,
达新平衡时,CO2的转化率增大
D.反应从开始到a点需时5 min,5 min内用H2表示的反应速率为0.3 mol·L-1·min-1
C
解析 根据题图知,b点之前,单位时间内,随着温度的升高,速率加快,所以二氧化碳的转化率增大,但b点之后,温度升高,不利于平衡正向移动,导致二氧化碳的平衡转化率降低,则该反应为放热反应,ΔH<0,A错误;2 L刚性不可变容器中发生反应,气体的总质量不变,容器的容积不变,气体的密度始终不变,不能判断是否达到平衡状态,B错误;c点平衡后,向容器中再充入等量原反应气体,等效于增大压强,则会使平衡正向移动,达新平衡时,CO2的转化率增大,C正确;a点时CO2的转化率为50%,则转化的CO2为0.5 mol,转化的H2为0.5 mol×3=1.5 mol,则有v(H2)=0.15 mol·L-1·min-1,D错误。
8.(2023·河南省豫南地区联考)三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃时SiHCl3的转化率随时间变化的结果如图所示。
下列叙述不正确的是( )
A.该反应为吸热反应
B.反应速率大小:v(a)>v(b)
C.70 ℃时,平衡常数K≈0.02
D.增大压强,可以提高SiHCl3的平衡
转化率,缩短达平衡的时间
D
解析 升高温度,SiHCl3的平衡转化率增大,则该反应为吸热反应,A正确;a、b两点的浓度相同,a点的温度大于b点,则反应速率大小:v(a)>v(b),B正确;70 ℃时,达到平衡SiHCl3的平衡转化率为22%,设起始c(SiHCl3)=1 mol·L-1,利用“三段式”计算:
2SiHCl3(g) SiH2Cl2(g)+SiCl4(g)
起始浓度/(mol·L-1) 1 0 0
转化浓度/(mol·L-1) 0.22 0.11 0.11
平衡浓度/(mol·L-1) 0.78 0.11 0.11
则平衡常数 ,C正确;增大压强,平衡不移动,不能提高SiHCl3的平衡转化率,D错误。
9.(2023·广东广州一模)向密闭容器中充入S2Cl2、Cl2和SCl2,发生反应S2Cl2(g)+Cl2(g) 2SCl2(g),S2Cl2与SCl2的初始消耗速率(v)与温度(T)的关系如图所示(图中A、B点处于平衡状态),下列说法不正确的是( )
A.a为v(SCl2)随温度的变化曲线
B.该反应的ΔH<0
C.200 ℃下反应一段时间,S2Cl2的物质的
量增多
D.反应达到平衡后向体系中充入氮气,
平衡不移动
C
解析 化学反应速率与反应的系数成正比,由化学方程式可知,平衡时S2Cl2与SCl2的反应速率为1∶2,结合图像可知,图中A、B点处于平衡状态,则正逆反应速率相等,a为v(SCl2)随温度的变化曲线,A正确;随着温度升高,SCl2的消耗速率更大,反应逆向进行,则正反应为放热反应,ΔH<0,B正确;题图中A、B点处于平衡状态,200 ℃下反应没有达到平衡,此时逆反应速率小于正反应速率,反应正向进行,故反应一段时间,S2Cl2的物质的量减小,C错误;反应达到平衡后向体系中充入氮气,不影响反应中各物质的浓度,平衡不移动,D正确。
10.(2023·河北省名校联盟联考)T ℃时,将2.0 mol A(g)和2.0 mol B(g)充入容积为1 L的密闭容器中,在一定条件下发生反应:A(g)+B(g) 2C(g)+D(s) ΔH<0;t时刻反应达到平衡时,C(g)为2.0 mol。下列说法正确的是( )
A.t时刻反应达到平衡时,A(g)的体积分数为20%
B.T ℃时,该反应的化学平衡常数为K=8.0
C.t时刻反应达到平衡后,缩小容器的容积,平衡逆向移动
D.T ℃时,若将A(g)、B(g)各1.0 mol充入同样容器,平衡后,A的转化率α(A)为50%
D
11.(2023·天津市第一中学二模)一定条件下,CO2(g)+3H2(g) H2O(g)+CH3OH(g) ΔH=-53.7 kJ·mol-1;向2 L恒容恒温密闭容器中充入1 mol CO2和2.8 mol H2反应,图中过程Ⅰ、Ⅱ是在两种不同催化剂作用下建立平衡的过程中CO2的转化率[α(CO2)]随时间(t)的变化曲线。下列说法不正确的是( )
A.m点:v(正)>v(逆)
B.活化能:过程Ⅱ>过程Ⅰ
C.n点时该反应的平衡常数K=50
D.过程Ⅰ,t2时刻改变的反应条件可能是升高温度
C
解析 m点CO2的转化率不是最大,反应向正反应方向进行,则有v(正)>v(逆),A正确;过程Ⅰ先达到平衡状态,说明反应速率快,因此活化能:过程Ⅱ>过程Ⅰ,B正确;n点时CO2的转化率为80%,列出“三段式”:
CO2(g) + 3H2(g) H2O(g) + CH3OH(g)
则该反应的平衡常数 ,C错误;过程Ⅰ,t2时刻转化率降低,说明反应向逆反应方向进行,由于正反应放热,改变的反应条件可能是升高温度,D正确。
12.(2023·湖北襄阳一模)在160 ℃、200 ℃条件下,分别向两个容积为2 L的刚性容器中充入2 mol CO和2 mol N2O,发生反应: CO(g)+N2O(g) CO2(g)+N2(g) ΔH<0。实验测得两容器中CO或N2的物质的量随时间的变化关系如图所示。下列说法正确的是( )
A.当容器中混合气体的密度不随时间变化时,
该反应达到平衡状态
B.ac段N2的平均反应速率为0.10 mol·L-1·min-1
C.逆反应速率:c>b>d
D.160 ℃时,该反应的平衡常数Kp=9
D
解析 该反应前后气体的物质的量不变,恒温恒容时,容器的压强保持不变,故当容器中混合气体的密度不随时间变化时,不能说明该反应达到平衡状态,A错误;ac段N2的平均反应速率为
=0.05 mol·L-1·min-1,B错误;随着反应的进行,N2的物质的量增大,CO的物质的量减小,故ac曲线表示N2的物质的量随时间的变化,bd曲线表示CO的物质的量随时间的变化,由图中可知ac先达到平衡,说明ac对应的温度更高,故逆反应速率c>d,由d点生成物浓度高于b点,故逆反应速率d>b,因此逆反应速率:c>d>b,C错误;bd曲线对应温度为160 ℃,由题图中数据可知160 ℃时,d点达到平衡,平衡时CO的物质的量为0.5 mol,列出“三段式”分析:
CO(g)+N2O(g) CO2(g)+N2(g)
起始量/mol 2 2 0 0
转化量/mol 1.5 1.5 1.5 1.5
平衡量/mol 0.5 0.5 1.5 1.5
13.(2023·福建师大附中一模)工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。
反应1:C4H10(g,正丁烷) CH4(g)+C3H6(g) ΔH1
反应2:C4H10(g,正丁烷) C2H6(g)+C2H4(g) ΔH2
已知几种共价键的键能如下表:
共价键 C—H C=C C—C
键能/(kJ·mol-1) 413 614 347
(1)根据上述数据估算,ΔH1= kJ·mol-1。
+80
(2)正丁烷和异丁烷之间转化的能量变化如图所示。
图1
①正丁烷气体转化成异丁烷气体的热化学方程式为
。 ②下列有关催化剂的叙述错误的
是 (填字母)。
A.能改变反应途径 B.能降低反应焓变
C.能加快反应速率 D.能增大平衡常数
C4H10(g,正丁烷) C4H10(g,异丁烷)
ΔH=-7 kJ·mol-1
BD
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率(α)与压强(p)、温度(T)的关系如图所示。
图2
①p1、p2、p3由小到大的顺序为
。
②随着温度升高,三种不同压强下正丁烷的平衡
转化率趋向相等,原因是______________________
。
p1
平衡的影响逐渐减小,平衡转化率主要由温度决定
(4)在一定温度下,向恒容密闭容器中投入正丁烷,同时发生反应1和反应2,测得部分物质的浓度与时间的关系如图,平衡时压强为17a kPa。
图3
①7 min时改变的条件可能是 (填字母)。
A.增大压强
B.增大正丁烷的浓度
C.加入催化剂
②该温度下,反应1的平衡常数Kp= kPa。
(提示:组分分压=总压×体积分数)
B
3a
解析 (1)根据键能计算反应热,ΔH1=(347×2-614) kJ·mol-1=+80 kJ·mol-1。
(2)②催化剂参与化学反应,改变了反应途径,A正确;反应热与产物、反应物的相对能量有关,催化剂同等程度降低正、逆反应活化能,不改变反应热,B错误;催化剂能够加快反应速率,C正确;催化剂同倍数改变正、逆反应速率,平衡不移动,平衡常数不变,D错误。
(3)①正反应是气体分子数增大的反应,减小压强,平衡向正反应方向移动,正丁烷的平衡转化率增大,则p1
(4)①增大压强,即缩小容器容积,瞬时CH4浓度增大,随后CH4浓度减小,A错误;增大正丁烷的浓度,平衡向正反应方向移动,CH4浓度增大,B正确;加入催化剂,平衡不移动,甲烷的浓度不变,C错误。②根据题图3,同时发生反应1和反应2,平衡时生成了0.3 mol·L-1的CH4,消耗了0.7 mol·L-1的C4H10,说明反应2生成了0.4 mol·L-1的C2H6,平衡体系中各组分的浓度分别是c(CH4)=c(C3H6)=0.3 mol·L-1,c(C2H6)=c(C2H4)=0.4 mol·L-1,
同课章节目录
