专题 溶液中的“三大平衡”及应用 课件(共47张PPT)
文档属性
| 名称 | 专题 溶液中的“三大平衡”及应用 课件(共47张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 23:25:39 | ||
图片预览








文档简介
(共47张PPT)
专题 溶液中的“三大平衡”及应用
聚焦核心要点
要点1电离平衡及应用
课标指引:1.认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。 2.认识水的电离,了解水的离子积常数。 3.认识溶液的酸碱性及pH,掌握检测溶液pH的方法。
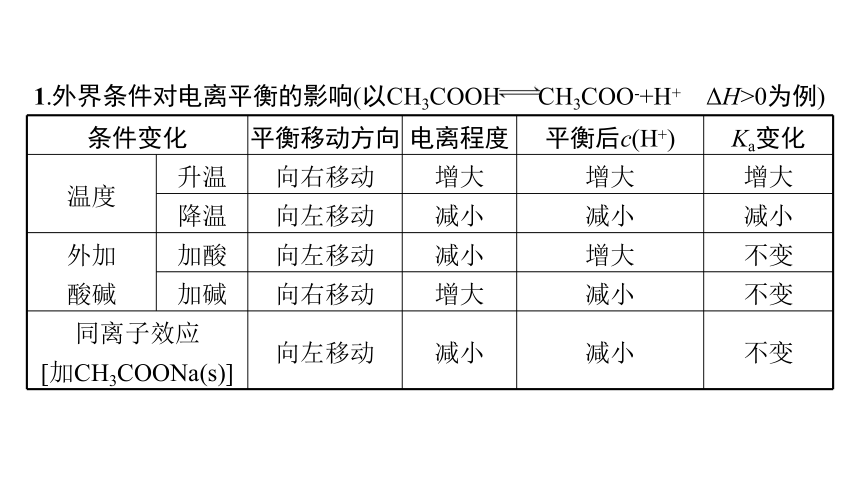
1.外界条件对电离平衡的影响(以CH3COOH CH3COO-+H+ ΔH>0为例)
条件变化 平衡移动方向 电离程度 平衡后c(H+) Ka变化
温度 升温 向右移动 增大 增大 增大
降温 向左移动 减小 减小 减小
外加 酸碱 加酸 向左移动 减小 增大 不变
加碱 向右移动 增大 减小 不变
同离子效应 [加CH3COONa(s)] 向左移动 减小 减小 不变
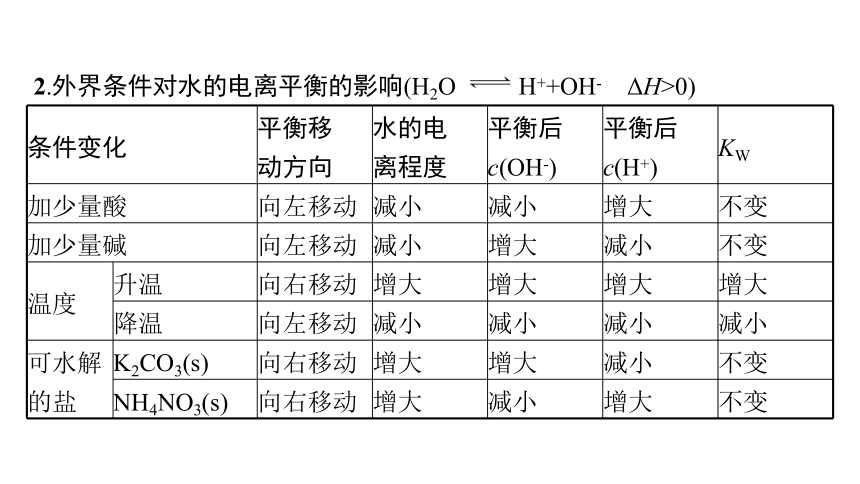
2.外界条件对水的电离平衡的影响(H2O H++OH- ΔH>0)
条件变化 平衡移 动方向 水的电 离程度 平衡后 c(OH-) 平衡后 c(H+) KW
加少量酸 向左移动 减小 减小 增大 不变
加少量碱 向左移动 减小 增大 减小 不变
温度 升温 向右移动 增大 增大 增大 增大
降温 向左移动 减小 减小 减小 减小
可水解 的盐 K2CO3(s) 向右移动 增大 增大 减小 不变
NH4NO3(s) 向右移动 增大 减小 增大 不变
要点2水解平衡及应用
课标指引:1.认识盐类水解的原理和影响盐类水解的主要因素。 2.了解溶液pH的调控在工农业生产和科学研究中的应用。
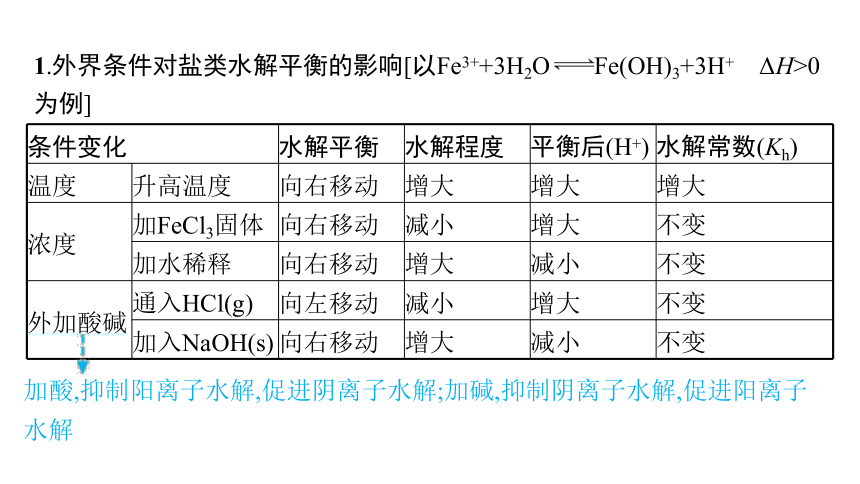
1.外界条件对盐类水解平衡的影响[以Fe3++3H2O Fe(OH)3+3H+ ΔH>0为例]
条件变化 水解平衡 水解程度 平衡后(H+) 水解常数(Kh)
温度 升高温度 向右移动 增大 增大 增大
浓度 加FeCl3固体 向右移动 减小 增大 不变
加水稀释 向右移动 增大 减小 不变
外加酸碱 通入HCl(g) 向左移动 减小 增大 不变
加入NaOH(s) 向右移动 增大 减小 不变
加酸,抑制阳离子水解,促进阴离子水解;加碱,抑制阴离子水解,促进阳离子水解
2.水解平衡中的两个“易错点”
(1)盐类水解受温度、浓度、溶液的酸碱性等因素影响,要结合“控制变量法”,从平衡移动方向、水解程度、pH变化、产生现象等角度进行分析、判断。
(2)多元弱酸的酸式盐(如NaHX)溶液中同时存在酸式根(HX-)的电离平衡和水解平衡,判断溶液的酸碱性,要考虑电离程度和水解程度的相对大小。
要点3沉淀溶解平衡及应用
课标指引:1.认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。 2.了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。
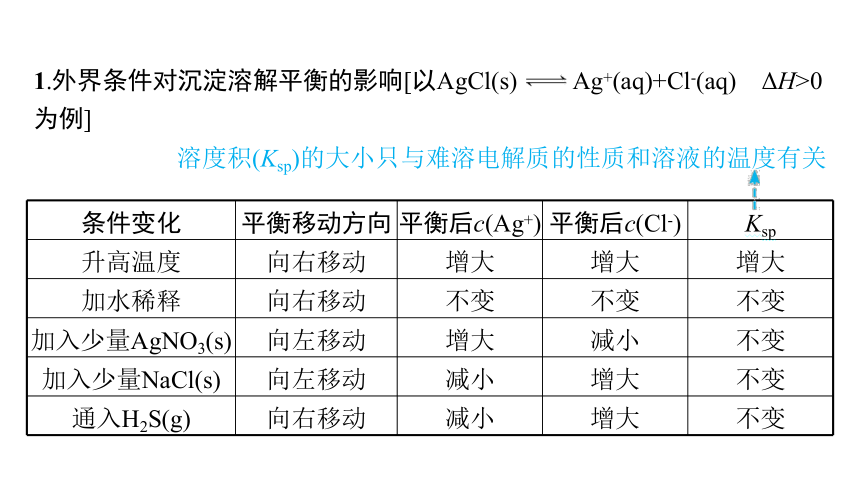
1.外界条件对沉淀溶解平衡的影响[以AgCl(s) Ag+(aq)+Cl-(aq) ΔH>0为例]
溶度积(Ksp)的大小只与难溶电解质的性质和溶液的温度有关
条件变化 平衡移动方向 平衡后c(Ag+) 平衡后c(Cl-) Ksp
升高温度 向右移动 增大 增大 增大
加水稀释 向右移动 不变 不变 不变
加入少量AgNO3(s) 向左移动 增大 减小 不变
加入少量NaCl(s) 向左移动 减小 增大 不变
通入H2S(g) 向右移动 减小 增大 不变
2.沉淀溶解平衡中的两个“易错点”
(1)沉淀溶解平衡具有动态平衡特征,平衡时溶液中各离子的浓度保持不变,要依据化学平衡移动原理分析外界条件对沉淀溶解平衡的影响。
(2)不能只根据Ksp的大小比较两种难溶电解质的溶解性,相同类型(如AB、AB2等)的难溶电解质的Ksp越小,其溶解度越小。
易错辨析
1.电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大。( )
2.弱电解质电离平衡右移,电离平衡常数一定增大。( )
3.显酸性的盐溶液,一定是该盐的阳离子发生了水解。( )
×
增大电解质分子的浓度和加水稀释都会使电离平衡向右移动,前者电解质分子的浓度增大,但后者离子浓度减小。
×
电离平衡常数只与温度有关。
×
NaHSO4溶液因盐电离出H+而显酸性。
4.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)。( )
5.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小。( )
√
根据电荷守恒,当溶液显中性时,c(Na+)=c(CH3COO-)。
×
Ksp只与难溶电解质自身的性质和温度有关,所以BaCO3的Ksp不变。
精研核心命题
命题点1电离平衡及影响因素
典例1 (2022·全国乙卷)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
B
解析 本题考查物质在水溶液中的行为,主要涉及弱电解质的电离、溶液电荷守恒、电离度的计算和应用等。由溶液Ⅰ pH=7.0可知,c(H+)=c(OH-),故c(H+)与[c(OH-)+c(A-)]不相等,由于溶液电荷守恒,一定存在与A-对应的阳离子,A项错误。
图解要点 本题中关键信息分析如下:
变式演练(2023·北京房山区一模)某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述不正确的是( )
A.稀释前溶液的浓度:c(HCl)B.溶液中水的电离程度:b点C.从b点到d点,溶液中c(H+)·c(OH-)逐渐增大
D.在d点和e点均存在:c(H+)>c(酸根阴离子)
C
解析 稀释前两溶液的pH相等,由于醋酸是部分电离,则溶液的浓度:c(HCl)c(酸根阴离子),D正确。
【思维建模】
解答弱电解质的电离平衡及分析类题目的思维模型
命题点2水解平衡及影响因素
典例2 (2022·湖南卷)为探究FeCl3的性质,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.1 mol·L-1)。
实验 操作与现象
① 在5 mL水中滴加2滴FeCl3溶液,呈棕黄色;煮沸,溶液变红褐色
② 在5 mL FeCl3溶液中滴加2滴Na2SO3溶液,变红褐色;再滴加K3[Fe(CN)6]溶液,产生蓝色沉淀
③ 在5 mL Na2SO3溶液中滴加2滴FeCl3溶液,变红褐色;将上述混合液分成两份,一份滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成;另一份煮沸,产生红褐色沉淀
依据上述实验现象,结论不合理的是( )
A.实验①说明加热促进Fe3+水解反应
B.实验②说明Fe3+既发生了水解反应,又发生了还原反应
C.实验③说明Fe3+发生了水解反应,但没有发生还原反应
D.整个实验说明 对Fe3+的水解反应无影响,但对还原反应有影响
D
解析 本题考查实验方案的评价。
FeCl3溶液为棕黄色,Fe(OH)3胶体呈红褐色,溶液由棕黄色变为红褐色,说明加热促进了Fe3+的水解,A项结论合理;实验②与实验①相比较,说明少量的
促进了Fe3+的水解,滴加K3[Fe(CN)6]溶液产生蓝色沉淀,说明溶液中存在Fe2+,即Fe3+也发生了还原反应,B项结论合理;实验③是向过量的Na2SO3溶液中滴加少量的FeCl3溶液,分组实验说明Fe3+发生水解,但是未发生还原反应,C项结论合理;综合分析整个实验,可知 对Fe3+的水解反应和还原反应都有影响,D项结论不合理。
变式演练(2023·河南名校联盟联考)实验测得0.5 mol·L-1 CH3COONa溶液、0.5 mol·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是KW改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
C
解析 升高温度,会促进纯水的电离,但是水电离出的c(H+)=c(OH-),仍为中性,A错误;升高温度,会促进盐类水解,CH3COO-水解程度变大,溶液中c(OH-)变大,B错误;加热会促进Cu2+水解,同时由于温度升高,也会促进水的电离,c(H+)变大,C正确;加热,溶液中CH3COO-、Cu2+的水解平衡均正向移动,D错误。
命题点3沉淀溶解平衡及影响因素
典例3 (2023·浙江1月选考卷)碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
A.上层清液中存在c(Ca2+)=c( )
B.上层清液中含碳微粒主要以 形式存在
C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变
D.通过加Na2SO4溶液可实现CaCO3向CaSO4的有效转化
B
向体系中通入CO2气体,发生反应:CaCO3+CO2+H2O ══ Ca(HCO3)2,生成可溶于水的Ca(HCO3)2,故溶液中c(Ca2+)增大,C错误;由题给信息可知,Ksp(CaSO4)>Ksp(CaCO3),说明CaCO3比CaSO4更难溶,加入Na2SO4溶液不能实现CaCO3向CaSO4的转化,D错误。
变式演练(2023·全国甲卷)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全)。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为 mol·L-1
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
C
解析 a点c(Fe3+)=10-2.5 mol·L-1,c(OH-)=10-12 mol·L-1,则Fe(OH)3的Ksp=c(Fe3+)·c3(OH-)=10-2.5×(10-12)3=10-38.5,A错误。pH=5时,c(Al3+)=10-6 mol·L-1,c(OH-)=10-9 mol·L-1,Ksp[Al(OH)3]=c(Al3+)·c3(OH-)=10-6×(10-9)3=10-33;
pH=4时,c(Al3+)= mol·L-1=10-3 mol·L-1,B错误。根据Fe(OH)3的
Ksp可知,Fe3+沉淀完全时,c3(OH-)×10-5=10-38.5,则c(OH-)≈10-11.17 mol·L-1。而Al3+开始沉淀时,0.01×c3(OH-)=10-33,则c(OH-)≈10-10.33 mol·L-1。因此Fe3+沉淀完全时,Al3+还未开始沉淀,C正确。Al3+沉淀完全时,10-5×c3(OH-)=10-33,c(OH-) ≈10-9.33 mol·L-1,根据pH=6的点可知,Cu(OH)2的Ksp=10-3.5×(10-8)2=10-19.5,当Al3+沉淀完全时,c(Cu2+)·c2(OH-)=0.2×10-18.66=2×10-19.66>Ksp[Cu(OH)2],此时Cu2+已经开始沉淀,故题述条件下Al3+、Cu2+可以同时沉淀,D错误。
【思维建模】
解答沉淀溶解平衡及分析类题目的思维模型
训练分层落实
练真题·明考向
1.(2022·浙江1月选考卷)已知25 ℃时二元酸H2A的 =1.3×10-7,
=7.1×10-15。下列说法正确的是( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
B
2.(2023·湖北卷)H2L为某邻苯二酚类配体,其 =7.46, =12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4 mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)= ,已知lg 2≈0.30,lg 3≈0.48。下列说法正确的是( )
Fe(Ⅲ)-H2L体系部分物种分布图
A.当pH=1时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+ [FeL2]-的平衡常数的lg K约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
答案 C
练易错·避陷阱
3.(2023·天津红桥区一模)已知物质的相关数据如下表,下列说法正确的是
( )
A.NaF不与盐酸反应
B.NaF溶液中存在的所有微粒有:H2O、Na+、F-、OH-、H+
C.HF与碳酸钠溶液反应,可能产生气体
D.向石灰水悬浊液中加入NaF溶液,溶液可能变澄清
C
4.(2023·河北邯郸六校联考)硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用于催吐剂。已知25 ℃时,Ksp[Zn(OH)2]=
1.0×10-17,Ksp(Ag2SO4)=1.4×10-5,则下列说法正确的是( )
A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,KW减小
B.在ZnSO4溶液中各离子的浓度关系为c(Zn2+)+c(H+)=c(OH-)+c( )
C.向0.5 L 0.10 mol·L-1 ZnSO4溶液中加入等体积0.02 mol·L-1 AgNO3溶液,即可生成Ag2SO4沉淀
D.常温下,要除去0.20 mol·L-1 ZnSO4溶液中的Zn2+,要调节pH≥8
D
解析 在水中加入ZnSO4固体,Zn2+发生水解反应,促使水的电离平衡正向移动,由于温度不变,则KW不变,A错误;ZnSO4溶液中,据电荷守恒可得
5.(2023·北京石景山区统考)已知:Ag++SCN- ══ AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
下列说法中,不正确的是( )
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+ ══ 3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
C
解析 由题图可知,AgNO3和KSCN溶液恰好完全反应生成AgSCN沉淀,向上层清液中滴加Fe(NO3)3溶液,得到浅红色溶液,则上层清液中含有SCN-,说明Ag+与SCN-生成AgSCN沉淀的反应有限度,A正确。向含Fe(SCN)3的浅红色溶液中加入AgNO3溶液,红色褪去,产生白色沉淀,发生的反应:Fe(SCN)3+3Ag+ ══ 3AgSCN↓+Fe3+,B正确。①中加入AgNO3溶液生成白色沉淀AgSCN后,AgNO3仍剩余;②中加入2 mol·L-1 KI溶液,溶液中Ag+和I-反应生成AgI黄色沉淀,未发生AgI和AgSCN之间的转化,故不能比较二者的溶解度大小,C错误。④白色沉淀AgSCN中加入2 mL 2 mol·L-1 KI溶液,白色沉淀转化为黄色沉淀,则AgSCN转化为AgI;随后沉淀溶解,得到无色溶液,由于溶液中KI剩余,可能是AgI和I-反应生成无色易溶性物质,D正确。
练预测·押考向
6.常温下,将4.0 g铁钉加入30 mL 4%的CuSO4溶液中,一段时间后观察到铁钉表面产生气泡,氧气含量和溶液pH变化如下图所示。
下列说法不正确的是( )
A.CuSO4溶液pH<7的原因:Cu2++2H2O Cu(OH)2+2H+
B.铁钉表面产生气泡的原因:Fe+2H+ ══ Fe2++H2↑
C.加入铁钉消耗H+,Cu2+水解平衡正向移动,产生Cu(OH)2沉淀
D.推测溶液pH减小的原因:4Fe2++O2+10H2O ══ 4Fe(OH)3↓+8H+
C
7.25 ℃时,某二元弱碱M(OH)2的水溶液中含有M(OH)2、M(OH)+、M2+,它们的分布系数δ随溶液pH的变化曲线如图所示。 为M(OH)2的第二步电离平衡常数,下列说法错误的是( )
B.曲线Ⅱ代表的微粒为M(OH)+
C.m、n、p三点对应的水溶液中,m点水的电离程度最小
D.0.1 mol·L-1 M(OH)Cl溶液中:c(Cl-)>c[M(OH)2]>c(M2+)>c(OH-)>c(H+)
D
解析 溶液的pH越小,溶液的酸性越强,越促进M(OH)2的电离,则溶液中M2+浓度越大,M(OH)2浓度越小,则曲线Ⅰ、Ⅱ、Ⅲ代表的微粒分别为M2+、
专题 溶液中的“三大平衡”及应用
聚焦核心要点
要点1电离平衡及应用
课标指引:1.认识弱电解质在水溶液中存在电离平衡,了解电离平衡常数的含义。 2.认识水的电离,了解水的离子积常数。 3.认识溶液的酸碱性及pH,掌握检测溶液pH的方法。
1.外界条件对电离平衡的影响(以CH3COOH CH3COO-+H+ ΔH>0为例)
条件变化 平衡移动方向 电离程度 平衡后c(H+) Ka变化
温度 升温 向右移动 增大 增大 增大
降温 向左移动 减小 减小 减小
外加 酸碱 加酸 向左移动 减小 增大 不变
加碱 向右移动 增大 减小 不变
同离子效应 [加CH3COONa(s)] 向左移动 减小 减小 不变
2.外界条件对水的电离平衡的影响(H2O H++OH- ΔH>0)
条件变化 平衡移 动方向 水的电 离程度 平衡后 c(OH-) 平衡后 c(H+) KW
加少量酸 向左移动 减小 减小 增大 不变
加少量碱 向左移动 减小 增大 减小 不变
温度 升温 向右移动 增大 增大 增大 增大
降温 向左移动 减小 减小 减小 减小
可水解 的盐 K2CO3(s) 向右移动 增大 增大 减小 不变
NH4NO3(s) 向右移动 增大 减小 增大 不变
要点2水解平衡及应用
课标指引:1.认识盐类水解的原理和影响盐类水解的主要因素。 2.了解溶液pH的调控在工农业生产和科学研究中的应用。
1.外界条件对盐类水解平衡的影响[以Fe3++3H2O Fe(OH)3+3H+ ΔH>0为例]
条件变化 水解平衡 水解程度 平衡后(H+) 水解常数(Kh)
温度 升高温度 向右移动 增大 增大 增大
浓度 加FeCl3固体 向右移动 减小 增大 不变
加水稀释 向右移动 增大 减小 不变
外加酸碱 通入HCl(g) 向左移动 减小 增大 不变
加入NaOH(s) 向右移动 增大 减小 不变
加酸,抑制阳离子水解,促进阴离子水解;加碱,抑制阴离子水解,促进阳离子水解
2.水解平衡中的两个“易错点”
(1)盐类水解受温度、浓度、溶液的酸碱性等因素影响,要结合“控制变量法”,从平衡移动方向、水解程度、pH变化、产生现象等角度进行分析、判断。
(2)多元弱酸的酸式盐(如NaHX)溶液中同时存在酸式根(HX-)的电离平衡和水解平衡,判断溶液的酸碱性,要考虑电离程度和水解程度的相对大小。
要点3沉淀溶解平衡及应用
课标指引:1.认识难溶电解质在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解与转化。 2.了解水溶液中的离子反应与平衡在物质检测、化学反应规律研究、物质转化中的应用。
1.外界条件对沉淀溶解平衡的影响[以AgCl(s) Ag+(aq)+Cl-(aq) ΔH>0为例]
溶度积(Ksp)的大小只与难溶电解质的性质和溶液的温度有关
条件变化 平衡移动方向 平衡后c(Ag+) 平衡后c(Cl-) Ksp
升高温度 向右移动 增大 增大 增大
加水稀释 向右移动 不变 不变 不变
加入少量AgNO3(s) 向左移动 增大 减小 不变
加入少量NaCl(s) 向左移动 减小 增大 不变
通入H2S(g) 向右移动 减小 增大 不变
2.沉淀溶解平衡中的两个“易错点”
(1)沉淀溶解平衡具有动态平衡特征,平衡时溶液中各离子的浓度保持不变,要依据化学平衡移动原理分析外界条件对沉淀溶解平衡的影响。
(2)不能只根据Ksp的大小比较两种难溶电解质的溶解性,相同类型(如AB、AB2等)的难溶电解质的Ksp越小,其溶解度越小。
易错辨析
1.电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大。( )
2.弱电解质电离平衡右移,电离平衡常数一定增大。( )
3.显酸性的盐溶液,一定是该盐的阳离子发生了水解。( )
×
增大电解质分子的浓度和加水稀释都会使电离平衡向右移动,前者电解质分子的浓度增大,但后者离子浓度减小。
×
电离平衡常数只与温度有关。
×
NaHSO4溶液因盐电离出H+而显酸性。
4.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)。( )
5.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小。( )
√
根据电荷守恒,当溶液显中性时,c(Na+)=c(CH3COO-)。
×
Ksp只与难溶电解质自身的性质和温度有关,所以BaCO3的Ksp不变。
精研核心命题
命题点1电离平衡及影响因素
典例1 (2022·全国乙卷)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-离子不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
B
解析 本题考查物质在水溶液中的行为,主要涉及弱电解质的电离、溶液电荷守恒、电离度的计算和应用等。由溶液Ⅰ pH=7.0可知,c(H+)=c(OH-),故c(H+)与[c(OH-)+c(A-)]不相等,由于溶液电荷守恒,一定存在与A-对应的阳离子,A项错误。
图解要点 本题中关键信息分析如下:
变式演练(2023·北京房山区一模)某温度下,将pH和体积均相同的HCl和CH3COOH溶液分别加水稀释,其pH随加水体积的变化如图所示。下列叙述不正确的是( )
A.稀释前溶液的浓度:c(HCl)
D.在d点和e点均存在:c(H+)>c(酸根阴离子)
C
解析 稀释前两溶液的pH相等,由于醋酸是部分电离,则溶液的浓度:c(HCl)
【思维建模】
解答弱电解质的电离平衡及分析类题目的思维模型
命题点2水解平衡及影响因素
典例2 (2022·湖南卷)为探究FeCl3的性质,进行了如下实验(FeCl3和Na2SO3溶液浓度均为0.1 mol·L-1)。
实验 操作与现象
① 在5 mL水中滴加2滴FeCl3溶液,呈棕黄色;煮沸,溶液变红褐色
② 在5 mL FeCl3溶液中滴加2滴Na2SO3溶液,变红褐色;再滴加K3[Fe(CN)6]溶液,产生蓝色沉淀
③ 在5 mL Na2SO3溶液中滴加2滴FeCl3溶液,变红褐色;将上述混合液分成两份,一份滴加K3[Fe(CN)6]溶液,无蓝色沉淀生成;另一份煮沸,产生红褐色沉淀
依据上述实验现象,结论不合理的是( )
A.实验①说明加热促进Fe3+水解反应
B.实验②说明Fe3+既发生了水解反应,又发生了还原反应
C.实验③说明Fe3+发生了水解反应,但没有发生还原反应
D.整个实验说明 对Fe3+的水解反应无影响,但对还原反应有影响
D
解析 本题考查实验方案的评价。
FeCl3溶液为棕黄色,Fe(OH)3胶体呈红褐色,溶液由棕黄色变为红褐色,说明加热促进了Fe3+的水解,A项结论合理;实验②与实验①相比较,说明少量的
促进了Fe3+的水解,滴加K3[Fe(CN)6]溶液产生蓝色沉淀,说明溶液中存在Fe2+,即Fe3+也发生了还原反应,B项结论合理;实验③是向过量的Na2SO3溶液中滴加少量的FeCl3溶液,分组实验说明Fe3+发生水解,但是未发生还原反应,C项结论合理;综合分析整个实验,可知 对Fe3+的水解反应和还原反应都有影响,D项结论不合理。
变式演练(2023·河南名校联盟联考)实验测得0.5 mol·L-1 CH3COONa溶液、0.5 mol·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是KW改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
C
解析 升高温度,会促进纯水的电离,但是水电离出的c(H+)=c(OH-),仍为中性,A错误;升高温度,会促进盐类水解,CH3COO-水解程度变大,溶液中c(OH-)变大,B错误;加热会促进Cu2+水解,同时由于温度升高,也会促进水的电离,c(H+)变大,C正确;加热,溶液中CH3COO-、Cu2+的水解平衡均正向移动,D错误。
命题点3沉淀溶解平衡及影响因素
典例3 (2023·浙江1月选考卷)碳酸钙是常见难溶物,将过量碳酸钙粉末置于水中达到溶解平衡:
A.上层清液中存在c(Ca2+)=c( )
B.上层清液中含碳微粒主要以 形式存在
C.向体系中通入CO2气体,溶液中c(Ca2+)保持不变
D.通过加Na2SO4溶液可实现CaCO3向CaSO4的有效转化
B
向体系中通入CO2气体,发生反应:CaCO3+CO2+H2O ══ Ca(HCO3)2,生成可溶于水的Ca(HCO3)2,故溶液中c(Ca2+)增大,C错误;由题给信息可知,Ksp(CaSO4)>Ksp(CaCO3),说明CaCO3比CaSO4更难溶,加入Na2SO4溶液不能实现CaCO3向CaSO4的转化,D错误。
变式演练(2023·全国甲卷)下图为Fe(OH)3、Al(OH)3和Cu(OH)2在水中达沉淀溶解平衡时的pM-pH关系图(pM=-lg[c(M)/(mol·L-1)];c(M)≤10-5 mol·L-1可认为M离子沉淀完全)。下列叙述正确的是( )
A.由a点可求得Ksp[Fe(OH)3]=10-8.5
B.pH=4时Al(OH)3的溶解度为 mol·L-1
C.浓度均为0.01 mol·L-1的Al3+和Fe3+可通过分步沉淀进行分离
D.Al3+、Cu2+混合溶液中c(Cu2+)=0.2 mol·L-1时二者不会同时沉淀
C
解析 a点c(Fe3+)=10-2.5 mol·L-1,c(OH-)=10-12 mol·L-1,则Fe(OH)3的Ksp=c(Fe3+)·c3(OH-)=10-2.5×(10-12)3=10-38.5,A错误。pH=5时,c(Al3+)=10-6 mol·L-1,c(OH-)=10-9 mol·L-1,Ksp[Al(OH)3]=c(Al3+)·c3(OH-)=10-6×(10-9)3=10-33;
pH=4时,c(Al3+)= mol·L-1=10-3 mol·L-1,B错误。根据Fe(OH)3的
Ksp可知,Fe3+沉淀完全时,c3(OH-)×10-5=10-38.5,则c(OH-)≈10-11.17 mol·L-1。而Al3+开始沉淀时,0.01×c3(OH-)=10-33,则c(OH-)≈10-10.33 mol·L-1。因此Fe3+沉淀完全时,Al3+还未开始沉淀,C正确。Al3+沉淀完全时,10-5×c3(OH-)=10-33,c(OH-) ≈10-9.33 mol·L-1,根据pH=6的点可知,Cu(OH)2的Ksp=10-3.5×(10-8)2=10-19.5,当Al3+沉淀完全时,c(Cu2+)·c2(OH-)=0.2×10-18.66=2×10-19.66>Ksp[Cu(OH)2],此时Cu2+已经开始沉淀,故题述条件下Al3+、Cu2+可以同时沉淀,D错误。
【思维建模】
解答沉淀溶解平衡及分析类题目的思维模型
训练分层落实
练真题·明考向
1.(2022·浙江1月选考卷)已知25 ℃时二元酸H2A的 =1.3×10-7,
=7.1×10-15。下列说法正确的是( )
A.在等浓度的Na2A、NaHA溶液中,水的电离程度前者小于后者
B.向0.1 mol·L-1的H2A溶液中通入HCl气体(忽略溶液体积的变化)至pH=3,则H2A的电离度为0.013%
C.向H2A溶液中加入NaOH溶液至pH=11,则c(A2-)>c(HA-)
D.取pH=a的H2A溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
B
2.(2023·湖北卷)H2L为某邻苯二酚类配体,其 =7.46, =12.4。常温下构建Fe(Ⅲ)-H2L溶液体系,其中c0(Fe3+)=2.0×10-4 mol·L-1,c0(H2L)=5.0×10-3 mol·L-1。体系中含Fe物种的组分分布系数δ与pH的关系如图所示,分布系数δ(x)= ,已知lg 2≈0.30,lg 3≈0.48。下列说法正确的是( )
Fe(Ⅲ)-H2L体系部分物种分布图
A.当pH=1时,体系中c(H2L)>c([FeL]+)>c(OH-)>c(HL-)
B.pH在9.5~10.5之间,含L的物种主要为L2-
C.L2-+[FeL]+ [FeL2]-的平衡常数的lg K约为14
D.当pH=10时,参与配位的c(L2-)≈1.0×10-3 mol·L-1
答案 C
练易错·避陷阱
3.(2023·天津红桥区一模)已知物质的相关数据如下表,下列说法正确的是
( )
A.NaF不与盐酸反应
B.NaF溶液中存在的所有微粒有:H2O、Na+、F-、OH-、H+
C.HF与碳酸钠溶液反应,可能产生气体
D.向石灰水悬浊液中加入NaF溶液,溶液可能变澄清
C
4.(2023·河北邯郸六校联考)硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用于催吐剂。已知25 ℃时,Ksp[Zn(OH)2]=
1.0×10-17,Ksp(Ag2SO4)=1.4×10-5,则下列说法正确的是( )
A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,KW减小
B.在ZnSO4溶液中各离子的浓度关系为c(Zn2+)+c(H+)=c(OH-)+c( )
C.向0.5 L 0.10 mol·L-1 ZnSO4溶液中加入等体积0.02 mol·L-1 AgNO3溶液,即可生成Ag2SO4沉淀
D.常温下,要除去0.20 mol·L-1 ZnSO4溶液中的Zn2+,要调节pH≥8
D
解析 在水中加入ZnSO4固体,Zn2+发生水解反应,促使水的电离平衡正向移动,由于温度不变,则KW不变,A错误;ZnSO4溶液中,据电荷守恒可得
5.(2023·北京石景山区统考)已知:Ag++SCN- ══ AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
下列说法中,不正确的是( )
A.①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B.②中现象产生的原因是发生了反应Fe(SCN)3+3Ag+ ══ 3AgSCN↓+Fe3+
C.③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D.④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
C
解析 由题图可知,AgNO3和KSCN溶液恰好完全反应生成AgSCN沉淀,向上层清液中滴加Fe(NO3)3溶液,得到浅红色溶液,则上层清液中含有SCN-,说明Ag+与SCN-生成AgSCN沉淀的反应有限度,A正确。向含Fe(SCN)3的浅红色溶液中加入AgNO3溶液,红色褪去,产生白色沉淀,发生的反应:Fe(SCN)3+3Ag+ ══ 3AgSCN↓+Fe3+,B正确。①中加入AgNO3溶液生成白色沉淀AgSCN后,AgNO3仍剩余;②中加入2 mol·L-1 KI溶液,溶液中Ag+和I-反应生成AgI黄色沉淀,未发生AgI和AgSCN之间的转化,故不能比较二者的溶解度大小,C错误。④白色沉淀AgSCN中加入2 mL 2 mol·L-1 KI溶液,白色沉淀转化为黄色沉淀,则AgSCN转化为AgI;随后沉淀溶解,得到无色溶液,由于溶液中KI剩余,可能是AgI和I-反应生成无色易溶性物质,D正确。
练预测·押考向
6.常温下,将4.0 g铁钉加入30 mL 4%的CuSO4溶液中,一段时间后观察到铁钉表面产生气泡,氧气含量和溶液pH变化如下图所示。
下列说法不正确的是( )
A.CuSO4溶液pH<7的原因:Cu2++2H2O Cu(OH)2+2H+
B.铁钉表面产生气泡的原因:Fe+2H+ ══ Fe2++H2↑
C.加入铁钉消耗H+,Cu2+水解平衡正向移动,产生Cu(OH)2沉淀
D.推测溶液pH减小的原因:4Fe2++O2+10H2O ══ 4Fe(OH)3↓+8H+
C
7.25 ℃时,某二元弱碱M(OH)2的水溶液中含有M(OH)2、M(OH)+、M2+,它们的分布系数δ随溶液pH的变化曲线如图所示。 为M(OH)2的第二步电离平衡常数,下列说法错误的是( )
B.曲线Ⅱ代表的微粒为M(OH)+
C.m、n、p三点对应的水溶液中,m点水的电离程度最小
D.0.1 mol·L-1 M(OH)Cl溶液中:c(Cl-)>c[M(OH)2]>c(M2+)>c(OH-)>c(H+)
D
解析 溶液的pH越小,溶液的酸性越强,越促进M(OH)2的电离,则溶液中M2+浓度越大,M(OH)2浓度越小,则曲线Ⅰ、Ⅱ、Ⅲ代表的微粒分别为M2+、
同课章节目录
