专题 溶液中的“四大常数”及应用(共44张PPT)
文档属性
| 名称 | 专题 溶液中的“四大常数”及应用(共44张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 23:26:02 | ||
图片预览











文档简介
(共44张PPT)
专题 溶液中的“四大常数”及应用
考情分析
高考命题分析
命 题 情 境 (1)日常生活情境:从醋酸、纯碱去油污、铁盐(铝盐)净水、溶洞的形成等情境选材,要求考生利用基本概念和原理阐释生活中的化学现象,激发钻研化学的兴趣。
(2)生产环保情境:从化工流程中物质的分离及提纯、定量实验分析等情境选材,要求考生结合Ksp进行除杂、迁移应用滴定原理进行物质的含量测定等,解决工业生产的实际问题。
(3)实验探究情境:利用水溶液中的离子反应与平衡移动,探究物质的制备、分离及提纯等,通过实验情境构建,要求考生在实验中寻求思维创新和能力提升。
素 养 能 力 (1)理解与辨析能力:理解水溶液中的“三大平衡”及移动原理,辨析模型、图表等信息,并能解决相关的化学问题。
(2)分析与推测能力:结合电解质在水溶液中的行为及变化,分析与推测“三大平衡”的移动及结果,从定量角度(各类常数)进行分析及计算。
(3)思维方法:具有证据意识,能基于实验现象或数据对物质组成、结构及其变化提出假设,并从定性和定量相结合的角度归纳总结出电解质的变化特征和规律。
聚焦核心要点
课标指引:1.了解电离平衡常数和水的离子积常数的含义,能进行简单计算。 2.了解水解常数和溶度积常数的含义,并能进行相关计算。
1.电离平衡常数(Ka或Kb)的两种计算方法
列出电离常数表达式,注意两个近似处理
(1)根据电离常数表达式近似计算
已知c(HX)和c(H+),计算HX的电离平衡常数Ka(HX):
适用于电离常数较小的弱电解质,平衡时c(HX)和c(H+)相差100倍以上
(2)根据分布分数(δ)图像近似计算
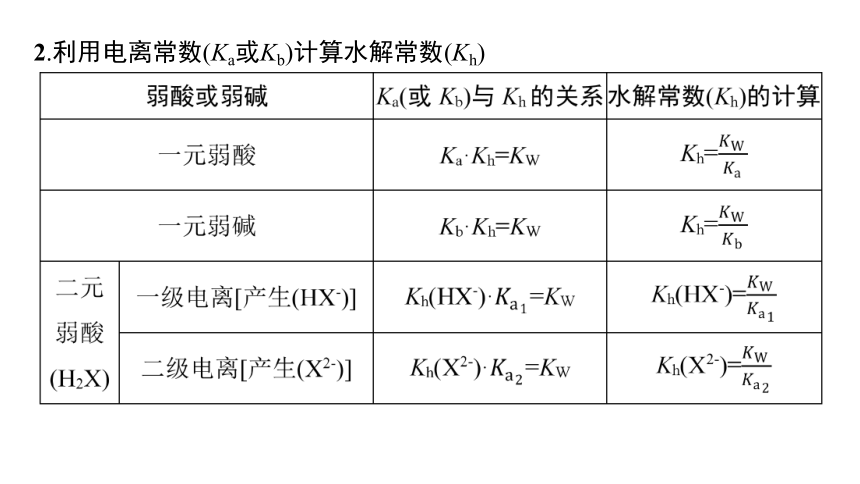
2.利用电离常数(Ka或Kb)计算水解常数(Kh)
微点拨
判断弱酸的酸式盐NaHX溶液的酸碱性,要比较与Kh(HX-)的大小,前者大时溶液呈酸性,后者大时溶液呈碱性;同理,可推测等物质的量浓度的HX和NaX混合液的酸碱性。
3.溶度积常数(Ksp)及相关计算
(1)M(OH)n悬浊液中Ksp、KW和pH间的关系:
(2)建立Ksp与沉淀转化反应平衡常数(K)的关系
建立Ksp与K的关系,一般是在K的表达式的分子、分母中同乘以某个离子的浓度,将分子、分母转化为不同物质的Ksp。例如,反应AgCl(s)+Br-(aq)
易错辨析
1.相同温度下,Ksp小的电解质其溶解能力一定比Ksp大的电解质的溶解能力小。( )
2.若向NaHSO3溶液中加入少量的I2,则溶液中 将增大。( )
×
对于相同类型的物质,Ksp的大小能够反映难溶电解质溶解能力的大小,不是同种类型的不能直接通过Ksp的大小来比较。
√
√
精研核心命题
命题点1Ka(或Kb)与Kh的计算及应用
典例1 (1)(2022·湖南卷,16节选)一种脱除和利用水煤气中CO2方法的示意图如下:
10
5×10-5
③在pH=4~7溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,原因是
。
c(OH-)越大,FeS表面吸附的Cr(Ⅵ)的量越少,FeS溶出量越少,Cr(Ⅵ)中 物质的量分数越大
③在pH=4~7的溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,是由于c(OH-)越大,FeS表面吸附的Cr(Ⅵ)的量越少,FeS溶出量越少,Cr(Ⅵ)中
物质的量分数越大。
变式演练已知25 ℃时,NH3·H2O的电离平衡常数Kb=2×10-5。将浓度均为1.0 mol·L-1的氨水和NH4Cl溶液等体积混合,则混合溶液呈 (填“酸性”“中性”或“碱性”),此时混合溶液的pH= 。
(已知:lg 5=0.7)
碱性
9.3
命题点2Ksp的计算及应用
典例2 (2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
C
变式演练(1)(2021·湖北卷,16节选)25 ℃时,已知:Kb(NH3·H2O)≈2.0×10-5, Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,Ksp[Cu(OH)2]≈1.0×10-20, “浸出液”中c(Cu2+)=0.01 mol·L-1。
①当金属阳离子浓度小于1.0×10-5 mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为 (保留一位小数);
②若继续加入6.0 mol·L-1氨水至过量,观察到的实验现象是先有蓝色沉淀,然后 ;
4.7
蓝色沉淀溶解,溶液变成深蓝色
2.0×10-6
3.25×103
②若继续加入6.0 mol·L-1氨水至过量,先有蓝色沉淀Cu(OH)2生成,然后蓝色沉淀溶解,生成[Cu(NH3)4](OH)2,得到深蓝色溶液。
训练分层落实
练真题·明考向
1.(2023·全国新课标卷)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示(其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+)。
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)
A
解析 溶液中存在足量的AgCl固体,根据平衡移动原理,随着氨水的滴加AgCl溶解度逐渐增大,则Cl-浓度增大、Ag+浓度减小,[Ag(NH3)]+开始占优势,而随着氨水的滴加[Ag(NH3)2]+浓度会逐渐超过[Ag(NH3)]+,结合图像可知,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表[Ag(NH3)2]+、[Ag(NH3)]+、Ag+、Cl-。曲线Ⅰ代表[Ag(NH3)2]+浓度随NH3浓度变化曲线,A错误;根据lg[c(NH3)/(mol·L-1)]=-1相关数据进行计算,AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-7.40×10-2.35=10-9.75,B正确;根据lg[c(NH3)/(mol·L-1)]=-1相关数据进行计算反应
2.(2023·辽宁卷)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如下图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
D
解析 H2S为弱电解质,分步电离,随pH增大,HS-、S2-浓度均应逐渐增大,且pH较小范围内-lg c(S2-)比-lg c(HS-)大,故③为pH与-lg c(S2-)的关系曲线,④为pH与-lg c(HS-)的关系曲线;已知Ksp(NiS)>Ksp(CdS),则①、②分别为pH与-lg c(Cd2+)、-lg c(Ni2+)的关系曲线。根据(4.9,13.0)点可知,Ksp(CdS)=c2(Cd2+)=(1×10-13)2=1×10-26,A错误;根据上述分析③为pH与-lg c(S2-)的关系曲线,B错误;
3.(2022·山东卷)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1 Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是( )
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
答案 D
解析 本题属于沉淀溶解平衡图像题,重点考查学生分析图像的能力、平衡常数的表达式及相关计算。
对于含SrSO4(s)的Na2SO4溶液,当溶液pH变化时,溶液中硫酸根离子浓度几乎不变,不会使SrSO4(s) Sr2+(aq)+ (aq)发生移动,即含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,又因为pH相同时,溶液中硫酸根离子浓度增大,SrSO4的沉淀溶解平衡向沉淀方向移动,因此锶离子浓度减小,所以曲线①代表含硫酸锶固体的0.1 mol·L-1硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1.0 mol·L-1硫酸钠溶液的变化曲线;对于含SrCO3(s)的Na2CO3溶液,当溶液pH减小时,溶液中碳酸根离子浓度减小,
SrCO3的沉淀溶解平衡向溶解的方向移动,锶离子浓度增大,又因为pH相同时,1.0 mol·L-1碳酸钠溶液中碳酸根离子浓度大于0.1 mol·L-1碳酸钠溶液中碳酸根离子的浓度,因此曲线③表示含碳酸锶固体的0.1 mol·L-1碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1.0 mol·L-1碳酸钠溶液的变化
由分析可知,曲线④表示含碳酸锶固体的1.0 mol·L-1碳酸钠溶液的变化曲线,C项正确;根据图像分析可知,对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥6.9时,溶液中Sr2+浓度减小,发生了SrSO4(s)到SrCO3(s)的转化,D项错误。
练易错·避陷阱
B.将浓度均为3×10-4.5 mol·L-1的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C.25 ℃时,RSO4的Ksp为4.9×10-5
D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
C
练预测·押考向
5.溶洞水体中的H2CO3与空气中的CO2保持平衡,其水体中lg c(X)(X为H2CO3、 或Ca2+)与pH的关系如图所示。已知Ksp(CaCO3)=2.8×10-9。下列说法错误的是( )
C.2pH(b)=pH(a)+pH(c)
D.a点溶液中,c(Ca2+)<2.8 mol·L-1
D
6.HX是一元弱酸,微溶盐MX2的饱和溶液中c(M2+)随c(H+)而变化,M2+不发生水解。25 ℃时,实验测得pM与δ(X-)的关系如图所示,其中A点对应的pH=5.0。[已知lg 2≈0.3,pM=-lg c(M2+),δ(X-)= ]。下列说法正确的是( )
A.A点对应溶液中存在2c(M2+)=3c(HX)
B.B点对应溶液的pH约为5.6
C.25 ℃时,Ksp(MX2)的数量级为10-8
D.25 ℃时,HX的电离常数Ka为2.5×10-5
B
专题 溶液中的“四大常数”及应用
考情分析
高考命题分析
命 题 情 境 (1)日常生活情境:从醋酸、纯碱去油污、铁盐(铝盐)净水、溶洞的形成等情境选材,要求考生利用基本概念和原理阐释生活中的化学现象,激发钻研化学的兴趣。
(2)生产环保情境:从化工流程中物质的分离及提纯、定量实验分析等情境选材,要求考生结合Ksp进行除杂、迁移应用滴定原理进行物质的含量测定等,解决工业生产的实际问题。
(3)实验探究情境:利用水溶液中的离子反应与平衡移动,探究物质的制备、分离及提纯等,通过实验情境构建,要求考生在实验中寻求思维创新和能力提升。
素 养 能 力 (1)理解与辨析能力:理解水溶液中的“三大平衡”及移动原理,辨析模型、图表等信息,并能解决相关的化学问题。
(2)分析与推测能力:结合电解质在水溶液中的行为及变化,分析与推测“三大平衡”的移动及结果,从定量角度(各类常数)进行分析及计算。
(3)思维方法:具有证据意识,能基于实验现象或数据对物质组成、结构及其变化提出假设,并从定性和定量相结合的角度归纳总结出电解质的变化特征和规律。
聚焦核心要点
课标指引:1.了解电离平衡常数和水的离子积常数的含义,能进行简单计算。 2.了解水解常数和溶度积常数的含义,并能进行相关计算。
1.电离平衡常数(Ka或Kb)的两种计算方法
列出电离常数表达式,注意两个近似处理
(1)根据电离常数表达式近似计算
已知c(HX)和c(H+),计算HX的电离平衡常数Ka(HX):
适用于电离常数较小的弱电解质,平衡时c(HX)和c(H+)相差100倍以上
(2)根据分布分数(δ)图像近似计算
2.利用电离常数(Ka或Kb)计算水解常数(Kh)
微点拨
判断弱酸的酸式盐NaHX溶液的酸碱性,要比较与Kh(HX-)的大小,前者大时溶液呈酸性,后者大时溶液呈碱性;同理,可推测等物质的量浓度的HX和NaX混合液的酸碱性。
3.溶度积常数(Ksp)及相关计算
(1)M(OH)n悬浊液中Ksp、KW和pH间的关系:
(2)建立Ksp与沉淀转化反应平衡常数(K)的关系
建立Ksp与K的关系,一般是在K的表达式的分子、分母中同乘以某个离子的浓度,将分子、分母转化为不同物质的Ksp。例如,反应AgCl(s)+Br-(aq)
易错辨析
1.相同温度下,Ksp小的电解质其溶解能力一定比Ksp大的电解质的溶解能力小。( )
2.若向NaHSO3溶液中加入少量的I2,则溶液中 将增大。( )
×
对于相同类型的物质,Ksp的大小能够反映难溶电解质溶解能力的大小,不是同种类型的不能直接通过Ksp的大小来比较。
√
√
精研核心命题
命题点1Ka(或Kb)与Kh的计算及应用
典例1 (1)(2022·湖南卷,16节选)一种脱除和利用水煤气中CO2方法的示意图如下:
10
5×10-5
③在pH=4~7溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,原因是
。
c(OH-)越大,FeS表面吸附的Cr(Ⅵ)的量越少,FeS溶出量越少,Cr(Ⅵ)中 物质的量分数越大
③在pH=4~7的溶液中,pH越大,FeS去除水中Cr(Ⅵ)的速率越慢,是由于c(OH-)越大,FeS表面吸附的Cr(Ⅵ)的量越少,FeS溶出量越少,Cr(Ⅵ)中
物质的量分数越大。
变式演练已知25 ℃时,NH3·H2O的电离平衡常数Kb=2×10-5。将浓度均为1.0 mol·L-1的氨水和NH4Cl溶液等体积混合,则混合溶液呈 (填“酸性”“中性”或“碱性”),此时混合溶液的pH= 。
(已知:lg 5=0.7)
碱性
9.3
命题点2Ksp的计算及应用
典例2 (2023·全国乙卷)一定温度下,AgCl和Ag2CrO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A.a点条件下能生成Ag2CrO4沉淀,也能生成AgCl沉淀
D.向NaCl、Na2CrO4均为0.1 mol·L-1的混合溶液中滴加AgNO3溶液,先产生Ag2CrO4沉淀
C
变式演练(1)(2021·湖北卷,16节选)25 ℃时,已知:Kb(NH3·H2O)≈2.0×10-5, Ksp[Ga(OH)3]≈1.0×10-35,Ksp[In(OH)3]≈1.0×10-33,Ksp[Cu(OH)2]≈1.0×10-20, “浸出液”中c(Cu2+)=0.01 mol·L-1。
①当金属阳离子浓度小于1.0×10-5 mol·L-1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为 (保留一位小数);
②若继续加入6.0 mol·L-1氨水至过量,观察到的实验现象是先有蓝色沉淀,然后 ;
4.7
蓝色沉淀溶解,溶液变成深蓝色
2.0×10-6
3.25×103
②若继续加入6.0 mol·L-1氨水至过量,先有蓝色沉淀Cu(OH)2生成,然后蓝色沉淀溶解,生成[Cu(NH3)4](OH)2,得到深蓝色溶液。
训练分层落实
练真题·明考向
1.(2023·全国新课标卷)向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应Ag++NH3 [Ag(NH3)]+和[Ag(NH3)]++NH3 [Ag(NH3)2]+。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如下图所示(其中M代表Ag+、Cl-、[Ag(NH3)]+或[Ag(NH3)2]+)。
下列说法错误的是( )
A.曲线Ⅰ可视为AgCl溶解度随NH3浓度变化曲线
B.AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-9.75
C.反应[Ag(NH3)]++NH3 [Ag(NH3)2]+的平衡常数K的值为103.81
D.c(NH3)=0.01 mol·L-1时,溶液中c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+)
A
解析 溶液中存在足量的AgCl固体,根据平衡移动原理,随着氨水的滴加AgCl溶解度逐渐增大,则Cl-浓度增大、Ag+浓度减小,[Ag(NH3)]+开始占优势,而随着氨水的滴加[Ag(NH3)2]+浓度会逐渐超过[Ag(NH3)]+,结合图像可知,Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表[Ag(NH3)2]+、[Ag(NH3)]+、Ag+、Cl-。曲线Ⅰ代表[Ag(NH3)2]+浓度随NH3浓度变化曲线,A错误;根据lg[c(NH3)/(mol·L-1)]=-1相关数据进行计算,AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-7.40×10-2.35=10-9.75,B正确;根据lg[c(NH3)/(mol·L-1)]=-1相关数据进行计算反应
2.(2023·辽宁卷)某废水处理过程中始终保持H2S饱和,即c(H2S)=0.1 mol·L-1,通过调节pH使Ni2+和Cd2+形成硫化物而分离,体系中pH与-lg c关系如下图所示,c为HS-、S2-、Ni2+和Cd2+的浓度,单位为mol·L-1。已知Ksp(NiS)>Ksp(CdS),下列说法正确的是( )
A.Ksp(CdS)=10-18.4
B.③为pH与-lg c(HS-)的关系曲线
D
解析 H2S为弱电解质,分步电离,随pH增大,HS-、S2-浓度均应逐渐增大,且pH较小范围内-lg c(S2-)比-lg c(HS-)大,故③为pH与-lg c(S2-)的关系曲线,④为pH与-lg c(HS-)的关系曲线;已知Ksp(NiS)>Ksp(CdS),则①、②分别为pH与-lg c(Cd2+)、-lg c(Ni2+)的关系曲线。根据(4.9,13.0)点可知,Ksp(CdS)=c2(Cd2+)=(1×10-13)2=1×10-26,A错误;根据上述分析③为pH与-lg c(S2-)的关系曲线,B错误;
3.(2022·山东卷)工业上以SrSO4(s)为原料生产SrCO3(s),对其工艺条件进行研究。现有含SrCO3(s)的0.1 mol·L-1、1.0 mol·L-1 Na2CO3溶液,含SrSO4(s)的0.1 mol·L-1、1.0 mol·L-1 Na2SO4溶液。在一定pH范围内,四种溶液中lg[c(Sr2+)/mol·L-1]随pH的变化关系如图所示。下列说法错误的是( )
B.a=-6.5
C.曲线④代表含SrCO3(s)的1.0 mol·L-1 Na2CO3溶液的变化曲线
D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥7.7时才发生沉淀转化
答案 D
解析 本题属于沉淀溶解平衡图像题,重点考查学生分析图像的能力、平衡常数的表达式及相关计算。
对于含SrSO4(s)的Na2SO4溶液,当溶液pH变化时,溶液中硫酸根离子浓度几乎不变,不会使SrSO4(s) Sr2+(aq)+ (aq)发生移动,即含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,又因为pH相同时,溶液中硫酸根离子浓度增大,SrSO4的沉淀溶解平衡向沉淀方向移动,因此锶离子浓度减小,所以曲线①代表含硫酸锶固体的0.1 mol·L-1硫酸钠溶液的变化曲线,曲线②代表含硫酸锶固体的1.0 mol·L-1硫酸钠溶液的变化曲线;对于含SrCO3(s)的Na2CO3溶液,当溶液pH减小时,溶液中碳酸根离子浓度减小,
SrCO3的沉淀溶解平衡向溶解的方向移动,锶离子浓度增大,又因为pH相同时,1.0 mol·L-1碳酸钠溶液中碳酸根离子浓度大于0.1 mol·L-1碳酸钠溶液中碳酸根离子的浓度,因此曲线③表示含碳酸锶固体的0.1 mol·L-1碳酸钠溶液的变化曲线,曲线④表示含碳酸锶固体的1.0 mol·L-1碳酸钠溶液的变化
由分析可知,曲线④表示含碳酸锶固体的1.0 mol·L-1碳酸钠溶液的变化曲线,C项正确;根据图像分析可知,对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH≥6.9时,溶液中Sr2+浓度减小,发生了SrSO4(s)到SrCO3(s)的转化,D项错误。
练易错·避陷阱
B.将浓度均为3×10-4.5 mol·L-1的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C.25 ℃时,RSO4的Ksp为4.9×10-5
D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
C
练预测·押考向
5.溶洞水体中的H2CO3与空气中的CO2保持平衡,其水体中lg c(X)(X为H2CO3、 或Ca2+)与pH的关系如图所示。已知Ksp(CaCO3)=2.8×10-9。下列说法错误的是( )
C.2pH(b)=pH(a)+pH(c)
D.a点溶液中,c(Ca2+)<2.8 mol·L-1
D
6.HX是一元弱酸,微溶盐MX2的饱和溶液中c(M2+)随c(H+)而变化,M2+不发生水解。25 ℃时,实验测得pM与δ(X-)的关系如图所示,其中A点对应的pH=5.0。[已知lg 2≈0.3,pM=-lg c(M2+),δ(X-)= ]。下列说法正确的是( )
A.A点对应溶液中存在2c(M2+)=3c(HX)
B.B点对应溶液的pH约为5.6
C.25 ℃时,Ksp(MX2)的数量级为10-8
D.25 ℃时,HX的电离常数Ka为2.5×10-5
B
同课章节目录
