专题 中和滴定及拓展应用 课件(共37张PPT)
文档属性
| 名称 | 专题 中和滴定及拓展应用 课件(共37张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 23:26:50 | ||
图片预览









文档简介
(共37张PPT)
专题 中和滴定及拓展应用
聚焦核心要点
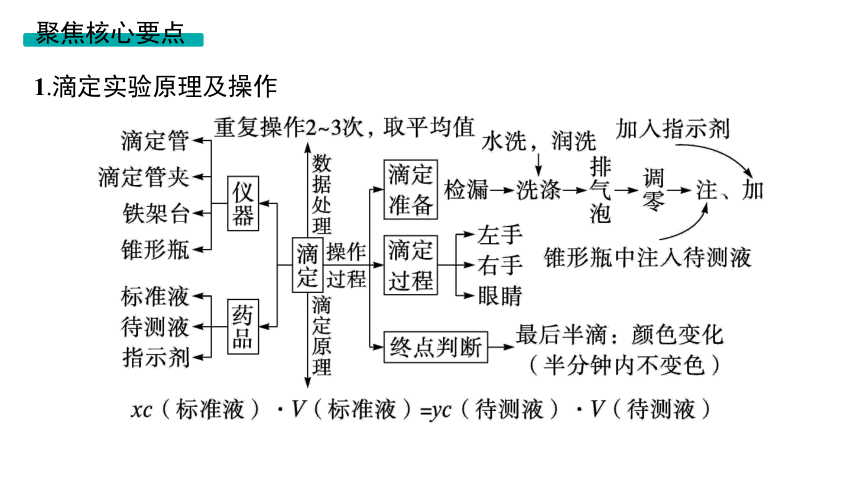
1.滴定实验原理及操作
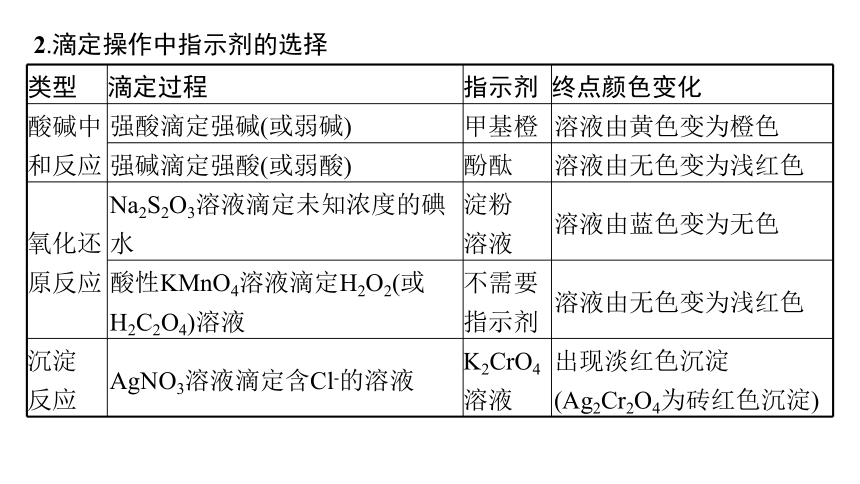
2.滴定操作中指示剂的选择
类型 滴定过程 指示剂 终点颜色变化
酸碱中 和反应 强酸滴定强碱(或弱碱) 甲基橙 溶液由黄色变为橙色
强碱滴定强酸(或弱酸) 酚酞 溶液由无色变为浅红色
氧化还 原反应 Na2S2O3溶液滴定未知浓度的碘水 淀粉 溶液 溶液由蓝色变为无色
酸性KMnO4溶液滴定H2O2(或H2C2O4)溶液 不需要 指示剂 溶液由无色变为浅红色
沉淀 反应 AgNO3溶液滴定含Cl-的溶液 K2CrO4 溶液 出现淡红色沉淀(Ag2Cr2O4为砖红色沉淀)
3.氧化还原滴定原理及应用
(1)间接碘量法(滴定碘法)
先用KI还原具有氧化性的物质(如Fe3+、ClO-等)产生I2,再利用标准Na2S2O3溶液滴定生成的I2。
示例:测定漂白粉中有效氯的含量
原理:用淀粉作指示剂,ClO-+2I-+2H+ ══ I2+Cl-+H2O、2Na2S2O3+I2 ══ Na2S4O6+2NaI。
滴定终点:当滴加最后半滴Na2S2O3标准溶液后,溶液的蓝色褪去,且半分钟内不恢复原来颜色。
(2)高锰酸钾法
①直接滴定法:利用KMnO4溶液的强氧化性滴定具有还原性的物质(如Fe2+、H2C2O4等)。
示例:利用标准KMnO4溶液滴定H2C2O4溶液
原理:不需要外加指示剂,2 +6H++5H2C2O4 ══ 10CO2↑+2Mn2++8H2O。
滴定终点:当滴加最后半滴标准KMnO4溶液后,溶液由无色变为浅红色,且半分钟内不褪色。
②返滴定法:常用于测定一些不能直接滴定的氧化性(或还原性)物质。
示例:测定某固体物质中MnO2的含量
原理:加入一定量Na2C2O4标准溶液(过量)还原MnO2,再用标准KMnO4溶液滴定剩余的Na2C2O4,实质上是Na2C2O4还原MnO2和KMnO4生成Mn2+,据此列式计算。
4.沉淀滴定原理及应用
(1)沉淀滴定法是利用沉淀反应进行滴定、测量分析的方法。生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-浓度。
(2)沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以 为指示剂,这是因为AgCl比Ag2CrO4更难溶。
精研核心命题
命题点1酸碱中和滴定原理及应用
典例1 (2021·湖南卷,15节选)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量。
产品中NaHCO3含量测定
①称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;
②移取25.00 mL上述溶液于锥形瓶,加入2滴指示剂M,用0.100 0 mol·L-1盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1 mL;
③在上述锥形瓶中再加入2滴指示剂N,继续用0.100 0 mol·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2 mL;
④平行测定三次,V1平均值为22.45,V2平均值为23.51。
回答下列问题:
(1)指示剂N为 ,描述第二滴定终点前后颜色变化: 。
(2)产品中NaHCO3的质量分数为 (保留三位有效数字)。
(3)第一滴定终点时,某同学俯视读数,其他操作均正确,则NaHCO3质量分数的计算结果 (填“偏大”“偏小”或“无影响”)。
甲基橙
由黄色变橙色,且半分钟内不褪色
3.56%
偏大
解析 (1)第二次滴定时,使用的指示剂N为甲基橙试液,滴定到终点前溶液的溶质为碳酸氢钠和氯化钠,滴定达到终点后溶液的溶质为氯化钠,故溶液的颜色变化:由黄色变为橙色,且半分钟内不褪色。
(2)第一次滴定发生的反应:Na2CO3+HCl ══ NaHCO3+NaCl,则n(Na2CO3)=
n生成(NaHCO3)=n(HCl)=0.100 0 mol·L-1×22.45×10-3 L=2.245×10-3 mol。第二次滴定消耗的盐酸的体积V2=23.51 mL,根据方程式NaHCO3+HCl ══ NaCl+H2O+CO2↑可知,消耗的NaHCO3的物质的量n总(NaHCO3)=0.100 0 mol·L-1 ×23.51×10-3 L=2.351×10-3 mol,则原溶液中的NaHCO3的物质的量n(NaHCO3)=n总(NaHCO3)-n生成(NaHCO3) =2.351×10-3 mol-2.245×10-3 mol= 1.06×10-4 mol,则原产品中NaHCO3的物质的量为 ×1.06×10-4 mol= 1.06×10-3 mol,故产品中NaHCO3的质量分数为
(3)其他操作均正确,俯视读数,则会使标准液盐酸的体积偏小,即测得V1偏小,原产品中NaHCO3的物质的量会偏大,最终导致其质量分数会偏大。
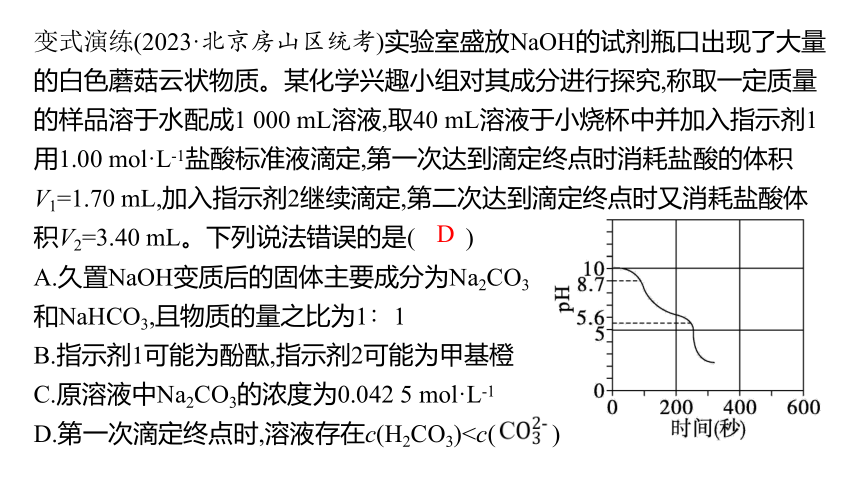
变式演练(2023·北京房山区统考)实验室盛放NaOH的试剂瓶口出现了大量的白色蘑菇云状物质。某化学兴趣小组对其成分进行探究,称取一定质量的样品溶于水配成1 000 mL溶液,取40 mL溶液于小烧杯中并加入指示剂1用1.00 mol·L-1盐酸标准液滴定,第一次达到滴定终点时消耗盐酸的体积V1=1.70 mL,加入指示剂2继续滴定,第二次达到滴定终点时又消耗盐酸体积V2=3.40 mL。下列说法错误的是( )
A.久置NaOH变质后的固体主要成分为Na2CO3
和NaHCO3,且物质的量之比为1∶1
B.指示剂1可能为酚酞,指示剂2可能为甲基橙
C.原溶液中Na2CO3的浓度为0.042 5 mol·L-1
D.第一次滴定终点时,溶液存在c(H2CO3)D
解析 NaOH变质后生成Na2CO3和NaHCO3,加入稀盐酸第一次滴定先与Na2CO3反应,反应的化学方程式为Na2CO3+HCl ══ NaHCO3+NaCl,则V生成(NaHCO3)=V1=1.7 mL,第二次滴定与NaHCO3反应,反应的化学方程式为NaHCO3+HCl ══ NaCl+H2O+CO2↑,V总(NaHCO3)=V2=3.4 mL,则原样品中V原(NaHCO3)=1.7 mL,由化学方程式NaHCO3+HCl ══ NaCl+H2O+CO2↑可知,n(Na2CO3)∶n(NaHCO3)=1∶1,A正确;第一次达到滴定终点时pH=8.7,溶液呈碱性,可选酚酞为指示剂,第二次达到滴定终点时pH=5.6,溶液呈酸性,可选甲基橙为指示剂,B正确;
命题点2氧化还原滴定原理及应用
典例2 (2022·辽宁卷,15节选)
H2O2作为绿色氧化剂应用
广泛,氢醌法制备H2O2
原理如下:
(1)氢醌法制备H2O2总反应的化学方程式为 。
(2)测定产品中H2O2的质量分数:取2.50 g产品,加蒸馏水定容至100 mL摇匀,取20.00 mL于锥形瓶中,用0.050 0 mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为 。
H2+O2 H2O2
17%
解析 (2)滴定反应的离子方程式为2 +5H2O2+6H+ ══ 2Mn2++5O2↑+8H2O,可得关系式:2KMnO4~5H2O2。三组数据中20.90 mL偏差较大,舍去,则消耗酸性高锰酸钾标准溶液的平均体积为20.00 mL,故产品中H2O2的质量分数
变式演练(2021·山东卷,18节选)利用碘量法测定WCl6产品纯度,实验如下:
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1 g;开盖并计时1分钟,盖紧称重为m2 g;再开盖加入待测样品并计时1分钟,盖紧称重为m3 g,则样品质量为 g(不考虑空气中水蒸气的干扰)。
(m3+m1-2m2) g
滴定达终点时消耗c mol·L-1的Na2S2O3溶液V mL,则样品中WCl6(摩尔质量为M g·mol-1)的质量分数为 。
称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将 (填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将 (填“偏大”“偏小”或“不变”)。
不变
偏大
解析 ①根据分析,称量时加入足量的CS2,盖紧称重为m1 g,由于CS2易挥发,开盖时要挥发出来,称量的质量要减少,开盖并计时1分钟,盖紧称重m2 g,则挥发出的CS2的质量为(m1-m2) g,再开盖加入待测样品并计时1分钟,又挥发出(m1-m2) g的CS2,盖紧称重为m3 g,则样品质量为m3 g+2(m1-m2) g-m1 g=(m3+m1-2m2)g。
训练分层落实
练真题·明考向
1.(2023·山东卷)一定条件下,乙酸酐[(CH3CO)2O]醇解反应[(CH3CO)2O+ROH→CH3COOR+CH3COOH]可进行完全,利用此反应定量测定有机醇(ROH)中的烃基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐—苯溶液。
②量取一定体积乙酸酐—苯溶液置于锥形瓶中,加入m g ROH样品,充分反应后,加适量水使剩余乙酸酐完全水解:(CH3CO)2O+H2O→2CH3COOH。
③加指示剂并用c mol·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V1 mL。
④在相同条件下,量取相同体积的乙酸酐—苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用c mol·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V2 mL。
(1)对于上述实验,下列做法正确的是( )
A.进行容量瓶检漏时,倒置一次即可
B.滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点
C.滴定读数时,应单手持滴定管上端并保持其自然垂直
D.滴定读数时,应双手一上一下持滴定管
C
解析 容量瓶检漏时,应倒置两次,第二次时将塞子旋转180°再将容量瓶倒置,两次倒置,容量瓶瓶塞周围均无水渗出,表明容量瓶不漏水,A错误;判断滴定终点时,锥形瓶中溶液变色,且半分钟内不恢复原来的颜色,即可判定到达滴定终点,B错误;滴定读数时,应将滴定管固定在滴定台上,或者单手持滴定管上端无刻度处,并保持其自然垂直,C正确,D错误。
(2)ROH样品中羟基含量(质量分数)计算正确的是( )
A
解析根据CH3COOH+NaOH→CH3COONa+H2O,可计算出步骤④中乙酸酐水解反应生成的CH3COOH的物质的量为cV2×10-3 mol;根据(CH3CO)2O+ROH→CH3COOR+CH3COOH、(CH3CO)2O+H2O→2CH3COOH,可计算出步骤②中乙酸酐醇解反应生成的CH3COOH和乙酸酐水解反应生成的CH3COOH的物质的量之和为cV1×10-3 mol;因为两次滴定量取的是相同条件下、相同体积的乙酸酐—苯溶液,所以可求出ROH样品中羟基的物质的量为n(—OH)=n(ROH)=
n(CH3COOR)=(cV2×10-3-cV1×10-3) mol=c(V2-V1)×10-3 mol,羟基含量为
(3)根据上述实验原理,下列说法正确的是( )
A.可以用乙酸代替乙酸酐进行上述实验
B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小
C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小
D.步骤④中,若加水量不足,将导致测定结果偏大
B
解析乙酸与醇的酯化反应是可逆反应,因此无法用乙酸定量测定有机醇中的羟基含量,A错误;甲醇挥发会造成标准溶液浓度增大,进行步骤③时,消耗的标准溶液体积变小,即V1变小,由于在使用过程中甲醇不断挥发,步骤④中的NaOH—甲醇溶液的浓度相对步骤③中溶液浓度更大了,即V2减小的程度更大了,因此V2-V1偏小,导致测定结果偏小,B正确;若步骤③滴定时锥形瓶内液体溅出,则V1偏小,则导致测定结果偏大,C错误;若步骤④中加水量不足,在滴定过程中未水解的乙酸酐继续醇解,乙酸酐不能完全转化为乙酸,则V2偏小,导致测定结果偏小,D错误。
2.(2022·江苏卷,16节选)实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用准确浓度的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为Fe2++Ce4+ ══ Fe3++Ce3+。请补充完整实验方案:
①准确量取25.00 mL Ce3+溶液[c(Ce3+)约为0.2 mol·L-1],
加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用
稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;
②按规定操作分别将0.020 00 mol·L-1
(NH4)2Fe(SO4)2和待测Ce4+溶液装入如图所示的滴定管中;
③ 。
答案 从左侧滴定管中放出一定体积的待测Ce4+溶液,加入苯代邻氨基苯甲酸作指示剂,用0.020 00 mol·L-1 (NH4)2Fe(SO4)2滴定,当滴入最后半滴标准液时,溶液由紫红色变为亮黄色,即达到滴定终点,记录标准液的体积
练易错·避陷阱
3.(2023·北京朝阳区一模)分析化学中以K2CrO4为指示剂,用AgNO3标准溶液滴定溶液中的Cl-,测定c(Cl-)。
ⅱ.25 ℃时,Ksp(Ag2CrO4)=2.0×10-12(砖红色),Ksp(AgCl)=1.8×10-10(白色)。下列分析不正确的是( )
A.实验中先产生白色沉淀,滴定终点时产生砖红色沉淀
B.产生白色沉淀时,存在AgCl(s) Ag+(aq)+Cl-(aq)
C.当产生砖红色沉淀时,若c( )=5.0×10-3 mol·L-1,Cl-已沉淀完全
D.滴定时应控制溶液pH在合适范围内,若pH过低,会导致测定结果偏低
D
4.(2023·天津十二区联考)某研究小组为测定食用白醋中醋酸的含量进行如下操作,正确的是( )
A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中
B.称取4.0 g NaOH放到1 000 mL容量瓶中,加水至刻度,配成1.00 mol·L-1 NaOH标准溶液
C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
C
解析 量取白醋应用酸式滴定管,A错误;NaOH的溶解应在烧杯中完成,B错误;在滴定中操作时眼睛要注视锥形瓶内溶液颜色的变化,D错误。
练预测·押考向
5.用氧化还原滴定法可以测定市售双氧水中过氧化氢的浓度(单位g·L-1),实验过程包括标准溶液的准备和滴定待测溶液。
Ⅰ.准备标准溶液
a.配制100 mL KMnO4溶液备用;
b.准确称取Na2C2O4基准物质3.35 g(0.025 mol),配制成250 mL标准溶液。取出25.00 mL于锥形瓶中,加入适量3 mol·L-1硫酸酸化后,用待标定的KMnO4溶液滴定至终点,记录数据,计算KMnO4溶液的浓度。
Ⅱ.滴定主要步骤
a.取待测双氧水10.00 mL于锥形瓶中;
b.锥形瓶中加入30.00 mL蒸馏水和30.00 mL 3 mol·L-1硫酸,然后用已标定的KMnO4溶液(0.100 0 mol·L-1)滴定至终点;
e.重复上述操作两次,三次测定的数据如下表:
组别 1 2 3
消耗标准溶液体积/mL 25.24 25.02 24.98
d.数据处理。
回答下列问题:
(1)将称得的Na2C2O4配制成250 mL标准溶液,所使用的仪器除烧杯和玻璃棒外还有 。
(2)标定KMnO4溶液时,能否用稀硝酸调节溶液酸度 (填“能”或“不能”),简述理由: 。
写出标定过程中发生反应的化学方程式:
。
(3)滴定待测双氧水时,标准溶液应装入 滴定管,装入标准溶液的前一步应进行的操作是 。
(4)滴定双氧水至终点的现象是
。
250 mL容量瓶、胶头滴管
不能
稀硝酸有氧化性,会影响KMnO4溶液浓度的标定
2KMnO4+5Na2C2O4+8H2SO4══K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O
酸式
用标准溶液润洗滴定管
滴入最后半滴标准溶液,锥形瓶中的液体变为浅紫色,且半分钟不变色
(5)计算此双氧水的浓度为 g·L-1。
(6)若在配制Na2C2O4标准溶液时,烧杯中的溶液有少量溅出,则最后测定出的双氧水的浓度会 (填“偏高”“偏低”或“无影响”)。
21.25
偏高
解析 (1)配制250 mL Na2C2O4标准溶液时,所使用的仪器有烧杯、玻璃棒、胶头滴管和250 mL容量瓶;
(2)稀硝酸具有氧化性,也会氧化草酸钠,会影响KMnO4溶液浓度的标定,因此不能用稀硝酸调节溶液酸度;标定过程中KMnO4氧化Na2C2O4,发生反应的化学方程式为2KMnO4+5Na2C2O4+8H2SO4 ══ K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O;
(3)滴定待测双氧水时,标准溶液为已标定的KMnO4溶液,具有强氧化性,应装入酸式滴定管中,装入标准溶液前需要用标准溶液润洗滴定管;
(5)由数据分析可知,三次滴定消耗KMnO4溶液的体积第1组与2、3组差距较大,要舍去,则消耗KMnO4溶液的平均体积为25.00 mL,根据得失电子守恒可得关系式:2KMnO4~5H2O2,则此双氧水的浓度为
(6)若在配制Na2C2O4标准溶液时,烧杯中的溶液有少量溅出,则标定出的KMnO4溶液实际浓度偏低,消耗的KMnO4溶液体积偏大,导致最后测定出的双氧水的浓度会偏高。
专题 中和滴定及拓展应用
聚焦核心要点
1.滴定实验原理及操作
2.滴定操作中指示剂的选择
类型 滴定过程 指示剂 终点颜色变化
酸碱中 和反应 强酸滴定强碱(或弱碱) 甲基橙 溶液由黄色变为橙色
强碱滴定强酸(或弱酸) 酚酞 溶液由无色变为浅红色
氧化还 原反应 Na2S2O3溶液滴定未知浓度的碘水 淀粉 溶液 溶液由蓝色变为无色
酸性KMnO4溶液滴定H2O2(或H2C2O4)溶液 不需要 指示剂 溶液由无色变为浅红色
沉淀 反应 AgNO3溶液滴定含Cl-的溶液 K2CrO4 溶液 出现淡红色沉淀(Ag2Cr2O4为砖红色沉淀)
3.氧化还原滴定原理及应用
(1)间接碘量法(滴定碘法)
先用KI还原具有氧化性的物质(如Fe3+、ClO-等)产生I2,再利用标准Na2S2O3溶液滴定生成的I2。
示例:测定漂白粉中有效氯的含量
原理:用淀粉作指示剂,ClO-+2I-+2H+ ══ I2+Cl-+H2O、2Na2S2O3+I2 ══ Na2S4O6+2NaI。
滴定终点:当滴加最后半滴Na2S2O3标准溶液后,溶液的蓝色褪去,且半分钟内不恢复原来颜色。
(2)高锰酸钾法
①直接滴定法:利用KMnO4溶液的强氧化性滴定具有还原性的物质(如Fe2+、H2C2O4等)。
示例:利用标准KMnO4溶液滴定H2C2O4溶液
原理:不需要外加指示剂,2 +6H++5H2C2O4 ══ 10CO2↑+2Mn2++8H2O。
滴定终点:当滴加最后半滴标准KMnO4溶液后,溶液由无色变为浅红色,且半分钟内不褪色。
②返滴定法:常用于测定一些不能直接滴定的氧化性(或还原性)物质。
示例:测定某固体物质中MnO2的含量
原理:加入一定量Na2C2O4标准溶液(过量)还原MnO2,再用标准KMnO4溶液滴定剩余的Na2C2O4,实质上是Na2C2O4还原MnO2和KMnO4生成Mn2+,据此列式计算。
4.沉淀滴定原理及应用
(1)沉淀滴定法是利用沉淀反应进行滴定、测量分析的方法。生成沉淀的反应很多,但符合条件的却很少,实际上应用最多的是银量法,即利用Ag+与卤素离子的反应来测定Cl-、Br-、I-浓度。
(2)沉淀滴定所用的指示剂本身就是一种沉淀剂,滴定剂与被滴定物反应的生成物的溶解度要比滴定剂与指示剂反应的生成物的溶解度小,否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以 为指示剂,这是因为AgCl比Ag2CrO4更难溶。
精研核心命题
命题点1酸碱中和滴定原理及应用
典例1 (2021·湖南卷,15节选)碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量。
产品中NaHCO3含量测定
①称取产品2.500 g,用蒸馏水溶解,定容于250 mL容量瓶中;
②移取25.00 mL上述溶液于锥形瓶,加入2滴指示剂M,用0.100 0 mol·L-1盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸V1 mL;
③在上述锥形瓶中再加入2滴指示剂N,继续用0.100 0 mol·L-1盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸V2 mL;
④平行测定三次,V1平均值为22.45,V2平均值为23.51。
回答下列问题:
(1)指示剂N为 ,描述第二滴定终点前后颜色变化: 。
(2)产品中NaHCO3的质量分数为 (保留三位有效数字)。
(3)第一滴定终点时,某同学俯视读数,其他操作均正确,则NaHCO3质量分数的计算结果 (填“偏大”“偏小”或“无影响”)。
甲基橙
由黄色变橙色,且半分钟内不褪色
3.56%
偏大
解析 (1)第二次滴定时,使用的指示剂N为甲基橙试液,滴定到终点前溶液的溶质为碳酸氢钠和氯化钠,滴定达到终点后溶液的溶质为氯化钠,故溶液的颜色变化:由黄色变为橙色,且半分钟内不褪色。
(2)第一次滴定发生的反应:Na2CO3+HCl ══ NaHCO3+NaCl,则n(Na2CO3)=
n生成(NaHCO3)=n(HCl)=0.100 0 mol·L-1×22.45×10-3 L=2.245×10-3 mol。第二次滴定消耗的盐酸的体积V2=23.51 mL,根据方程式NaHCO3+HCl ══ NaCl+H2O+CO2↑可知,消耗的NaHCO3的物质的量n总(NaHCO3)=0.100 0 mol·L-1 ×23.51×10-3 L=2.351×10-3 mol,则原溶液中的NaHCO3的物质的量n(NaHCO3)=n总(NaHCO3)-n生成(NaHCO3) =2.351×10-3 mol-2.245×10-3 mol= 1.06×10-4 mol,则原产品中NaHCO3的物质的量为 ×1.06×10-4 mol= 1.06×10-3 mol,故产品中NaHCO3的质量分数为
(3)其他操作均正确,俯视读数,则会使标准液盐酸的体积偏小,即测得V1偏小,原产品中NaHCO3的物质的量会偏大,最终导致其质量分数会偏大。
变式演练(2023·北京房山区统考)实验室盛放NaOH的试剂瓶口出现了大量的白色蘑菇云状物质。某化学兴趣小组对其成分进行探究,称取一定质量的样品溶于水配成1 000 mL溶液,取40 mL溶液于小烧杯中并加入指示剂1用1.00 mol·L-1盐酸标准液滴定,第一次达到滴定终点时消耗盐酸的体积V1=1.70 mL,加入指示剂2继续滴定,第二次达到滴定终点时又消耗盐酸体积V2=3.40 mL。下列说法错误的是( )
A.久置NaOH变质后的固体主要成分为Na2CO3
和NaHCO3,且物质的量之比为1∶1
B.指示剂1可能为酚酞,指示剂2可能为甲基橙
C.原溶液中Na2CO3的浓度为0.042 5 mol·L-1
D.第一次滴定终点时,溶液存在c(H2CO3)
解析 NaOH变质后生成Na2CO3和NaHCO3,加入稀盐酸第一次滴定先与Na2CO3反应,反应的化学方程式为Na2CO3+HCl ══ NaHCO3+NaCl,则V生成(NaHCO3)=V1=1.7 mL,第二次滴定与NaHCO3反应,反应的化学方程式为NaHCO3+HCl ══ NaCl+H2O+CO2↑,V总(NaHCO3)=V2=3.4 mL,则原样品中V原(NaHCO3)=1.7 mL,由化学方程式NaHCO3+HCl ══ NaCl+H2O+CO2↑可知,n(Na2CO3)∶n(NaHCO3)=1∶1,A正确;第一次达到滴定终点时pH=8.7,溶液呈碱性,可选酚酞为指示剂,第二次达到滴定终点时pH=5.6,溶液呈酸性,可选甲基橙为指示剂,B正确;
命题点2氧化还原滴定原理及应用
典例2 (2022·辽宁卷,15节选)
H2O2作为绿色氧化剂应用
广泛,氢醌法制备H2O2
原理如下:
(1)氢醌法制备H2O2总反应的化学方程式为 。
(2)测定产品中H2O2的质量分数:取2.50 g产品,加蒸馏水定容至100 mL摇匀,取20.00 mL于锥形瓶中,用0.050 0 mol·L-1酸性KMnO4标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为19.98 mL、20.90 mL、20.02 mL。假设其他杂质不干扰结果,产品中H2O2质量分数为 。
H2+O2 H2O2
17%
解析 (2)滴定反应的离子方程式为2 +5H2O2+6H+ ══ 2Mn2++5O2↑+8H2O,可得关系式:2KMnO4~5H2O2。三组数据中20.90 mL偏差较大,舍去,则消耗酸性高锰酸钾标准溶液的平均体积为20.00 mL,故产品中H2O2的质量分数
变式演练(2021·山东卷,18节选)利用碘量法测定WCl6产品纯度,实验如下:
①称量:将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称重为m1 g;开盖并计时1分钟,盖紧称重为m2 g;再开盖加入待测样品并计时1分钟,盖紧称重为m3 g,则样品质量为 g(不考虑空气中水蒸气的干扰)。
(m3+m1-2m2) g
滴定达终点时消耗c mol·L-1的Na2S2O3溶液V mL,则样品中WCl6(摩尔质量为M g·mol-1)的质量分数为 。
称量时,若加入待测样品后,开盖时间超过1分钟,则滴定时消耗Na2S2O3溶液的体积将 (填“偏大”“偏小”或“不变”),样品中WCl6质量分数的测定值将 (填“偏大”“偏小”或“不变”)。
不变
偏大
解析 ①根据分析,称量时加入足量的CS2,盖紧称重为m1 g,由于CS2易挥发,开盖时要挥发出来,称量的质量要减少,开盖并计时1分钟,盖紧称重m2 g,则挥发出的CS2的质量为(m1-m2) g,再开盖加入待测样品并计时1分钟,又挥发出(m1-m2) g的CS2,盖紧称重为m3 g,则样品质量为m3 g+2(m1-m2) g-m1 g=(m3+m1-2m2)g。
训练分层落实
练真题·明考向
1.(2023·山东卷)一定条件下,乙酸酐[(CH3CO)2O]醇解反应[(CH3CO)2O+ROH→CH3COOR+CH3COOH]可进行完全,利用此反应定量测定有机醇(ROH)中的烃基含量,实验过程中酯的水解可忽略。实验步骤如下:
①配制一定浓度的乙酸酐—苯溶液。
②量取一定体积乙酸酐—苯溶液置于锥形瓶中,加入m g ROH样品,充分反应后,加适量水使剩余乙酸酐完全水解:(CH3CO)2O+H2O→2CH3COOH。
③加指示剂并用c mol·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V1 mL。
④在相同条件下,量取相同体积的乙酸酐—苯溶液,只加适量水使乙酸酐完全水解;加指示剂并用c mol·L-1 NaOH—甲醇标准溶液滴定至终点,消耗标准溶液V2 mL。
(1)对于上述实验,下列做法正确的是( )
A.进行容量瓶检漏时,倒置一次即可
B.滴入半滴标准溶液,锥形瓶中溶液变色,即可判定达滴定终点
C.滴定读数时,应单手持滴定管上端并保持其自然垂直
D.滴定读数时,应双手一上一下持滴定管
C
解析 容量瓶检漏时,应倒置两次,第二次时将塞子旋转180°再将容量瓶倒置,两次倒置,容量瓶瓶塞周围均无水渗出,表明容量瓶不漏水,A错误;判断滴定终点时,锥形瓶中溶液变色,且半分钟内不恢复原来的颜色,即可判定到达滴定终点,B错误;滴定读数时,应将滴定管固定在滴定台上,或者单手持滴定管上端无刻度处,并保持其自然垂直,C正确,D错误。
(2)ROH样品中羟基含量(质量分数)计算正确的是( )
A
解析根据CH3COOH+NaOH→CH3COONa+H2O,可计算出步骤④中乙酸酐水解反应生成的CH3COOH的物质的量为cV2×10-3 mol;根据(CH3CO)2O+ROH→CH3COOR+CH3COOH、(CH3CO)2O+H2O→2CH3COOH,可计算出步骤②中乙酸酐醇解反应生成的CH3COOH和乙酸酐水解反应生成的CH3COOH的物质的量之和为cV1×10-3 mol;因为两次滴定量取的是相同条件下、相同体积的乙酸酐—苯溶液,所以可求出ROH样品中羟基的物质的量为n(—OH)=n(ROH)=
n(CH3COOR)=(cV2×10-3-cV1×10-3) mol=c(V2-V1)×10-3 mol,羟基含量为
(3)根据上述实验原理,下列说法正确的是( )
A.可以用乙酸代替乙酸酐进行上述实验
B.若因甲醇挥发造成标准溶液浓度发生变化,将导致测定结果偏小
C.步骤③滴定时,不慎将锥形瓶内溶液溅出,将导致测定结果偏小
D.步骤④中,若加水量不足,将导致测定结果偏大
B
解析乙酸与醇的酯化反应是可逆反应,因此无法用乙酸定量测定有机醇中的羟基含量,A错误;甲醇挥发会造成标准溶液浓度增大,进行步骤③时,消耗的标准溶液体积变小,即V1变小,由于在使用过程中甲醇不断挥发,步骤④中的NaOH—甲醇溶液的浓度相对步骤③中溶液浓度更大了,即V2减小的程度更大了,因此V2-V1偏小,导致测定结果偏小,B正确;若步骤③滴定时锥形瓶内液体溅出,则V1偏小,则导致测定结果偏大,C错误;若步骤④中加水量不足,在滴定过程中未水解的乙酸酐继续醇解,乙酸酐不能完全转化为乙酸,则V2偏小,导致测定结果偏小,D错误。
2.(2022·江苏卷,16节选)实验中需要测定溶液中Ce3+的含量。已知水溶液中Ce4+可用准确浓度的(NH4)2Fe(SO4)2溶液滴定。以苯代邻氨基苯甲酸为指示剂,滴定终点时溶液由紫红色变为亮黄色,滴定反应为Fe2++Ce4+ ══ Fe3++Ce3+。请补充完整实验方案:
①准确量取25.00 mL Ce3+溶液[c(Ce3+)约为0.2 mol·L-1],
加氧化剂将Ce3+完全氧化并去除多余氧化剂后,用
稀硫酸酸化,将溶液完全转移到250 mL容量瓶中后定容;
②按规定操作分别将0.020 00 mol·L-1
(NH4)2Fe(SO4)2和待测Ce4+溶液装入如图所示的滴定管中;
③ 。
答案 从左侧滴定管中放出一定体积的待测Ce4+溶液,加入苯代邻氨基苯甲酸作指示剂,用0.020 00 mol·L-1 (NH4)2Fe(SO4)2滴定,当滴入最后半滴标准液时,溶液由紫红色变为亮黄色,即达到滴定终点,记录标准液的体积
练易错·避陷阱
3.(2023·北京朝阳区一模)分析化学中以K2CrO4为指示剂,用AgNO3标准溶液滴定溶液中的Cl-,测定c(Cl-)。
ⅱ.25 ℃时,Ksp(Ag2CrO4)=2.0×10-12(砖红色),Ksp(AgCl)=1.8×10-10(白色)。下列分析不正确的是( )
A.实验中先产生白色沉淀,滴定终点时产生砖红色沉淀
B.产生白色沉淀时,存在AgCl(s) Ag+(aq)+Cl-(aq)
C.当产生砖红色沉淀时,若c( )=5.0×10-3 mol·L-1,Cl-已沉淀完全
D.滴定时应控制溶液pH在合适范围内,若pH过低,会导致测定结果偏低
D
4.(2023·天津十二区联考)某研究小组为测定食用白醋中醋酸的含量进行如下操作,正确的是( )
A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中
B.称取4.0 g NaOH放到1 000 mL容量瓶中,加水至刻度,配成1.00 mol·L-1 NaOH标准溶液
C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
D.滴定时眼睛要注视着滴定管内NaOH溶液的液面变化,防止滴定过量
C
解析 量取白醋应用酸式滴定管,A错误;NaOH的溶解应在烧杯中完成,B错误;在滴定中操作时眼睛要注视锥形瓶内溶液颜色的变化,D错误。
练预测·押考向
5.用氧化还原滴定法可以测定市售双氧水中过氧化氢的浓度(单位g·L-1),实验过程包括标准溶液的准备和滴定待测溶液。
Ⅰ.准备标准溶液
a.配制100 mL KMnO4溶液备用;
b.准确称取Na2C2O4基准物质3.35 g(0.025 mol),配制成250 mL标准溶液。取出25.00 mL于锥形瓶中,加入适量3 mol·L-1硫酸酸化后,用待标定的KMnO4溶液滴定至终点,记录数据,计算KMnO4溶液的浓度。
Ⅱ.滴定主要步骤
a.取待测双氧水10.00 mL于锥形瓶中;
b.锥形瓶中加入30.00 mL蒸馏水和30.00 mL 3 mol·L-1硫酸,然后用已标定的KMnO4溶液(0.100 0 mol·L-1)滴定至终点;
e.重复上述操作两次,三次测定的数据如下表:
组别 1 2 3
消耗标准溶液体积/mL 25.24 25.02 24.98
d.数据处理。
回答下列问题:
(1)将称得的Na2C2O4配制成250 mL标准溶液,所使用的仪器除烧杯和玻璃棒外还有 。
(2)标定KMnO4溶液时,能否用稀硝酸调节溶液酸度 (填“能”或“不能”),简述理由: 。
写出标定过程中发生反应的化学方程式:
。
(3)滴定待测双氧水时,标准溶液应装入 滴定管,装入标准溶液的前一步应进行的操作是 。
(4)滴定双氧水至终点的现象是
。
250 mL容量瓶、胶头滴管
不能
稀硝酸有氧化性,会影响KMnO4溶液浓度的标定
2KMnO4+5Na2C2O4+8H2SO4══K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O
酸式
用标准溶液润洗滴定管
滴入最后半滴标准溶液,锥形瓶中的液体变为浅紫色,且半分钟不变色
(5)计算此双氧水的浓度为 g·L-1。
(6)若在配制Na2C2O4标准溶液时,烧杯中的溶液有少量溅出,则最后测定出的双氧水的浓度会 (填“偏高”“偏低”或“无影响”)。
21.25
偏高
解析 (1)配制250 mL Na2C2O4标准溶液时,所使用的仪器有烧杯、玻璃棒、胶头滴管和250 mL容量瓶;
(2)稀硝酸具有氧化性,也会氧化草酸钠,会影响KMnO4溶液浓度的标定,因此不能用稀硝酸调节溶液酸度;标定过程中KMnO4氧化Na2C2O4,发生反应的化学方程式为2KMnO4+5Na2C2O4+8H2SO4 ══ K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O;
(3)滴定待测双氧水时,标准溶液为已标定的KMnO4溶液,具有强氧化性,应装入酸式滴定管中,装入标准溶液前需要用标准溶液润洗滴定管;
(5)由数据分析可知,三次滴定消耗KMnO4溶液的体积第1组与2、3组差距较大,要舍去,则消耗KMnO4溶液的平均体积为25.00 mL,根据得失电子守恒可得关系式:2KMnO4~5H2O2,则此双氧水的浓度为
(6)若在配制Na2C2O4标准溶液时,烧杯中的溶液有少量溅出,则标定出的KMnO4溶液实际浓度偏低,消耗的KMnO4溶液体积偏大,导致最后测定出的双氧水的浓度会偏高。
同课章节目录
