专题 溶液中粒子浓度的关系及分析(共32张PPT)
文档属性
| 名称 | 专题 溶液中粒子浓度的关系及分析(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 23:27:16 | ||
图片预览









文档简介
(共32张PPT)
专题 溶液中粒子浓度的关系及分析
聚焦核心要点
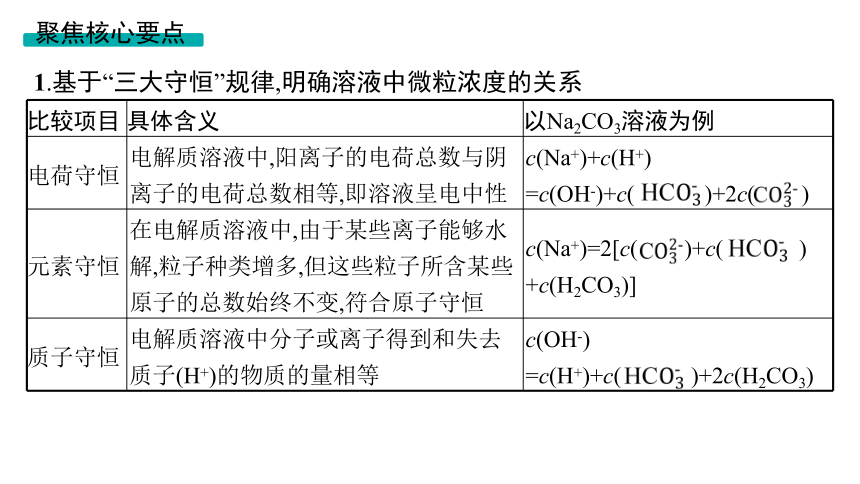
1.基于“三大守恒”规律,明确溶液中微粒浓度的关系
比较项目 具体含义 以Na2CO3溶液为例
电荷守恒 电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性 c(Na+)+c(H+)
=c(OH-)+c( )+2c( )
元素守恒 在电解质溶液中,由于某些离子能够水解,粒子种类增多,但这些粒子所含某些原子的总数始终不变,符合原子守恒 c(Na+)=2[c( )+c( ) +c(H2CO3)]
质子守恒 电解质溶液中分子或离子得到和失去质子(H+)的物质的量相等 c(OH-)
=c(H+)+c( )+2c(H2CO3)
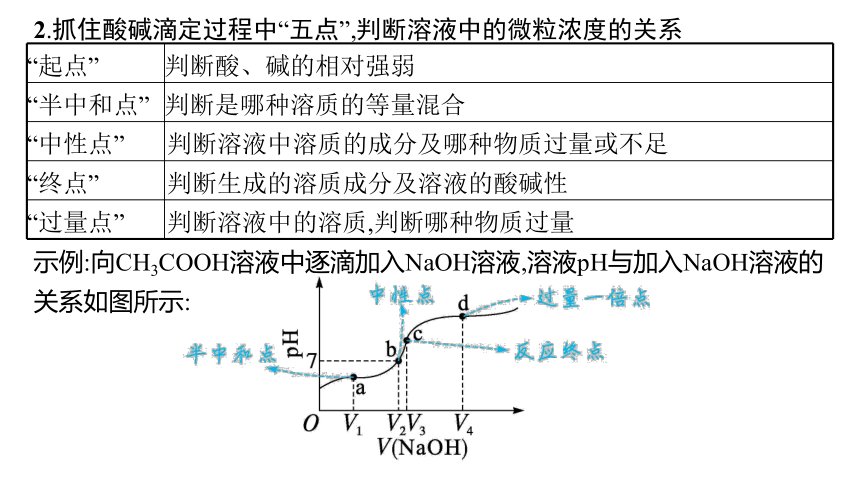
2.抓住酸碱滴定过程中“五点”,判断溶液中的微粒浓度的关系
“起点” 判断酸、碱的相对强弱
“半中和点” 判断是哪种溶质的等量混合
“中性点” 判断溶液中溶质的成分及哪种物质过量或不足
“终点” 判断生成的溶质成分及溶液的酸碱性
“过量点” 判断溶液中的溶质,判断哪种物质过量
示例:向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示:
分析:
(1)a点:溶质为等浓度的CH3COONa、CH3COOH,离子浓度关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2)b点:溶质为CH3COONa、CH3COOH,离子浓度关系:
c(CH3COO-)=c(Na+)>c(H+)=c(OH-);
(3)c点:溶质为CH3COONa,离子浓度关系:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(4)d点:溶质为等浓度的CH3COONa、NaOH,离子浓度关系:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)。
易错辨析
常温下,试判断下列有关电解质溶液中的微粒浓度关系的正误。
1.在0.1 mol·L-1 Na2C2O4溶液中
( )
2.在0.1 mol·L-1 NaHCO3溶液中c(H2CO3)+c( )=0.1 mol·L-1。( )
×
×
在0.1 mol·L-1 NaHCO3溶液中,根据元素守恒得
3.氨水和NH4Cl溶液混合,形成pH=9的溶液中c(Cl-)>c( )>c(OH-)>c(H+)。
( )
×
氨水和NH4Cl溶液混合,形成pH=9的溶液,则c(Cl-)精研核心命题
命题点1描述型溶液中微粒浓度的比较
典例1 (2022·重庆卷)某小组模拟成垢-除垢过程如图。
100 mL 0.1 mol·L-1 CaCl2水溶液
D
变式演练(2021·天津卷)常温下,下列有关电解质溶液的叙述正确的是( )
A
命题点2图像型溶液中微粒浓度的比较
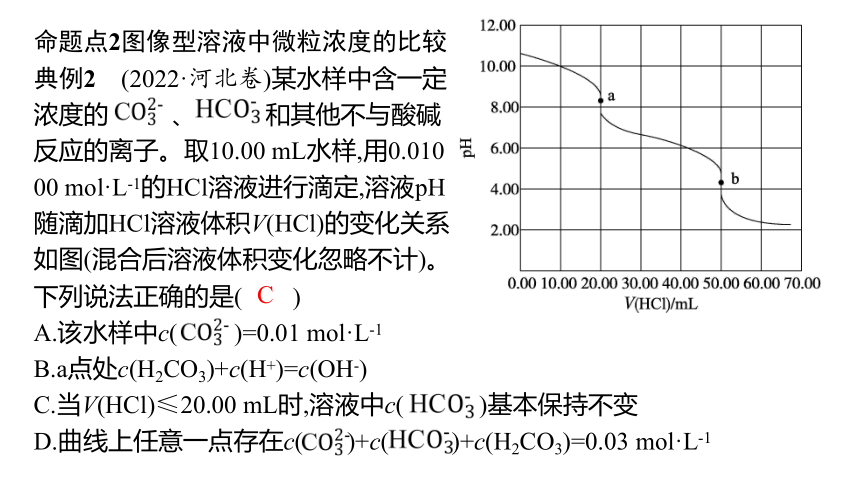
典例2 (2022·河北卷)某水样中含一定浓度的 、 和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 00 mol·L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是( )
A.该水样中c( )=0.01 mol·L-1
B.a点处c(H2CO3)+c(H+)=c(OH-)
C.当V(HCl)≤20.00 mL时,溶液中c( )基本保持不变
D.曲线上任意一点存在c( )+c( )+c(H2CO3)=0.03 mol·L-1
C
图解要点 滴加HCl溶液过程中的变化分析如下:
变式演练(2023·辽宁鞍山一模)为测定某二元弱酸H2A与NaOH溶液反应过程中溶液pH与粒子关系,在25 ℃时进行实验,向H2A溶液中滴加NaOH溶液,混合溶液中lg X[X表示 随溶液pH的变化关系如图所示。下列说法正确的是( )
A.直线Ⅱ中X表示的是
B.当pH=3.81时,溶液中c(HA-)∶c(H2A)=10∶1
C.0.1 mol·L-1 NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.当pH=6.91时,对应的溶液中:3c(A2-)=c(Na+)+c(H+)-c(OH-)
D
【思维建模】
解答图像型溶液中微粒浓度的比较类题目的思维模型
训练分层落实
1.(2023·湖南卷)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随
η[η= ]的变化曲线如图所示。下列说法错误的是( )
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)D.水的电离程度:aD
点b对应η=1.50,CH3COOH被中和一半,此时溶液中的溶质组成为c(NaCl)∶c(CH3COOH)∶c(CH3COONa)=2∶1∶1,由图像可知溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COOH)2.00时NaOH过量,水的电离被抑制,故点d水的电离程度小于点c,D错误。
2.(2022·江苏卷)一种捕集烟气中CO2的过程如图所示。室温下以0.1 mol·L-1 KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度
下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c( )
B.KOH完全转化为K2CO3时,溶液中:c(OH-)=c(H+)+c( )+c(H2CO3)
C.KOH溶液吸收CO2,c总=0.1 mol·L-1溶液中:c(H2CO3)>c( )
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
C
练易错·避陷阱
3.(2023·江苏连云港统考)室温下,通过下列实验来探究NH4HCO3的性质。
实验1:测得0.1 mol·L-1 NH4HCO3溶液的pH=9.68
实验2:向浓度为0.1 mol·L-1 NH4HCO3溶液中加入足量NaOH,有刺激性气味气体产生
实验3:浓度均为2.0 mol·L-1 NH4HCO3溶液和NaCl溶液等体积混合,有晶体析出,过滤
下列说法正确的是( )
A.0.1 mol·L-1 NH4HCO3溶液中存在:
c(H+)+2c(H2CO3)=c( )+c(OH-)+c(NH3·H2O)
B.由实验1可得:Kb(NH3·H2O)> (H2CO3)
C.实验2中发生反应的离子方程式为 +OH- ══ NH3↑+H2O
D.实验3所得滤液中存在:
B
4.(2023·北京大兴区统考)常温下,以酚酞作指示剂,用0.1 mol·L-1的NaOH溶液滴定20.00 mL 0.1 mol·L-1的二元酸H2A溶液(变化关系如图所示)。下列说法不正确的是( )
注:δ为含A微粒的分布系数即物质的量分数
A.H2A的电离方程式为H2A ══ HA-+H+、
HA- A2-+H+
B.当V(NaOH)=0 mL时,c(HA-)+c(A2-)=0.1 mol·L-1
C.当V(NaOH)=20.00 mL时,c(Na+)=c(HA-)+2c(A2-)
D.当V(NaOH)=30.00 mL时,c(Na+)<2c(A2-)+c(HA-)
C
解析 由题图可知,二元酸H2A溶液中HA-占90%,A2-占10%,说明不含H2A分子,第一步完全电离,HA-部分电离,A正确;当V(NaOH)=0 mL时,0.1 mol·L-1二元酸H2A溶液中H2A的第一步电离完全电离,溶液中不存在H2A,根据元素守恒可得:c(HA-)+c(A2-)=0.1 mol·L-1,B正确;当V(NaOH)=20.00 mL时,反应得到NaHA溶液,据电荷守恒:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),由pH曲线可知,此时溶液呈酸性,即c(H+)>c(OH-),则有c(Na+)c(OH-),则有c(Na+)<2c(A2-)+c(HA-),D正确。
练预测·押考向
5.常温时,向10 mL 0.1 mol·L-1 HX溶液中逐滴加入0.1 mol·L-1氨水,其导电能力、pH与V(NH3·H2O)的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
A.水的电离程度:b>d,a>c
B.a点对应的溶液中存在
c(HX)+2c(H+)=
c(X-)+2c(NH3·H2O)+2c(OH-)
C.d点所得溶液中:c(H+)>c(OH-)
D.Kb(NH3·H2O)=Ka(HX)=10-4.6
C
解析 HX溶液中逐滴加入氨水,pH随V(NH3·H2O)的增大而增大,故过a点的曲线代表导电能力变化曲线,另一条代表pH变化曲线。b点导电能力最强,则b点NH3·H2O恰好完全反应,溶质为NH4X;a点氨水体积为b点的一半,则a点HX反应一半,a点为等浓度的HX、NH4X混合溶液,HX抑制水的电离,c点HX浓度大,对水电离抑制程度大,水的电离程度:a>c,b点,NH4X因水解促进水的电离,d点氨水浓度大,抑制水电离,水的电离程度:b>d,故水的电离程度:b>d,a>c,A正确。a点为等浓度的HX、NH4X混合溶液,据电荷守恒可得:
由题图可知,pH随V(NH3·H2O)的增大而增大,d点所得溶液的pH>7,则有c(H+)6.乙二酸(用H2A表示)为二元弱酸。25 ℃时,向0.1 mol·L-1的NH4HA溶液中滴加适量的盐酸或NaOH溶液,溶液中各含氮(或A)微粒的分布分数(δ)与溶液pH的关系如图所示(不考虑溶液中NH3分子)。例如,溶液中H2A的分布分数
δ(H2A)= 。下列说法正确的是( )
B
NH4HA的浓度为0.1 mol·L-1,若未向溶液中加入酸或碱,据元素守恒,溶液中存在:c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1,但加入酸或碱,溶液体积增大,故有c(H2A)+c(HA-)+c(A2-)<0.1 mol·L-1,C错误。NH4HA溶液显酸性,主要是HA-的电离,故向NH4HA溶液中滴加少量NaOH溶液:HA-+OH- ══ A2-+H2O,D错误。
专题 溶液中粒子浓度的关系及分析
聚焦核心要点
1.基于“三大守恒”规律,明确溶液中微粒浓度的关系
比较项目 具体含义 以Na2CO3溶液为例
电荷守恒 电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性 c(Na+)+c(H+)
=c(OH-)+c( )+2c( )
元素守恒 在电解质溶液中,由于某些离子能够水解,粒子种类增多,但这些粒子所含某些原子的总数始终不变,符合原子守恒 c(Na+)=2[c( )+c( ) +c(H2CO3)]
质子守恒 电解质溶液中分子或离子得到和失去质子(H+)的物质的量相等 c(OH-)
=c(H+)+c( )+2c(H2CO3)
2.抓住酸碱滴定过程中“五点”,判断溶液中的微粒浓度的关系
“起点” 判断酸、碱的相对强弱
“半中和点” 判断是哪种溶质的等量混合
“中性点” 判断溶液中溶质的成分及哪种物质过量或不足
“终点” 判断生成的溶质成分及溶液的酸碱性
“过量点” 判断溶液中的溶质,判断哪种物质过量
示例:向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示:
分析:
(1)a点:溶质为等浓度的CH3COONa、CH3COOH,离子浓度关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2)b点:溶质为CH3COONa、CH3COOH,离子浓度关系:
c(CH3COO-)=c(Na+)>c(H+)=c(OH-);
(3)c点:溶质为CH3COONa,离子浓度关系:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(4)d点:溶质为等浓度的CH3COONa、NaOH,离子浓度关系:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)。
易错辨析
常温下,试判断下列有关电解质溶液中的微粒浓度关系的正误。
1.在0.1 mol·L-1 Na2C2O4溶液中
( )
2.在0.1 mol·L-1 NaHCO3溶液中c(H2CO3)+c( )=0.1 mol·L-1。( )
×
×
在0.1 mol·L-1 NaHCO3溶液中,根据元素守恒得
3.氨水和NH4Cl溶液混合,形成pH=9的溶液中c(Cl-)>c( )>c(OH-)>c(H+)。
( )
×
氨水和NH4Cl溶液混合,形成pH=9的溶液,则c(Cl-)
命题点1描述型溶液中微粒浓度的比较
典例1 (2022·重庆卷)某小组模拟成垢-除垢过程如图。
100 mL 0.1 mol·L-1 CaCl2水溶液
D
变式演练(2021·天津卷)常温下,下列有关电解质溶液的叙述正确的是( )
A
命题点2图像型溶液中微粒浓度的比较
典例2 (2022·河北卷)某水样中含一定浓度的 、 和其他不与酸碱反应的离子。取10.00 mL水样,用0.010 00 mol·L-1的HCl溶液进行滴定,溶液pH随滴加HCl溶液体积V(HCl)的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是( )
A.该水样中c( )=0.01 mol·L-1
B.a点处c(H2CO3)+c(H+)=c(OH-)
C.当V(HCl)≤20.00 mL时,溶液中c( )基本保持不变
D.曲线上任意一点存在c( )+c( )+c(H2CO3)=0.03 mol·L-1
C
图解要点 滴加HCl溶液过程中的变化分析如下:
变式演练(2023·辽宁鞍山一模)为测定某二元弱酸H2A与NaOH溶液反应过程中溶液pH与粒子关系,在25 ℃时进行实验,向H2A溶液中滴加NaOH溶液,混合溶液中lg X[X表示 随溶液pH的变化关系如图所示。下列说法正确的是( )
A.直线Ⅱ中X表示的是
B.当pH=3.81时,溶液中c(HA-)∶c(H2A)=10∶1
C.0.1 mol·L-1 NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
D.当pH=6.91时,对应的溶液中:3c(A2-)=c(Na+)+c(H+)-c(OH-)
D
【思维建模】
解答图像型溶液中微粒浓度的比较类题目的思维模型
训练分层落实
1.(2023·湖南卷)常温下,用浓度为0.020 0 mol·L-1的NaOH标准溶液滴定浓度均为0.020 0 mol·L-1的HCl和CH3COOH的混合溶液,滴定过程中溶液的pH随
η[η= ]的变化曲线如图所示。下列说法错误的是( )
A.Ka(CH3COOH)约为10-4.76
B.点a:c(Na+)=c(Cl-)=c(CH3COO-)+c(CH3COOH)
C.点b:c(CH3COOH)
点b对应η=1.50,CH3COOH被中和一半,此时溶液中的溶质组成为c(NaCl)∶c(CH3COOH)∶c(CH3COONa)=2∶1∶1,由图像可知溶液呈酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COOH)
2.(2022·江苏卷)一种捕集烟气中CO2的过程如图所示。室温下以0.1 mol·L-1 KOH溶液吸收CO2,若通入CO2所引起的溶液体积变化和H2O挥发可忽略,溶液中含碳物种的浓度
下列说法正确的是( )
A.KOH吸收CO2所得到的溶液中:c(H2CO3)>c( )
B.KOH完全转化为K2CO3时,溶液中:c(OH-)=c(H+)+c( )+c(H2CO3)
C.KOH溶液吸收CO2,c总=0.1 mol·L-1溶液中:c(H2CO3)>c( )
D.题图所示的“吸收”“转化”过程中,溶液的温度下降
C
练易错·避陷阱
3.(2023·江苏连云港统考)室温下,通过下列实验来探究NH4HCO3的性质。
实验1:测得0.1 mol·L-1 NH4HCO3溶液的pH=9.68
实验2:向浓度为0.1 mol·L-1 NH4HCO3溶液中加入足量NaOH,有刺激性气味气体产生
实验3:浓度均为2.0 mol·L-1 NH4HCO3溶液和NaCl溶液等体积混合,有晶体析出,过滤
下列说法正确的是( )
A.0.1 mol·L-1 NH4HCO3溶液中存在:
c(H+)+2c(H2CO3)=c( )+c(OH-)+c(NH3·H2O)
B.由实验1可得:Kb(NH3·H2O)> (H2CO3)
C.实验2中发生反应的离子方程式为 +OH- ══ NH3↑+H2O
D.实验3所得滤液中存在:
B
4.(2023·北京大兴区统考)常温下,以酚酞作指示剂,用0.1 mol·L-1的NaOH溶液滴定20.00 mL 0.1 mol·L-1的二元酸H2A溶液(变化关系如图所示)。下列说法不正确的是( )
注:δ为含A微粒的分布系数即物质的量分数
A.H2A的电离方程式为H2A ══ HA-+H+、
HA- A2-+H+
B.当V(NaOH)=0 mL时,c(HA-)+c(A2-)=0.1 mol·L-1
C.当V(NaOH)=20.00 mL时,c(Na+)=c(HA-)+2c(A2-)
D.当V(NaOH)=30.00 mL时,c(Na+)<2c(A2-)+c(HA-)
C
解析 由题图可知,二元酸H2A溶液中HA-占90%,A2-占10%,说明不含H2A分子,第一步完全电离,HA-部分电离,A正确;当V(NaOH)=0 mL时,0.1 mol·L-1二元酸H2A溶液中H2A的第一步电离完全电离,溶液中不存在H2A,根据元素守恒可得:c(HA-)+c(A2-)=0.1 mol·L-1,B正确;当V(NaOH)=20.00 mL时,反应得到NaHA溶液,据电荷守恒:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),由pH曲线可知,此时溶液呈酸性,即c(H+)>c(OH-),则有c(Na+)
练预测·押考向
5.常温时,向10 mL 0.1 mol·L-1 HX溶液中逐滴加入0.1 mol·L-1氨水,其导电能力、pH与V(NH3·H2O)的关系变化如图所示(假设反应过程中温度不变)。下列分析错误的是( )
A.水的电离程度:b>d,a>c
B.a点对应的溶液中存在
c(HX)+2c(H+)=
c(X-)+2c(NH3·H2O)+2c(OH-)
C.d点所得溶液中:c(H+)>c(OH-)
D.Kb(NH3·H2O)=Ka(HX)=10-4.6
C
解析 HX溶液中逐滴加入氨水,pH随V(NH3·H2O)的增大而增大,故过a点的曲线代表导电能力变化曲线,另一条代表pH变化曲线。b点导电能力最强,则b点NH3·H2O恰好完全反应,溶质为NH4X;a点氨水体积为b点的一半,则a点HX反应一半,a点为等浓度的HX、NH4X混合溶液,HX抑制水的电离,c点HX浓度大,对水电离抑制程度大,水的电离程度:a>c,b点,NH4X因水解促进水的电离,d点氨水浓度大,抑制水电离,水的电离程度:b>d,故水的电离程度:b>d,a>c,A正确。a点为等浓度的HX、NH4X混合溶液,据电荷守恒可得:
由题图可知,pH随V(NH3·H2O)的增大而增大,d点所得溶液的pH>7,则有c(H+)
δ(H2A)= 。下列说法正确的是( )
B
NH4HA的浓度为0.1 mol·L-1,若未向溶液中加入酸或碱,据元素守恒,溶液中存在:c(H2A)+c(HA-)+c(A2-)=0.1 mol·L-1,但加入酸或碱,溶液体积增大,故有c(H2A)+c(HA-)+c(A2-)<0.1 mol·L-1,C错误。NH4HA溶液显酸性,主要是HA-的电离,故向NH4HA溶液中滴加少量NaOH溶液:HA-+OH- ══ A2-+H2O,D错误。
同课章节目录
