专题 水溶液中的离子反应与平衡——基础巩固练(共32张PPT)
文档属性
| 名称 | 专题 水溶液中的离子反应与平衡——基础巩固练(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 23:28:23 | ||
图片预览











文档简介
(共32张PPT)
专题 水溶液中的离子反应与平衡
----基础巩固练
基础巩固练
1.(2023·北京西城区一模)下列反应与电离平衡无关的是( )
A.FeSO4溶液与NH4HCO3溶液反应制备FeCO3
B.电解饱和NaCl溶液制备NaOH
C.加氨水除去NH4Cl溶液中的杂质FeCl3
D.将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3
C
解析 将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3,利用了难溶电解质的转化,与电离平衡无关,D符合题意。
2.(2023·上海闵行区一模)H2S是一种有毒气体,能溶于水,人们常用CuSO4溶液除去气体中混有的H2S杂质,生成黑褐色的CuS沉淀。下列说法正确的是( )
A.离子方程式:Cu2++S2- ══ CuS↓
B.溶解或电离出S2-的能力:H2S>CuS
C.足量NaOH溶液吸收H2S可得到NaHS
D.稀释H2S溶液,溶液中的离子浓度都降低
B
解析 H2S为弱电解质,不能写成离子形式,正确的离子方程式为Cu2++H2S ══ CuS↓+2H+,A错误;由Cu2+和H2S生成CuS沉淀可知,相同条件下溶解或电离出S2-的能力:H2S>CuS,B正确;足量NaOH溶液吸收H2S可得到Na2S和H2O,C错误;温度不变,KW不变,稀释H2S溶液,c(H+)降低,则c(OH-)必然增大,故不是溶液中的所有离子浓度都降低,D错误。
3.(2023·安徽鼎尖名校联盟联考)酸性强弱与物质本身电离出氢离子的能力有关,还与溶剂接受氢离子的能力有关,如HCl在冰醋酸中只有部分电离,CH3COOH与HF在液氨中可完全电离。下列说法不正确的是( )
A.在水中,HCl的电离方程式为HCl ══ H++Cl-
B.比较H2SO4、HClO4、HNO3酸性时,可在冰醋酸中进行
C.在液氨中,反应CH3COONa+HCl ══ CH3COOH+NaCl能够发生
D.在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性不可能小于乙
C
解析 在水中H2SO4、HClO4、HNO3都完全电离,不能比较其酸性,在冰醋酸中电离程度不同,可在冰醋酸中比较H2SO4、HClO4、HNO3的酸性,B正确。液氨能接受H+,在液氨中CH3COOH和HCl都完全电离,在液氨中反应CH3COONa+HCl ══ NaCl+CH3COOH不能够发生,C错误。在A溶剂中甲的酸性大于乙,甲电离出H+的能力强于乙;在B溶剂中,甲电离出H+的能力可能强于乙,也可能相等(如HCl和CH3COOH在液氨中都完全电离),即甲的酸性可能大于或等于乙,但不可能小于乙,D正确。
4.(2023·湖南衡阳八中模拟)常温下,下列说法正确的是( )
A.室温下,0.01 mol·L-1 CH3COONH4溶液的pH=7,1 L该溶液中含有 的数目为0.01NA
B.用CH3COOH溶液做导电性试验,灯泡很暗,说明CH3COOH是弱电解质
C.相同物质的量浓度的盐酸与醋酸分别稀释相同倍数,稀释后溶液pH:盐酸<醋酸
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合,混合液呈碱性
C
解析 在水中会发生水解,故1 L 0.01 mol·L-1 CH3COONH4溶液含有
的数目小于0.01NA,A错误;用CH3COOH溶液做导电性试验,灯泡很暗,只能说明溶液中阴阳离子浓度较小,无法证明CH3COOH的电离程度,即无法证明醋酸为弱电解质,B错误;醋酸为弱酸,不能完全电离,盐酸、醋酸稀释相同倍数后,醋酸中氢离子浓度小,pH较大,C正确;等体积的pH=3的醋酸溶液与pH=11的氢氧化钠溶液,醋酸溶液浓度大于氢氧化钠溶液浓度,等体积混合后反应生成醋酸钠,还会剩余醋酸,所得溶液呈酸性,D错误。
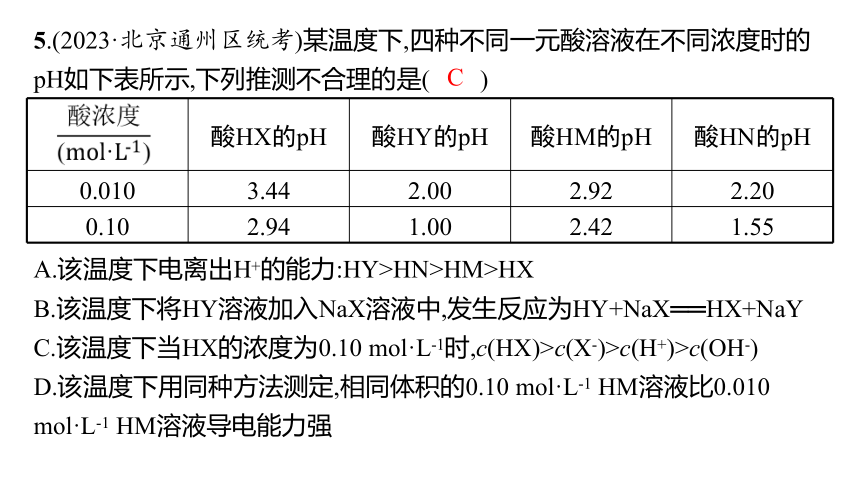
5.(2023·北京通州区统考)某温度下,四种不同一元酸溶液在不同浓度时的pH如下表所示,下列推测不合理的是( )
酸HX的pH 酸HY的pH 酸HM的pH 酸HN的pH
0.010 3.44 2.00 2.92 2.20
0.10 2.94 1.00 2.42 1.55
A.该温度下电离出H+的能力:HY>HN>HM>HX
B.该温度下将HY溶液加入NaX溶液中,发生反应为HY+NaX══HX+NaY
C.该温度下当HX的浓度为0.10 mol·L-1时,c(HX)>c(X-)>c(H+)>c(OH-)
D.该温度下用同种方法测定,相同体积的0.10 mol·L-1 HM溶液比0.010 mol·L-1 HM溶液导电能力强
C
解析 由题表中数据可知,等浓度的四种一元酸溶液的pH: HX>HM>HN>HY,则该温度下四种酸电离出H+的能力: HY>HN>HM>HX,A正确;等浓度HY溶液的pH小于HX溶液,说明HY的酸性强于HX,由强酸制弱酸的原理可知,HY溶液加入NaX溶液中发生反应的化学方程式为HY+NaX ══ HX+NaY,B正确;HX为一元弱酸,在溶液中部分电离出H+和X-,则溶液中:c(HX)>c(H+)>c(X-)>c(OH-),C错误;HM为一元弱酸,则相同体积的0.10 mol·L-1 HM溶液中离子浓度大于0.010 mol·L-1 HM溶液,故导电能力强于0.010 mol·L-1 HM溶液,D正确。
6.(2023·黑龙江齐齐哈尔一模)室温下,通过下列实验探究Na2SO3溶液的性质(已知:室温下,NaHSO3水溶性约为300 g·L-1)
实验 实验操作和现象
1 用pH试纸测定0.1 mol·L-1 Na2SO3溶液的pH,测得pH约为10
2 向1 mol·L-1 Na2SO3溶液中滴加Ba(NO3)2溶液,产生白色沉淀,加入稀盐酸后沉淀不溶解
3 向2 mol·L-1 Na2SO3溶液中通入足量SO2至有固体析出,测得溶液pH约为5
4 向1 mol·L-1 Na2SO3溶液中滴入稀盐酸,调节至溶液pH=7
答案 C
7.(2023·北京清华附中统考)向NaOH溶液中持续滴加稀盐酸,记录溶液pH及温度随时间的变化如图所示。下列说法正确的是( )
A.NaOH溶液的起始浓度为10-a mol·L-1
B.在滴定至终点的过程中,水的电离程度不断减小
C.t1 s→t3 s对应的溶液中均存在:c(Na+)+c(H+)=c(Cl-)+c(OH-)
D.由t2 s后溶液的温度变化可推知,NaOH与HCl的反应是吸热反应
C
解析 向NaOH溶液中持续滴加稀盐酸,曲线a到b为中和曲线,b点时刚好反应完全,此时反应温度最高。未滴加盐酸时,溶液pH最大,起始时NaOH溶液pH=a,c(H+)=10-a mol·L-1,常温下,根据KW=c(OH-)·c(H+)=10-14可得c(OH-)
mol·L-1=10a-14 mol·L-1,故NaOH溶液的起始浓度为
10a-14 mol·L-1, A错误;酸或碱均抑制水的电离,在滴定至终点的过程中,NaOH浓度减小,水的电离程度不断增大,恰好反应时,达到最大,B错误;t1 s时,NaOH过量,溶质为NaOH和NaCl,t3 s时,盐酸过量,溶质为HCl和NaCl,根据电荷守恒,t1 s→t3 s对应的溶液中均存在:c(Na+)+c(H+)=c(Cl-)+c(OH-),C正确;曲线a到b为中和曲线,b点时刚好反应完全,此时反应温度最高,故NaOH与HCl的反应是放热反应,D错误。
8.(2023·天津红桥区一模)常温下,下列溶液中的粒子浓度关系正确的是( )
D
9.(2023·广州天河区一模)常温下,用20 mL 0.1 mol·L-1 Na2SO3溶液吸收SO2气体。吸收液的pH与 的关系如图所示。下列说法不正确的是( )
C
10.(2023·河南洛阳统考)已知:pCu=-lg c(Cu2+),常温下向20 mL 0.1 mol·L-1 CuCl2溶液中滴加0.2 mol·L-1 Na2S溶液的滴定曲线如图所示。已知: Ksp(FeS)>Ksp(CuS)。下列说法正确的是( )
A.A、B、C三点的Ksp从大到小的顺序为C>B>A
B.在A点的溶液中存在c(Cu2+)C.常温下,Ksp(CuS)为1.0×10-36.6
D.其他条件相同,若将CuCl2溶液换为同浓度、
同体积的FeCl2溶液,B点会平行向右移动
C
解析 Ksp只受温度影响,A、B、C三点温度不变,则三点的Ksp相等,A错误;向20 mL 0.1 mol·L-1 CuCl2溶液中滴加10 mL 0.2 mol·L-1 Na2S溶液时, c(Cu2+)=c(S2-),此时pCu=18.3,A点V[Na2S(aq)]小于10 mL,则c(Cu2+)>c(S2-),B错误;向20 mL 0.1 mol·L-1 CuCl2溶液中滴加10 mL 0.2 mol·L-1 Na2S溶液时,c(Cu2+)=c(S2-),此时pCu=18.3,c(Cu2+)=10-18.3 mol·L-1=c(S2-), Ksp(CuS)=c(Cu2+)·c(S2-)=1.0×10-36.6,C正确;其他条件相同,若将CuCl2溶液换为同浓度、同体积的FeCl2溶液,滴加10 mL 0.2 mol·L-1 Na2S溶液时,
pFe=-lg c(Fe2+)= ,由于Ksp(FeS)>Ksp(CuS),则pFe曲线会向左移动,D错误。
11.(2023·湖南邵阳一模)常温下,将0.1 mol·L-1羟胺溶液滴加到20 mL的稀盐酸中,羟胺的电离方程式为NH2OH+H2O NH3OH++OH-(常温时,Kb=9.0×10-9),溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg 3=0.5),下列说法正确的是( )
A.该盐酸的浓度为0.2 mol·L-1
B.b点溶液中c(H+)C.0.1 mol·L-1羟胺溶液的pH=9.5
D.d点对应溶液中存在:
c(OH-)=c(H+)+c(NH2OH)
C
解析 由题图可知,a点为未加入羟胺溶液的盐酸、b点和c点为NH3OHCl和盐酸的混合溶液,d点为NH3OHCl溶液,e点和f点为NH2OH和NH3OHCl的混合溶液。a点为未加入羟胺溶液的盐酸,溶液中水电离出的c(H+)=10-13 mol·L-1,则由水电离出的c总(H+)等于水电离出的c(OH-)可知,盐酸的浓度为0.1 mol·L-1,A错误;b点溶液为NH3OHCl和盐酸的混合溶液,溶液呈酸性,溶液中c(H+)>c(OH-),B错误;由羟胺的电离常数可知,溶液中c(OH-)≈
mol·L-1=3×10-5 mol·L-1,则溶液的pH为14-5+lg 3=9.5,
C正确;d点为NH3OHCl溶液,溶液中存在质子守恒关系c(H+)=c(OH-) +c(NH2OH),D错误。
12.(2023·广东梅州名校联考)25 ℃时,向20 mL 0.2 mol·L-1 MOH溶液中逐滴加入浓度为0.2 mol·L-1的盐酸,溶液中 与pOH[pOH=-lg c(OH-)]、加入盐酸的体积的变化关系如图所示。下列说法错误的是( )
A.MCl水解平衡常数的数量级为10-10
B.b点溶液中各微粒的浓度关系为
c(MOH)>c(Cl-)>c(M+)>c(OH-)
C.a、b、c、d四点溶液中水的
电离程度逐渐增大
D.d点溶液的pOH>7
B
b点加入10 mL 0.2 mol·L-1盐酸,溶质为等物质的量的MOH和MCl,溶液呈碱性,c(OH-)>c(H+),则MOH的电离程度大于M+的水解程度,故离子浓度:c(M+)>c(Cl-)>c(MOH)>c(OH-)>c(H+),B错误;
酸和碱都会抑制水的电离,开始未加入HCl溶液,原碱溶液电离出的OH-抑制水的电离,加入HCl溶液到中和率100%时生成可以水解的MCl,促进水的电离,即中和率从0至100%的过程水的电离程度一直增大,故水的电离程度:a7,D正确。
13.(2023·湖南岳阳一模)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子方程式:
,铜帽溶解完全后,需将溶液中过量的H2O2除去,除去H2O2的简便操作是 。
Cu+H2O2+2H+ ══ Cu2++2H2O
加热(至沸腾)
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。某同学称取1.0 g电池铜帽进行实验,得到100.00 mL含有Cu2+的溶液,量取20.00 mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,滴入几滴淀粉溶液,加入过量的KI,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 1 2 3 4
V(Na2S2O3)/mL 26.32 25.31 25.30 25.32
①滴定终点的判断方法是
。②计算电池铜帽中Cu的质量分数为 %(保留小数点后2位),若滴定前溶液中的H2O2没有除尽,则所测定c(Cu2+)将会 (填“偏高”“偏低”或“无影响”)。
当滴加最后半滴Na2S2O3标准溶液后,溶液蓝色褪去,且半分钟内颜色不变
80.99
偏高
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。如图列出了几种离子生成氢氧化物沉淀的pH(开始沉淀pH以离子浓度为1.0 mol·L-1计)。
请结合图中相关数据,完成由除去铜的滤液制备ZnO的实验步骤(以最佳方案填写,可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH)。
①向滤液中加入适量30% H2O2,使其充分反应;
②滴加1.0 mol·L-1 NaOH,调节溶液pH范围为 ;
③过滤;
④____________________________________________________________
;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。
3.2~5.9
向滤液中滴加1 mol·L-1 NaOH,调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全
专题 水溶液中的离子反应与平衡
----基础巩固练
基础巩固练
1.(2023·北京西城区一模)下列反应与电离平衡无关的是( )
A.FeSO4溶液与NH4HCO3溶液反应制备FeCO3
B.电解饱和NaCl溶液制备NaOH
C.加氨水除去NH4Cl溶液中的杂质FeCl3
D.将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3
C
解析 将Na2CO3溶液加入水垢中使CaSO4转化为CaCO3,利用了难溶电解质的转化,与电离平衡无关,D符合题意。
2.(2023·上海闵行区一模)H2S是一种有毒气体,能溶于水,人们常用CuSO4溶液除去气体中混有的H2S杂质,生成黑褐色的CuS沉淀。下列说法正确的是( )
A.离子方程式:Cu2++S2- ══ CuS↓
B.溶解或电离出S2-的能力:H2S>CuS
C.足量NaOH溶液吸收H2S可得到NaHS
D.稀释H2S溶液,溶液中的离子浓度都降低
B
解析 H2S为弱电解质,不能写成离子形式,正确的离子方程式为Cu2++H2S ══ CuS↓+2H+,A错误;由Cu2+和H2S生成CuS沉淀可知,相同条件下溶解或电离出S2-的能力:H2S>CuS,B正确;足量NaOH溶液吸收H2S可得到Na2S和H2O,C错误;温度不变,KW不变,稀释H2S溶液,c(H+)降低,则c(OH-)必然增大,故不是溶液中的所有离子浓度都降低,D错误。
3.(2023·安徽鼎尖名校联盟联考)酸性强弱与物质本身电离出氢离子的能力有关,还与溶剂接受氢离子的能力有关,如HCl在冰醋酸中只有部分电离,CH3COOH与HF在液氨中可完全电离。下列说法不正确的是( )
A.在水中,HCl的电离方程式为HCl ══ H++Cl-
B.比较H2SO4、HClO4、HNO3酸性时,可在冰醋酸中进行
C.在液氨中,反应CH3COONa+HCl ══ CH3COOH+NaCl能够发生
D.在A溶剂中,甲的酸性大于乙;在B溶剂中,甲的酸性不可能小于乙
C
解析 在水中H2SO4、HClO4、HNO3都完全电离,不能比较其酸性,在冰醋酸中电离程度不同,可在冰醋酸中比较H2SO4、HClO4、HNO3的酸性,B正确。液氨能接受H+,在液氨中CH3COOH和HCl都完全电离,在液氨中反应CH3COONa+HCl ══ NaCl+CH3COOH不能够发生,C错误。在A溶剂中甲的酸性大于乙,甲电离出H+的能力强于乙;在B溶剂中,甲电离出H+的能力可能强于乙,也可能相等(如HCl和CH3COOH在液氨中都完全电离),即甲的酸性可能大于或等于乙,但不可能小于乙,D正确。
4.(2023·湖南衡阳八中模拟)常温下,下列说法正确的是( )
A.室温下,0.01 mol·L-1 CH3COONH4溶液的pH=7,1 L该溶液中含有 的数目为0.01NA
B.用CH3COOH溶液做导电性试验,灯泡很暗,说明CH3COOH是弱电解质
C.相同物质的量浓度的盐酸与醋酸分别稀释相同倍数,稀释后溶液pH:盐酸<醋酸
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合,混合液呈碱性
C
解析 在水中会发生水解,故1 L 0.01 mol·L-1 CH3COONH4溶液含有
的数目小于0.01NA,A错误;用CH3COOH溶液做导电性试验,灯泡很暗,只能说明溶液中阴阳离子浓度较小,无法证明CH3COOH的电离程度,即无法证明醋酸为弱电解质,B错误;醋酸为弱酸,不能完全电离,盐酸、醋酸稀释相同倍数后,醋酸中氢离子浓度小,pH较大,C正确;等体积的pH=3的醋酸溶液与pH=11的氢氧化钠溶液,醋酸溶液浓度大于氢氧化钠溶液浓度,等体积混合后反应生成醋酸钠,还会剩余醋酸,所得溶液呈酸性,D错误。
5.(2023·北京通州区统考)某温度下,四种不同一元酸溶液在不同浓度时的pH如下表所示,下列推测不合理的是( )
酸HX的pH 酸HY的pH 酸HM的pH 酸HN的pH
0.010 3.44 2.00 2.92 2.20
0.10 2.94 1.00 2.42 1.55
A.该温度下电离出H+的能力:HY>HN>HM>HX
B.该温度下将HY溶液加入NaX溶液中,发生反应为HY+NaX══HX+NaY
C.该温度下当HX的浓度为0.10 mol·L-1时,c(HX)>c(X-)>c(H+)>c(OH-)
D.该温度下用同种方法测定,相同体积的0.10 mol·L-1 HM溶液比0.010 mol·L-1 HM溶液导电能力强
C
解析 由题表中数据可知,等浓度的四种一元酸溶液的pH: HX>HM>HN>HY,则该温度下四种酸电离出H+的能力: HY>HN>HM>HX,A正确;等浓度HY溶液的pH小于HX溶液,说明HY的酸性强于HX,由强酸制弱酸的原理可知,HY溶液加入NaX溶液中发生反应的化学方程式为HY+NaX ══ HX+NaY,B正确;HX为一元弱酸,在溶液中部分电离出H+和X-,则溶液中:c(HX)>c(H+)>c(X-)>c(OH-),C错误;HM为一元弱酸,则相同体积的0.10 mol·L-1 HM溶液中离子浓度大于0.010 mol·L-1 HM溶液,故导电能力强于0.010 mol·L-1 HM溶液,D正确。
6.(2023·黑龙江齐齐哈尔一模)室温下,通过下列实验探究Na2SO3溶液的性质(已知:室温下,NaHSO3水溶性约为300 g·L-1)
实验 实验操作和现象
1 用pH试纸测定0.1 mol·L-1 Na2SO3溶液的pH,测得pH约为10
2 向1 mol·L-1 Na2SO3溶液中滴加Ba(NO3)2溶液,产生白色沉淀,加入稀盐酸后沉淀不溶解
3 向2 mol·L-1 Na2SO3溶液中通入足量SO2至有固体析出,测得溶液pH约为5
4 向1 mol·L-1 Na2SO3溶液中滴入稀盐酸,调节至溶液pH=7
答案 C
7.(2023·北京清华附中统考)向NaOH溶液中持续滴加稀盐酸,记录溶液pH及温度随时间的变化如图所示。下列说法正确的是( )
A.NaOH溶液的起始浓度为10-a mol·L-1
B.在滴定至终点的过程中,水的电离程度不断减小
C.t1 s→t3 s对应的溶液中均存在:c(Na+)+c(H+)=c(Cl-)+c(OH-)
D.由t2 s后溶液的温度变化可推知,NaOH与HCl的反应是吸热反应
C
解析 向NaOH溶液中持续滴加稀盐酸,曲线a到b为中和曲线,b点时刚好反应完全,此时反应温度最高。未滴加盐酸时,溶液pH最大,起始时NaOH溶液pH=a,c(H+)=10-a mol·L-1,常温下,根据KW=c(OH-)·c(H+)=10-14可得c(OH-)
mol·L-1=10a-14 mol·L-1,故NaOH溶液的起始浓度为
10a-14 mol·L-1, A错误;酸或碱均抑制水的电离,在滴定至终点的过程中,NaOH浓度减小,水的电离程度不断增大,恰好反应时,达到最大,B错误;t1 s时,NaOH过量,溶质为NaOH和NaCl,t3 s时,盐酸过量,溶质为HCl和NaCl,根据电荷守恒,t1 s→t3 s对应的溶液中均存在:c(Na+)+c(H+)=c(Cl-)+c(OH-),C正确;曲线a到b为中和曲线,b点时刚好反应完全,此时反应温度最高,故NaOH与HCl的反应是放热反应,D错误。
8.(2023·天津红桥区一模)常温下,下列溶液中的粒子浓度关系正确的是( )
D
9.(2023·广州天河区一模)常温下,用20 mL 0.1 mol·L-1 Na2SO3溶液吸收SO2气体。吸收液的pH与 的关系如图所示。下列说法不正确的是( )
C
10.(2023·河南洛阳统考)已知:pCu=-lg c(Cu2+),常温下向20 mL 0.1 mol·L-1 CuCl2溶液中滴加0.2 mol·L-1 Na2S溶液的滴定曲线如图所示。已知: Ksp(FeS)>Ksp(CuS)。下列说法正确的是( )
A.A、B、C三点的Ksp从大到小的顺序为C>B>A
B.在A点的溶液中存在c(Cu2+)
D.其他条件相同,若将CuCl2溶液换为同浓度、
同体积的FeCl2溶液,B点会平行向右移动
C
解析 Ksp只受温度影响,A、B、C三点温度不变,则三点的Ksp相等,A错误;向20 mL 0.1 mol·L-1 CuCl2溶液中滴加10 mL 0.2 mol·L-1 Na2S溶液时, c(Cu2+)=c(S2-),此时pCu=18.3,A点V[Na2S(aq)]小于10 mL,则c(Cu2+)>c(S2-),B错误;向20 mL 0.1 mol·L-1 CuCl2溶液中滴加10 mL 0.2 mol·L-1 Na2S溶液时,c(Cu2+)=c(S2-),此时pCu=18.3,c(Cu2+)=10-18.3 mol·L-1=c(S2-), Ksp(CuS)=c(Cu2+)·c(S2-)=1.0×10-36.6,C正确;其他条件相同,若将CuCl2溶液换为同浓度、同体积的FeCl2溶液,滴加10 mL 0.2 mol·L-1 Na2S溶液时,
pFe=-lg c(Fe2+)= ,由于Ksp(FeS)>Ksp(CuS),则pFe曲线会向左移动,D错误。
11.(2023·湖南邵阳一模)常温下,将0.1 mol·L-1羟胺溶液滴加到20 mL的稀盐酸中,羟胺的电离方程式为NH2OH+H2O NH3OH++OH-(常温时,Kb=9.0×10-9),溶液中由水电离出的氢离子浓度随滴入羟胺溶液体积的变化如图(已知:lg 3=0.5),下列说法正确的是( )
A.该盐酸的浓度为0.2 mol·L-1
B.b点溶液中c(H+)
D.d点对应溶液中存在:
c(OH-)=c(H+)+c(NH2OH)
C
解析 由题图可知,a点为未加入羟胺溶液的盐酸、b点和c点为NH3OHCl和盐酸的混合溶液,d点为NH3OHCl溶液,e点和f点为NH2OH和NH3OHCl的混合溶液。a点为未加入羟胺溶液的盐酸,溶液中水电离出的c(H+)=10-13 mol·L-1,则由水电离出的c总(H+)等于水电离出的c(OH-)可知,盐酸的浓度为0.1 mol·L-1,A错误;b点溶液为NH3OHCl和盐酸的混合溶液,溶液呈酸性,溶液中c(H+)>c(OH-),B错误;由羟胺的电离常数可知,溶液中c(OH-)≈
mol·L-1=3×10-5 mol·L-1,则溶液的pH为14-5+lg 3=9.5,
C正确;d点为NH3OHCl溶液,溶液中存在质子守恒关系c(H+)=c(OH-) +c(NH2OH),D错误。
12.(2023·广东梅州名校联考)25 ℃时,向20 mL 0.2 mol·L-1 MOH溶液中逐滴加入浓度为0.2 mol·L-1的盐酸,溶液中 与pOH[pOH=-lg c(OH-)]、加入盐酸的体积的变化关系如图所示。下列说法错误的是( )
A.MCl水解平衡常数的数量级为10-10
B.b点溶液中各微粒的浓度关系为
c(MOH)>c(Cl-)>c(M+)>c(OH-)
C.a、b、c、d四点溶液中水的
电离程度逐渐增大
D.d点溶液的pOH>7
B
b点加入10 mL 0.2 mol·L-1盐酸,溶质为等物质的量的MOH和MCl,溶液呈碱性,c(OH-)>c(H+),则MOH的电离程度大于M+的水解程度,故离子浓度:c(M+)>c(Cl-)>c(MOH)>c(OH-)>c(H+),B错误;
酸和碱都会抑制水的电离,开始未加入HCl溶液,原碱溶液电离出的OH-抑制水的电离,加入HCl溶液到中和率100%时生成可以水解的MCl,促进水的电离,即中和率从0至100%的过程水的电离程度一直增大,故水的电离程度:a
13.(2023·湖南岳阳一模)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收Cu并制备ZnO的部分实验过程如下:
(1)写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子方程式:
,铜帽溶解完全后,需将溶液中过量的H2O2除去,除去H2O2的简便操作是 。
Cu+H2O2+2H+ ══ Cu2++2H2O
加热(至沸腾)
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。某同学称取1.0 g电池铜帽进行实验,得到100.00 mL含有Cu2+的溶液,量取20.00 mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,滴入几滴淀粉溶液,加入过量的KI,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号 1 2 3 4
V(Na2S2O3)/mL 26.32 25.31 25.30 25.32
①滴定终点的判断方法是
。②计算电池铜帽中Cu的质量分数为 %(保留小数点后2位),若滴定前溶液中的H2O2没有除尽,则所测定c(Cu2+)将会 (填“偏高”“偏低”或“无影响”)。
当滴加最后半滴Na2S2O3标准溶液后,溶液蓝色褪去,且半分钟内颜色不变
80.99
偏高
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。如图列出了几种离子生成氢氧化物沉淀的pH(开始沉淀pH以离子浓度为1.0 mol·L-1计)。
请结合图中相关数据,完成由除去铜的滤液制备ZnO的实验步骤(以最佳方案填写,可选用的试剂:30% H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH)。
①向滤液中加入适量30% H2O2,使其充分反应;
②滴加1.0 mol·L-1 NaOH,调节溶液pH范围为 ;
③过滤;
④____________________________________________________________
;
⑤过滤、洗涤、干燥;
⑥900 ℃煅烧。
3.2~5.9
向滤液中滴加1 mol·L-1 NaOH,调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全
同课章节目录
