专题 水溶液中的离子反应与平衡----能力提升练课件(共33张PPT)
文档属性
| 名称 | 专题 水溶液中的离子反应与平衡----能力提升练课件(共33张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 23:28:29 | ||
图片预览








文档简介
(共33张PPT)
专题 水溶液中的离子反应与平衡
----能力提升练
能力提升练
1.(2023·江西吉安统考)25 ℃时,下列说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中 减小
B.等物质的量的CH3COONa、Na2CO3混合溶液中:
C.2.0×10-7 mol·L-1的盐酸中c(H+)=2.0×10-7 mol·L-1
D.可溶性正盐BA的溶液呈中性,可以推测BA为强酸强碱盐
B
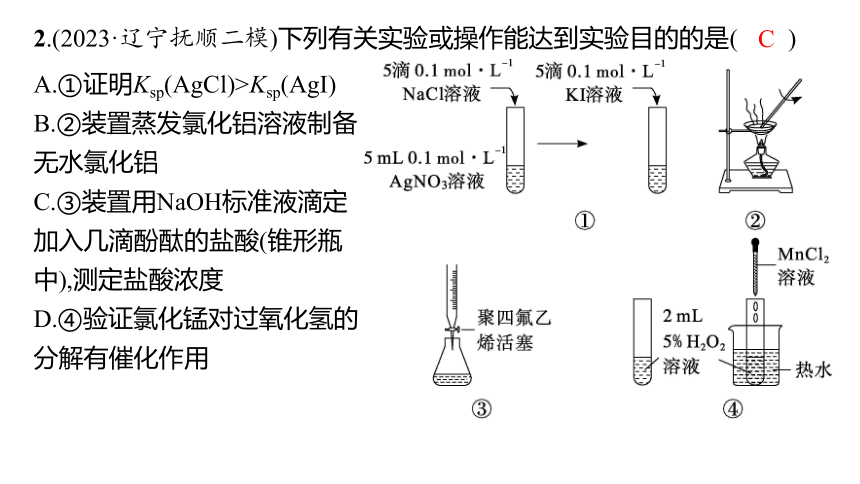
2.(2023·辽宁抚顺二模)下列有关实验或操作能达到实验目的的是( )
A.①证明Ksp(AgCl)>Ksp(AgI)
B.②装置蒸发氯化铝溶液制备无水氯化铝
C.③装置用NaOH标准液滴定加入几滴酚酞的盐酸(锥形瓶中),测定盐酸浓度
D.④验证氯化锰对过氧化氢的分解有催化作用
C
解析 ①中硝酸银过量,过量硝酸银会和碘化钾生成碘化银沉淀,不能证明Ksp(AgCl)>Ksp(AgI),A错误;铝离子容易水解生成氢氧化铝,另一水解产物是易挥发的盐酸,故不能蒸发氯化铝溶液制备无水氯化铝,B错误;装置用NaOH标准液滴定加入几滴酚酞的盐酸(锥形瓶中),当最后半滴标准液滴入后溶液变红色且半分钟不褪色,说明恰好反应,可以测定盐酸浓度,聚四氟乙烯活塞滴定管可以酸碱两用,C正确;实验中有氯化锰、温度两个变量,不能验证氯化锰对过氧化氢的分解有催化作用,D错误。
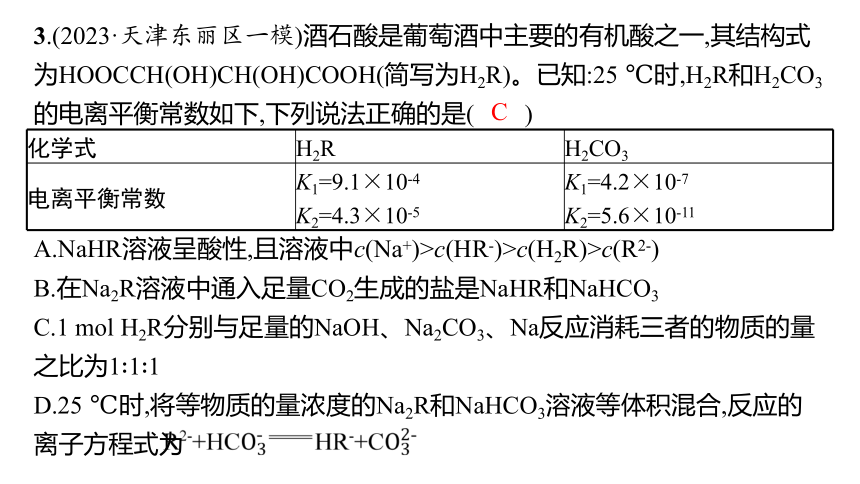
3.(2023·天津东丽区一模)酒石酸是葡萄酒中主要的有机酸之一,其结构式为HOOCCH(OH)CH(OH)COOH(简写为H2R)。已知:25 ℃时,H2R和H2CO3的电离平衡常数如下,下列说法正确的是( )
化学式 H2R H2CO3
电离平衡常数 K1=9.1×10-4 K2=4.3×10-5 K1=4.2×10-7
K2=5.6×10-11
A.NaHR溶液呈酸性,且溶液中c(Na+)>c(HR-)>c(H2R)>c(R2-)
B.在Na2R溶液中通入足量CO2生成的盐是NaHR和NaHCO3
C.1 mol H2R分别与足量的NaOH、Na2CO3、Na反应消耗三者的物质的量之比为1∶1∶1
D.25 ℃时,将等物质的量浓度的Na2R和NaHCO3溶液等体积混合,反应的离子方程式为
C
解析 由于K2(H2R)=4.3×10-5>Kh(H2R),则NaHR在溶液中以电离为主,溶液呈酸性,则有溶液中c(Na+)>c(HR-)>c(R2-)>c(H2R),A错误;由于K2(H2R)=4.3×10-5>K1(H2CO3),在Na2R溶液中通入足量CO2气体,不能发生反应,B错误;1 mol H2R分别与足量的NaOH、Na2CO3、Na反应,都生成Na2R,且Na2CO3转化为NaHCO3,消耗NaOH、Na2CO3、Na都为2 mol,则消耗三者的物质的量之比为1∶1∶1,C正确;25 ℃时,将等物质的量浓度的Na2R和NaHCO3溶液等体积混合,由于K2(H2R)=4.3×10-5>K2(H2CO3),不能发生反应,D错误。
4.(2023·天津河东区一模)常温下,苯酚(C6H5OH)的Ka=1.0×10-10,甲酸(HCOOH)的Ka=1.77×10-4,下列说法正确的是( )
A.相同温度下,pH相等的C6H5ONa和HCOONa溶液中,c(C6H5O-)>c(HCOO-)
B.常温时,取pH=a的HCOOH溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
C.常温时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
D.向HCOONa溶液中加入NaOH至pH等于11,则c(HCOO-)>c(HCOOH)
D
解析 相同温度下,pH相等的C6H5ONa和HCOONa溶液中,水解生成的
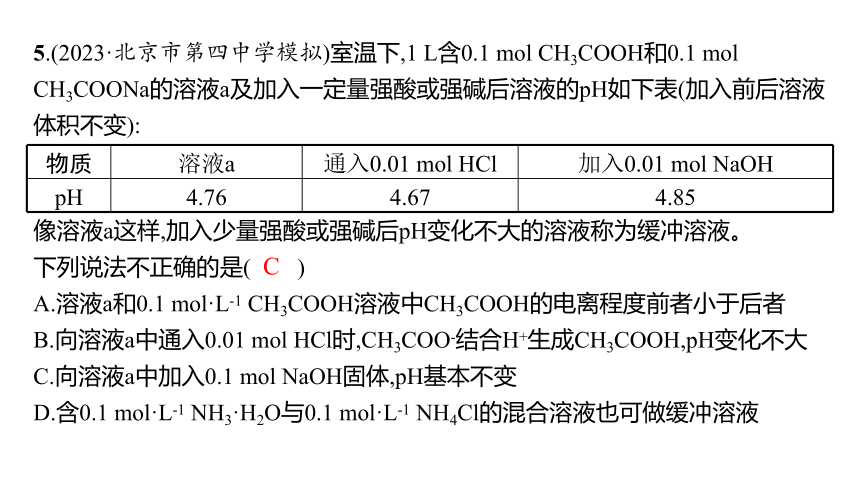
c(OH-)相等,根据越弱越水解,则有c(C6H5O-)5.(2023·北京市第四中学模拟)室温下,1 L含0.1 mol CH3COOH和0.1 mol CH3COONa的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
物质 溶液a 通入0.01 mol HCl 加入0.01 mol NaOH
pH 4.76 4.67 4.85
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法不正确的是( )
A.溶液a和0.1 mol·L-1 CH3COOH溶液中CH3COOH的电离程度前者小于后者
B.向溶液a中通入0.01 mol HCl时,CH3COO-结合H+生成CH3COOH,pH变化不大
C.向溶液a中加入0.1 mol NaOH固体,pH基本不变
D.含0.1 mol·L-1 NH3·H2O与0.1 mol·L-1 NH4Cl的混合溶液也可做缓冲溶液
C
解析 1 L含0.1 mol CH3COOH和0.1 mol CH3COONa的溶液a中, CH3COONa电离出CH3COO-,对CH3COOH的电离有抑制作用,溶液a中CH3COOH的电离程度小于0.1 mol·L-1 CH3COOH溶液中CH3COOH的电离程度,A正确;向溶液a中通入0.01 mol HCl时,CH3COO-结合H+生成CH3COOH,反应后溶液组成为0.11 mol CH3COOH和0.09 mol CH3COONa,溶液组成没有大的变化,pH变化不大,B正确;向溶液a中加入0.1 mol NaOH固体,0.1 mol CH3COOH完全反应,得到CH3COONa溶液,显碱性,pH变化大,C错误;含0.1 mol·L-1 NH3·H2O与0.1 mol·L-1 NH4Cl的混合溶液,加入少量强酸或强碱,溶液组成不会明显改变,故也可叫缓冲溶液,D正确。
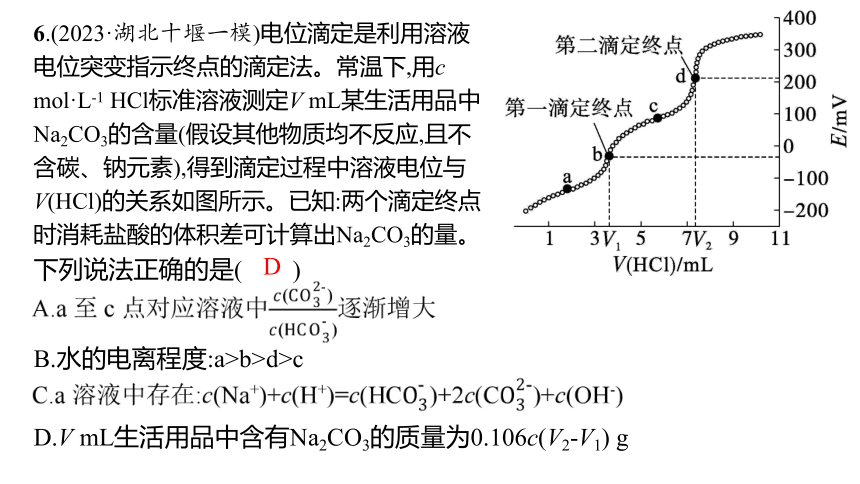
6.(2023·湖北十堰一模)电位滴定是利用溶液电位突变指示终点的滴定法。常温下,用c mol·L-1 HCl标准溶液测定V mL某生活用品中Na2CO3的含量(假设其他物质均不反应,且不含碳、钠元素),得到滴定过程中溶液电位与V(HCl)的关系如图所示。已知:两个滴定终点时消耗盐酸的体积差可计算出Na2CO3的量。
下列说法正确的是( )
B.水的电离程度:a>b>d>c
D.V mL生活用品中含有Na2CO3的质量为0.106c(V2-V1) g
D
7.(2023·江西南昌一模)常温下,向1 L 1.0 mol·L-1的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是( )
A.a点时,被还原的NaClO的物质的量为0.2 mol
B.b点的总反应:SO2+H2O+3NaClO ══ Na2SO4+NaCl+2HClO
C.c点的总反应:SO2+H2O+NaClO ══ H2SO4+NaCl
D.常温下,HClO的电离平衡常数为1.5×10-8
D
解析 反应中,硫元素从+4价升高到+6价、氯元素从+1价降低到-1价,按得失电子数守恒,则a点时,被还原的NaClO为0.2 mol,A正确;b点为1 L 1.0 mol·L-1的NaClO溶液中通入 mol二氧化硫,总反应为SO2+H2O+3NaClO ══ Na2SO4+NaCl+2HClO,B正确;c点为1 L 1.0 mol·L-1的NaClO溶液中通入1 mol二氧化硫,被氧化二氧化硫和被还原的次氯酸根等物质的量,则总反应为SO2+H2O+NaClO ══ H2SO4+NaCl,C正确;由B项分析,常温下,
HClO的电离平衡常数为 D错误。
8.(2023·江苏南通一模)室温下,以0.1 mol·L-1 NaOH溶液吸收含少量SO2的烟气(主要成分为空气),并用H2SO4再生SO2的过程如图所示。若吸收过程中溶液体积、温度变化可忽略,H2SO3电离常数分别为 =1×10-2,
=5×10-8,下列说法正确的是( )
C
A.a点时,c(HM)+c(M-)=2c(Na+)
B.溶液中水的电离程度:c点>b点
C.b点时,c(M-)>c(Na+)>c(H+)>c(OH-)
D.HM的电离常数为10-5.2
A
解析 a点时 =0,此时c(HM)=c(M-),据电荷守恒:c(H+)+c(Na+)=
c(OH-)+c(M-),此时pH=5.2,则c(H+)>c(OH-),则有c(Na+)c(OH-),则有c(Na+)c(Na+)>c(H+)>c(OH-),C正确;a点时c(HM)=c(M-),pH=5.2,则HM电离常数
A.线①代表-lg c(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-17
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向 =0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl溶液后,体系中元素M主要以M2+存在
答案 D
11.(2023·广东佛山调研)常温下,用0.1 mol·L-1的NaOH溶液滴定20 mL 0.1 mol·L-1的H3PO2溶液,滴定过程中混合溶液的pH随加入的NaOH溶液体积变化关系如图所示,下列说法不正确的是( )
A.常温下,Ka(H3PO2)的数量级为10-5
B.B点对应的溶液中:
2[c(H+)-c(OH-)]=c( )-c(H3PO2)
C.H3PO2为一元弱酸
D.滴定至V=20 mL的过程中,溶液中由
水电离出的c(H+)·c(OH-)不变
D
12.(2023·北京海淀区统考)食醋的酸度是指每100 mL食醋中含酸(均折合成醋酸计)的质量。国家标准规定酿造食醋酸度不得低于3.5 g/100 mL,可用滴定法测定食醋的酸度。某小组同学量取10.00 mL自制食醋样品稀释至250.00 mL(溶液几乎无色),每次量取25.00 mL于锥形瓶中,加入3.00 mL中性甲醛溶液(掩蔽氨基的碱性),以酚酞为指示剂,用0.100 0 mol·L-1 NaOH标准溶液滴定,滴定管读数记录如下表。
NaOH溶液的体积 第一次 第二次 第三次
滴定前NaOH溶液的体积读数/mL 0.00 1.00 2.00
滴定后NaOH溶液的体积读数/mL 9.90 11.00 12.10
下列说法不正确的是( )
A.醋酸易溶于水与“醋酸分子和水分子之间能形成氢键”有关
B.锥形瓶中溶液由无色变为粉红色,且半分钟内不褪色时停止滴定
C.该自制食醋样品的酸度不符合国家标准
D.若不加甲醛溶液,测定结果会偏低
答案 C
13.(2023·河北省名校联盟联考)磷的含氧酸有磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等多种,它们在工业上都是重要的化工原料。
(1)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式: 。
(2)某温度下,0.01 mol·L-1 H3PO3溶液的pH为2.7,该温度下,H3PO3的一级电离常数= (已知:lg 2=0.3,lg 3=0.5,lg 5=0.7,H3PO3的第二步电离忽略不计)。
(3)某实验小组用NaOH溶液处理含H3PO3的废水,当溶液中c(Na+)= c( )+2c( )时,溶液呈 (填“酸”“碱”或“中”)性。
H3PO3+2NaOH ══ Na2HPO3+2H2O
5×10-4
中
(5)向某浓度的磷酸溶液中滴加NaOH溶液,其pH与溶液中H3PO4、
的物质的量分数δ(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离
子方程式是 。
(6)已知:常温下,Ksp(FePO4)=1.3×10-22、Ksp(AlPO4)=5.2×10-19。常温下,向含Fe3+、Al3+的混合溶液中滴加Na3PO4溶液,当FePO4、AlPO4同时生成时,溶液中c(Fe3+)∶c(Al3+)= 。
1∶(4×103)
专题 水溶液中的离子反应与平衡
----能力提升练
能力提升练
1.(2023·江西吉安统考)25 ℃时,下列说法正确的是( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中 减小
B.等物质的量的CH3COONa、Na2CO3混合溶液中:
C.2.0×10-7 mol·L-1的盐酸中c(H+)=2.0×10-7 mol·L-1
D.可溶性正盐BA的溶液呈中性,可以推测BA为强酸强碱盐
B
2.(2023·辽宁抚顺二模)下列有关实验或操作能达到实验目的的是( )
A.①证明Ksp(AgCl)>Ksp(AgI)
B.②装置蒸发氯化铝溶液制备无水氯化铝
C.③装置用NaOH标准液滴定加入几滴酚酞的盐酸(锥形瓶中),测定盐酸浓度
D.④验证氯化锰对过氧化氢的分解有催化作用
C
解析 ①中硝酸银过量,过量硝酸银会和碘化钾生成碘化银沉淀,不能证明Ksp(AgCl)>Ksp(AgI),A错误;铝离子容易水解生成氢氧化铝,另一水解产物是易挥发的盐酸,故不能蒸发氯化铝溶液制备无水氯化铝,B错误;装置用NaOH标准液滴定加入几滴酚酞的盐酸(锥形瓶中),当最后半滴标准液滴入后溶液变红色且半分钟不褪色,说明恰好反应,可以测定盐酸浓度,聚四氟乙烯活塞滴定管可以酸碱两用,C正确;实验中有氯化锰、温度两个变量,不能验证氯化锰对过氧化氢的分解有催化作用,D错误。
3.(2023·天津东丽区一模)酒石酸是葡萄酒中主要的有机酸之一,其结构式为HOOCCH(OH)CH(OH)COOH(简写为H2R)。已知:25 ℃时,H2R和H2CO3的电离平衡常数如下,下列说法正确的是( )
化学式 H2R H2CO3
电离平衡常数 K1=9.1×10-4 K2=4.3×10-5 K1=4.2×10-7
K2=5.6×10-11
A.NaHR溶液呈酸性,且溶液中c(Na+)>c(HR-)>c(H2R)>c(R2-)
B.在Na2R溶液中通入足量CO2生成的盐是NaHR和NaHCO3
C.1 mol H2R分别与足量的NaOH、Na2CO3、Na反应消耗三者的物质的量之比为1∶1∶1
D.25 ℃时,将等物质的量浓度的Na2R和NaHCO3溶液等体积混合,反应的离子方程式为
C
解析 由于K2(H2R)=4.3×10-5>Kh(H2R),则NaHR在溶液中以电离为主,溶液呈酸性,则有溶液中c(Na+)>c(HR-)>c(R2-)>c(H2R),A错误;由于K2(H2R)=4.3×10-5>K1(H2CO3),在Na2R溶液中通入足量CO2气体,不能发生反应,B错误;1 mol H2R分别与足量的NaOH、Na2CO3、Na反应,都生成Na2R,且Na2CO3转化为NaHCO3,消耗NaOH、Na2CO3、Na都为2 mol,则消耗三者的物质的量之比为1∶1∶1,C正确;25 ℃时,将等物质的量浓度的Na2R和NaHCO3溶液等体积混合,由于K2(H2R)=4.3×10-5>K2(H2CO3),不能发生反应,D错误。
4.(2023·天津河东区一模)常温下,苯酚(C6H5OH)的Ka=1.0×10-10,甲酸(HCOOH)的Ka=1.77×10-4,下列说法正确的是( )
A.相同温度下,pH相等的C6H5ONa和HCOONa溶液中,c(C6H5O-)>c(HCOO-)
B.常温时,取pH=a的HCOOH溶液10 mL,加蒸馏水稀释至100 mL,则该溶液pH=a+1
C.常温时,0.10 mol·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
D.向HCOONa溶液中加入NaOH至pH等于11,则c(HCOO-)>c(HCOOH)
D
解析 相同温度下,pH相等的C6H5ONa和HCOONa溶液中,水解生成的
c(OH-)相等,根据越弱越水解,则有c(C6H5O-)
物质 溶液a 通入0.01 mol HCl 加入0.01 mol NaOH
pH 4.76 4.67 4.85
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法不正确的是( )
A.溶液a和0.1 mol·L-1 CH3COOH溶液中CH3COOH的电离程度前者小于后者
B.向溶液a中通入0.01 mol HCl时,CH3COO-结合H+生成CH3COOH,pH变化不大
C.向溶液a中加入0.1 mol NaOH固体,pH基本不变
D.含0.1 mol·L-1 NH3·H2O与0.1 mol·L-1 NH4Cl的混合溶液也可做缓冲溶液
C
解析 1 L含0.1 mol CH3COOH和0.1 mol CH3COONa的溶液a中, CH3COONa电离出CH3COO-,对CH3COOH的电离有抑制作用,溶液a中CH3COOH的电离程度小于0.1 mol·L-1 CH3COOH溶液中CH3COOH的电离程度,A正确;向溶液a中通入0.01 mol HCl时,CH3COO-结合H+生成CH3COOH,反应后溶液组成为0.11 mol CH3COOH和0.09 mol CH3COONa,溶液组成没有大的变化,pH变化不大,B正确;向溶液a中加入0.1 mol NaOH固体,0.1 mol CH3COOH完全反应,得到CH3COONa溶液,显碱性,pH变化大,C错误;含0.1 mol·L-1 NH3·H2O与0.1 mol·L-1 NH4Cl的混合溶液,加入少量强酸或强碱,溶液组成不会明显改变,故也可叫缓冲溶液,D正确。
6.(2023·湖北十堰一模)电位滴定是利用溶液电位突变指示终点的滴定法。常温下,用c mol·L-1 HCl标准溶液测定V mL某生活用品中Na2CO3的含量(假设其他物质均不反应,且不含碳、钠元素),得到滴定过程中溶液电位与V(HCl)的关系如图所示。已知:两个滴定终点时消耗盐酸的体积差可计算出Na2CO3的量。
下列说法正确的是( )
B.水的电离程度:a>b>d>c
D.V mL生活用品中含有Na2CO3的质量为0.106c(V2-V1) g
D
7.(2023·江西南昌一模)常温下,向1 L 1.0 mol·L-1的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是( )
A.a点时,被还原的NaClO的物质的量为0.2 mol
B.b点的总反应:SO2+H2O+3NaClO ══ Na2SO4+NaCl+2HClO
C.c点的总反应:SO2+H2O+NaClO ══ H2SO4+NaCl
D.常温下,HClO的电离平衡常数为1.5×10-8
D
解析 反应中,硫元素从+4价升高到+6价、氯元素从+1价降低到-1价,按得失电子数守恒,则a点时,被还原的NaClO为0.2 mol,A正确;b点为1 L 1.0 mol·L-1的NaClO溶液中通入 mol二氧化硫,总反应为SO2+H2O+3NaClO ══ Na2SO4+NaCl+2HClO,B正确;c点为1 L 1.0 mol·L-1的NaClO溶液中通入1 mol二氧化硫,被氧化二氧化硫和被还原的次氯酸根等物质的量,则总反应为SO2+H2O+NaClO ══ H2SO4+NaCl,C正确;由B项分析,常温下,
HClO的电离平衡常数为 D错误。
8.(2023·江苏南通一模)室温下,以0.1 mol·L-1 NaOH溶液吸收含少量SO2的烟气(主要成分为空气),并用H2SO4再生SO2的过程如图所示。若吸收过程中溶液体积、温度变化可忽略,H2SO3电离常数分别为 =1×10-2,
=5×10-8,下列说法正确的是( )
C
A.a点时,c(HM)+c(M-)=2c(Na+)
B.溶液中水的电离程度:c点>b点
C.b点时,c(M-)>c(Na+)>c(H+)>c(OH-)
D.HM的电离常数为10-5.2
A
解析 a点时 =0,此时c(HM)=c(M-),据电荷守恒:c(H+)+c(Na+)=
c(OH-)+c(M-),此时pH=5.2,则c(H+)>c(OH-),则有c(Na+)
A.线①代表-lg c(M2+)与pH的关系
B.M(OH)2的Ksp约为1×10-17
C.向c(M2+)=0.1 mol·L-1的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以M(OH)2(s)存在
D.向 =0.1 mol·L-1的溶液中加入等体积0.4 mol·L-1的HCl溶液后,体系中元素M主要以M2+存在
答案 D
11.(2023·广东佛山调研)常温下,用0.1 mol·L-1的NaOH溶液滴定20 mL 0.1 mol·L-1的H3PO2溶液,滴定过程中混合溶液的pH随加入的NaOH溶液体积变化关系如图所示,下列说法不正确的是( )
A.常温下,Ka(H3PO2)的数量级为10-5
B.B点对应的溶液中:
2[c(H+)-c(OH-)]=c( )-c(H3PO2)
C.H3PO2为一元弱酸
D.滴定至V=20 mL的过程中,溶液中由
水电离出的c(H+)·c(OH-)不变
D
12.(2023·北京海淀区统考)食醋的酸度是指每100 mL食醋中含酸(均折合成醋酸计)的质量。国家标准规定酿造食醋酸度不得低于3.5 g/100 mL,可用滴定法测定食醋的酸度。某小组同学量取10.00 mL自制食醋样品稀释至250.00 mL(溶液几乎无色),每次量取25.00 mL于锥形瓶中,加入3.00 mL中性甲醛溶液(掩蔽氨基的碱性),以酚酞为指示剂,用0.100 0 mol·L-1 NaOH标准溶液滴定,滴定管读数记录如下表。
NaOH溶液的体积 第一次 第二次 第三次
滴定前NaOH溶液的体积读数/mL 0.00 1.00 2.00
滴定后NaOH溶液的体积读数/mL 9.90 11.00 12.10
下列说法不正确的是( )
A.醋酸易溶于水与“醋酸分子和水分子之间能形成氢键”有关
B.锥形瓶中溶液由无色变为粉红色,且半分钟内不褪色时停止滴定
C.该自制食醋样品的酸度不符合国家标准
D.若不加甲醛溶液,测定结果会偏低
答案 C
13.(2023·河北省名校联盟联考)磷的含氧酸有磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等多种,它们在工业上都是重要的化工原料。
(1)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式: 。
(2)某温度下,0.01 mol·L-1 H3PO3溶液的pH为2.7,该温度下,H3PO3的一级电离常数= (已知:lg 2=0.3,lg 3=0.5,lg 5=0.7,H3PO3的第二步电离忽略不计)。
(3)某实验小组用NaOH溶液处理含H3PO3的废水,当溶液中c(Na+)= c( )+2c( )时,溶液呈 (填“酸”“碱”或“中”)性。
H3PO3+2NaOH ══ Na2HPO3+2H2O
5×10-4
中
(5)向某浓度的磷酸溶液中滴加NaOH溶液,其pH与溶液中H3PO4、
的物质的量分数δ(X)(平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离
子方程式是 。
(6)已知:常温下,Ksp(FePO4)=1.3×10-22、Ksp(AlPO4)=5.2×10-19。常温下,向含Fe3+、Al3+的混合溶液中滴加Na3PO4溶液,当FePO4、AlPO4同时生成时,溶液中c(Fe3+)∶c(Al3+)= 。
1∶(4×103)
同课章节目录
