适用于老高考旧教材2024版高考化学二轮复习专题5物质结构元素周期律课件(共103张PPT)
文档属性
| 名称 | 适用于老高考旧教材2024版高考化学二轮复习专题5物质结构元素周期律课件(共103张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-27 16:20:14 | ||
图片预览








文档简介
(共103张PPT)
专题五 物质结构 元素周期律
考情分析
高考命题分析
命 题 情 境 (1)生产环保情境:从酸雨、新型有机物结构式、催化剂、矿物主要元素组成等选材,设置特定的命题情境,考查考生解决问题的能力。
(2)学术探索情境:从人造放射性核素、考古研究、月球土壤分析等选材,开拓考生的学科视野,锤炼考生的学术思维,提高考生的创新能力。
(3)化学史料情境:作为考查载体的情境,最关键的是素材的真实性,试题情境最好取材于真实的文献资料、生产生活实际,要有丰富的数据作为支撑。要体现出情境素材的价值引领作用以及思维方法和态度责任等学科素养导向功能。
素 养 能 力 (1)理解与辨析能力:理解原子结构、核素中各微粒间的关系、原子核外电子排布规律、元素金属性与非金属性等,辨识模型、图表等信息,解决相关化学问题。
(2)分析与推测能力:运用碱金属元素、卤素性质递变规律推测同主族元素性质递变规律;运用第三周期元素的性质递变规律推测同一周期元素的性质递变规律。
(3)思维方法:根据原子结构、元素或相关物质的性质及转化规律,推断未知元素,并运用元素周期律及相关知识,推测有关物质的性质或递变规律的正误。
考题统计
(1)原子结构与核外电子排布:
(2023全国甲卷,11)(2023全国乙卷,10)(2022全国甲卷,12)(2022全国乙卷,11)(2021全国甲卷,11)(2021全国乙卷,11)(2020全国Ⅰ卷,11)(2020全国Ⅲ卷,13)(2019全国Ⅰ卷,13)(2019全国Ⅲ卷,9)
(2)化学键:
(2023全国甲卷,11)(2021全国甲卷,11)(2021全国乙卷,11)(2020全国Ⅱ卷,13)(2019全国Ⅲ卷,9)
(3)元素周期表和元素周期律:
(2023全国甲卷,11)(2023全国乙卷,10)(2022全国甲卷,12)(2022全国乙卷,11)(2021全国甲卷,11)(2021全国乙卷,11)(2020全国Ⅰ卷,11)(2020全国Ⅱ卷,13)(2020全国Ⅲ卷,13)(2019全国Ⅰ卷,13)(2019全国Ⅱ卷,9)(2019全国Ⅲ卷,9)
(4)元素综合推断:
(2023全国甲卷,11)(2023全国乙卷,10)(2022全国甲卷,12)(2022全国乙卷,11)(2021全国甲卷,11)(2021全国乙卷,11)(2020全国Ⅱ卷,13)(2020全国Ⅲ卷,13)(2019全国Ⅰ卷,13)(2019全国Ⅱ卷,9)(2019全国Ⅲ卷,9)
考点1原子结构与核外电子排布
聚焦核心要点
要点1原子结构、核素和同位素
课标指引:1.能画出1~20号元素的原子结构示意图。 2.知道元素、核素和同位素的含义。
1.原子构成
(1)构成原子的微粒及作用
(2)明确微粒间三个“数量”关系:
①中性原子:核电荷数=质子数=核外电子数=原子序数
②阴离子:核外电子数=质子数+所带的电荷数
③阳离子:核外电子数=质子数-所带的电荷数
微点拨
阴、阳离子电子层结构相同时,阴离子对应元素处于上一周期,阳离子对应元素处于下一周期。
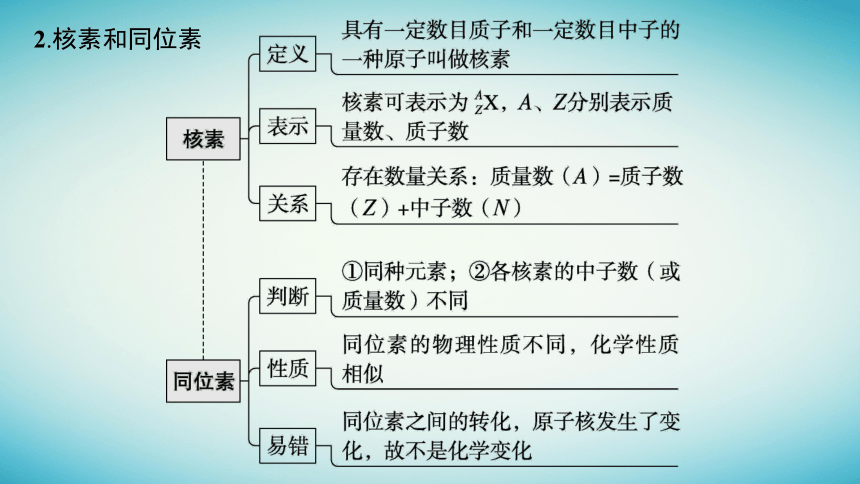
2.核素和同位素
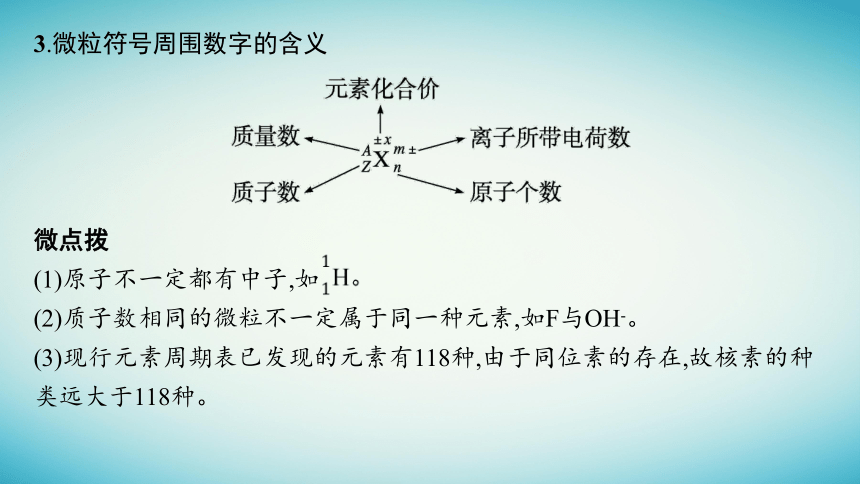
3.微粒符号周围数字的含义
微点拨
(1)原子不一定都有中子,如
(2)质子数相同的微粒不一定属于同一种元素,如F与OH-。
(3)现行元素周期表已发现的元素有118种,由于同位素的存在,故核素的种类远大于118种。
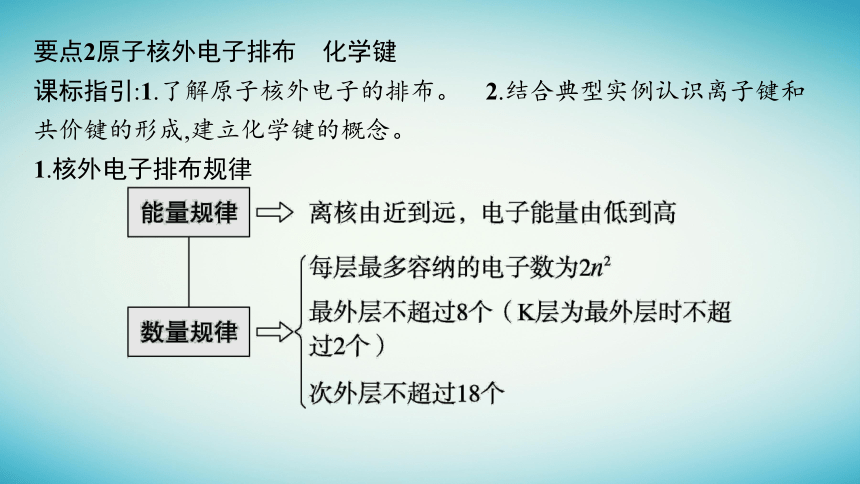
要点2原子核外电子排布 化学键
课标指引:1.了解原子核外电子的排布。 2.结合典型实例认识离子键和共价键的形成,建立化学键的概念。
1.核外电子排布规律
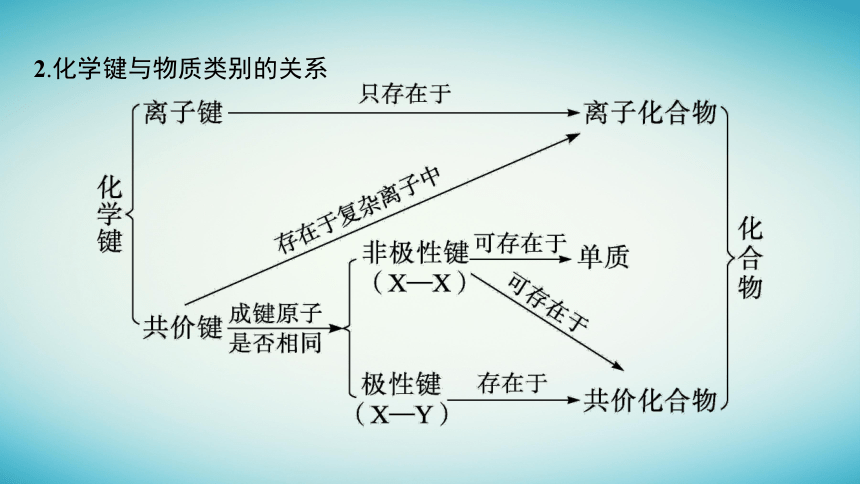
2.化学键与物质类别的关系
(1)从以上可以看出,离子化合物一定含有离子键,离子键只能存在于离子化合物中。
(2)共价键可存在于离子化合物、共价化合物和单质分子中。
单原子分子(如稀有气体),分子内不存在化学键
(3)熔融状态下能导电的化合物是离子化合物,如NaCl。熔融状态下不能导电的化合物是共价化合物,如HCl。
易错辨析
2.元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素。( )
3.某原子M层上电子数为L层电子数的4倍。( )
×
×
×
当M层上排有电子时,L层上一定排满了8个电子,而M层上最多只能排18个电子。
4.在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素有3种。( )
5.某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键。( )
√
第一周期H;第二周期Be;第三周期Al。
×
精研核心命题
命题点1核素和同位素
A. 的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
D
解析 原子轰击实验中,满足质子和质量数守恒,因此W+4=30+1,则W=27,X与Y原子之间质子数相差2,因X元素为金属元素,Y的质子数比X大,则Y与X位于同一周期,且Y位于X右侧,元素X、Y的最外层电子数之和为8,设X最外层电子数为a,则Y的最外层电子数为a+2,解得a=3,因此X为Al,Y为P 。
的质量数为27,则该原子相对原子质量为27,A错误;Al元素可形成AlCl3,P元素可形成PCl3,B正确;Al原子与P原子位于同一周期,且Al原子序数小于P原子序数,故原子半径Al>P,C错误;P的含氧酸有H3PO4、H3PO3、H3PO2等,D错误。
变式演练(2023·北京房山区一模)在考古研究中,通过分析铜器中82Pb(铅)同位素的比值,可以推断铜器是否同源。下列说法不正确的是( )
A.Pb是第五周期元素
B.204Pb含有中子数为122
C.可用质谱法区分204Pb和206Pb
D.Pb的原子半径比Ge大
A
解析 Pb是82号元素,属于第六周期元素,A错误;Pb是82号元素,Pb的质子数为82,则204Pb含有中子数为204-82=122,B正确;质谱法可准确测定物质的相对分子质量,204Pb和206Pb的质量数不同,故可以用质谱法区分,C正确;Pb和Ge是同主族元素,Pb是第六周期元素,Ge是第四周期元素,则Pb的原子半径比Ge大,D正确。
命题点2核外电子排布规律应用与化学键类型判断
典例2 (2021·全国甲卷)W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )
A.原子半径:Z>Y>X>W
B.W与X只能形成一种化合物
C.Y的氧化物为碱性氧化物,不与强碱反应
D.W、X和Z可形成既含有离子键又含有共价键的化合物
D
解析 短周期主族元素形成的常温下为气体的单质有:H2、N2、O2、F2、Cl2,由Z的最外层电子数是W和X最外层电子数之和并且是Y最外层电子数的2倍,可以推知W为H,X为N,Z为S,则Y为Al。四种元素的原子半径Al(Y)>S(Z)>N(X)>H(W),A项说法错误;W(H)与X(N)可以形成NH3、N2H4等多种化合物,B项说法错误;Y(Al)的氧化物Al2O3是两性氧化物,能与强碱反应,C项说法错误;W(H)、X(N)、Z(S)可以形成既含有离子键又含有共价键的化合物如(NH4)2S、NH4HS,D项说法正确。
变式演练(2023·四川成都一诊)短周期主族元素Q、X、Y、Z质子数之和为37,Q与X、Y、Z位于不同周期,Q与Z位于同一主族。X、Y、Z最外层电子数分别为x、y、z,且依次增大,x、y、z之和为15,x+z=2y。下列说法正确的是( )
A.Q是原子半径最小的元素
B.最高正价含氧酸的酸性:X>Y
C.XQ2分子中各原子最外层达到8电子结构
D.Z的氢化物不可能含有非极性共价键
C
解析 由题意,x、y、z之和为15,x+z=2y,可推知y=5,x=3或4,z=7或6,又由Q、X、Y、Z质子数之和为37,Q与X、Y、Z位于不同周期,Q与Z位于同一主族,可推出X为C,Y为N,Z为O,Q为S。根据元素周期律,同周期元素,原子序数越大,原子半径越小;同主族元素,原子序数越大,原子半径越大,得Z是原子半径最小的元素,A错误;同周期元素的非金属性随原子序数的增大而逐渐增强,元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性X训练分层落实
练真题·明考向
1.(2021·全国乙卷)我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )
A.原子半径大小顺序为W>X>Y>Z
B.化合物XW中的化学键为离子键
C.Y单质的导电性能弱于Z单质的
D.Z的氧化物的水化物的酸性强于碳酸
B
解析 由于X、Y、Z为同周期相邻元素,因此它们的最外层电子数之和必然是3的倍数并且小于15。假设是12,则X、Y、Z最外层电子数依次为3、4、5,W的最外层电子数为3,则W与X同族,与题意不符;假设是9,则X、Y、Z最外层电子数依次为2、3、4,W的最外层电子数为6,符合题意。由W、X、Y、Z的原子序数依次增大可知,W、X、Y、Z分别是O、Mg、Al、Si。原子半径:Mg>Al>Si>O,即X>Y>Z>W,A错误;MgO是由离子键构成的化合物,B正确;Al是导体,而Si是半导体,Al的导电性强于Si,C错误;Si的最高价氧化物的水化物为H2SiO3,其酸性弱于碳酸,D错误。
B
练易错·避陷阱
D
4.(2023·四川凉山州二诊)短周期主族元素W、X、Y、Z的原子序数依次增大。W与X不在同周期,X原子的最外层电子数与核外电子总数之比为3∶4,Y、Z相邻,Y的单质在空气中燃烧,产物有两种离子化合物和一种单质。下列说法错误的是( )
A.简单离子的半径:X>Y>Z
B.工业上常用电解熔融YX的方法制备Y单质
C.Z2(SO4)3溶液是泡沫灭火器原料之一,原理利用了Z离子的水解
D.X的某氢化物可作为杀菌消毒剂
B
解析 短周期主族元素W、X、Y、Z的原子序数依次增大,X原子的最外层电子数与核外电子总数之比为3∶4,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,则X为O元素;W与X不在同周期,则W为H元素;Y的单质在空气中燃烧,产物有两种离子化合物和一种单质,反应产物为氧化镁、氮化镁和碳,则Y为Mg元素;Y、Z相邻,则Z为Al元素。O2-、Mg2+、Al3+的核外电子排布相同,核电荷数越大离子半径越小,则简单离子的半径:O2->Mg2+>Al3+,即X>Y>Z,A正确;MgO的熔点较高,工业上常用电解熔融氯化镁的方法制备镁,B错误;Al2(SO4)3溶液是泡沫灭火器原料之一,原理是 与Al3+发生相互促进的水解生成氢氧化铝沉淀和二氧化碳、水,利用了Al3+的水解,C正确;X为O,氢化物H2O2可作为杀菌消毒剂,D正确。
练预测·押考向
D
6.(2023·宁夏吴忠青铜峡高中期中)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y元素的最高正价和最低负价代数和为零;Z的非金属性在同周期元素中最强。下列说法正确的是( )
A.对应简单离子半径:WB.化合物XZW既含离子键,又含共价键
C.对应最简单气态氢化物的稳定性:Y>Z
D.Y的氧化物不能和X的最高价氧化物的水化物反应
B
解析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,其质子数=18-10=8,则W为O元素;X和Ne原子的核外电子数相差1,原子半径大于O,则X为Na;Y的最高正价和最低负价之和为零,原子序数大于Na,处于第三周期ⅣA族,则Y为Si;Z的非金属性在同周期元素中最强,原子序数大于Si,则Z为Cl。O2-、Na+电子层结构相同,核电荷数越大离子半径越小,则离子半径O2->Na+,A错误;化合物NaClO中Na+与ClO-之间形成离子键,ClO-中氯原子与氧原子之间形成共价键,B正确;Y为Si、Z为Cl,非金属性Si考点2元素周期表 元素周期律
聚焦核心要点
要点1元素周期表
课标指引:1.知道元素周期表的结构。 2.体会元素周期表在学习元素化合物知识和科学研究中的重要作用。
1.强化记忆元素周期表的结构
2.利用区间定位推断元素
对于原子序数较大的元素,可采用区间定位确定元素。
元素周期表中各族序数的排列顺序从左到右依次为ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0,牢记各周期对应的0族元素的原子序数,可以快速确定元素所在的周期数。
周期 一 二 三 四 五 六 七
起止序数 1~2 3~10 11~18 19~36 37~54 55~86 87~118
要点2元素周期律
课标指引:1.以第三周期的钠、镁、铝、硅、磷、硫、氯,以及碱金属和卤族元素为例,了解同周期和同主族元素性质的递变规律。 2.体会元素周期律在学习元素化合物知识和科学研究中的重要作用。
1.掌握元素的金属性和非金属性强弱的判断方法
2.熟记同周期(主族)元素原子结构和元素性质的变化规律
类型 同周期(左→右) 同主族(上→下)
原子结构 核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 逐渐减小 逐渐增大
离子半径 阳离子逐渐减小,阴离子逐渐减小,且r(阴离子)>r(阳离子) 逐渐增大
类型 同周期(左→右) 同主族(上→下)
元素性质 化合价 最高正化合价:+1→+7(O、F除外) 负化合价=-(8-主族序数) 相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性 金属性逐渐减弱非金属性逐渐增强 金属性逐渐增强
非金属性逐渐减弱
气态氢化物的稳定性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸性(或碱性) 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强
酸性逐渐减弱
离子的氧化性、还原性 阳离子氧化性逐渐增强,阴离子还原性逐渐减弱 阳离子氧化性逐渐减弱,阴离子还原性逐渐增强
3.通过“三看”比较微粒半径大小
在中学化学要求的范围内,可按“三看”规律来比较粒子半径的大小:
易错辨析
1.两短周期元素原子序数相差8,则周期数一定相差1。( )
2.原子及离子的核外电子层数等于该元素所在的周期数。( )
3.元素周期表中位于金属与非金属分界线附近的元素属于过渡元素。( )
4.热稳定性:SiH4>PH3>H2S。( )
5.酸性:HClO4>H2SO4>H3PO4。( )
√
×
×
×
非金属性:S>P>Si,则简单氢化物的稳定性:H2S>PH3>SiH4。
√
精研核心命题
命题点1元素周期表与元素周期律
典例1 (2019·全国Ⅱ卷)2019年是门捷列夫发现元素周期律150周年。如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:WB.常温常压下,Y单质为固态
C.气态氢化物热稳定性:ZD.X的最高价氧化物的水化物是强碱
W
X Y Z
D
解析 由题中信息和图示可知W位于第二周期,X、Y、Z位于第三周期,结合W与X的最高化合价之和为8,且族序数相差2,可知X为Al,W和Z分别为N和P,Y为Si。原子半径:N变式演练(2023·广东梅州联考)X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X Y
Z W
A.简单离子半径:W>Z
B.X的气态氢化物稳定性强于Y的气态氢化物
C.W的最高价氧化物对应的水化物酸性比Z的弱
D.含X的某些盐可作为化肥使用,保障农作物增产
D
解析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在元素周期表中的相对位置可知,X为氮元素,Z为硫元素,W为氯元素。电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;简单离子半径:WZ,非金属性越强,最高价氧化物对应水化物的酸性越强,所以W的最高价氧化物对应的水化物的酸性比Z的强,C错误;含X的某些盐可作为氮肥使用,保障农作物增产,D正确。
命题点2“位—构—性”综合应用
典例2 (2023·全国乙卷)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子X2-与Y2+具有相同的电子结构。下列叙述正确的是( )
A.X的常见化合价有-1、-2
B.原子半径大小为Y>X>W
C.YX的水合物具有两性
D.W单质只有4种同素异形体
A
解析 X2-与Y2+具有相同的电子结构,W、X、Y为短周期元素,符合条件的短周期元素X、Y分别为O、Mg,结合原子序数关系和矿物可溶于稀盐酸且有无色无味气体生成,则可推出W为碳元素。氧元素常见化合价有-1、-2价,A正确;原子半径Mg>C>O(Y>W>X),B错误;MgO的水合物(即水化物)Mg(OH)2不具有两性,C错误;碳单质有金刚石、石墨、C60、C70、石墨烯等多种同素异形体,D错误。
【思维建模】
解答“位—构—性”的关系及应用类题目的方法
训练分层落实
练真题·明考向
1.(2022·广东卷)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示;戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( )
A.原子半径:丁>戊>乙
B.非金属性:戊>丁>丙
C.甲的氢化物遇氯化氢一定有白烟产生
D.丙的最高价氧化物对应的水化物一定能与强碱反应
C
解析 根据题干信息,戊的最高价氧化物对应的水化物为强酸,在短周期元素中,符合此条件的可以是S或Cl。如果戊为S元素,则甲、乙、丙、丁分别为C、O、Si、P元素;如果戊为Cl元素,则甲、乙、丙、丁分别为N、F、P、S元素。但无论戊是什么元素,同周期的主族元素,原子序数越大,半径越小,原子半径:丁>戊;同主族元素的原子序数越大,半径越大,原子半径:戊>乙,则原子半径:丁>戊>乙,A项正确,不符合题意;无论戊是什么元素,同周期主族元素的原子序数越大,非金属性越强,因此非金属性:戊>丁>丙,B项正确,不符合题意;若戊为S元素,则甲为C元素,甲的氢化物如甲烷遇氯化氢无白烟产生,C项错误,符合题意;不论丙是Si元素还是P元素,其最高价氧化物对应的水化物均为酸,均可以与强碱反应,D项正确,不符合题意。
2.(2018·全国Ⅲ卷)W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是( )
A.原子半径大小为WB.X的氢化物水溶液酸性强于Z的
C.Y2W2与ZW2均含有非极性共价键
D.标准状况下W的单质状态与X的相同
D
解析 由题可知W是氧、Y是钠、Z是氯。X和Z同族,则X是氟。标准状况下,O2、O3与F2均为气体,D项正确;原子半径大小应为X练易错·避陷阱
3.(2023·福建宁德联考)T、Q、R、W四种元素在元素周期表中所处位置如图,已知W能与氧元素形成化合物WO2,WO2中氧的质量分数为50%,且W原子中质子数等于中子数。下列说法错误的是( )
A.简单气态氢化物的稳定性:QB.T的最高价氧化物能与强酸溶液反应
C.WO2有毒,不能添加到任何饮品中
D.Q与氧元素形成的化合物的种类不止一种
Q R
T W
C
解析 W能与氧元素形成化合物WO2,WO2中氧的质量分数为50%,则W的相对原子质量为32,W原子中质子数等于中子数,则W的质子数为16,W是S元素;根据T、Q、R、W四种元素在元素周期表中所处位置,可知T、Q、R分别是Al元素、C元素、N元素。同周期元素从左到右非金属性增强,简单气态氢化物的稳定性增强,则稳定性:CH44.(2023·江苏盐城联考)已知X、Y、Z、W、R五种元素中,X是宇宙中最丰富的元素,Y元素原子最外层电子数是内层电子总数的2倍;Z元素原子最外层电子数比其次外层电子数多4;W元素原子K层和M层电子总数比其L层电子数多1;R元素原子最外层有1个电子,其阳离子与Z的阴离子核外电子总数相同。下列说法中正确的是( )
A.上述五种原子中一定都含有质子、电子和中子
B.X、Y、Z只能形成一种化合物
C.YZ2对应水化物的酸性较HClO强
D.可用pH试纸测定W的水溶液的pH
C
解析 X是宇宙中最丰富的元素,则X为H元素,Y元素原子最外层电子数是内层电子总数的2倍说明Y只有2层电子,电子排布为2、4,则Y为C元素;Z元素原子最外层电子数比其次外层电子数多4,电子排布为2、6,则Z为O元素;W元素原子K层和M层电子总数比其L层电子数多1,说明W有3层电子,电子排布为2、8、7,则W为Cl元素;R元素原子最外层有1个电子,其阳离子与Z的阴离子核外电子总数相同即为10,则R为Na元素。X为H原子,质子数为1,中子数为0,A错误;H、C、O能形成H2CO3、H2C2O4等多种化合物,B错误;CO2对应水化物H2CO3的酸性较HClO强,C正确;W为Cl元素,氯水具有漂白性,能漂白pH试纸,不能用pH试纸测定氯水溶液的pH,D错误。
练预测·押考向
5.(2023·陕西榆林一模)短周期主族元素X、Y、Z、W、R的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液中,却不溶于其浓溶液。下列说法正确的是( )
A.简单离子半径:R>W>X>Y>Z
B.Y与W具有相同的最高化合价
C.Z、W的简单离子都能促进水的电离
D.往元素X的最简单氢化物的稀溶液中滴加酚酞,无明显变化
C
解析 常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液中,却不溶于其浓溶液,可联想到Al在浓硝酸、浓硫酸中的钝化,则Z应为Al元素,W的原子序数大于Al,则W为S元素,R为原子序数大于S的短周期主族元素,则为Cl元素;X的气态氢化物极易溶于Y的氢化物中,且X的原子序数小于Y,应是指氨极易溶于水,所以X为N元素,Y为O元素。核外电子排布相同时,原子序数越小半径越大,另外电子层数越多,半径越大,故简单离子半径:W>R>X>Y>Z,A错误;W为S元素,Y为O元素,S的最高化合价为+6价,O不能失去最外层的6个电子,没有+6价,最高化合价不同,B错误;Z、W的简单离子分别为铝离子、硫离子,都可以水解,促进水的电离,C正确;由分析可知,X为N元素,N的气态氢化物为NH3,其水溶液显碱性,滴加酚酞,溶液显红色,D错误。
6.(2023·江西南昌统考二模)元素周期表中前20号元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,X的简单离子半径在同周期元素中最小。由这四种元素组成一种化合物Q,在Q的溶液中滴加Ba(OH)2溶液,产生沉淀的物质的量与Ba(OH)2的物质的量的关系如图所示,下列说法正确的是( )
A.简单离子半径:Z>Y
B.简单气态氢化物的热稳定性:Y>R
C.Q的水溶液显酸性,可作为净水剂
D.M点沉淀物有2种,且物质的量之比为4∶1
C
解析 元素周期表中前20号元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,X的简单离子半径在同周期元素中最小。由这四种元素组成一种化合物Q,在Q的溶液中滴加Ba(OH)2溶液,产生沉淀的物质的量与Ba(OH)2的物质的量的关系如题图所示,则X为Al元素,1 mol氢氧化钡会溶解2 mol氢氧化铝,但实际只减少1 mol沉淀,说明还生成了另外的1 mol沉淀,加入3 mol氢氧化钡会生成2 mol氢氧化铝沉淀和3 mol其他沉淀,则另外3 mol沉淀是硫酸钡或碳酸钡沉淀,又根据R和Y位于同主族,则R为O元素,Y为S元素,Z为K元素,Q为硫酸铝钾。根据同电子层结构“核多径小”,则简单离子半径:Y>Z,A错误;根据非金属性越强,其气态氢化物越稳定,则简单气态氢化物的热稳定性:R>Y,B错误;Q为硫酸铝钾,铝离子水解生成氢氧化铝和氢离子,因此其水溶液显酸性,可作为净水剂,C正确;M点沉淀物有2种,由图中量的关系可知,2 mol硫酸铝钾溶液中加入3 mol氢氧化钡得到3 mol硫酸钡和2 mol氢氧化铝,其物质的量之比为3∶2,D错误。
突破高考题型(五)元素推断及元素“位—构—性”
的综合考查
高考指引:近几年来,每一年的全国卷中的化学选择题都考查了元素综合推断与元素周期律的综合题,有关“位—构—性”的互相推断,实质是元素周期表和元素周期律的具体应用的体现,主要考查元素化合物的性质、原子半径的比较、元素周期律等,侧重考查考生的“理解与辨析能力”“分析与推测能力”“归纳与论证能力”等关键能力。
1.审题关注什么
仔细审读题给信息,根据原子结构、元素周期表的知识及已知元素化合物的性质,可推断元素,判断元素在周期表中的位置等,基本思路如下:
2.题目考什么
(1)已知元素原子(离子)的核外电子排布推断元素
核外电子排布 电子层数和最外层电子数 周期序数和族序数 单质及化合物的性质
(2)已知单质或化合物的特性推断元素
(3)已知元素在周期表中的位置推断元素
3.规避元素推断的误区
突破点1 依据核外电子排布进行元素综合推断
核心归纳
1.短周期元素原子核外电子排布的特征
最外层电子数等于次外层电子数→Ar、Be
电子层数与最外层电子数相等→Al、Be
最外层电子数是内层电子总数的一半→P、Li
次外层电子数是最外层电子数的2倍→Si、Li
电子层数是最外层电子数的2倍→Li
最外层电子数是电子层数的2倍→S、C
最外层电子数是次外层电子数的2倍→C
最外层电子数是次外层电子数的3倍→O
最外层电子数是次外层电子数的4倍→Ne
2.寻找“10电子”粒子和“18电子”粒子的方法
(1)“10电子”粒子
(2)“18电子”粒子
真题感悟
1.(2023·全国甲卷)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径:X>W
B.简单氢化物的沸点:XC.Y与X可形成离子化合物
D.Z的最高价含氧酸是弱酸
C
解析 WX2是形成酸雨的物质之一,结合原子序数关系可知W、X分别为N、O;Y的最外层电子数与其K层电子数相等,则Y是Mg;四种元素最外层电子数之和为19,故Z最外层电子数为6,结合原子序数可知Z为S元素。四种元素在元素周期表中的位置关系如下图。
…… N(W) O(X)
Mg(Y) …… S(Z)
根据元素周期律:原子半径W>X,A项错误;H2O分子间形成氢键导致其沸点比H2S的沸点高,B项错误;Mg(Y)与O(X)可以形成离子化合物MgO,C项正确;H2SO4是强酸,D项错误。
2.(2022·全国甲卷)Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍。下列说法正确的是( )
A.非金属性:X>Q
B.单质的熔点:X>Y
C.简单氢化物的沸点:Z>Q
D.最高价含氧酸的酸性:Z>Y
D
解析 由题意可知,Q为第二周期元素,X、Y、Z为第三周期元素,再依据Y原子最外层电子数是Q原子内层电子数的2倍,可推知Y为Si元素,由“X、Y相邻”,且X的原子序数小于Y,可推知X为Al元素,最后依据原子序数的大小关系和四种元素最外层电子数之和为19可推知,若Q为O元素,则Z为S元素;若Q为N元素,则Z为Cl元素;若Q为F元素,则Z为P元素。非金属性:AlSi(或Cl>Si或P>Si),所以最高价含氧酸的酸性:H2SO4>H2SiO3(或HClO4>H2SiO3或H3PO4>H2SiO3),D项正确。
考向预测
1.(2023·陕西榆林第四次模拟)X、Y、Z、W为原子序数依次增大的短周期主族元素。X、Y为相邻元素,X、W为同主族元素,X、Y的最外层电子数之差等于Z的最外层电子数,在地壳中W的含量仅次于氧元素。下列说法正确的是( )
A.Y的最简单氢化物的水溶液呈酸性
B.原子半径:Z>Y>W
C.W位于元素周期表第三周期第ⅥA族
D.X、Y的氧化物均不止一种
D
解析 地壳中元素的含量O>Si>Al>Fe>Ca,则W为Si元素,X、W为同主族短周期元素,X为C元素,X、Y为相邻元素,X、Y的最外层电子数之差等于1,为Z的最外层电子数,Z为Na元素,Y为N元素。Y的简单氢化物为氨,水溶液呈碱性,A错误;Z为Na元素,Y为N元素,W为Si元素,则原子半径:Na>Si>N,B错误;W为Si元素,位于第三周期第ⅣA族,C错误;C的氧化物有CO、CO2,N的氧化物有NO、NO2、N2O、N2O3、N2O5等,D正确。
2.(2023·江西龙南中学二模)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
B
解析 a、b、c、d分别为O、Na(或Mg)、Al、S。A项,原子半径b>c>d>a,错误;B正确;C项,c的氧化物的水化物为氢氧化铝,为两性氢氧化物,不是强碱,错误;D项,S的氧化性比氧气的氧化性弱,错误。
突破点2 依据元素周期表的片段进行元素综合推断
核心归纳
元素周期表片段结构型推断题一般给出两种信息:
一是给出局部的元素周期表,展示出几种不同元素的相对位置。
二是给出某种元素的位置特征、原子结构特征或由该元素形成的单质或化合物的特殊性质。解答此类题目时,首先根据给出的某种元素的特殊结构或性质,确定该元素在元素周期表中的位置,然后以此为“坐标原点”,根据其他元素与该元素的位置关系,进而确定其他未知的元素。
真题感悟
(2017·全国Ⅲ卷)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W X
Y Z
A.氢化物沸点:WB.氧化物对应水化物的酸性:Y>W
C.化合物熔点:Y2X3D.简单离子的半径:YD
解析 根据短周期元素W、X、Y和Z在周期表中的相对位置可知四种元素位于第二、三周期,又知这四种元素原子的最外层电子数之和为21,可设Y的最外层电子数为x,则有x+(x+2)+(x+3)+(x+4)=21,x=3,所以W、X、Y、Z依次为N、O、Al、Cl。A项,NH3分子之间存在氢键,故沸点:NH3>HCl,错误;B项,Y的氧化物对应水化物为Al(OH)3,W的氧化物对应水化物若为HNO3,则HNO3酸性强于Al(OH)3,错误;C项,Al2O3是冶炼金属铝的原料,也是一种比较好的耐火材料,熔点高于AlCl3,错误;D项,O2-与Al3+的电子层结构相同,但O2-的核电荷数少,故其半径较大,正确。
考向预测
(2023·北京顺义区一模)如表为元素周期表的一部分,其中X、Y、W、Z为短周期元素,W的单质常温下为黄绿色气体。下列说法不正确的是( )
Y Z
X W
R T
A.X、Y的单质均存在同素异形体
B.Y、Z的简单氢化物的稳定性依次递增
C.R的单质可用于制造半导体材料
D.工业上电解NaW溶液得W2可使用阴离子交换膜
D
解析 W的单质常温下为黄绿色气体,则W为Cl元素,由元素在周期表中的位置可知,X为P元素,Y为O元素,Z为F元素,R为Ge元素,T为Br元素。P对应的同素异形体有红磷、白磷等,O对应的同素异形体有氧气、臭氧等,A正确;同周期主族元素从左到右元素的非金属性增强,元素的非金属性越强,对应的氢化物越稳定,故Y、Z的简单氢化物的稳定性依次递增,B正确;Ge和Si位于同一主族,为重要的半导体材料,C正确;工业上电解饱和食盐水可制得Cl2,Cl2在阳极生成,NaOH在阴极生成,若使用阴离子交换膜,则OH-会从阴极向阳极移动,消耗Cl2,D错误。
突破点3 依据元素成键情况进行元素综合推断
核心归纳
注意陌生物质中各原子的成键情况和化合价等信息。
①化学键信息:如能形成4个共价键的元素为C、Si等,能形成2个共价键的元素为O、S等,能形成1个共价键的元素为H等。
②根据形成的简单阴、阳离子可确定原子的最外层电子数,如X2+和Y2-,即X、Y原子最外层电子数分别为2和6。
③化合价信息:化合物中各元素化合价的代数和为0,结合某些常见元素的化合价或化学键等,可确定未知元素的化合价,间接确定最外层电子数目。
真题感悟
1.(2020·全国Ⅱ卷)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是( )
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
D
解析 根据题意可知Z的原子序数是W、X、Y、Z四种元素中最大的,Z能形成+1价离子,可初步判断Z为钠元素;W的原子序数是W、X、Y、Z四种元素中最小的,W与X、Y均以一个单键结合,可初步判断W为氢元素;根据W、X、Y、Z的原子序数之和为24,可知X、Y的原子序数之和为12,结合成键特点,可判断X、Y分别是硼、氮元素。H、B、N形成的阴离子中,各原子均以共价键结合,A正确;Na单质能与H2O、CH3OH反应,B正确;N元素最高价氧化物的水化物HNO3为强酸,C正确;BF3中硼原子最外层有6个电子,D错误。
2.(2019·全国Ⅰ卷)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
C
解析 由题给化合物的结构可知,W为第ⅠA族金属元素;Z最外层有7个电子,由“Z核外最外层电子数是X核外电子数的一半”可知,X核外电子数为14,即X为硅元素;由四种元素为同一短周期元素可知,W为钠元素;Z为氯元素;Y为P元素。NaCl的水溶液呈中性,A项错误;元素非金属性的顺序为Z(Cl)>Y (P)>X(Si),B项错误;P的最高价氧化物的水化物为磷酸,是中强酸,C项正确;P原子最外层有5个电子,与Si共用两对电子,加上得到Na的1个电子,因此最外层满足8电子稳定结构,D项错误。
考向预测
1.(2023·内蒙古呼和浩特二模)短周期主族元素A、B、C、D、E的原子序数依次增大,由这五种元素组成的一种化合物M是一种高效消毒剂,M的结构式如图所示。下列说法不正确的是( )
A.原子半径D>E>C
B.简单氢化物稳定性C>B>A
C.C与D形成的化合物仅含有离子键
D.工业上采用电解DE的饱和水溶液制备E的单质
C
解析 短周期主族元素A、B、C、D、E的原子序数依次增大,由M的结构式可知,D为带1个单位正电荷的阳离子,结合原子序数可知D为Na元素;E只能形成1个共价单键,且原子序数最大,E为Cl元素;C能形成2个共价键,则C为O元素,A能形成4个共价键、B能形成3个共价键,且短周期主族元素A、B、C、D、E的原子序数依次增大,则A为C元素,B为N元素。原子半径Na>Cl>O,即D>E>C,A正确;非金属性O>N>C,则简单氢化物稳定性H2O>NH3>CH4,即C>B>A,B正确;Na元素与O元素形成的化合物Na2O中仅含有离子键,但Na2O2中既有离子键又有共价键,C错误;工业上采用电解DE即NaCl的饱和水溶液制备E的单质即Cl2,反应方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,D正确。
2.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A.原子半径大小:Q>Z>Y
B.该化合物中Y原子不满足8电子稳定结构
C.该化合物中,W、X、Y、Z、Q之间均为共价键
D.Q元素对应的单质能与水反应
D
解析 短周期主族元素W、X、Y、Z、Q原子序数依次增大,W的原子半径在周期表中最小,则W为H元素;由图示化合物的结构可知,X为第ⅣA族元素,Y为第ⅤA族元素,Q为第ⅠA族元素,Z为第ⅥA族元素,且Z核外最外层电子数与X核外电子总数相等,结合原子序数大小可知,X为C元素,Y为N元素,Z为O元素,Q为Na元素。主族元素同周期从左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径:Na>N>O,A错误;该化合物中Y原子即N原子形成3对共用电子对之后满足8电子稳定结构,B错误;该化合物中含有离子键,C错误;钠与水反应生成氢氧化钠和氢气,D正确。
突破点4 依据元素及其化合物的性质或转化关系进行元素综合推断
核心归纳
常考短周期元素的主要化合物的特性
(1)形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C。
(2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3)地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:O。
(4)等物质的量的单质最轻的元素:H;等物质的量的最轻的金属单质:Li。
(5)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
(6)元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
(7)具有漂白性的物质:氯水、二氧化硫、过氧化钠、双氧水(H2O2)。
真题感悟
1.(2020·全国Ⅲ卷)W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )
A.非金属性:W>X>Y>Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物的水化物为强碱
D
解析 根据“化合物XW3与WZ相遇会产生白烟”可先推测W为氢元素,X为氮元素,Z为氯元素,再依据四种元素的核外电子总数满足X+Y=W+Z推知,Y为钠元素,上述推断出的元素也满足了“W、X、Y、Z为原子序数依次增大的短周期元素”这一条件。非金属性:Cl>N>H>Na,A项错误;原子半径:Na>Cl>N>H,B项错误;HNO2不属于强酸,C项错误;NaOH属于强碱,D项正确。
2.(2016·全国Ⅰ卷)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。
下列说法正确的是( )
A.原子半径的大小WB.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
C
解析 由n是元素Z的单质,通常为黄绿色气体,可知Z为Cl元素,n为Cl2,再根据q的水溶液具有漂白性,可知q为HClO,由0.01 mol·L-1 r溶液的pH为2,可判断r为一元强酸,则r为HCl,然后根据n和p的反应条件,以及s通常是难溶于水的混合物,可知p为烷烃,s为烷烃的氯代物;根据题意,W、X、Y、Z是短周期原子序数依次增加的四种元素,可进一步推知W、X、Y、Z分别为H元素、C元素、O元素、Cl元素。A项,根据原子半径的变化规律,可知原子半径:HC,再由CCl4、ClO2中化合价的正负,可知非金属性:O>Cl>C,错误;C项,氧的氢化物可能为H2O或H2O2,常温常压下二者均为液态,正确;D项,碳的最高价氧化物的水化物H2CO3为弱酸,错误。
考向预测
1.(2023·山东青岛期中)短周期主族元素a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,w溶液可使酚酞溶液显红色。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小:aC.简单氢化物的沸点:b>d
D.y、w溶于水,破坏的化学键类型完全相同
C
解析 短周期主族元素a、b、c、d的原子序数依次增大,四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,则z为SO2或NO2,由于N2化学性质稳定,可知z为SO2,由于原子序数bH2S,C正确;y为Na2O2,溶于水生成氢氧化钠和氧气,破坏离子键和共价键,而w为NaOH或Na2CO3,溶于水,只破坏离子键,D错误。
2.短周期主族元素W、X、Y、Z的原子序数依次增大,某研究团队以mY2X3·nZX2(固态物质)为载体,利用Au-Pd纳米颗粒催化气态单质W2、X2合成W2X2,其原理如图所示。下列说法正确的是( )
A.简单离子半径:XB.化合物ZW4中原子均满足最外层8电子结构
C.Y2X3、ZX2均具有较高熔点
D.工业上常用电解Y的氯化物的方法冶炼Y
C
解析 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X都能形成双原子分子,单质为气体,且二者能结合成化合物W2X2、W2X,由图可知W原子半径小于X的,则W为H元素,X为O元素;由固态化合物Y2X3、ZX2及ZW4中元素的化合价,可知Z显-4或+4价,又Z的原子序数比O的大,则Z为Si元素,Y显+3价且原子序数大于O小于Si,则Y为Al元素。O2-与Al3+的电子层结构相同,但Al的核电荷数大,则简单离子半径:O2->Al3+,A错误;化合物ZW4为SiH4,Si原子满足最外层8电子结构,但H原子不满足最外层8电子结构,B错误;Y2X3、ZX2分别为Al2O3、SiO2,均具有较高熔点,C正确;工业上冶炼Al时,常用电解熔融Al2O3的方法,D错误。
专题五 物质结构 元素周期律
考情分析
高考命题分析
命 题 情 境 (1)生产环保情境:从酸雨、新型有机物结构式、催化剂、矿物主要元素组成等选材,设置特定的命题情境,考查考生解决问题的能力。
(2)学术探索情境:从人造放射性核素、考古研究、月球土壤分析等选材,开拓考生的学科视野,锤炼考生的学术思维,提高考生的创新能力。
(3)化学史料情境:作为考查载体的情境,最关键的是素材的真实性,试题情境最好取材于真实的文献资料、生产生活实际,要有丰富的数据作为支撑。要体现出情境素材的价值引领作用以及思维方法和态度责任等学科素养导向功能。
素 养 能 力 (1)理解与辨析能力:理解原子结构、核素中各微粒间的关系、原子核外电子排布规律、元素金属性与非金属性等,辨识模型、图表等信息,解决相关化学问题。
(2)分析与推测能力:运用碱金属元素、卤素性质递变规律推测同主族元素性质递变规律;运用第三周期元素的性质递变规律推测同一周期元素的性质递变规律。
(3)思维方法:根据原子结构、元素或相关物质的性质及转化规律,推断未知元素,并运用元素周期律及相关知识,推测有关物质的性质或递变规律的正误。
考题统计
(1)原子结构与核外电子排布:
(2023全国甲卷,11)(2023全国乙卷,10)(2022全国甲卷,12)(2022全国乙卷,11)(2021全国甲卷,11)(2021全国乙卷,11)(2020全国Ⅰ卷,11)(2020全国Ⅲ卷,13)(2019全国Ⅰ卷,13)(2019全国Ⅲ卷,9)
(2)化学键:
(2023全国甲卷,11)(2021全国甲卷,11)(2021全国乙卷,11)(2020全国Ⅱ卷,13)(2019全国Ⅲ卷,9)
(3)元素周期表和元素周期律:
(2023全国甲卷,11)(2023全国乙卷,10)(2022全国甲卷,12)(2022全国乙卷,11)(2021全国甲卷,11)(2021全国乙卷,11)(2020全国Ⅰ卷,11)(2020全国Ⅱ卷,13)(2020全国Ⅲ卷,13)(2019全国Ⅰ卷,13)(2019全国Ⅱ卷,9)(2019全国Ⅲ卷,9)
(4)元素综合推断:
(2023全国甲卷,11)(2023全国乙卷,10)(2022全国甲卷,12)(2022全国乙卷,11)(2021全国甲卷,11)(2021全国乙卷,11)(2020全国Ⅱ卷,13)(2020全国Ⅲ卷,13)(2019全国Ⅰ卷,13)(2019全国Ⅱ卷,9)(2019全国Ⅲ卷,9)
考点1原子结构与核外电子排布
聚焦核心要点
要点1原子结构、核素和同位素
课标指引:1.能画出1~20号元素的原子结构示意图。 2.知道元素、核素和同位素的含义。
1.原子构成
(1)构成原子的微粒及作用
(2)明确微粒间三个“数量”关系:
①中性原子:核电荷数=质子数=核外电子数=原子序数
②阴离子:核外电子数=质子数+所带的电荷数
③阳离子:核外电子数=质子数-所带的电荷数
微点拨
阴、阳离子电子层结构相同时,阴离子对应元素处于上一周期,阳离子对应元素处于下一周期。
2.核素和同位素
3.微粒符号周围数字的含义
微点拨
(1)原子不一定都有中子,如
(2)质子数相同的微粒不一定属于同一种元素,如F与OH-。
(3)现行元素周期表已发现的元素有118种,由于同位素的存在,故核素的种类远大于118种。
要点2原子核外电子排布 化学键
课标指引:1.了解原子核外电子的排布。 2.结合典型实例认识离子键和共价键的形成,建立化学键的概念。
1.核外电子排布规律
2.化学键与物质类别的关系
(1)从以上可以看出,离子化合物一定含有离子键,离子键只能存在于离子化合物中。
(2)共价键可存在于离子化合物、共价化合物和单质分子中。
单原子分子(如稀有气体),分子内不存在化学键
(3)熔融状态下能导电的化合物是离子化合物,如NaCl。熔融状态下不能导电的化合物是共价化合物,如HCl。
易错辨析
2.元素周期表中镧系元素和锕系元素都占据同一格,它们是同位素。( )
3.某原子M层上电子数为L层电子数的4倍。( )
×
×
×
当M层上排有电子时,L层上一定排满了8个电子,而M层上最多只能排18个电子。
4.在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素有3种。( )
5.某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键。( )
√
第一周期H;第二周期Be;第三周期Al。
×
精研核心命题
命题点1核素和同位素
A. 的相对原子质量为26
B.X、Y均可形成三氯化物
C.X的原子半径小于Y的
D.Y仅有一种含氧酸
D
解析 原子轰击实验中,满足质子和质量数守恒,因此W+4=30+1,则W=27,X与Y原子之间质子数相差2,因X元素为金属元素,Y的质子数比X大,则Y与X位于同一周期,且Y位于X右侧,元素X、Y的最外层电子数之和为8,设X最外层电子数为a,则Y的最外层电子数为a+2,解得a=3,因此X为Al,Y为P 。
的质量数为27,则该原子相对原子质量为27,A错误;Al元素可形成AlCl3,P元素可形成PCl3,B正确;Al原子与P原子位于同一周期,且Al原子序数小于P原子序数,故原子半径Al>P,C错误;P的含氧酸有H3PO4、H3PO3、H3PO2等,D错误。
变式演练(2023·北京房山区一模)在考古研究中,通过分析铜器中82Pb(铅)同位素的比值,可以推断铜器是否同源。下列说法不正确的是( )
A.Pb是第五周期元素
B.204Pb含有中子数为122
C.可用质谱法区分204Pb和206Pb
D.Pb的原子半径比Ge大
A
解析 Pb是82号元素,属于第六周期元素,A错误;Pb是82号元素,Pb的质子数为82,则204Pb含有中子数为204-82=122,B正确;质谱法可准确测定物质的相对分子质量,204Pb和206Pb的质量数不同,故可以用质谱法区分,C正确;Pb和Ge是同主族元素,Pb是第六周期元素,Ge是第四周期元素,则Pb的原子半径比Ge大,D正确。
命题点2核外电子排布规律应用与化学键类型判断
典例2 (2021·全国甲卷)W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )
A.原子半径:Z>Y>X>W
B.W与X只能形成一种化合物
C.Y的氧化物为碱性氧化物,不与强碱反应
D.W、X和Z可形成既含有离子键又含有共价键的化合物
D
解析 短周期主族元素形成的常温下为气体的单质有:H2、N2、O2、F2、Cl2,由Z的最外层电子数是W和X最外层电子数之和并且是Y最外层电子数的2倍,可以推知W为H,X为N,Z为S,则Y为Al。四种元素的原子半径Al(Y)>S(Z)>N(X)>H(W),A项说法错误;W(H)与X(N)可以形成NH3、N2H4等多种化合物,B项说法错误;Y(Al)的氧化物Al2O3是两性氧化物,能与强碱反应,C项说法错误;W(H)、X(N)、Z(S)可以形成既含有离子键又含有共价键的化合物如(NH4)2S、NH4HS,D项说法正确。
变式演练(2023·四川成都一诊)短周期主族元素Q、X、Y、Z质子数之和为37,Q与X、Y、Z位于不同周期,Q与Z位于同一主族。X、Y、Z最外层电子数分别为x、y、z,且依次增大,x、y、z之和为15,x+z=2y。下列说法正确的是( )
A.Q是原子半径最小的元素
B.最高正价含氧酸的酸性:X>Y
C.XQ2分子中各原子最外层达到8电子结构
D.Z的氢化物不可能含有非极性共价键
C
解析 由题意,x、y、z之和为15,x+z=2y,可推知y=5,x=3或4,z=7或6,又由Q、X、Y、Z质子数之和为37,Q与X、Y、Z位于不同周期,Q与Z位于同一主族,可推出X为C,Y为N,Z为O,Q为S。根据元素周期律,同周期元素,原子序数越大,原子半径越小;同主族元素,原子序数越大,原子半径越大,得Z是原子半径最小的元素,A错误;同周期元素的非金属性随原子序数的增大而逐渐增强,元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性X
练真题·明考向
1.(2021·全国乙卷)我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )
A.原子半径大小顺序为W>X>Y>Z
B.化合物XW中的化学键为离子键
C.Y单质的导电性能弱于Z单质的
D.Z的氧化物的水化物的酸性强于碳酸
B
解析 由于X、Y、Z为同周期相邻元素,因此它们的最外层电子数之和必然是3的倍数并且小于15。假设是12,则X、Y、Z最外层电子数依次为3、4、5,W的最外层电子数为3,则W与X同族,与题意不符;假设是9,则X、Y、Z最外层电子数依次为2、3、4,W的最外层电子数为6,符合题意。由W、X、Y、Z的原子序数依次增大可知,W、X、Y、Z分别是O、Mg、Al、Si。原子半径:Mg>Al>Si>O,即X>Y>Z>W,A错误;MgO是由离子键构成的化合物,B正确;Al是导体,而Si是半导体,Al的导电性强于Si,C错误;Si的最高价氧化物的水化物为H2SiO3,其酸性弱于碳酸,D错误。
B
练易错·避陷阱
D
4.(2023·四川凉山州二诊)短周期主族元素W、X、Y、Z的原子序数依次增大。W与X不在同周期,X原子的最外层电子数与核外电子总数之比为3∶4,Y、Z相邻,Y的单质在空气中燃烧,产物有两种离子化合物和一种单质。下列说法错误的是( )
A.简单离子的半径:X>Y>Z
B.工业上常用电解熔融YX的方法制备Y单质
C.Z2(SO4)3溶液是泡沫灭火器原料之一,原理利用了Z离子的水解
D.X的某氢化物可作为杀菌消毒剂
B
解析 短周期主族元素W、X、Y、Z的原子序数依次增大,X原子的最外层电子数与核外电子总数之比为3∶4,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,则X为O元素;W与X不在同周期,则W为H元素;Y的单质在空气中燃烧,产物有两种离子化合物和一种单质,反应产物为氧化镁、氮化镁和碳,则Y为Mg元素;Y、Z相邻,则Z为Al元素。O2-、Mg2+、Al3+的核外电子排布相同,核电荷数越大离子半径越小,则简单离子的半径:O2->Mg2+>Al3+,即X>Y>Z,A正确;MgO的熔点较高,工业上常用电解熔融氯化镁的方法制备镁,B错误;Al2(SO4)3溶液是泡沫灭火器原料之一,原理是 与Al3+发生相互促进的水解生成氢氧化铝沉淀和二氧化碳、水,利用了Al3+的水解,C正确;X为O,氢化物H2O2可作为杀菌消毒剂,D正确。
练预测·押考向
D
6.(2023·宁夏吴忠青铜峡高中期中)W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y元素的最高正价和最低负价代数和为零;Z的非金属性在同周期元素中最强。下列说法正确的是( )
A.对应简单离子半径:W
C.对应最简单气态氢化物的稳定性:Y>Z
D.Y的氧化物不能和X的最高价氧化物的水化物反应
B
解析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,其质子数=18-10=8,则W为O元素;X和Ne原子的核外电子数相差1,原子半径大于O,则X为Na;Y的最高正价和最低负价之和为零,原子序数大于Na,处于第三周期ⅣA族,则Y为Si;Z的非金属性在同周期元素中最强,原子序数大于Si,则Z为Cl。O2-、Na+电子层结构相同,核电荷数越大离子半径越小,则离子半径O2->Na+,A错误;化合物NaClO中Na+与ClO-之间形成离子键,ClO-中氯原子与氧原子之间形成共价键,B正确;Y为Si、Z为Cl,非金属性Si
聚焦核心要点
要点1元素周期表
课标指引:1.知道元素周期表的结构。 2.体会元素周期表在学习元素化合物知识和科学研究中的重要作用。
1.强化记忆元素周期表的结构
2.利用区间定位推断元素
对于原子序数较大的元素,可采用区间定位确定元素。
元素周期表中各族序数的排列顺序从左到右依次为ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0,牢记各周期对应的0族元素的原子序数,可以快速确定元素所在的周期数。
周期 一 二 三 四 五 六 七
起止序数 1~2 3~10 11~18 19~36 37~54 55~86 87~118
要点2元素周期律
课标指引:1.以第三周期的钠、镁、铝、硅、磷、硫、氯,以及碱金属和卤族元素为例,了解同周期和同主族元素性质的递变规律。 2.体会元素周期律在学习元素化合物知识和科学研究中的重要作用。
1.掌握元素的金属性和非金属性强弱的判断方法
2.熟记同周期(主族)元素原子结构和元素性质的变化规律
类型 同周期(左→右) 同主族(上→下)
原子结构 核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 逐渐减小 逐渐增大
离子半径 阳离子逐渐减小,阴离子逐渐减小,且r(阴离子)>r(阳离子) 逐渐增大
类型 同周期(左→右) 同主族(上→下)
元素性质 化合价 最高正化合价:+1→+7(O、F除外) 负化合价=-(8-主族序数) 相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性 金属性逐渐减弱非金属性逐渐增强 金属性逐渐增强
非金属性逐渐减弱
气态氢化物的稳定性 逐渐增强 逐渐减弱
最高价氧化物对应水化物的酸性(或碱性) 碱性逐渐减弱 酸性逐渐增强 碱性逐渐增强
酸性逐渐减弱
离子的氧化性、还原性 阳离子氧化性逐渐增强,阴离子还原性逐渐减弱 阳离子氧化性逐渐减弱,阴离子还原性逐渐增强
3.通过“三看”比较微粒半径大小
在中学化学要求的范围内,可按“三看”规律来比较粒子半径的大小:
易错辨析
1.两短周期元素原子序数相差8,则周期数一定相差1。( )
2.原子及离子的核外电子层数等于该元素所在的周期数。( )
3.元素周期表中位于金属与非金属分界线附近的元素属于过渡元素。( )
4.热稳定性:SiH4>PH3>H2S。( )
5.酸性:HClO4>H2SO4>H3PO4。( )
√
×
×
×
非金属性:S>P>Si,则简单氢化物的稳定性:H2S>PH3>SiH4。
√
精研核心命题
命题点1元素周期表与元素周期律
典例1 (2019·全国Ⅱ卷)2019年是门捷列夫发现元素周期律150周年。如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W
C.气态氢化物热稳定性:Z
W
X Y Z
D
解析 由题中信息和图示可知W位于第二周期,X、Y、Z位于第三周期,结合W与X的最高化合价之和为8,且族序数相差2,可知X为Al,W和Z分别为N和P,Y为Si。原子半径:N
X Y
Z W
A.简单离子半径:W>Z
B.X的气态氢化物稳定性强于Y的气态氢化物
C.W的最高价氧化物对应的水化物酸性比Z的弱
D.含X的某些盐可作为化肥使用,保障农作物增产
D
解析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在元素周期表中的相对位置可知,X为氮元素,Z为硫元素,W为氯元素。电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;简单离子半径:W
命题点2“位—构—性”综合应用
典例2 (2023·全国乙卷)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子X2-与Y2+具有相同的电子结构。下列叙述正确的是( )
A.X的常见化合价有-1、-2
B.原子半径大小为Y>X>W
C.YX的水合物具有两性
D.W单质只有4种同素异形体
A
解析 X2-与Y2+具有相同的电子结构,W、X、Y为短周期元素,符合条件的短周期元素X、Y分别为O、Mg,结合原子序数关系和矿物可溶于稀盐酸且有无色无味气体生成,则可推出W为碳元素。氧元素常见化合价有-1、-2价,A正确;原子半径Mg>C>O(Y>W>X),B错误;MgO的水合物(即水化物)Mg(OH)2不具有两性,C错误;碳单质有金刚石、石墨、C60、C70、石墨烯等多种同素异形体,D错误。
【思维建模】
解答“位—构—性”的关系及应用类题目的方法
训练分层落实
练真题·明考向
1.(2022·广东卷)甲~戊均为短周期元素,在元素周期表中的相对位置如图所示;戊的最高价氧化物对应的水化物为强酸。下列说法不正确的是( )
A.原子半径:丁>戊>乙
B.非金属性:戊>丁>丙
C.甲的氢化物遇氯化氢一定有白烟产生
D.丙的最高价氧化物对应的水化物一定能与强碱反应
C
解析 根据题干信息,戊的最高价氧化物对应的水化物为强酸,在短周期元素中,符合此条件的可以是S或Cl。如果戊为S元素,则甲、乙、丙、丁分别为C、O、Si、P元素;如果戊为Cl元素,则甲、乙、丙、丁分别为N、F、P、S元素。但无论戊是什么元素,同周期的主族元素,原子序数越大,半径越小,原子半径:丁>戊;同主族元素的原子序数越大,半径越大,原子半径:戊>乙,则原子半径:丁>戊>乙,A项正确,不符合题意;无论戊是什么元素,同周期主族元素的原子序数越大,非金属性越强,因此非金属性:戊>丁>丙,B项正确,不符合题意;若戊为S元素,则甲为C元素,甲的氢化物如甲烷遇氯化氢无白烟产生,C项错误,符合题意;不论丙是Si元素还是P元素,其最高价氧化物对应的水化物均为酸,均可以与强碱反应,D项正确,不符合题意。
2.(2018·全国Ⅲ卷)W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是( )
A.原子半径大小为W
C.Y2W2与ZW2均含有非极性共价键
D.标准状况下W的单质状态与X的相同
D
解析 由题可知W是氧、Y是钠、Z是氯。X和Z同族,则X是氟。标准状况下,O2、O3与F2均为气体,D项正确;原子半径大小应为X
3.(2023·福建宁德联考)T、Q、R、W四种元素在元素周期表中所处位置如图,已知W能与氧元素形成化合物WO2,WO2中氧的质量分数为50%,且W原子中质子数等于中子数。下列说法错误的是( )
A.简单气态氢化物的稳定性:Q
C.WO2有毒,不能添加到任何饮品中
D.Q与氧元素形成的化合物的种类不止一种
Q R
T W
C
解析 W能与氧元素形成化合物WO2,WO2中氧的质量分数为50%,则W的相对原子质量为32,W原子中质子数等于中子数,则W的质子数为16,W是S元素;根据T、Q、R、W四种元素在元素周期表中所处位置,可知T、Q、R分别是Al元素、C元素、N元素。同周期元素从左到右非金属性增强,简单气态氢化物的稳定性增强,则稳定性:CH4
A.上述五种原子中一定都含有质子、电子和中子
B.X、Y、Z只能形成一种化合物
C.YZ2对应水化物的酸性较HClO强
D.可用pH试纸测定W的水溶液的pH
C
解析 X是宇宙中最丰富的元素,则X为H元素,Y元素原子最外层电子数是内层电子总数的2倍说明Y只有2层电子,电子排布为2、4,则Y为C元素;Z元素原子最外层电子数比其次外层电子数多4,电子排布为2、6,则Z为O元素;W元素原子K层和M层电子总数比其L层电子数多1,说明W有3层电子,电子排布为2、8、7,则W为Cl元素;R元素原子最外层有1个电子,其阳离子与Z的阴离子核外电子总数相同即为10,则R为Na元素。X为H原子,质子数为1,中子数为0,A错误;H、C、O能形成H2CO3、H2C2O4等多种化合物,B错误;CO2对应水化物H2CO3的酸性较HClO强,C正确;W为Cl元素,氯水具有漂白性,能漂白pH试纸,不能用pH试纸测定氯水溶液的pH,D错误。
练预测·押考向
5.(2023·陕西榆林一模)短周期主族元素X、Y、Z、W、R的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液中,却不溶于其浓溶液。下列说法正确的是( )
A.简单离子半径:R>W>X>Y>Z
B.Y与W具有相同的最高化合价
C.Z、W的简单离子都能促进水的电离
D.往元素X的最简单氢化物的稀溶液中滴加酚酞,无明显变化
C
解析 常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液中,却不溶于其浓溶液,可联想到Al在浓硝酸、浓硫酸中的钝化,则Z应为Al元素,W的原子序数大于Al,则W为S元素,R为原子序数大于S的短周期主族元素,则为Cl元素;X的气态氢化物极易溶于Y的氢化物中,且X的原子序数小于Y,应是指氨极易溶于水,所以X为N元素,Y为O元素。核外电子排布相同时,原子序数越小半径越大,另外电子层数越多,半径越大,故简单离子半径:W>R>X>Y>Z,A错误;W为S元素,Y为O元素,S的最高化合价为+6价,O不能失去最外层的6个电子,没有+6价,最高化合价不同,B错误;Z、W的简单离子分别为铝离子、硫离子,都可以水解,促进水的电离,C正确;由分析可知,X为N元素,N的气态氢化物为NH3,其水溶液显碱性,滴加酚酞,溶液显红色,D错误。
6.(2023·江西南昌统考二模)元素周期表中前20号元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,X的简单离子半径在同周期元素中最小。由这四种元素组成一种化合物Q,在Q的溶液中滴加Ba(OH)2溶液,产生沉淀的物质的量与Ba(OH)2的物质的量的关系如图所示,下列说法正确的是( )
A.简单离子半径:Z>Y
B.简单气态氢化物的热稳定性:Y>R
C.Q的水溶液显酸性,可作为净水剂
D.M点沉淀物有2种,且物质的量之比为4∶1
C
解析 元素周期表中前20号元素R、X、Y、Z的原子序数依次增大,R和Y位于同主族,X的简单离子半径在同周期元素中最小。由这四种元素组成一种化合物Q,在Q的溶液中滴加Ba(OH)2溶液,产生沉淀的物质的量与Ba(OH)2的物质的量的关系如题图所示,则X为Al元素,1 mol氢氧化钡会溶解2 mol氢氧化铝,但实际只减少1 mol沉淀,说明还生成了另外的1 mol沉淀,加入3 mol氢氧化钡会生成2 mol氢氧化铝沉淀和3 mol其他沉淀,则另外3 mol沉淀是硫酸钡或碳酸钡沉淀,又根据R和Y位于同主族,则R为O元素,Y为S元素,Z为K元素,Q为硫酸铝钾。根据同电子层结构“核多径小”,则简单离子半径:Y>Z,A错误;根据非金属性越强,其气态氢化物越稳定,则简单气态氢化物的热稳定性:R>Y,B错误;Q为硫酸铝钾,铝离子水解生成氢氧化铝和氢离子,因此其水溶液显酸性,可作为净水剂,C正确;M点沉淀物有2种,由图中量的关系可知,2 mol硫酸铝钾溶液中加入3 mol氢氧化钡得到3 mol硫酸钡和2 mol氢氧化铝,其物质的量之比为3∶2,D错误。
突破高考题型(五)元素推断及元素“位—构—性”
的综合考查
高考指引:近几年来,每一年的全国卷中的化学选择题都考查了元素综合推断与元素周期律的综合题,有关“位—构—性”的互相推断,实质是元素周期表和元素周期律的具体应用的体现,主要考查元素化合物的性质、原子半径的比较、元素周期律等,侧重考查考生的“理解与辨析能力”“分析与推测能力”“归纳与论证能力”等关键能力。
1.审题关注什么
仔细审读题给信息,根据原子结构、元素周期表的知识及已知元素化合物的性质,可推断元素,判断元素在周期表中的位置等,基本思路如下:
2.题目考什么
(1)已知元素原子(离子)的核外电子排布推断元素
核外电子排布 电子层数和最外层电子数 周期序数和族序数 单质及化合物的性质
(2)已知单质或化合物的特性推断元素
(3)已知元素在周期表中的位置推断元素
3.规避元素推断的误区
突破点1 依据核外电子排布进行元素综合推断
核心归纳
1.短周期元素原子核外电子排布的特征
最外层电子数等于次外层电子数→Ar、Be
电子层数与最外层电子数相等→Al、Be
最外层电子数是内层电子总数的一半→P、Li
次外层电子数是最外层电子数的2倍→Si、Li
电子层数是最外层电子数的2倍→Li
最外层电子数是电子层数的2倍→S、C
最外层电子数是次外层电子数的2倍→C
最外层电子数是次外层电子数的3倍→O
最外层电子数是次外层电子数的4倍→Ne
2.寻找“10电子”粒子和“18电子”粒子的方法
(1)“10电子”粒子
(2)“18电子”粒子
真题感悟
1.(2023·全国甲卷)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径:X>W
B.简单氢化物的沸点:X
D.Z的最高价含氧酸是弱酸
C
解析 WX2是形成酸雨的物质之一,结合原子序数关系可知W、X分别为N、O;Y的最外层电子数与其K层电子数相等,则Y是Mg;四种元素最外层电子数之和为19,故Z最外层电子数为6,结合原子序数可知Z为S元素。四种元素在元素周期表中的位置关系如下图。
…… N(W) O(X)
Mg(Y) …… S(Z)
根据元素周期律:原子半径W>X,A项错误;H2O分子间形成氢键导致其沸点比H2S的沸点高,B项错误;Mg(Y)与O(X)可以形成离子化合物MgO,C项正确;H2SO4是强酸,D项错误。
2.(2022·全国甲卷)Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍。下列说法正确的是( )
A.非金属性:X>Q
B.单质的熔点:X>Y
C.简单氢化物的沸点:Z>Q
D.最高价含氧酸的酸性:Z>Y
D
解析 由题意可知,Q为第二周期元素,X、Y、Z为第三周期元素,再依据Y原子最外层电子数是Q原子内层电子数的2倍,可推知Y为Si元素,由“X、Y相邻”,且X的原子序数小于Y,可推知X为Al元素,最后依据原子序数的大小关系和四种元素最外层电子数之和为19可推知,若Q为O元素,则Z为S元素;若Q为N元素,则Z为Cl元素;若Q为F元素,则Z为P元素。非金属性:Al
考向预测
1.(2023·陕西榆林第四次模拟)X、Y、Z、W为原子序数依次增大的短周期主族元素。X、Y为相邻元素,X、W为同主族元素,X、Y的最外层电子数之差等于Z的最外层电子数,在地壳中W的含量仅次于氧元素。下列说法正确的是( )
A.Y的最简单氢化物的水溶液呈酸性
B.原子半径:Z>Y>W
C.W位于元素周期表第三周期第ⅥA族
D.X、Y的氧化物均不止一种
D
解析 地壳中元素的含量O>Si>Al>Fe>Ca,则W为Si元素,X、W为同主族短周期元素,X为C元素,X、Y为相邻元素,X、Y的最外层电子数之差等于1,为Z的最外层电子数,Z为Na元素,Y为N元素。Y的简单氢化物为氨,水溶液呈碱性,A错误;Z为Na元素,Y为N元素,W为Si元素,则原子半径:Na>Si>N,B错误;W为Si元素,位于第三周期第ⅣA族,C错误;C的氧化物有CO、CO2,N的氧化物有NO、NO2、N2O、N2O3、N2O5等,D正确。
2.(2023·江西龙南中学二模)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族,下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
B
解析 a、b、c、d分别为O、Na(或Mg)、Al、S。A项,原子半径b>c>d>a,错误;B正确;C项,c的氧化物的水化物为氢氧化铝,为两性氢氧化物,不是强碱,错误;D项,S的氧化性比氧气的氧化性弱,错误。
突破点2 依据元素周期表的片段进行元素综合推断
核心归纳
元素周期表片段结构型推断题一般给出两种信息:
一是给出局部的元素周期表,展示出几种不同元素的相对位置。
二是给出某种元素的位置特征、原子结构特征或由该元素形成的单质或化合物的特殊性质。解答此类题目时,首先根据给出的某种元素的特殊结构或性质,确定该元素在元素周期表中的位置,然后以此为“坐标原点”,根据其他元素与该元素的位置关系,进而确定其他未知的元素。
真题感悟
(2017·全国Ⅲ卷)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )
W X
Y Z
A.氢化物沸点:W
C.化合物熔点:Y2X3
解析 根据短周期元素W、X、Y和Z在周期表中的相对位置可知四种元素位于第二、三周期,又知这四种元素原子的最外层电子数之和为21,可设Y的最外层电子数为x,则有x+(x+2)+(x+3)+(x+4)=21,x=3,所以W、X、Y、Z依次为N、O、Al、Cl。A项,NH3分子之间存在氢键,故沸点:NH3>HCl,错误;B项,Y的氧化物对应水化物为Al(OH)3,W的氧化物对应水化物若为HNO3,则HNO3酸性强于Al(OH)3,错误;C项,Al2O3是冶炼金属铝的原料,也是一种比较好的耐火材料,熔点高于AlCl3,错误;D项,O2-与Al3+的电子层结构相同,但O2-的核电荷数少,故其半径较大,正确。
考向预测
(2023·北京顺义区一模)如表为元素周期表的一部分,其中X、Y、W、Z为短周期元素,W的单质常温下为黄绿色气体。下列说法不正确的是( )
Y Z
X W
R T
A.X、Y的单质均存在同素异形体
B.Y、Z的简单氢化物的稳定性依次递增
C.R的单质可用于制造半导体材料
D.工业上电解NaW溶液得W2可使用阴离子交换膜
D
解析 W的单质常温下为黄绿色气体,则W为Cl元素,由元素在周期表中的位置可知,X为P元素,Y为O元素,Z为F元素,R为Ge元素,T为Br元素。P对应的同素异形体有红磷、白磷等,O对应的同素异形体有氧气、臭氧等,A正确;同周期主族元素从左到右元素的非金属性增强,元素的非金属性越强,对应的氢化物越稳定,故Y、Z的简单氢化物的稳定性依次递增,B正确;Ge和Si位于同一主族,为重要的半导体材料,C正确;工业上电解饱和食盐水可制得Cl2,Cl2在阳极生成,NaOH在阴极生成,若使用阴离子交换膜,则OH-会从阴极向阳极移动,消耗Cl2,D错误。
突破点3 依据元素成键情况进行元素综合推断
核心归纳
注意陌生物质中各原子的成键情况和化合价等信息。
①化学键信息:如能形成4个共价键的元素为C、Si等,能形成2个共价键的元素为O、S等,能形成1个共价键的元素为H等。
②根据形成的简单阴、阳离子可确定原子的最外层电子数,如X2+和Y2-,即X、Y原子最外层电子数分别为2和6。
③化合价信息:化合物中各元素化合价的代数和为0,结合某些常见元素的化合价或化学键等,可确定未知元素的化合价,间接确定最外层电子数目。
真题感悟
1.(2020·全国Ⅱ卷)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是( )
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
D
解析 根据题意可知Z的原子序数是W、X、Y、Z四种元素中最大的,Z能形成+1价离子,可初步判断Z为钠元素;W的原子序数是W、X、Y、Z四种元素中最小的,W与X、Y均以一个单键结合,可初步判断W为氢元素;根据W、X、Y、Z的原子序数之和为24,可知X、Y的原子序数之和为12,结合成键特点,可判断X、Y分别是硼、氮元素。H、B、N形成的阴离子中,各原子均以共价键结合,A正确;Na单质能与H2O、CH3OH反应,B正确;N元素最高价氧化物的水化物HNO3为强酸,C正确;BF3中硼原子最外层有6个电子,D错误。
2.(2019·全国Ⅰ卷)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
C
解析 由题给化合物的结构可知,W为第ⅠA族金属元素;Z最外层有7个电子,由“Z核外最外层电子数是X核外电子数的一半”可知,X核外电子数为14,即X为硅元素;由四种元素为同一短周期元素可知,W为钠元素;Z为氯元素;Y为P元素。NaCl的水溶液呈中性,A项错误;元素非金属性的顺序为Z(Cl)>Y (P)>X(Si),B项错误;P的最高价氧化物的水化物为磷酸,是中强酸,C项正确;P原子最外层有5个电子,与Si共用两对电子,加上得到Na的1个电子,因此最外层满足8电子稳定结构,D项错误。
考向预测
1.(2023·内蒙古呼和浩特二模)短周期主族元素A、B、C、D、E的原子序数依次增大,由这五种元素组成的一种化合物M是一种高效消毒剂,M的结构式如图所示。下列说法不正确的是( )
A.原子半径D>E>C
B.简单氢化物稳定性C>B>A
C.C与D形成的化合物仅含有离子键
D.工业上采用电解DE的饱和水溶液制备E的单质
C
解析 短周期主族元素A、B、C、D、E的原子序数依次增大,由M的结构式可知,D为带1个单位正电荷的阳离子,结合原子序数可知D为Na元素;E只能形成1个共价单键,且原子序数最大,E为Cl元素;C能形成2个共价键,则C为O元素,A能形成4个共价键、B能形成3个共价键,且短周期主族元素A、B、C、D、E的原子序数依次增大,则A为C元素,B为N元素。原子半径Na>Cl>O,即D>E>C,A正确;非金属性O>N>C,则简单氢化物稳定性H2O>NH3>CH4,即C>B>A,B正确;Na元素与O元素形成的化合物Na2O中仅含有离子键,但Na2O2中既有离子键又有共价键,C错误;工业上采用电解DE即NaCl的饱和水溶液制备E的单质即Cl2,反应方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,D正确。
2.短周期主族元素W、X、Y、Z、Q原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如下图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A.原子半径大小:Q>Z>Y
B.该化合物中Y原子不满足8电子稳定结构
C.该化合物中,W、X、Y、Z、Q之间均为共价键
D.Q元素对应的单质能与水反应
D
解析 短周期主族元素W、X、Y、Z、Q原子序数依次增大,W的原子半径在周期表中最小,则W为H元素;由图示化合物的结构可知,X为第ⅣA族元素,Y为第ⅤA族元素,Q为第ⅠA族元素,Z为第ⅥA族元素,且Z核外最外层电子数与X核外电子总数相等,结合原子序数大小可知,X为C元素,Y为N元素,Z为O元素,Q为Na元素。主族元素同周期从左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径:Na>N>O,A错误;该化合物中Y原子即N原子形成3对共用电子对之后满足8电子稳定结构,B错误;该化合物中含有离子键,C错误;钠与水反应生成氢氧化钠和氢气,D正确。
突破点4 依据元素及其化合物的性质或转化关系进行元素综合推断
核心归纳
常考短周期元素的主要化合物的特性
(1)形成化合物种类最多的元素、单质是自然界中硬度最大的物质的元素或气态氢化物中氢的质量分数最高的元素:C。
(2)空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
(3)地壳中含量最多的元素、氢化物沸点最高的元素或氢化物在通常情况下呈液态的元素:O。
(4)等物质的量的单质最轻的元素:H;等物质的量的最轻的金属单质:Li。
(5)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
(6)元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
(7)具有漂白性的物质:氯水、二氧化硫、过氧化钠、双氧水(H2O2)。
真题感悟
1.(2020·全国Ⅲ卷)W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )
A.非金属性:W>X>Y>Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物的水化物为强碱
D
解析 根据“化合物XW3与WZ相遇会产生白烟”可先推测W为氢元素,X为氮元素,Z为氯元素,再依据四种元素的核外电子总数满足X+Y=W+Z推知,Y为钠元素,上述推断出的元素也满足了“W、X、Y、Z为原子序数依次增大的短周期元素”这一条件。非金属性:Cl>N>H>Na,A项错误;原子半径:Na>Cl>N>H,B项错误;HNO2不属于强酸,C项错误;NaOH属于强碱,D项正确。
2.(2016·全国Ⅰ卷)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。
下列说法正确的是( )
A.原子半径的大小W
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
C
解析 由n是元素Z的单质,通常为黄绿色气体,可知Z为Cl元素,n为Cl2,再根据q的水溶液具有漂白性,可知q为HClO,由0.01 mol·L-1 r溶液的pH为2,可判断r为一元强酸,则r为HCl,然后根据n和p的反应条件,以及s通常是难溶于水的混合物,可知p为烷烃,s为烷烃的氯代物;根据题意,W、X、Y、Z是短周期原子序数依次增加的四种元素,可进一步推知W、X、Y、Z分别为H元素、C元素、O元素、Cl元素。A项,根据原子半径的变化规律,可知原子半径:H
考向预测
1.(2023·山东青岛期中)短周期主族元素a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,w溶液可使酚酞溶液显红色。上述物质的转化关系如图所示。下列说法正确的是( )
A.原子半径的大小:a
D.y、w溶于水,破坏的化学键类型完全相同
C
解析 短周期主族元素a、b、c、d的原子序数依次增大,四种元素形成的单质依次为m、n、p、q,x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一,则z为SO2或NO2,由于N2化学性质稳定,可知z为SO2,由于原子序数b
2.短周期主族元素W、X、Y、Z的原子序数依次增大,某研究团队以mY2X3·nZX2(固态物质)为载体,利用Au-Pd纳米颗粒催化气态单质W2、X2合成W2X2,其原理如图所示。下列说法正确的是( )
A.简单离子半径:X
C.Y2X3、ZX2均具有较高熔点
D.工业上常用电解Y的氯化物的方法冶炼Y
C
解析 短周期主族元素W、X、Y、Z的原子序数依次增大,W、X都能形成双原子分子,单质为气体,且二者能结合成化合物W2X2、W2X,由图可知W原子半径小于X的,则W为H元素,X为O元素;由固态化合物Y2X3、ZX2及ZW4中元素的化合价,可知Z显-4或+4价,又Z的原子序数比O的大,则Z为Si元素,Y显+3价且原子序数大于O小于Si,则Y为Al元素。O2-与Al3+的电子层结构相同,但Al的核电荷数大,则简单离子半径:O2->Al3+,A错误;化合物ZW4为SiH4,Si原子满足最外层8电子结构,但H原子不满足最外层8电子结构,B错误;Y2X3、ZX2分别为Al2O3、SiO2,均具有较高熔点,C正确;工业上冶炼Al时,常用电解熔融Al2O3的方法,D错误。
同课章节目录
