适用于老高考旧教材2024版高考化学二轮复习专题7化学反应速率与化学平衡课件(共212张PPT)
文档属性
| 名称 | 适用于老高考旧教材2024版高考化学二轮复习专题7化学反应速率与化学平衡课件(共212张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-27 16:20:48 | ||
图片预览











文档简介
(共212张PPT)
专题七 化学反应速率与化学平衡
考情分析
高考命题分析
命 题 情 境 (1)生产环保情境:从能源(如氢能)、科技(合成氨、煤的气化等)、材料等情境选材,考查考生对陌生图像(图表)的辨识与应用,结合影响化学平衡的因素选择最佳反应条件,进行有关反应速率、化学平衡常数、转化率或产率等方面的计算,考查考生应用所学知识解决化工生产实际问题的能力。
(2)学术探索情境:从CO2的利用、反应机理研究等情境选材,要求考生能够对信息进行理解与辨析,从反应快慢和限度角度调控化学反应的转化率和产率,解决工业生产、科技创新等方面的实际问题。
素 养 能 力 (1)分析与推测能力:结合题目给定反应体系条件和可逆反应的特点,结合平衡图像中曲线变化,分析与推测化学反应速率和化学平衡的影响因素。
(2)理解与辨析能力:辨识化学反应速率和化学平衡的图像、图表等信息,提取关键信息,并与已学知识进行整合;辨析速率和平衡在解决生产、社会问题中运用的基本原理和方法,并能解决相关的化学问题。
(3)思维方法:分析题中图表信息或数据,提取关键信息,认识物质变化的特征及规律,进行化学反应速率和平衡常数的计算,利用平衡常数和浓度商的关系论证平衡移动方向,从定量角度推测化学平衡移动及结果。
考题统计
(1)化学反应速率及影响因素:
(2022全国甲卷,26)(2020全国Ⅰ卷,26)(2020全国Ⅱ卷,28)(2020全国Ⅲ卷,28)(2019全国Ⅰ卷,28)(2019全国Ⅱ卷,27)
(2)化学平衡的移动及分析:
(2023全国乙卷,28)(2022全国甲卷,13、28)(2022全国乙卷,28)(2020全国Ⅰ卷,28)(2020全国Ⅱ卷,28)(2020全国Ⅲ卷,28)(2019全国Ⅰ卷,28)(2019全国Ⅱ卷,27)(2019全国Ⅲ卷,28)
(3)化学平衡常数和转化率:
(2023全国甲卷,28)(2023全国乙卷,28)(2022全国甲卷,28)(2022全国乙卷,28)(2021全国甲卷,28)(2021全国乙卷,28)(2020全国Ⅰ卷,28)(2020全国Ⅱ卷,28)(2020全国Ⅲ卷,28)(2019全国Ⅰ卷,28)(2019全国Ⅱ卷,27)(2019全国Ⅲ卷,28)
(4)化学反应速率和平衡图像:
(2023全国甲卷,28)(2023全国乙卷,28)(2022全国甲卷,28)(2022全国乙卷,28)(2021全国甲卷,28)(2021全国乙卷,28)(2020全国Ⅰ卷,28)(2020全国Ⅲ卷,28)(2019全国Ⅰ卷,28)(2019全国Ⅱ卷,27)(2019全国Ⅲ卷,28)
考点1化学反应速率及影响因素
聚焦核心要点
要点1化学反应速率及影响因素
课标指引:1.知道化学反应速率的表示方法,了解测定化学反应速率的简单方法;能进行化学反应速率的简单计算。 2.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响。
1.计算化学反应速率的两种方法
注意单位的规范书写
(1)依据定义式计算:依据“ ”计算时一定要注意容器的容积或溶液的体积,不能盲目地把Δn当作Δc代入公式进行计算。
(2)根据比例关系计算:对于反应“mA(g)+nB(g) ══ pC(g)+qD(g)”,不同物质的化学反应速率与化学计量数的关系:v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
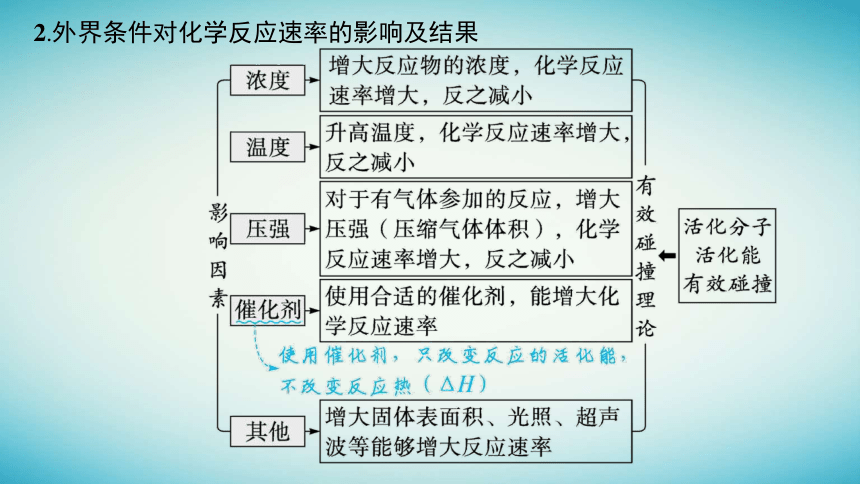
2.外界条件对化学反应速率的影响及结果
微点拨
“惰性气体”(非反应气体)对化学反应速率的影响
要点2化学反应速率常数及应用
课标指引:1.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。 2.知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义。
1.速率常数(k)
(1)速率常数(k)是指在给定温度下,反应物浓度皆为1 mol·L-1时的反应速率。
(2)在相同的浓度条件下,可用速率常数大小来比较化学反应的反应速率。
(3)速率常数是温度的函数,同一反应,温度不同,速率常数不同,温度相同,速率常数(k)相同。
浓度、压强不影响速率常数(k)
2.速率方程
对于基元反应:aA(g)+bB(g) gG(g)+hH(g),则v(正)=k(正)ca(A)·cb(B)[其中k(正)为正反应的速率常数],v(逆)=k(逆)cg(G)·ch(H)[其中k(逆)为逆反应的速率常数]。
易错辨析
1.升高温度时,不论正反应是吸热还是放热,正、逆反应的速率都增大。( )
2.碳酸钙与盐酸反应的过程中,再增加CaCO3固体,可以加快反应速率。( )
3.增大反应体系的压强,反应速率一定增大。( )
4.对于反应2H2O2 ══ 2H2O+O2↑,加入MnO2或降低温度都能加快O2的生成速率。( )
√
升高温度,正反应速率和逆反应速率都增大,但增大的程度不同。
×
固体或纯液体物质量的改变,不影响化学反应速率。
×
恒容情况下,在化学反应体系中加入不参与反应的气体,压强增大,而化学反应速率不变。
×
加入MnO2能加快O2的生成速率,降低温度会减慢O2的生成速率。
精研核心命题
命题点1化学反应速率及计算
典例1 (2019·全国Ⅰ卷,28节选)水煤气变换[CO(g)+H2O(g) ══ CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体
计算曲线a的反应在30~90 min内的平均速率 (a)= kPa·min-1。
0.004 7
解析 由题图可知,30~90 min内a曲线对应物质的分压变化量
Δp=(4.08-3.80) kPa=0.28 kPa,故曲线a的反应在30~90 min内的平均速率
思路剖析解答本题的思路如下:
变式演练(2023·宁夏中卫一模)CuBr2可用作有机合成溴化剂,在一定温度下CuBr2(s)可发生反应:2CuBr2(s) 2CuBr(s)+Br2(g),在密闭容器中投入足量的CuBr2(s),15分钟后反应到达平衡状态,此时Br2的浓度为9.5 mol·L-1。则这段时间内的平均反应速率v(Br2)= (保留两位小数)。如果温度保持不变,将容器容积缩小到原来的一半,则再次平衡时Br2的浓度为 mol·L-1。
0.63 mol·L-1·min-1
9.5
解析 在密闭容器中投入足量的CuBr2(s),发生反应2CuBr2(s) 2CuBr(s)+Br2(g),15分钟后反应到达平衡状态,此时Br2的浓度为9.5 mol·L-1。则这段时间内的平均反应速率v(Br2)= =0.63 mol·L-1·min-1;该温度下反应平衡常数K=c(Br2)=9.5 mol·L-1,如果温度保持不变,将容器容积缩小到原来的一半,平衡常数不变,则再次平衡时Br2的浓度为9.5 mol·L-1。
命题点2影响化学反应速率的因素
典例2 (2019·全国Ⅱ卷,27节选)环戊二烯( )容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 (填字母)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
CD
解析 由相同时间内,环戊二烯浓度减小量越大,反应速率越快可知,T1变式演练(2023·辽宁省教研联盟一模)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图,已知反应物消耗一半所需的时间称为半衰期。下列说法错误的是( )
A.其他条件相同时,催化剂浓度越大,反应速率越大
B.其他条件相同时,降冰片烯浓度越大,反应速率越大
C.条件①,反应速率为0.012 mol·L-1·min-1
D.条件②,降冰片烯起始浓度为3.0 mol·L-1时,半衰期为62.5 min
B
解析 对比曲线①②可知,其他条件相同时,催化剂浓度越大,反应所需要的时间更短,故反应速率越大,A正确;对比曲线①③可知,其他条件相同时,降冰片烯浓度①是③的两倍,所用时间①也是③的两倍,说明反应速率相等,故反应速率与降冰片烯浓度无关,B错误;条件①中Δc为3.0 mol·L-1,时间为
【思维建模】
利用“变量控制法”分析外界条件对化学反应速率的影响
命题点3速率常数(k)及其应用
典例3 (2022·河北卷,13改编)恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为
①X Y;②Y Z。反应①的速率v1=k1c(X),反应②的速率v2=k2c(Y),式中k1、k2为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的ln k- 曲线。下列说法正确的是( )
A.随c(X)的减小,反应①、②的速率均降低
B.c(Y)达到最大值之前,体系中v(X)=v(Y)+v(Z)
C.欲提高Y的产率,需提高反应温度且控制反应时间
D.温度低于T1时,总反应速率由反应①决定
B
解析 随c(X)的减小,c(Y)先增大后减小,c(Z)逐渐增大,故反应①的速率随c(X)的减小而减小,而反应②的速率先增大后减小,A错误;在Y的浓度达到最大值之前,单位时间内Δc(X)=Δc(Y)+Δc(Z),根据速率之比等于单位时间内各物质的浓度变化之比,则有v(X)=v(Y)+v(Z),B正确;由题图可知,随着
增大(即T减小),k1、k2均减小,但k2减小幅度大于k1,即k2受温度影响较大,欲提高Y的产率,应使v1>v2,故应降低温度,C错误;由题图乙信息可知,降低温度,当温度低于T1时,k1>k2,v2减慢程度大,故总反应速率由反应②决定,D错误。
变式演练(2023·河北唐山一模)室温下,气体M、N、P、Q之间存在如下转化关系:①M N+P;②M N+Q,反应①的速率可表示为v1=k1c(M),反应②的速率可表示为v2=k2c(M)(k1、k2为速率常数),在容积为10 L的密闭容器中,反应体系中组分M、P的物质的量随时间的变化如下表所示:
t/min 0 1 2 3 4 5 6
M/mol 1.00 0.76 0.56 0.40 0.36 0.36 0.36
P/mol 0 0.06 0.11 0.15 0.16 0.16 0.16
下列说法正确的是( )
A.0~3 min时间段内,Q的平均反应速率为0.15 mol·L-1·min-1
B.反应开始后,体系中P和Q的浓度之比保持不变
C.平衡时M生成Q的转化率为36%
D.反应①的活化能比反应②的活化能低
B
解析 0~3 min内,Δn(M)=0.60 mol、Δn(P)=0.15 mol,则反应生成的n(Q)=0.60 mol-0.15 mol=0.45 mol,则Q的平均反应速率为
=0.015 mol·L-1·min-1,A错误;反应开始后,体系中P和Q的浓度变化量之比Δc(P)∶Δc(Q)=tv1∶tv2=k1c(M)∶k2c(M)=k1∶k2,由于k1、k2为定值,故反应开始后,体系中P和Q的浓度之比保持不变,B正确;由题表格数据可知,4 min反应达到平衡时,Δn(M)=0.64 mol、Δn(P)=0.16 mol,则反应生成的Q的物质的量为0.64 mol-0.16 mol=0.48 mol,故M生成Q的转化率为 ×100% =48%,C错误;反应①的反应速率慢于反应②,反应速率越快,活化能越小,则反应①的活化能比反应②的活化能高,D错误。
训练分层落实
练真题·明考向
1.(2022·浙江6月选考卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化如下表所示,下列说法不正确的是( )
编号 表面积/cm2 c(NH3)/(10-3 mol·L-1) 0 min 20 min 40 min 60 min 80 min
① a 2.40 2.00 1.60 1.20 0.80
② a 1.20 0.80 0.40 x
③ 2a 2.40 1.60 0.80 0.40 0.40
A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
答案 C
率,不影响化学平衡常数,实验③中氨气初始浓度与实验①相同,则实验③和①达到平衡时氨气浓度均为4.00×10-4 mol·L-1,而恒温恒容条件下,实验②相对于实验①为减小压强,平衡正向移动,故实验②中60 min时处于平衡状态,x<0.40,B正确;
实验①、实验②中0~20 min、20~40 min氨气浓度变化量都是
4.00×10-4 mol·L-1,实验②中60 min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨气初始浓度是实验②中氨气初始浓度的两倍,实验①中60 min时反应未达到平衡状态,相同条件下,增加氨气浓度,反应速率并没有增大,C错误;对比实验①和③,氨气浓度相同,实验③中催化剂表面积大,实验③先达到平衡状态,实验③的反应速率大,说明相同条件下,增加催化剂的表面积,反应速率增大,D正确。
2.(2022·辽宁卷,18节选)工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 ΔS=-200 J·K-1·mol-1。
(1) (填“高”或“低”,下同)温有利于提高反应速率, 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用400~500 ℃。
高
低
(2)某合成氨速率方程为v=kcα(N2)cβ(H2)·cγ(NH3),根据表中数据,γ= 。
-1
解析 (2)将实验1、3中数据分别代入合成氨的速率方程可得:
①q=k·mα·nβ·pγ,③10q=k·mα·nβ·(0.1p)γ,综合两式可得γ=-1。
练易错·避陷阱
3.(2023·浙江丽水、衢州一模)在密闭容器中发生反应2A(g) 2B(g)+C(g),其速率可表示为vp= 。在500 ℃,实验测得体系总压强数据如下表:
t/min 0 50 100 150 200
p总/kPa 200 250 275 x 293.75
下列说法正确的是( )
A.0~50 min,生成B的平均速率为1 kPa·min-1
B.第80 min的瞬时速率小于第120 min的瞬时速率
C.推测上表中的x为287.5
D.反应到达平衡时2v正(A)=v逆(C)
C
解析 等温等容条件下,气体的压强之比等于物质的量之比,由表格数据可知,0~50 min,Δp=50 kPa,结合反应2A(g) 2B(g)+C(g),ΔpB=2Δp=100 kPa,则生成B的平均速率为v正(B)= =2 kPa·min-1,A错误;0~50 min, Δp=50 kPa,50~100 min,Δp=25 kPa,而100~200 min,Δp=18.75 kPa,速率越来越慢,第80 min的瞬时速率大于第120 min的瞬时速率,B错误;第一个50 min, Δp=50 kPa,第二个50 min,Δp=25 kPa,如果第三个50 min,Δp=12.5 kPa,此时x为275+12.5=287.5,第四个50 min,Δp=6.25 kPa,200 min时287.5+6.25=293.75,推测出x为287.5,C正确;达到平衡时v(正)=v(逆),用不同物质表示同一反应速率,速率之比等于化学计量数之比,则反应达到平衡时v正(A)=2v逆(C),D错误。
4.(2023·浙江宁波一模)研究反应
2X Y+3Z的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
A.比较实验①②得出:增大反应物浓度,化学反应速率加快
B.比较实验②④得出:升高温度,化学反应速率加快
C.若实验②③只有一个条件不同,则实验③使用了催化剂
D.在0~10 min之间,实验④的平均速率v(Y)=0.06 mol·L-1·min-1
D
解析 实验①②温度相同,但浓度不同,①浓度较大,可得出增大反应物浓度,化学反应速率加快,A正确;实验②④起始浓度相同,但温度不同,④反应速率较大,可得出温度升高,化学反应速率加快,B正确;实验②③温度、浓度相同,③反应速率较大,应该使用了催化剂,C正确;在0~10 min之间,实验④中X的浓度变化为0.60 mol·L-1,则
5.(2023·广东佛山一模)向1 L的恒容密闭容器中加入1 mol X和3 mol Y,发生反应X(g)+3Y(g) 2Z(g),X的转化率α随温度T的变化如图所示(不同温度下的转化率均为反应第10 min数据)。下列说法正确的是( )
A.a点的反应速率v(Z)=0.03 mol·L-1·min-1
B.a、b、c点对应的v逆(Y)大小关系:b>c>a
C.c点时,每消耗3 mol Y的同时,消耗2 mol Z
D.若将容器容积扩大为原来的2倍,则c点对应温度下的α(X)增大
C
解析 a点X的转化率为30%,反应消耗0.3 mol X,同时生成0.6 mol Z,则有v(Z)= =0.06 mol·L-1·min-1,A错误;由题图可知,a、b两点10 min时未达到平衡,c点10 min时达到平衡,而温度越高,正、逆反应速率越快,故a、b、c点对应的v逆(Y)大小关系:c>b>a,B错误;c点时达到平衡,消耗3 mol Y的同时消耗2 mol Z,即正、逆反应速率相等,C正确;该反应的正反应是气体体积减小的反应,若将容器容积扩大为原来的2倍,即减小容器压强,平衡逆向移动,α(X)减小,故c点对应温度下的α(X)减小,D错误。
练预测·押考向
6.某小组同学欲通过实验探究影响金属与酸反应速率的因素,进行下列实验。
序号 实验操作 实验现象
实验 1 取下胶塞,放入一小片金属钠,迅速塞上胶塞 钠浮在液面上并来回移动,表面出现白色固体,白色固体逐渐沉到锥形瓶底部,液体不沸腾;气球迅速鼓起,15 s时测量气球直径约为3 cm
实验 2 取下胶塞,放入与钠表面积基本相同的镁条,迅速塞上胶塞 镁条开始时下沉,很快上浮至液面,片刻后液体呈沸腾状,同时产生大量白雾;气球迅速鼓起,15 s时测量气球直径约为5 cm
下列说法不正确的是( )
A.上述实验不能说明Na比Mg的金属活动性强
B.上述实验能说明相同温度下,金属Na与酸反应比金属Mg与酸反应的速率慢
C.金属Na、Mg与盐酸反应的速率与反应物的接触面积等因素有关
D.向实验1所得溶液中通入HCl气体,会继续析出白色沉淀
答案 B
解析 钠表面生成了白色固体,阻碍了钠和酸的反应,上述实验不能说明Na比Mg的金属活动性强,A正确;上述实验现象受浓盐酸与钠反应的影响,生成NaCl覆盖在钠的表面,影响反应速率,不能说明相同温度下,金属Na与酸反应比金属Mg与酸反应的速率慢,但可以说明反应的速率与反应物的性质、反应物的接触面积等因素有关,B错误、C正确;向实验1所得溶液中通入HCl气体,氯离子浓度增大,会继续析出白色沉淀,D正确。
7.已知反-2-丁烯转化为顺-2-丁烯反应如下,ln k=ln A- ,ln k(正)和ln k(逆)随温度变化的曲线如图。下列有关该反应的说法正确的是( )
A.反-2-丁烯与顺-2-丁烯互为位置异构体
B.温度变化对k(正)的影响程度小于对k(逆)的影响程度
C.正反应的活化能大于逆反应的活化能
D.顺-2-丁烯比反-2-丁烯稳定
C
解析 反-2-丁烯与顺-2-丁烯互为顺反异构体,A错误;由题图可知,ln k(正)的斜率更大,受温度影响更大,温度变化对k(正)的影响程度大于对k(逆)的影响程度,B错误;题图中曲线的斜率代表活化能,正反应的斜率更大,活化能更大,C正确;正反应的活化能更大,则反应为吸热反应,则生成物具有的总能量大于反应物具有的总能量,故反-2-丁烯比顺-2-丁烯稳定,D错误。
8.(2023·青海海东一中一模)无论是在环境保护还是工农业生产方面,氮及其化合物一直是我国科研重点。
已知:反应ⅰ.6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH1=-1 808 kJ·mol-1;
反应ⅱ.N2(g)+3H2(g) 2NH3(g) ΔH2=-91.4 kJ·mol-1。
(1)向2 L刚性密闭容器中充入0.06 mol NO(g)和0.04 mol NH3(g),发生反应ⅰ。不同温度下,测得10 min时NO的转化率如图1所示。
图1
①T1 K下反应ⅰ的平均反应速率v(NO)= mol·L-1·min-1(用含α1的代数式表示)。
②NH3和NO(g)的有效碰撞频率M (填“>”“=”或“<”)N,原因为 。
③NO转化率先升高后降低的原因为
。
0.003α1
<
N点温度更高,活化分子百分数更大
温度低于T1时,10 min内反应未达到平衡,温度越高反应速率越快,NO的转化率增大;温度高于T1时,10 min内反应达到平衡,该反应为放热反应,升高温度平衡逆向移动,NO的转化率减小
(2)固氮在工农业生产中具有重要意义。
①反应ⅱ是工业固氮的反应原理,合成氨的速率公式为v=k·c(N2)·c1.5(H2)·c-1(NH3),其中k为反应速率常数。下列条件能影响k值大小的是 (填字母)。
A.反应温度 B.反应物的浓度 C.反应压强 D.催化剂
AD
②某固氮反应机理如图2所示:
图2
该固氮的总反应方程式为 ;已知三步反应的活化能由大到小的顺序为Ⅲ>Ⅰ>Ⅱ,则该固氮过程的决速步骤为_____ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
2N2+6H2O 4NH3+3O2
Ⅲ
解析 (1)①据图可知T1 K下,10 min时NO的转化率为α1,则Δn(NO)=
0.06α1 mol,容器容积为2 L,所以v(NO)= =0.003α1 mol·L-1·min-1。
②N点温度更高,活化分子百分比更高,所以N点有效碰撞频率更大,反应速率更快。
③温度低于T1时,10 min内反应未达到平衡,温度越高反应速率越快,NO的转化率增大;温度高于T1时,10 min内反应达到平衡,该反应为放热反应,升高温度平衡逆向移动,NO的转化率减小。
(2)①根据速率公式可知浓度以及k的大小会影响反应速率,反应温度、催化剂均不会改变浓度,但影响反应速率,说明温度和催化剂会影响k,故选AD。
②据图可知反应物为N2和H2O,在Li的催化作用下生成NH3和O2,总反应方程式为2N2+6H2O 4NH3+3O2,活化能越大反应速率越慢,慢反应决定整体反应速率,所以决速步骤为Ⅲ。
考点2化学平衡及影响因素
要点1化学平衡状态与平衡移动
课标指引:1.能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平衡移动的方向。 2.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。
聚焦核心要点
1.判断化学平衡状态的方法
2.判断化学平衡移动方向的方法
(1)依据勒夏特列原理判断 前提条件是可逆反应达到化学平衡状态
通过比较改变外界条件时,平衡破坏瞬间的正、逆反应速率的相对大小来判断平衡移动的方向。
引起v(正)、v(逆)的变化 占优势的反应 化学平衡移动方向
v(正)>v(逆) 正反应占优势 向正反应方向(或向右)移动
v(正)v(正)=v(逆) 双向进行程度相等 化学平衡不移动
(2)根据离子积(Q)与平衡常数(K)的大小判断平衡移动的方向
要点2化工生产中反应条件的选择
课标指引:1.认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用。 2.针对典型案例,能从限度、速率等角度对化学反应和化工生产条件进行综合分析。
1.化工生产中反应条件的选择方法
(1)从化学平衡移动分析,既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性。
(2)从原料的利用率分析,增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本。
(3)从实际生产能力分析,如设备承受高温、高压能力等,注意催化剂的活性对温度的限制。
2.优化和选择化工生产的反应条件
外界 条件 有利于增大反应速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
浓度 增大反应物的浓度 增大反应物的浓度、减小生成物的浓度 不断地补充反应物、及时地分离出生成物
催化剂 加合适的催化剂 — 加合适的催化剂
温度 高温 ΔH<0 低温 兼顾速率和平衡,考虑催化剂的适宜温度
ΔH>0 高温 在设备条件允许的前提下,尽量采取高温并考虑催化剂的活性
外界 条件 有利于增大反应速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
压强 高压(有气体参加) 反应后气体体积减小的反应 高压 在设备条件允许的前提下,尽量采取高压
反应后气体体积增大的反应 低压 兼顾速率和平衡,选取适宜的压强
易错辨析
1.增大反应物的量平衡一定会正向移动。( )
2.对于2NO2(g) N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅。( )
3.升高温度,化学平衡向吸热反应方向发生移动。( )
×
若反应物是固体或纯液体,增大反应物的量,对化学平衡无影响。
×
混合气体的颜色先变深再逐渐变浅。
√
对于吸热反应,升高温度,平衡正向移动。
4.工业合成氨的反应是ΔH<0、ΔS<0的反应,在任何温度下都可自发进行。
( )
5.合成氨反应选择在400~500 ℃进行的重要原因是催化剂在500 ℃左右时的活性最大。( )
×
工业合成氨的反应在低温下可以自发进行。
√
催化剂的活性受温度的限制。
命题点1化学平衡移动及分析
典例1 (2023·广东卷)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(如图)中,M为中间产物。其他条件相同时,下列说法不正确的是( )
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M所能达到的
最高浓度更大
精研核心命题
C
解析 由题图可知,使用催化剂Ⅰ和Ⅱ,均存在四个能垒,故反应历程都分为4步进行,A正确;由题图可知,该反应是放热反应,平衡后升高温度,平衡逆向移动,R的浓度增大,B正确;使用Ⅱ时,R→M转化的活化能更大,反应速率比使用Ⅰ更慢,故反应体系达到平衡所需时间更长,C错误;使用Ⅰ时,中间产物M转化为P的活化能更大,反应比使用Ⅱ慢,故反应过程中M所能达到的最高浓度更大,D正确。
变式演练(2023·宁夏吴忠一轮联考)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) ΔH3=-90.77 kJ·mol-1
回答下列问题:
(1)反应Ⅲ能够自发进行的条件是 (填“较低温度”“较高温度”或“任何温度”)。
较低温度
(2)恒温恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是 。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.甲醇的百分含量不再变化
BD
(3)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是 。
A.其他条件不变,若不使用催化剂,则250 ℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
ABD
解析 (1)该反应的ΔS<0,ΔH<0,当反应能自发时,必有ΔG=ΔH-TΔS<0,此时要求温度较低。
(2)由于气体的质量、体积不变,则混合气体的密度始终不变,密度不变不能用来判断该反应是否达到平衡,A错误;该反应是一个正向气体分子总数减小的反应,反应向右进行,混合气体的平均相对分子质量将变大,因此平均相对分子质量不变可说明该反应已达到平衡状态,B正确;平衡时是各物质的浓度或含量不变,不是浓度相等,也不是成比例,C错误;甲醇的百分含量不再变化,可说明该反应达到平衡状态,D正确;故选BD。
(3)催化剂不影响平衡移动,所以其他条件不变,若不使用催化剂,则250 ℃时CO2平衡转化率也一定位于曲线上的M点,不可能在M1点,A错误;温度低于250 ℃时,随温度升高二氧化碳转化率降低,则甲醇的产率减小,B错误;该反应正向放热,升温使平衡左移,平衡常数将减小,即M点平衡常数比N点平衡常数大,C正确;温度越低反应越慢,对生产不利,且催化剂有活性温度(250 ℃左右),D错误;故选ABD。
【思维建模】解答化学平衡移动及分析类题目的思维模型
命题点2化工生产条件的分析及选择
典例2 (2023·辽宁卷,18节选)接触法制硫酸的关键反应为SO2的催化氧化:
(1)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是
(填字母)。
a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同α下的最大速率,选择最佳生产温度
cd
(2)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是 (填字母)。
d
解析 (1)该反应为放热反应。从图像看,随着温度升高,反应速率先增大后减小,a错误;随着温度升高,反应的转化率应逐渐减小,图像中曲线为不同温度下的等转化率下的反应速率曲线,b错误;由题图可知,转化率越高对应的反应速率最高的温度越低,c正确;结合图像的转化率与速率最高的温度可选取最佳生产温度,d正确。
(2)结合图像可知,相对于a、b、c,d对应的催化剂随着温度的升高,SO2的转化率升高得快,达到一定温度后趋于平缓。
变式演练(2023·北京东城区一模)CH4/CO2催化重整的反应为①CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1,其中积炭是导致催化剂失活的主要原因。产生积炭的反应有:
②CH4(g) C(s)+2H2(g) ΔH2=+74.6 kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH3=-172.5 kJ·mol-1
科研人员研究压强对催化剂活性的影响,在1 073 K时,将恒定组成的CO2、CH4混合气体,以恒定流速通过反应器,测得数据如图。
科研人员研究压强对催化剂活性的影响,在1 073 K时,将恒定组成的CO2、CH4混合气体,以恒定流速通过反应器,测得数据如图。
A.ΔH1=+247.1 kJ·mol-1
B.压强越大,Ra降低越快,其主要原因是反应①平衡逆向移动
C.保持其他条件不变,适当增大投料时 ,可减缓Ra的衰减
D.研究表明“通入适量O2有利于重整反应”,因为O2能与C反应并放出热量
答案 B
解析 根据盖斯定律,由反应②-③可得①,则有ΔH1=ΔH2-ΔH3
=(+74.6 kJ·mol-1)-(-172.5 kJ·mol-1)=+247.1 kJ·mol-1,A正确;压强越大,Ra降低越快,说明催化剂活性降低越快,积炭越多,其主要原因是反应③为气体体积减小的反应,加压平衡正向移动,使得积炭增多,B错误;保持其他条件不变,适当增大投料时 ,增大CO2浓度,使反应③平衡逆向移动,减少积炭,可减缓Ra的衰减,C正确;通入适量O2,O2能与C反应并放出大量的热,可减少积炭减缓Ra的衰减,同时反应放热使得反应①正向移动,有利于重整反应,D正确。
练真题·明考向
1.(2023·北京卷)下列事实能用平衡移动原理解释的是( )
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓硝酸中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀硫酸反应过程中,加入少量CuSO4固体,促进H2的产生
训练分层落实
B
解析 MnO2作催化剂会催化H2O2分解,与平衡移动无关,A错误;NO2转化为N2O4的反应是放热反应,升温平衡逆向移动,NO2浓度增大,混合气体颜色加深,B正确;铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C错误;加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D错误。
2.(2022·浙江6月选考卷)关于反应Cl2(g)+H2O(l) HClO(aq)+H+(aq)+Cl-(aq) ΔH<0,达到平衡后,下列说法不正确的是( )
A.升高温度,氯水中的c(HClO)减小
B.氯水中加入少量醋酸钠固体,上述平衡正向移动,c(HClO)增大
C.取氯水稀释, 增大
D.取两份氯水,分别滴加AgNO3溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度
D
解析 HClO受热易分解,升高温度,HClO分解,平衡正向移动,c(HClO)减小,A正确;氯水中加入少量醋酸钠固体,CH3COO-和H+结合生成CH3COOH,c(H+)减小,平衡正向移动,c(HClO)增大,B正确;氯水稀释,平衡正向移动,而c(HClO)和c(Cl-)均减小,但HClO本身存在电离平衡HClO H++ClO-,稀释促进了HClO的电离,使c(HClO)减少更多,故 增大,C正确;氯水中加AgNO3溶液产生白色沉淀,证明溶液中有Cl-,氯水中加淀粉KI溶液,溶液变蓝,证明溶液中有强氧化性物质,而Cl2和HClO都有强氧化性,不能证明反应物和生成物共存,即不能证明上述反应存在限度,D错误。
3.(2022·江苏卷)乙醇-水催化重整可获得H2。其主要反应为
C2H5OH(g)+3H2O(g) ══ 2CO2(g)+6H2(g) ΔH=+173.3 kJ·mol-1
CO2(g)+H2(g) ══ CO(g)+H2O(g)
ΔH=+41.2 kJ·mol-1
在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。
下列说法正确的是( )
A.图中曲线①表示平衡时H2产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大 可提高乙醇平衡转化率
D.一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率
答案 B
解析 两个反应均为吸热反应,升高温度均使平衡正向移动。根据信息可知,CO与CO2的选择性之和为100%,二者变化趋势相反,只有第二个反应生成CO,故升高温度,CO的选择性升高(曲线③),CO2的选择性降低(曲线①),表示氢气产率的应该是曲线②,A错误,B正确;增大乙醇与水的投料比,可提高水的平衡转化率,但乙醇的平衡转化率会降低,C错误;加CaO(s)能吸收CO2,促进第一个反应正向进行,第二个反应逆向进行,可以提高H2产率,但使用催化剂不能提高平衡时H2产率,D错误。
练易错·避陷阱
4.(2023·天津十二区重点校联考)对于可逆反应2NO2(g) N2O4(g),下列说法错误的是( )
A.当2v正(N2O4)=v逆(NO2)时,该反应达到平衡状态
B.该反应在一定条件下能自发进行,则ΔH<0
C.恒温恒容条件下,若混合气体的颜色保持不变,则该反应达到平衡状态
D.恒温恒容条件下,达平衡状态后,再充入一定量的NO2,NO2转化率将减小
D
解析 v正(N2O4)代表正反应速率,v逆(NO2)代表逆反应速率,当2v正(N2O4)=v逆(NO2)时,正、逆反应速率之比等于其化学计量数之比,该反应达到平衡状态,A正确;该反应的ΔS<0,在一定条件下能自发进行,应满足ΔH-TΔS<0,推知ΔH<0,B正确;恒温恒容条件下,若混合气体的颜色保持不变,说明c(NO2)不变,则该反应达到平衡状态,C正确;恒温恒容条件下,达平衡状态后,再充入一定量的NO2,相当于增大压强,而增大压强,平衡正向移动,NO2的转化率增大,D错误。
5.(2023·辽宁沈阳一模)某温度下,恒容密闭容器内加入等物质的量H2和I2发生反应H2(g)+I2(g) 2HI(g),v(正)=k(正)c(H2)·c(I2),k为速率常数。反应一段时间后达到平衡。下列说法中错误的是( )
B.加入一定量HI,混合气体颜色变深
C.加入一定量氩气,容器内压强增大,反应速率不变
D.加入等物质的量的H2和I2,H2转化率不变
A
解析 若 =8.99,则有k正(308 K)>k正(298 K),k为速率常数,升高温
度,k(正)原本就增大,故不能判断该反应是吸热反应还是放热反应,A错误;加入一定量HI(g),平衡逆向移动,I2浓度增大,混合气体颜色变深,B正确;加入一定量氩气,容器容积和各反应物的浓度不变,则反应速率不变,C正确;加入等物质的量的H2和I2相当于增大压强,该反应是气体体积不变的反应,增大压强,平衡不移动,故H2转化率不变,D正确。
练预测·押考向
6.(2023·陕西榆林二模)丙烯是制备聚丙烯塑料的单体,工业上可用丙烷和CO2制取丙烯:
反应1:C3H8(g) C3H6(g)+H2(g) ΔH1=+246 kJ·mol-1。
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41 kJ·mol-1。
回答下列问题。
(1)反应3:C3H8(g)+CO2(g) C3H6(g)+CO(g)+H2O(g)
ΔH= kJ·mol-1。
+287
(2)向恒温恒容密闭容器中充入C3H8(g)和CO2(g),只发生反应3,不能说明反应3达到平衡状态的是 (填字母)。
A.混合气体密度不随时间变化
B.混合气体总压强不随时间变化
C.混合气体平均相对分子质量不随时间变化
D.丙烷的消耗速率等于丙烯的生成速率
AD
(3)向密闭容器中充入C3H8(g)只发生反应1,测得速率方程为v=kc(C3H8)(k为速率常数,只与温度、催化剂有关)。已知:Rln k= +C(R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对速率常数的影响如图1所示。其中,催化效能较高的是 (填“Cat1”或“Cat2”),判断的依据是 。
图1
Cat2
直线斜率小,活化能小
(4)向密闭容器中充入1 mol C3H8(g)和1 mol CO2(g),发生上述反应1和反应2,测得丙烷的平衡转化率与温度、压强的关系如图2所示。
图2
①X代表 (填“温度”或“压强”), Y2 (填“>”“<”或“=”)Y1。
②M点时,C3H8(g)和H2(g)的浓度相等。则M点对应的反应2的平衡常数
K= 。
温度
<
(5)向总压强恒定为76 kPa的密闭容器中充入C3H8(g)和Ar(g),只发生反应1,C3H8(g)的平衡转化率与 的关系如图3所示。其他条件不变,随着增大,C3H8的平衡转化率减小,其原因是_________________________________
_______________________________________________________________________________;当 等于2时,经10 min达到平衡,丙烯的分压变化速率为 kPa· min-1。
图3
其他条件不变,当总压一定时,C3H8的投料增加,占比越大分压越大,导致平衡向左移动,使得C3H8的平衡转化率减小
1.6
解析 (1)已知,反应1:C3H8(g) C3H6(g)+H2(g) ΔH1=+246 kJ·mol-1
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
由盖斯定律可知,反应1+反应2得反应3:C3H8(g)+CO2(g) C3H6(g)+CO(g)+H2O(g) ΔH=ΔH1+ΔH2=+287 kJ·mol-1。
(2)A.容器容积和气体质量始终不变,则混合气体的密度始终不变,因此不能说明反应已达平衡;B.反应为气体分子数增大的反应,混合气体总压强不随时间变化,说明已经达到平衡;C.气体总质量始终不变、反应为气体分子数增大的反应,则混合气体平均相对分子质量不随时间变化,说明已经达到平衡;D.丙烷的消耗速率等于丙烯的生成速率,描述的都是正反应,不能说明反应已达平衡;故选AD。
(3)已知:Rln k= +C,则Rln k=-Ea× +C,斜率越大说明Ea越大。活化能越小反应越快,活化能越大反应越慢,结合图像可知,Cat2反应的活化能小,催化效能较高,依据为直线斜率小,活化能小。
(4)①反应1和反应2均为吸热反应,升高温度平衡正向移动,丙烷转化率增大;反应1为气体分子数增加的反应,反应2为气体分子数不变的反应,增大压强导致反应1逆向移动,丙烷转化率下降;结合图像可知,X代表温度,相同条件下,增大压强导致反应1逆向移动,丙烷转化率下降,故Y2②M点时,丙烷转化率为60%,反应的丙烷为0.6 mol;
C3H8(g) C3H6(g)+H2(g)
起始/mol 1 0 0
转化/mol 0.6 0.6 0.6
平衡/mol 0.4 0.6
CO2(g)+H2(g) CO(g)+H2O(g)
起始/mol 1
转化/mol a a a a
平衡/mol
C3H8(g)和H2(g)的浓度相等,则0.4=0.6-a,a=0.2;则平衡时二氧化碳、氢气、一氧化碳、水分别为0.8 mol、0.4 mol、0.2 mol、0.2 mol,反应2为等分子数的反应,则M点对应的反应2的平衡常数
(5)其他条件不变,当总压一定时,C3H8的投料增加,占比越大分压越大,导致平衡向左移动,使得C3H8的平衡转化率减小。当 等于2时,经10 min达到平衡,C3H8(g)的转化率为40%,假设丙烷投料2 mol、氩气1 mol,则反应的丙烷为0.8 mol。
C3H8(g) C3H6(g)+H2(g)
起始/mol 2 0 0
转化/mol 0.8 0.8 0.8
平衡/mol 1.2 0.8 0.8
则平衡时总的物质的量为3.8 mol,丙烯的分压变化速率为 kPa·min-1 =1.6 kPa·min-1。
7.草酸二甲酯[(COOCH3)2]催化加氢制乙二醇的反应体系中,发生的主要反应为
反应Ⅰ:(COOCH3)2(g)+2H2(g) CH3OOCCH2OH(g)+CH3OH(g) ΔH1<0
反应Ⅱ:(COOCH3)2(g)+4H2(g) HOCH2CH2OH(g)+2CH3OH(g) ΔH2<0
压强一定的条件下,将(COOCH3)2、H2按一定比例、流速通过装有催化剂的反应管,测得(COOCH3)2的转化率及CH3OOCCH2OH、HOCH2CH2OH的选择性
与温度的关系如图所示。下列说法正确的是( )
A.曲线B表示HOCH2CH2OH的选择性随温度变化
B.190~198 ℃范围内,温度升高,(COOCH3)2的平衡转化率增大
C.190~198 ℃范围内,温度升高, 逐渐减小
D.192 ℃时,其他条件一定,加快气体的流速可以提高(COOCH3)2的转化率
答案 C
解析 曲线A上CH3OOCCH2OH选择性为50%时,曲线C表示HOCH2CH2OH的选择性恰好为50%,则曲线C表示HOCH2CH2OH的选择性随温度变化,A错误;两反应均为放热反应,升高温度,平衡逆向移动,190~198 ℃范围内,温度升高,(COOCH3)2的平衡转化率减小,B错误;190~198 ℃范围内,温度升高,反应Ⅱ的选择性增大,升高温度,对于放热反应,平衡逆向移动,每减少2 mol CH3OH,只减少1 mol HOCH2CH2OH,HOCH2CH2OH减小的幅度小于
CH3OH,故 逐渐减小,C正确;192 ℃时,其他条件一定,加快气体的流速,反应物(COOCH3)2转化率降低,D错误。
考点3化学平衡常数和转化率
聚焦核心要点
要点1化学平衡常数及应用
课标指引:1.认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义。 2.能书写平衡常数表达式,能进行平衡常数的简单计算。
1.高考常考的三种化学平衡常数[以反应mA(g)+nB(g) pC(g)+qD(g)为例]
2.结合化学方程式计算平衡常数
(1)同一可逆反应中,K(正)·K(逆)=1,其中K(正)表示正反应平衡常数,K(逆)表示逆反应平衡常数。
(2)若两个可逆反应的方程式相加,得到总反应方程式,如反应①+反应②=反应③,则总反应的平衡常数等于各分步反应的平衡常数之积,则有K3=K1·K2。
(3)若两个可逆反应的方程式相减,得到总反应方程式,如反应①-反应②=反应③,则总反应的平衡常数等于各分步反应的平衡常数之商,则有
要点2转化率和产率的计算
课标指引:1.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。 2.能进行转化率、产率的简单计算。
1.掌握常考的四种计算关系
变化量可以是物质的量或物质的量浓度
计算理论产量时,要注意过量计算
2.掌握常用的两个定量关系
易错辨析
1.减小反应物的浓度,平衡逆向移动,化学平衡常数减小。( )
2.化学平衡常数表达式中应含有参加反应的所有物质。( )
3.化学平衡常数能体现可逆反应进行的程度。( )
4.平衡常数发生变化,化学平衡必定发生移动。( )
×
K值只受温度影响,与物质的浓度、压强变化无关。
×
固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中。
√
K值越大,反应进行的程度越大。
√
平衡常数发生变化,说明温度发生改变,故化学平衡必定发生移动。
精研核心命题
命题点1化学平衡常数及计算
典例1 (2023·全国乙卷,28节选)(1)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:
2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)
平衡时 的关系如下图所示。660 K时,
该反应的平衡总压p总= kPa、
平衡常数Kp(Ⅰ)= (kPa)2。Kp(Ⅰ)
随反应温度升高而 (填“增大”
“减小”或“不变”)。
3
2.25
增大
46.26
(2)此体系为恒容体系,压强之比等于物质的量之比。开始时,SO2和SO3的压强相同,升高温度,三氧化硫进一步分解得到二氧化硫与氧气,设反应(Ⅰ)平衡时SO2的压强为a kPa,反应(Ⅱ)达到平衡时,SO3的转化压强为y kPa,根据反应方程式分析:
2SO3(g) 2SO2(g) + O2(g)
开始/kPa a a 0
转化/kPa y y
平衡/kPa a-y a+y
变式演练(2022·全国甲卷,28节选)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1 000 ℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2(s)+2Cl2(g) ══ TiCl4(g)+O2(g) ΔH1=+172 kJ·mol-1,
=1.0×10-2
(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s) ══TiCl4(g)+2CO(g)ΔH2=-51 kJ·mol-1,
=1.2×1012 Pa
则反应2C(s)+O2(g) ══ 2CO(g)的Kp= Pa。
1.2×1014
(2)在1.0×105 Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
则反应C(s)+CO2(g)══2CO(g)
的平衡常数Kp(1 400 ℃)=
Pa。
7.2×105
【思维建模】
计算压强平衡常数(Kp)的思维模型
在化学平衡体系中,用各气体物质的平衡分压替代平衡浓度计算的平衡常数叫压强平衡常数(Kp),计算步骤如下:
命题点2平衡转化率和平衡浓度的计算
典例2 (2021·全国甲卷,28节选)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。其总反应可表示为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1。回答下列问题:
合成总反应在起始物 =3时,
在不同条件下达到平衡,设体系中
甲醇的物质的量分数为x(CH3OH),
在t=250 ℃下的x(CH3OH)~p、在
p=5×105 Pa下的x(CH3OH)~t如图所示。
(1)用各物质的平衡分压表示总反应的平衡常数,表达式
Kp= ;
(2)图中对应等压过程的曲线是 ,判断的理由是
;
(3)当x(CH3OH)=0.10时,CO2的平衡转化率α= ,反应条件可能为 或 。
b
总反应ΔH<0,升高温度时平衡向逆反应方向移动,甲醇的物质的量分数变小
33.3%
5×105 Pa,210 ℃
9×105 Pa,250 ℃
解析 (1)二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g) ══ CH3OH(g)+H2O(g),因此利用各物质的平衡分压表示总反应的平衡常数,表达式
(2)该反应正向为放热反应,升高温度时平衡逆向移动,体系中x(CH3OH)将减小,因此图中对应等压过程的曲线是b。
(3)设起始n(CO2)=1 mol,n(H2)=3 mol,则
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始/mol 1 3 0 0
转化/mol x 3x x x
平衡/mol 1-x 3-3x x x
变式演练(2023·全国甲卷,28节选)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4 M++CH3OH,结果如下图所示。图中300 K的曲线是 (填“a”或“b”)。300 K、60 s时MO+的转化率为 (列出算式)。
b
(1-10-0.1)×100%
训练分层落实
练真题·明考向
1.(2022·重庆卷)两种酸式碳酸盐的分解反应如下,某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s) NH3(g)+H2O(g)+CO2(g) p1=3.6×104 Pa
反应2:2NaHCO3(s) Na2CO3(s)+H2O(g)+CO2(g) p2=4×103 Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是( )
A.反应2的平衡常数为4×106 Pa2
B.通入NH3,再次平衡后,总压强增大
C.平衡后总压强为4.36×105 Pa
D.缩小容积,再次平衡后总压强不变
B
2.(2022·湖南卷,16节选)在一定温度下,向容积固定的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4 kJ·mol-1
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
(1)下列说法正确的是 。
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数可能大于
D.将炭块粉碎,可加快反应速率
BD
(2)反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 mol。此时,整个体系 (填“吸收”或“放出”)热量 kJ,反应Ⅰ的平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
吸收
31.2
0.02 MPa
解析 (2)反应平衡时,H2O(g)的转化率为50%,则消耗H2O(g)的物质的量为
1 mol×50%=0.5 mol。CO的物质的量为0.1 mol,据O原子守恒可知,n(CO2)=
0.2 mol,生成0.2 mol CO2时消耗0.2 mol CO,故反应Ⅰ实际生成0.3 mol CO。据热化学方程式可知,生成0.3 mol CO要吸收热量39.42 kJ,生成0.2 mol CO2要放出热量8.22 kJ,此时整个体系吸收热量为39.42 kJ-8.22 kJ=31.2 kJ。
由H原子守恒可知,平衡时n(H2)=0.5 mol,n(CO)=0.1 mol,n(CO2)=0.2 mol,n(H2O)=0.5 mol,则平衡时气体的总物质的量为0.5 mol+0.1 mol+0.2 mol+
0.5 mol=1.3 mol。在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,则平衡体系的总压为0.2 MPa×1.3=0.26 MPa,故反应Ⅰ的平衡常数
练易错·避陷阱
3.(2023·北京丰台区一模)下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是( )
化学反应 平衡常数 温度 973 K 1 173 K
①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1 K1 1.47 2.15
②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2 K2 2.38 1.67
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3 K3 a b
A.1 173 K时,反应①起始c(CO2)=0.6 mol·L-1,平衡时c(CO2)约为0.4 mol·L-1
B.反应②是吸热反应,ΔH2>0
C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动
D.相同温度下,K3= ;ΔH3=ΔH2-ΔH1
D
解析 1 173 K时,反应①起始c(CO2)=0.6 mol·L-1,设CO2的转化量为x mol·L-1,列出三段式:
Fe(s)+CO2(g) FeO(s)+CO(g)
起始/(mol·L-1) 0.6 0
转化/(mol·L-1) x x
平衡/(mol·L-1) 0.6-x x
4.(2022·海南卷,16节选)已知:CO2(g)+4H2(g) 2H2O(g)+CH4(g)的平衡常数(K)与反应温度(t)之间的关系如图所示。
某研究小组模拟该反应,温度t ℃下,向容积为10 L的抽空的密闭容器中通入0.1 mol CO2和0.4 mol H2,反应平衡后测得容器中n(CH4)=0.05 mol,则CO2的转化率为 ,反应温度t约为 ℃。
50%
660.2
解析 反应平衡后测得容器中n(CH4)=0.05 mol,列出“三段式”如下:
CO2(g)+4H2(g) 2H2O(g) + CH4(g)
起始/mol 0.1 0.4 0 0
转化/mol 0.05 0.2 0.1 0.05
平衡/mol 0.05 0.2 0.1 0.05
练预测·押考向
5.氨气去除NO的反应原理为4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH<0,反应速率与浓度之间存在如下关系:v(正)=k(正)·c4(NH3)·c6(NO), v(逆)=k(逆)·c5(N2)·c6(H2O),k(正)、k(逆)为速率常数,只受温度影响。350 ℃时,在2 L恒容密闭容器中,通入0.45 mol NH3(g)和0.6 mol NO(g)发生反应,保持温度不变,5 min后反应达平衡,NO的转化率为50%。下列说法正确的是( )
A.用NH3表示的化学反应速率为0.06 mol·L-1·min-1
B.350 ℃时,该反应的平衡常数为0.5
C.其他条件不变,往反应后的容器中再通入0.45 mol NH3(g)和0.6 mol NO(g),重新达平衡时NO的体积分数减小
D.当温度改变为T ℃时,若k(正)=k(逆),则T<350
D
解析 由题意可列如下三段式:
4NH3(g)+6NO(g) 5N2(g)+6H2O(g)
起始/mol 0.45 0.6 0 0
转化/mol 0.2 0.3 0.25 0.3
平衡/mol 0.25 0.3 0.25 0.3
6.我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]制备三甲胺[N(CH3)3],反应方程式如下:(CH3)2NCHO(g)+2H2(g) N(CH3)3(g)+H2O(g) ΔH=-144 kJ·mol-1。向容积相等的Ⅰ、Ⅱ两个恒容密闭容器中分别充入1 mol DMF(g)和2 mol H2(g)发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
(1)容器Ⅰ中为 (填“绝热”或“恒温”)过程,判断的依据是 。
(2)若该反应是在恒温恒容的密闭容器中发生,以下能说明该反应达到化学平衡状态的是 (填字母)。
A.混合气体的密度不再发生改变
B.反应容器中H2的质量分数不变
C.2v正(H2)=v逆(H2O)
D.平均相对分子质量不变
E.该反应的焓变,即ΔH不变
(3)n点时反应的平衡常数Kp= kPa-1(提示:用分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
绝热
容器Ⅰ中的压强比容器Ⅱ中的压强大
BD
0.562 5
解析 (1)该反应是放热反应,若容器绝热,则反应过程中温度升高,不利于平衡正向移动;又知该反应的正反应是气体体积减小的反应,容器的压强大于恒温容器中平衡时的压强,题图中容器Ⅰ中的压强比容器Ⅱ中的压强大,则容器Ⅰ中为绝热过程。
(2)该反应中气体总质量和总体积都不变,则混合气体的密度是定值,不能说明反应达到平衡,A错误;反应容器中H2的质量分数不变,其浓度不变,则该反应达到平衡,B正确;达到平衡时,v正(H2)=2v逆(H2O),C错误;该反应中气体平均相对分子质量增大,当混合气体平均相对分子质量不变时,则反应达到平衡,D正确;该反应的焓变是定值,ΔH不变,不能判断反应是否平衡,E错误。③n点反应达到平衡,此时体系压强为36 kPa,起始压强是48 kPa,设(CH3)2NCHO的转化量为x mol,根据已知条件列出三段式:
(CH3)2NCHO(g) + 2H2(g) N(CH3)3(g)+H2O(g)
起始/mol 1 2 0 0
转化/mol x 2x x x
平衡/mol 1-x 2-2x x x
考点4化学反应速率和平衡图像
聚焦核心要点
要点化学平衡图像及分析
1.浓度(转化率、百分含量)-时间图像及分析
C%指生成物的百分含量,B%指反应物的百分含量。
微点拨
解题“秘钥”——“先拐先平,数值大”。即曲线先出现拐点的首先达到平衡,反应速率快,以此判断温度或压强的高低,再依据外界条件对平衡的影响分析判断反应的热效应及反应前后气体体积的变化。
2.转化率(或质量分数)与压强-温度图像
(1)恒压线图像
(2)恒温线图像
微点拨
表示两个外界条件同时变化时,反应物A的转化率变化情况,解决这类图像一般采用“定一议二”的方法,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。
3.两类特殊图像
(1)对于化学反应mA(g)+nB(g) pC(g)+qD(g),M点前,表示从反应开始,v(正)>v(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升高温度,A%增加或C%减少,平衡逆向移动,则有ΔH<0。
(2)对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点。L线的上方(E点),A%大于此压强时平衡体系中A%,则E点满足v(正)>v(逆);同理L线的下方(F点)满足v(正)精研核心命题
命题点1浓度(速率、转化率)-时间图像及分析
典例1 (2023·湖南卷)向一恒容密闭容器中加入1 mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比 随温度的变化曲线如图所示。下列说法错误的是( )
A.x1B.反应速率:vb正C.点a、b、c对应的平衡常数:KaD.反应温度为T1,当容器内压强不变时,
反应达到平衡状态
B
解析 加入1 mol CH4和一定量的H2O发生反应,增大n(H2O)时,x= 减小,但CH4的平衡转化率增大,结合图像知x1vc正,B错误;依据相同投料比时CH4转化率随温度变化曲线知,正反应为吸热反应,则温度升高,K值变大,故Ka变式演练(2023·湖南岳阳一模)在起始温度均为T ℃、容积均为10 L的密闭容器A(恒温)、B(绝热)中均加入1 mol N2O和4 mol CO,发生反应N2O(g)+CO(g) N2(g)+CO2(g) ΔH<0。已知k(正)、k(逆)分别是正、逆反应速率常数,v(正)=k(正)·c(N2O)·c(CO),v(逆)=k(逆)·c(N2)·c(CO2),A、B容器中N2O的转化率随时间的变化关系如图所示。下列说法错误的是( )
A.曲线M表示B容器中N2O的转化率随时间的变化
B.用CO的浓度变化表示曲线N在0~100 s内的反应速率为1×10-4 mol·L-1·s-1
C.Q点v(正)大于P点v(逆)
D
解析 该反应是放热反应,B(绝热)容器中温度高于A(恒温),又起始加入反应物量相同,则相同时间内B中速率大,先达到平衡,故M线表示B容器中N2O的转化率随时间的变化,A正确;曲线N在0~100 s N2O转化率为10%,则消耗N2O为0.1 mol,同时消耗0.1 mol CO,则有v(CO)= =1×10-4 mol·L-1·s-1,B正确;P点和Q点N2O转化率相同且均未达平衡,即P点v(正)>v(逆),又Q点温度高于P点,则Q点v(正)>P点v(正),故Q点v(正)>P点v(逆),C正确;曲线N达到平衡时N2O转化率为25%,即消耗0.25 mol N2O和0.25 mol CO,则平衡时N2O为0.75 mol、CO为3.75 mol、N2为0.25 mol、CO2为0.25 mol,由于平衡时有v(正)=v(逆),则
命题点2温度(或压强)-时间图像及分析
典例2 (2022·湖南卷,14改编)向容积均为1 L的两恒容容器中分别充入2 mol X和1 mol Y发生反应:2X(g)+Y(g) Z(g) ΔH,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
A.ΔH>0
B.气体的总物质的量:naC.a点平衡常数:K<12
D.反应速率:va正B
解析 甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程pV=nRT可知,刚开始压强增大的原因是容器内的温度升高,则上述反应放热,即ΔH<0,A错误。该反应为放热反应,图中a点和c点的压强相等,甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,说明a点气体总物质的量小于c点时气体总物质的量,即na 2X(g)+Y(g) Z(g)
起始/(mol·L-1) 2 1 0
转化/(mol·L-1) 2x x x
平衡/(mol·L-1) 2-2x 1-x x
变式演练(2023·广东佛山一模)一定温度下,在刚性容器中加入等物质的量的H2(g)与NO(g)发生反应:2H2(g)+2NO(g) N2(g)+2H2O(g) ΔH<0,测得H2(g)与H2O(g)的分压随时间变化如图所示。下列说法正确的是( )
A.当气体密度不再变化时,反应达到平衡
B.体系中气体总物质的量n初始∶n平衡=5∶4
C.升高温度,反应速率:v(正)减小,v(逆)增大
D.该反应的活化能:E(正)>E(逆)
B
解析 反应过程中气体总质量不变,容器容积不变,则气体密度保持不变,不能判断反应是否达到平衡,A错误;根据题意,列出三段式:
2H2(g)+2NO(g) N2(g)+2H2O(g) 总压强
起始/kPa 2.5p0 2.5p0 0 0 5p0
变化/kPa 2p0 2p0 p0 2p0
平衡/kPa 0.5p0 0.5p0 p0 2p0 4p0
则体系中气体总物质的量:n初始∶n平衡=p初始∶p平衡=5p0∶4p0=5∶4,B正确;升高温度,正、逆反应速率都增大,C错误;该反应为放热反应,则正反应活化能小于逆反应活化能,D错误。
【思维建模】解答化学反应速率和平衡图像类题目的思维模型
练真题·明考向
1.(2022·浙江1月选考卷)在恒温恒容条件下,发生反应A(s)+2B(g) 3X(g), c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是( )
A.从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率
B.从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
训练分层落实
D.维持温度、容积、反应物的起始量不变,向反应
体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示
C
解析 题图中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化计算得到,从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率,A正确;b点处的切线的斜率是CO的瞬时速率,B正确;化学反应速率之比等于化学方程式中各物质的化学计量数之比,则有3v(B)=2v(X),C错误;维持温度、容积不变,向反应体系中加入催化剂,平衡不移动,反应速率增大,达到新的平衡状态,平衡状态与原来的平衡状态相同,D正确。
2.(2021·重庆卷)甲异腈(CH3NC)在恒容密闭容器中发生异构化反应: CH3NC(g) ―→ CH3CN(g),反应过程中甲异腈浓度c随时间t的变化曲线如图所示(图中T为温度)。该反应的反应速率v与c的关系为v=kc,k为速率常数(常温下为常数),a点和b点反应速率相等,即v(a)=v(b)。下列说法错误的是( )
A.b~f段的平均反应速率为
1.0×10-4 mol·L-1·min-1
B.a点反应物的活化分子数多于d点
C.T1>T2
D.3v(d)=2v(e)
C
练易错·避陷阱
3.(2023·河北沧州一模)T ℃时,向容积为2 L的刚性容器中充入1 mol CO2和一定量的H2发生反应:CO2(g)+2H2(g) HCHO(g)+H2O(g),达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始 的关系如图所示。已知:初始加入2 mol H2时,容器内气体的总压强为1.2p kPa。下列说法错误的是( )
A.5 min时反应到达c点,v(H2)=0.1 mol·L-1·min-1
D.c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.2p kPa,平衡不移动
B
4.(2023·陕西西安统考二模)恒温密闭容器中,发生反应:2CO2(g)+6H2(g)
C2H4(g)+4H2O(g) ΔH<0。起始时,若按照n(CO2)∶n(H2)=1∶3的投料比充入容器,测得平衡时n(H2)和n(H2O)随温度的变化如图所示。下列说法中正确的是( )
A.L线表示平衡时n(H2O)随温度的变化
B.其他条件不变时,若扩大容器容积,则
v正减小,v逆增大
C.x=5.16
D.使用催化剂,可降低反应的活化能,减小ΔH的值
C
解析 由于ΔH<0,随着温度的升高,平衡逆向移动,n(H2)增大,n(H2O)减小,故L为n(H2)随温度的变化曲线,A错误;其他条件不变时,若扩大容器容积,浓度均减小,则v正、v逆均减小,B错误;由图知,在393 K时,n(H2)=4.2 mol, n(H2O)=5.8 mol,升高温度,反应将向逆反应方向移动,在a点时, n(H2)=n(H2O),设由393 K升温到460 K时,H2O(g)反应的物质的量为b mol,由关系式6H2(g)~4H2O(g),得4.2+ b=5.8-b,b=0.64,x=5.16,C正确;使用催化剂,降低反应的活化能,但不能减小ΔH的值,D错误。
练预测·押考向
5.T ℃时,含等浓度的AgNO3与Fe(NO3)2的混合溶液中发生反应Fe2+(aq)+Ag+(aq) Fe3+(aq)+Ag(s) ΔH<0,t1时刻,改变某一外界条件继续反应至t2(t2=4t1)时刻,溶液中c(Ag+)和c(Fe3+)随时间的变化关系如图所示。下列说法正确的是( )
已知:T ℃时,该反应的化学平衡常数K=1。
A.若t1时刻未改变外界条件,则此时该反应处于平衡状态
B.若t2时刻反应达到平衡,则t1时刻改变的条件可能为升温
C.若始终保持温度不变,则平均反应速率: 表示0~t1 s内Fe2+的平均反应速率, 表示0~t2 s内Fe2+的平均反应速率)
D.0~t2 s内Ag+的平均反应速率为 mol·L-1·s-1
答案 A
6.水煤气变换:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)将一定量的CO(g)和H2O(g)充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO的转化率与温度的变化如图1所示:点1~3中,达到平衡状态的点是 ;降低水煤气变换反应活化能效果最差的催化剂是 (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
图1
3
Ⅲ
(2)对于反应CO(g)+H2O(g) CO2(g)+H2(g),采用催化剂Ⅰ,在1 073 K和973 K时,在恒容密闭容器中充入等物质的量的CO(g)、H2O(g),CO的转化率随时间变化的结果如图2所示。
图2
①下列能表示该反应达到化学平衡状态的
是 (填字母)。
A.容器内压强不再变化
B.容器内气体的密度不再变化
C.混合气体的平均摩尔质量不再变化
D.v正(CO)=v逆(CO2)
D
②973 K时CO的平衡转化率α= %,1 073 K时该反应的平衡常数K= (写成分数形式,下同)。
③已知反应速率v=v(正)-v(逆)=k(正)x(CO)·x(H2O)-k(逆)x(CO2)·x(H2),k(正)、k(逆)分别为正、逆向反应速率常数,x为物质的量分数,计算点a处的
27
解析 (1)从题图中可知,同等条件下,在催化剂Ⅰ的作用下,相同时间内CO的转化率是最高的,所以催化剂Ⅰ的催化效果是最好的,催化剂Ⅲ效果最差,速率最慢,所以降低活化能的效果最差;该反应在点3达到平衡状态。
(2)①该反应为气体分子数不变的反应,故反应过程中,容器内压强始终不变,A项错误;恒容则容器容积不变,容器内气体的质量不变,故混合气体的密度始终不变,B项错误;气体的质量不变,气体的物质的量也不变,混合气体的平均摩尔质量也一直保持不变,C项错误;该反应过程中始终存在v正(CO)=v正(CO2),所以v正(CO2)=v逆(CO2)时,同一种物质的反应速率v(正)=v(逆),反应达到平衡状态,故D项正确。②该反应为放热反应,降低温度,平衡正向移动,CO的平衡转化率增大,973 K时反应的平衡转化率是27%。设CO(g)、H2O(g)的浓度均为1 mol·L-1,由题图知,1 073 K时CO的平衡转化率为25%。由三段式可知:
CO(g)+H2O(g) CO2(g)+H2(g)
起始/(mol·L-1) 1 1 0 0
转化/(mol·L-1) 0.25 0.25 0.25 0.25
平衡/(mol·L-1) 0.75 0.75 0.25 0.25
③由v=v(正)-v(逆)=k(正)x(CO)·x(H2O)-k(逆)x(CO2)·x(H2)可知v(正)=k(正)x(CO)·x(H2O);v(逆)=k(逆)x(CO2)·x(H2)。平衡时有v(正)=v(逆),即 ,点a处CO的转化率为20%。由三段式可知:
CO(g)+H2O(g) CO2(g)+H2(g)
起始/(mol·L-1) 1 1 0 0
转化/(mol·L-1) 0.20 0.20 0.20 0.20
a点/(mol·L-1) 0.80 0.80 0.20 0.20
突破高考题型(七)化学反应原理综合题
高考指引:近几年,全国及各省市化学试题都考查了化学反应原理综合题,大多以工业生产、环境保护等为命题载体,考查点主要集中在反应热的计算和盖斯定律的应用、化学平衡图像及分析、化学平衡的计算、电化学及应用等,侧重考查考生的“理解与辨析能力”“分析与推测能力”“归纳与论证能力”等关键能力。
突破点1 反应热的计算
核心归纳
1.化学反应原理综合题的考查角度
2.利用盖斯定律计算反应热的思维模型
3.利用键能(或活化能)计算反应热
(1)反应热ΔH=反应物的总键能-生成物的总键能。
(2)反应热ΔH=Ea(正反应)-Ea(逆反应)(Ea代表活化能)。
真题感悟
1.(2022·海南卷,16节选)某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:CO2(g)+4H2(g) 2H2O(g)+CH4(g)。
已知:电解液态水制备1 mol O2(g),电解反应的ΔH=+572 kJ·mol-1。由此计算H2(g)的燃烧热(焓)ΔH= kJ·mol-1。
-286
解析 根据题意,写出电解反应的热化学方程式:2H2O(l) ══ 2H2(g)+O2(g) ΔH=+572 kJ·mol-1,据此可得热化学方程式:2H2(g)+O2(g) ══ 2H2O(l) ΔH=-572 kJ·mol-1,结合燃烧热的概念推知,H2(g)的燃烧热(焓)
ΔH=-572 kJ·mol-1× =-286 kJ·mol-1。
2.(2021·江苏卷,18节选)CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ:CH4(g)+CO2(g) ══ 2CO(g)+2H2(g) ΔH=+246.5 kJ·mol-1
反应Ⅱ:H2(g)+CO2(g) ══ CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
反应Ⅲ:2CO(g) ══ CO2(g)+C(s) ΔH=-172.5 kJ·mol-1
在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g) ══ 4CO(g)+8H2(g)的ΔH= 。
+657.1 kJ·mol-1
解析 分析已知热化学方程式,根据盖斯定律,由反应Ⅰ×3-Ⅱ×2可得反应3CH4(g)+CO2(g)+2H2O(g) ══ 4CO(g)+8H2(g),则有ΔH=(+246.5 kJ·mol-1) ×3-(+41.2 kJ·mol-1)×2=+657.1 kJ·mol-1。
突破点2 化学平衡图像分析及最佳条件的选择
核心归纳
1.化学平衡图像中信息加工处理的方法
2.化学平衡移动的定性分析与定量计算
3.化工生产中最佳反应条件的选择
化工生产中反应条件的选择,除应考虑反应速率、反应限度等反应本身的因素外,还必须考虑生产成本,如动力设备要求、原料和能量的充分利用等。
条件 原则
从化学反应速率分析 既不能过快,又不能太慢
从化学反应限度分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析 如设备承受高温、高压能力等
从催化剂的使用活性分析 注意温度对催化剂活性的限制
真题感悟
3.(2020·全国Ⅲ卷,28节选)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)= 。当反应达到平衡时,若增大压强,则n(C2H4) (填“变大”“变小”或“不变”)。
1∶4
变大
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是 、 。CO2催化加氢合成C2H4反应的ΔH (填“大于”或“小于”)0。
d
c
小于
(3)根据图中点A(440 K,0.39),计算该温度时反应的平衡常数
Kp= (MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
选择合适的催化剂
解析 (1)二氧化碳催化加氢合成乙烯的反应方程式为2CO2+6H2 C2H4+4H2O,所以产物的物质的量之比n(C2H4)∶n(H2O)=1∶4,由于该反应是气体分子总数减少的反应,根据勒夏特列原理可知,加压平衡向正反应方向移动,所以增大压强,n(C2H4)变大。
(2)由于原料初始组成n(CO2)∶n(H2)=1∶3,且温度升高时二者变化趋势相同(即均增大或均减小),而生成的n(C2H4)∶n(H2O)=1∶4,且温度升高时二者变化趋势相同(即均增大或均减小),所以根据390 K平衡时各物质的质量分数之间的关系可知:c、a分别表示的是CO2和H2,b、d分别表示H2O与C2H4,所以表示C2H4、CO2变化的曲线分别是d和c;由图可知升高温度CO2和H2的物质的量分数增大,即平衡向逆反应方向移动,根据勒夏特列原理可知该反应为放热反应,即ΔH小于0。
(3)根据图中点A(440 K,0.39)可知此时H2和H2O的物质的量分数均为0.39,即二者分压均为0.039 MPa,由于原料初始组成n(CO2)∶n(H2)=1∶3,而且二者反应过程中也是按照物质的量1∶3的比例生成或者消耗,所以二者的物
(4)由于该反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃,由于不同的催化剂在不同的温度下对反应的选择性不同,所以要想提高反应速率和乙烯选择性,应该选择合适的催化剂。
突破点3 有关化学平衡的计算
核心归纳
1.计算化学平衡常数和转化率的思维模型
2.速率常数(k)与平衡常数(K)之间的关系
(1)建立关系的依据是达到平衡状态时,v(正)=v(逆)。
(2)T ℃时,可逆反应:aA(g)+bB(g) gG(g)+hH(g), v(正)=k(正)ca(A)·cb(B),v(逆)=k(逆)cg(G)·ch(H)。达到平衡状态时v(正)=v(逆),则有k(正)ca(A)·cb(B)=k(逆)cg(G)·ch(H),故化学平衡常数
真题感悟
4.(2023·湖北卷,19节选)纳米碗C40H10是一种奇特的碗状共轭体系。
(1)1 200 K时,假定体系内只有反应C40H12(g) C40H10(g)+H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平
衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
两个反应的化学键变化相似,使得ΔH数值相近,ln K的斜率取决于ΔH,所以两条线几乎平行
解析 (1)起始C40H12为整体1,平衡转化率为α,列出三段式:
C40H12(g) C40H10(g)+H2(g)
起始: 1 0 0
转化: α α α
平衡: 1-α α α
(2)因两个反应的化学键变化相似,使得ΔH数值相近,ln K的斜率取决于ΔH,所以两条线几乎平行。
5.(2021·全国乙卷,28节选)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
McMorris测定和计算了在136~180 ℃范围内下列反应的平衡常数Kp:
(1)由图可知,NOCl分解为NO和Cl2反应的ΔH (填“大于”或“小于”)0。
(2)反应2ICl(g) Cl2(g)+I2(g)的K= (用 表示);该反应的ΔH (填“大于”或“小于”)0,写出推理过程 。
大于
大于
解析 (1)由图可知, 随着温度的升高而增大,说明升高温度,平衡正向移动,则NOCl分解为NO和Cl2反应为吸热反应,ΔH大于0。(2)Ⅰ:2NO(g)+2ICl(g) 2NOCl(g)+I2(g),Ⅱ:2NOCl(g) 2NO(g)+Cl2(g),
根据盖斯定律Ⅰ+Ⅱ得2ICl(g) Cl2(g)+I2(g),则反应2ICl(g) Cl2(g)+I2(g)的K= ;假设T1>T2,通过分析lg K(T1)与lg K(T2)的相对大小判断ΔH的正负。
突破点4 电极反应式的书写及计算
核心归纳
1.书写电极反应式的思维模型
2.电化学装置图的分析方法
(1)判断物质类别:箭头一般指向生成物;箭尾一般指向反应物;
(2)判断方向:电子、离子、电流;
(3)判断电极反应:靠近电极的箭头曲线;
(4)判断物质进出:箭头曲线指向装置——进物质;箭头曲线背离装置——出物质。
3.电化学计算的方法
真题感悟
6.(2022·重庆卷,17节选)反应CO(g)+H2O(g) CO2(g)+H2(g)在工业上有重要应用,该反应可采用电化学方法实现,反应装置如图所示。
(1)固体电解质采用 (填“氧离子导体”或“质子导体”)。
(2)阴极的电极反应式为 。
(3)同温同压下,相同时间内,若进口Ⅰ处n(CO)∶n(H2O)=a∶b,出口Ⅰ处气
体体积为进口Ⅰ处的y倍,则CO的转化率为 (用a、b、y表示)。
氧离子导体
H2O+2e- ══ H2+O2-
解析 (2)电解时,阴极发生还原反应,电极反应式为H2O+2e- ══ H2+O2-。
(3)根据题给信息,列出三段式:
CO(g)+H2O(g) CO2(g)+H2(g)
起始/mol a b 0 0
转化/mol x x x x
平衡/mol a-x b-x x x
出口Ⅰ处气体为CO2,其物质的量为x mol,进口Ⅰ处的气体物质的量为
(a+b) mol,则x=(a+b)y,CO的转化率为
7.(2022·河北卷,16节选)氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)氢氧燃料电池中氢气在 (填“正”或“负”)极发生反应。
(2)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为 。
负
CnH2n+2+(3n+1)O2--(6n+2)e- ══ nCO2↑+(n+1)H2O
解析 (2)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2在负极发生氧化反应生成CO2和H2O。
考向预测演练
(2023·四川泸州二诊)铁的化合物在工业中有重要价值。回答下列问题:
(1)Fe(CO)5是一种重要的催化剂,制取反应为Fe(s)+5CO(g) Fe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.24 mol CO。
①0~30 min内在T温度下进行反应,测得c(CO)、c[Fe(CO)5]随时间的变化关系,以及30 min和40 min开始随条件的变化关系如图甲所示。0~20 min内用Fe(CO)5表示的平均反应速率为
mol·L-1·min-1;若平衡时体系总压强为p,则用气体分压表示的压强平衡常
数Kp= 。
图甲
2×10-3
②曲线Ⅰ代表 [填“CO”或“Fe(CO)5”]浓度的变化,30 min时改变的条件是 。40 min后曲线Ⅱ下降的原因是 。
图甲
CO
增大CO浓度或向体系中通入CO
平衡后升高温度,平衡逆向移动
(2)高铁酸钾(K2FeO4)被称为“绿色化学”净水剂,K2FeO4在水解过程中,铁元素形成的微粒分布分数与pH的关系如图乙所示,H2FeO4的一级电离平衡常数 = 。向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为 。
图乙
10-3.8
(3)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s) ══ MnFe2O(4-x)(s)+ O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g) ══ MnFe2O4(s)+xH2(g) ΔH2=a kJ·mol-1
③2H2O(g) ══ 2H2(g)+O2(g) ΔH3=+483.6 kJ·mol-1
则H2的燃烧热ΔH (填“>”“=”或“<”)-241.8 kJ·mol-1,
ΔH1= kJ·mol-1(用含a的代数式表示)。
<
+(241.8x-a)或-(a-241.8x)
解析 (1)①由图可知,0~20 min内,Fe(CO)5的浓度由0变化到0.04 mol·L-1,用Fe(CO)5表示的平均反应速率为 mol·L-1·min-1=
0.002 mol·L-1·min-1;若平衡时体系总压强为p,列三段式进行计算:
Fe(s)+5CO(g) Fe(CO)5(g)
起始/mol 0.24 0
转化/mol 0.2 0.04
平衡/mol 0.04 0.04
平衡时气体总物质的量为0.08 mol,则用气体分压表示的压强平衡常数
②曲线Ⅰ和Ⅱ对比,相同时间内,Ⅰ的变化量的绝对值大于Ⅱ,说明曲线Ⅰ对应物质的系数更大,即曲线Ⅰ代表CO浓度的变化;30 min时,CO浓度突然增大,而Fe(CO)5的浓度保持不变,说明30 min时改变的条件是增大CO浓度或向体系中通入CO;40 min后Fe(CO)5的浓度下降的原因是该反应达到平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,从而使Fe(CO)5的浓度下降。
专题七 化学反应速率与化学平衡
考情分析
高考命题分析
命 题 情 境 (1)生产环保情境:从能源(如氢能)、科技(合成氨、煤的气化等)、材料等情境选材,考查考生对陌生图像(图表)的辨识与应用,结合影响化学平衡的因素选择最佳反应条件,进行有关反应速率、化学平衡常数、转化率或产率等方面的计算,考查考生应用所学知识解决化工生产实际问题的能力。
(2)学术探索情境:从CO2的利用、反应机理研究等情境选材,要求考生能够对信息进行理解与辨析,从反应快慢和限度角度调控化学反应的转化率和产率,解决工业生产、科技创新等方面的实际问题。
素 养 能 力 (1)分析与推测能力:结合题目给定反应体系条件和可逆反应的特点,结合平衡图像中曲线变化,分析与推测化学反应速率和化学平衡的影响因素。
(2)理解与辨析能力:辨识化学反应速率和化学平衡的图像、图表等信息,提取关键信息,并与已学知识进行整合;辨析速率和平衡在解决生产、社会问题中运用的基本原理和方法,并能解决相关的化学问题。
(3)思维方法:分析题中图表信息或数据,提取关键信息,认识物质变化的特征及规律,进行化学反应速率和平衡常数的计算,利用平衡常数和浓度商的关系论证平衡移动方向,从定量角度推测化学平衡移动及结果。
考题统计
(1)化学反应速率及影响因素:
(2022全国甲卷,26)(2020全国Ⅰ卷,26)(2020全国Ⅱ卷,28)(2020全国Ⅲ卷,28)(2019全国Ⅰ卷,28)(2019全国Ⅱ卷,27)
(2)化学平衡的移动及分析:
(2023全国乙卷,28)(2022全国甲卷,13、28)(2022全国乙卷,28)(2020全国Ⅰ卷,28)(2020全国Ⅱ卷,28)(2020全国Ⅲ卷,28)(2019全国Ⅰ卷,28)(2019全国Ⅱ卷,27)(2019全国Ⅲ卷,28)
(3)化学平衡常数和转化率:
(2023全国甲卷,28)(2023全国乙卷,28)(2022全国甲卷,28)(2022全国乙卷,28)(2021全国甲卷,28)(2021全国乙卷,28)(2020全国Ⅰ卷,28)(2020全国Ⅱ卷,28)(2020全国Ⅲ卷,28)(2019全国Ⅰ卷,28)(2019全国Ⅱ卷,27)(2019全国Ⅲ卷,28)
(4)化学反应速率和平衡图像:
(2023全国甲卷,28)(2023全国乙卷,28)(2022全国甲卷,28)(2022全国乙卷,28)(2021全国甲卷,28)(2021全国乙卷,28)(2020全国Ⅰ卷,28)(2020全国Ⅲ卷,28)(2019全国Ⅰ卷,28)(2019全国Ⅱ卷,27)(2019全国Ⅲ卷,28)
考点1化学反应速率及影响因素
聚焦核心要点
要点1化学反应速率及影响因素
课标指引:1.知道化学反应速率的表示方法,了解测定化学反应速率的简单方法;能进行化学反应速率的简单计算。 2.通过实验探究,了解温度、浓度、压强和催化剂对化学反应速率的影响。
1.计算化学反应速率的两种方法
注意单位的规范书写
(1)依据定义式计算:依据“ ”计算时一定要注意容器的容积或溶液的体积,不能盲目地把Δn当作Δc代入公式进行计算。
(2)根据比例关系计算:对于反应“mA(g)+nB(g) ══ pC(g)+qD(g)”,不同物质的化学反应速率与化学计量数的关系:v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
2.外界条件对化学反应速率的影响及结果
微点拨
“惰性气体”(非反应气体)对化学反应速率的影响
要点2化学反应速率常数及应用
课标指引:1.知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响。 2.知道催化剂可以改变反应历程,对调控化学反应速率具有重要意义。
1.速率常数(k)
(1)速率常数(k)是指在给定温度下,反应物浓度皆为1 mol·L-1时的反应速率。
(2)在相同的浓度条件下,可用速率常数大小来比较化学反应的反应速率。
(3)速率常数是温度的函数,同一反应,温度不同,速率常数不同,温度相同,速率常数(k)相同。
浓度、压强不影响速率常数(k)
2.速率方程
对于基元反应:aA(g)+bB(g) gG(g)+hH(g),则v(正)=k(正)ca(A)·cb(B)[其中k(正)为正反应的速率常数],v(逆)=k(逆)cg(G)·ch(H)[其中k(逆)为逆反应的速率常数]。
易错辨析
1.升高温度时,不论正反应是吸热还是放热,正、逆反应的速率都增大。( )
2.碳酸钙与盐酸反应的过程中,再增加CaCO3固体,可以加快反应速率。( )
3.增大反应体系的压强,反应速率一定增大。( )
4.对于反应2H2O2 ══ 2H2O+O2↑,加入MnO2或降低温度都能加快O2的生成速率。( )
√
升高温度,正反应速率和逆反应速率都增大,但增大的程度不同。
×
固体或纯液体物质量的改变,不影响化学反应速率。
×
恒容情况下,在化学反应体系中加入不参与反应的气体,压强增大,而化学反应速率不变。
×
加入MnO2能加快O2的生成速率,降低温度会减慢O2的生成速率。
精研核心命题
命题点1化学反应速率及计算
典例1 (2019·全国Ⅰ卷,28节选)水煤气变换[CO(g)+H2O(g) ══ CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体
计算曲线a的反应在30~90 min内的平均速率 (a)= kPa·min-1。
0.004 7
解析 由题图可知,30~90 min内a曲线对应物质的分压变化量
Δp=(4.08-3.80) kPa=0.28 kPa,故曲线a的反应在30~90 min内的平均速率
思路剖析解答本题的思路如下:
变式演练(2023·宁夏中卫一模)CuBr2可用作有机合成溴化剂,在一定温度下CuBr2(s)可发生反应:2CuBr2(s) 2CuBr(s)+Br2(g),在密闭容器中投入足量的CuBr2(s),15分钟后反应到达平衡状态,此时Br2的浓度为9.5 mol·L-1。则这段时间内的平均反应速率v(Br2)= (保留两位小数)。如果温度保持不变,将容器容积缩小到原来的一半,则再次平衡时Br2的浓度为 mol·L-1。
0.63 mol·L-1·min-1
9.5
解析 在密闭容器中投入足量的CuBr2(s),发生反应2CuBr2(s) 2CuBr(s)+Br2(g),15分钟后反应到达平衡状态,此时Br2的浓度为9.5 mol·L-1。则这段时间内的平均反应速率v(Br2)= =0.63 mol·L-1·min-1;该温度下反应平衡常数K=c(Br2)=9.5 mol·L-1,如果温度保持不变,将容器容积缩小到原来的一半,平衡常数不变,则再次平衡时Br2的浓度为9.5 mol·L-1。
命题点2影响化学反应速率的因素
典例2 (2019·全国Ⅱ卷,27节选)环戊二烯( )容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是 (填字母)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L-1
CD
解析 由相同时间内,环戊二烯浓度减小量越大,反应速率越快可知,T1
A.其他条件相同时,催化剂浓度越大,反应速率越大
B.其他条件相同时,降冰片烯浓度越大,反应速率越大
C.条件①,反应速率为0.012 mol·L-1·min-1
D.条件②,降冰片烯起始浓度为3.0 mol·L-1时,半衰期为62.5 min
B
解析 对比曲线①②可知,其他条件相同时,催化剂浓度越大,反应所需要的时间更短,故反应速率越大,A正确;对比曲线①③可知,其他条件相同时,降冰片烯浓度①是③的两倍,所用时间①也是③的两倍,说明反应速率相等,故反应速率与降冰片烯浓度无关,B错误;条件①中Δc为3.0 mol·L-1,时间为
【思维建模】
利用“变量控制法”分析外界条件对化学反应速率的影响
命题点3速率常数(k)及其应用
典例3 (2022·河北卷,13改编)恒温恒容条件下,向密闭容器中加入一定量X,发生反应的方程式为
①X Y;②Y Z。反应①的速率v1=k1c(X),反应②的速率v2=k2c(Y),式中k1、k2为速率常数。图甲为该体系中X、Y、Z浓度随时间变化的曲线,图乙为反应①和②的ln k- 曲线。下列说法正确的是( )
A.随c(X)的减小,反应①、②的速率均降低
B.c(Y)达到最大值之前,体系中v(X)=v(Y)+v(Z)
C.欲提高Y的产率,需提高反应温度且控制反应时间
D.温度低于T1时,总反应速率由反应①决定
B
解析 随c(X)的减小,c(Y)先增大后减小,c(Z)逐渐增大,故反应①的速率随c(X)的减小而减小,而反应②的速率先增大后减小,A错误;在Y的浓度达到最大值之前,单位时间内Δc(X)=Δc(Y)+Δc(Z),根据速率之比等于单位时间内各物质的浓度变化之比,则有v(X)=v(Y)+v(Z),B正确;由题图可知,随着
增大(即T减小),k1、k2均减小,但k2减小幅度大于k1,即k2受温度影响较大,欲提高Y的产率,应使v1>v2,故应降低温度,C错误;由题图乙信息可知,降低温度,当温度低于T1时,k1>k2,v2减慢程度大,故总反应速率由反应②决定,D错误。
变式演练(2023·河北唐山一模)室温下,气体M、N、P、Q之间存在如下转化关系:①M N+P;②M N+Q,反应①的速率可表示为v1=k1c(M),反应②的速率可表示为v2=k2c(M)(k1、k2为速率常数),在容积为10 L的密闭容器中,反应体系中组分M、P的物质的量随时间的变化如下表所示:
t/min 0 1 2 3 4 5 6
M/mol 1.00 0.76 0.56 0.40 0.36 0.36 0.36
P/mol 0 0.06 0.11 0.15 0.16 0.16 0.16
下列说法正确的是( )
A.0~3 min时间段内,Q的平均反应速率为0.15 mol·L-1·min-1
B.反应开始后,体系中P和Q的浓度之比保持不变
C.平衡时M生成Q的转化率为36%
D.反应①的活化能比反应②的活化能低
B
解析 0~3 min内,Δn(M)=0.60 mol、Δn(P)=0.15 mol,则反应生成的n(Q)=0.60 mol-0.15 mol=0.45 mol,则Q的平均反应速率为
=0.015 mol·L-1·min-1,A错误;反应开始后,体系中P和Q的浓度变化量之比Δc(P)∶Δc(Q)=tv1∶tv2=k1c(M)∶k2c(M)=k1∶k2,由于k1、k2为定值,故反应开始后,体系中P和Q的浓度之比保持不变,B正确;由题表格数据可知,4 min反应达到平衡时,Δn(M)=0.64 mol、Δn(P)=0.16 mol,则反应生成的Q的物质的量为0.64 mol-0.16 mol=0.48 mol,故M生成Q的转化率为 ×100% =48%,C错误;反应①的反应速率慢于反应②,反应速率越快,活化能越小,则反应①的活化能比反应②的活化能高,D错误。
训练分层落实
练真题·明考向
1.(2022·浙江6月选考卷)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化如下表所示,下列说法不正确的是( )
编号 表面积/cm2 c(NH3)/(10-3 mol·L-1) 0 min 20 min 40 min 60 min 80 min
① a 2.40 2.00 1.60 1.20 0.80
② a 1.20 0.80 0.40 x
③ 2a 2.40 1.60 0.80 0.40 0.40
A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
答案 C
率,不影响化学平衡常数,实验③中氨气初始浓度与实验①相同,则实验③和①达到平衡时氨气浓度均为4.00×10-4 mol·L-1,而恒温恒容条件下,实验②相对于实验①为减小压强,平衡正向移动,故实验②中60 min时处于平衡状态,x<0.40,B正确;
实验①、实验②中0~20 min、20~40 min氨气浓度变化量都是
4.00×10-4 mol·L-1,实验②中60 min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨气初始浓度是实验②中氨气初始浓度的两倍,实验①中60 min时反应未达到平衡状态,相同条件下,增加氨气浓度,反应速率并没有增大,C错误;对比实验①和③,氨气浓度相同,实验③中催化剂表面积大,实验③先达到平衡状态,实验③的反应速率大,说明相同条件下,增加催化剂的表面积,反应速率增大,D正确。
2.(2022·辽宁卷,18节选)工业合成氨是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,其反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1 ΔS=-200 J·K-1·mol-1。
(1) (填“高”或“低”,下同)温有利于提高反应速率, 温有利于提高平衡转化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用400~500 ℃。
高
低
(2)某合成氨速率方程为v=kcα(N2)cβ(H2)·cγ(NH3),根据表中数据,γ= 。
-1
解析 (2)将实验1、3中数据分别代入合成氨的速率方程可得:
①q=k·mα·nβ·pγ,③10q=k·mα·nβ·(0.1p)γ,综合两式可得γ=-1。
练易错·避陷阱
3.(2023·浙江丽水、衢州一模)在密闭容器中发生反应2A(g) 2B(g)+C(g),其速率可表示为vp= 。在500 ℃,实验测得体系总压强数据如下表:
t/min 0 50 100 150 200
p总/kPa 200 250 275 x 293.75
下列说法正确的是( )
A.0~50 min,生成B的平均速率为1 kPa·min-1
B.第80 min的瞬时速率小于第120 min的瞬时速率
C.推测上表中的x为287.5
D.反应到达平衡时2v正(A)=v逆(C)
C
解析 等温等容条件下,气体的压强之比等于物质的量之比,由表格数据可知,0~50 min,Δp=50 kPa,结合反应2A(g) 2B(g)+C(g),ΔpB=2Δp=100 kPa,则生成B的平均速率为v正(B)= =2 kPa·min-1,A错误;0~50 min, Δp=50 kPa,50~100 min,Δp=25 kPa,而100~200 min,Δp=18.75 kPa,速率越来越慢,第80 min的瞬时速率大于第120 min的瞬时速率,B错误;第一个50 min, Δp=50 kPa,第二个50 min,Δp=25 kPa,如果第三个50 min,Δp=12.5 kPa,此时x为275+12.5=287.5,第四个50 min,Δp=6.25 kPa,200 min时287.5+6.25=293.75,推测出x为287.5,C正确;达到平衡时v(正)=v(逆),用不同物质表示同一反应速率,速率之比等于化学计量数之比,则反应达到平衡时v正(A)=2v逆(C),D错误。
4.(2023·浙江宁波一模)研究反应
2X Y+3Z的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是( )
A.比较实验①②得出:增大反应物浓度,化学反应速率加快
B.比较实验②④得出:升高温度,化学反应速率加快
C.若实验②③只有一个条件不同,则实验③使用了催化剂
D.在0~10 min之间,实验④的平均速率v(Y)=0.06 mol·L-1·min-1
D
解析 实验①②温度相同,但浓度不同,①浓度较大,可得出增大反应物浓度,化学反应速率加快,A正确;实验②④起始浓度相同,但温度不同,④反应速率较大,可得出温度升高,化学反应速率加快,B正确;实验②③温度、浓度相同,③反应速率较大,应该使用了催化剂,C正确;在0~10 min之间,实验④中X的浓度变化为0.60 mol·L-1,则
5.(2023·广东佛山一模)向1 L的恒容密闭容器中加入1 mol X和3 mol Y,发生反应X(g)+3Y(g) 2Z(g),X的转化率α随温度T的变化如图所示(不同温度下的转化率均为反应第10 min数据)。下列说法正确的是( )
A.a点的反应速率v(Z)=0.03 mol·L-1·min-1
B.a、b、c点对应的v逆(Y)大小关系:b>c>a
C.c点时,每消耗3 mol Y的同时,消耗2 mol Z
D.若将容器容积扩大为原来的2倍,则c点对应温度下的α(X)增大
C
解析 a点X的转化率为30%,反应消耗0.3 mol X,同时生成0.6 mol Z,则有v(Z)= =0.06 mol·L-1·min-1,A错误;由题图可知,a、b两点10 min时未达到平衡,c点10 min时达到平衡,而温度越高,正、逆反应速率越快,故a、b、c点对应的v逆(Y)大小关系:c>b>a,B错误;c点时达到平衡,消耗3 mol Y的同时消耗2 mol Z,即正、逆反应速率相等,C正确;该反应的正反应是气体体积减小的反应,若将容器容积扩大为原来的2倍,即减小容器压强,平衡逆向移动,α(X)减小,故c点对应温度下的α(X)减小,D错误。
练预测·押考向
6.某小组同学欲通过实验探究影响金属与酸反应速率的因素,进行下列实验。
序号 实验操作 实验现象
实验 1 取下胶塞,放入一小片金属钠,迅速塞上胶塞 钠浮在液面上并来回移动,表面出现白色固体,白色固体逐渐沉到锥形瓶底部,液体不沸腾;气球迅速鼓起,15 s时测量气球直径约为3 cm
实验 2 取下胶塞,放入与钠表面积基本相同的镁条,迅速塞上胶塞 镁条开始时下沉,很快上浮至液面,片刻后液体呈沸腾状,同时产生大量白雾;气球迅速鼓起,15 s时测量气球直径约为5 cm
下列说法不正确的是( )
A.上述实验不能说明Na比Mg的金属活动性强
B.上述实验能说明相同温度下,金属Na与酸反应比金属Mg与酸反应的速率慢
C.金属Na、Mg与盐酸反应的速率与反应物的接触面积等因素有关
D.向实验1所得溶液中通入HCl气体,会继续析出白色沉淀
答案 B
解析 钠表面生成了白色固体,阻碍了钠和酸的反应,上述实验不能说明Na比Mg的金属活动性强,A正确;上述实验现象受浓盐酸与钠反应的影响,生成NaCl覆盖在钠的表面,影响反应速率,不能说明相同温度下,金属Na与酸反应比金属Mg与酸反应的速率慢,但可以说明反应的速率与反应物的性质、反应物的接触面积等因素有关,B错误、C正确;向实验1所得溶液中通入HCl气体,氯离子浓度增大,会继续析出白色沉淀,D正确。
7.已知反-2-丁烯转化为顺-2-丁烯反应如下,ln k=ln A- ,ln k(正)和ln k(逆)随温度变化的曲线如图。下列有关该反应的说法正确的是( )
A.反-2-丁烯与顺-2-丁烯互为位置异构体
B.温度变化对k(正)的影响程度小于对k(逆)的影响程度
C.正反应的活化能大于逆反应的活化能
D.顺-2-丁烯比反-2-丁烯稳定
C
解析 反-2-丁烯与顺-2-丁烯互为顺反异构体,A错误;由题图可知,ln k(正)的斜率更大,受温度影响更大,温度变化对k(正)的影响程度大于对k(逆)的影响程度,B错误;题图中曲线的斜率代表活化能,正反应的斜率更大,活化能更大,C正确;正反应的活化能更大,则反应为吸热反应,则生成物具有的总能量大于反应物具有的总能量,故反-2-丁烯比顺-2-丁烯稳定,D错误。
8.(2023·青海海东一中一模)无论是在环境保护还是工农业生产方面,氮及其化合物一直是我国科研重点。
已知:反应ⅰ.6NO(g)+4NH3(g) 5N2(g)+6H2O(g) ΔH1=-1 808 kJ·mol-1;
反应ⅱ.N2(g)+3H2(g) 2NH3(g) ΔH2=-91.4 kJ·mol-1。
(1)向2 L刚性密闭容器中充入0.06 mol NO(g)和0.04 mol NH3(g),发生反应ⅰ。不同温度下,测得10 min时NO的转化率如图1所示。
图1
①T1 K下反应ⅰ的平均反应速率v(NO)= mol·L-1·min-1(用含α1的代数式表示)。
②NH3和NO(g)的有效碰撞频率M (填“>”“=”或“<”)N,原因为 。
③NO转化率先升高后降低的原因为
。
0.003α1
<
N点温度更高,活化分子百分数更大
温度低于T1时,10 min内反应未达到平衡,温度越高反应速率越快,NO的转化率增大;温度高于T1时,10 min内反应达到平衡,该反应为放热反应,升高温度平衡逆向移动,NO的转化率减小
(2)固氮在工农业生产中具有重要意义。
①反应ⅱ是工业固氮的反应原理,合成氨的速率公式为v=k·c(N2)·c1.5(H2)·c-1(NH3),其中k为反应速率常数。下列条件能影响k值大小的是 (填字母)。
A.反应温度 B.反应物的浓度 C.反应压强 D.催化剂
AD
②某固氮反应机理如图2所示:
图2
该固氮的总反应方程式为 ;已知三步反应的活化能由大到小的顺序为Ⅲ>Ⅰ>Ⅱ,则该固氮过程的决速步骤为_____ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
2N2+6H2O 4NH3+3O2
Ⅲ
解析 (1)①据图可知T1 K下,10 min时NO的转化率为α1,则Δn(NO)=
0.06α1 mol,容器容积为2 L,所以v(NO)= =0.003α1 mol·L-1·min-1。
②N点温度更高,活化分子百分比更高,所以N点有效碰撞频率更大,反应速率更快。
③温度低于T1时,10 min内反应未达到平衡,温度越高反应速率越快,NO的转化率增大;温度高于T1时,10 min内反应达到平衡,该反应为放热反应,升高温度平衡逆向移动,NO的转化率减小。
(2)①根据速率公式可知浓度以及k的大小会影响反应速率,反应温度、催化剂均不会改变浓度,但影响反应速率,说明温度和催化剂会影响k,故选AD。
②据图可知反应物为N2和H2O,在Li的催化作用下生成NH3和O2,总反应方程式为2N2+6H2O 4NH3+3O2,活化能越大反应速率越慢,慢反应决定整体反应速率,所以决速步骤为Ⅲ。
考点2化学平衡及影响因素
要点1化学平衡状态与平衡移动
课标指引:1.能利用平衡常数和浓度商的关系判断化学反应是否达到平衡及平衡移动的方向。 2.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。
聚焦核心要点
1.判断化学平衡状态的方法
2.判断化学平衡移动方向的方法
(1)依据勒夏特列原理判断 前提条件是可逆反应达到化学平衡状态
通过比较改变外界条件时,平衡破坏瞬间的正、逆反应速率的相对大小来判断平衡移动的方向。
引起v(正)、v(逆)的变化 占优势的反应 化学平衡移动方向
v(正)>v(逆) 正反应占优势 向正反应方向(或向右)移动
v(正)
(2)根据离子积(Q)与平衡常数(K)的大小判断平衡移动的方向
要点2化工生产中反应条件的选择
课标指引:1.认识化学反应速率和化学平衡的综合调控在生产、生活和科学研究中的重要作用。 2.针对典型案例,能从限度、速率等角度对化学反应和化工生产条件进行综合分析。
1.化工生产中反应条件的选择方法
(1)从化学平衡移动分析,既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性。
(2)从原料的利用率分析,增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本。
(3)从实际生产能力分析,如设备承受高温、高压能力等,注意催化剂的活性对温度的限制。
2.优化和选择化工生产的反应条件
外界 条件 有利于增大反应速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
浓度 增大反应物的浓度 增大反应物的浓度、减小生成物的浓度 不断地补充反应物、及时地分离出生成物
催化剂 加合适的催化剂 — 加合适的催化剂
温度 高温 ΔH<0 低温 兼顾速率和平衡,考虑催化剂的适宜温度
ΔH>0 高温 在设备条件允许的前提下,尽量采取高温并考虑催化剂的活性
外界 条件 有利于增大反应速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
压强 高压(有气体参加) 反应后气体体积减小的反应 高压 在设备条件允许的前提下,尽量采取高压
反应后气体体积增大的反应 低压 兼顾速率和平衡,选取适宜的压强
易错辨析
1.增大反应物的量平衡一定会正向移动。( )
2.对于2NO2(g) N2O4(g)的平衡体系,压缩体积,增大压强,平衡正向移动,混合气体的颜色变浅。( )
3.升高温度,化学平衡向吸热反应方向发生移动。( )
×
若反应物是固体或纯液体,增大反应物的量,对化学平衡无影响。
×
混合气体的颜色先变深再逐渐变浅。
√
对于吸热反应,升高温度,平衡正向移动。
4.工业合成氨的反应是ΔH<0、ΔS<0的反应,在任何温度下都可自发进行。
( )
5.合成氨反应选择在400~500 ℃进行的重要原因是催化剂在500 ℃左右时的活性最大。( )
×
工业合成氨的反应在低温下可以自发进行。
√
催化剂的活性受温度的限制。
命题点1化学平衡移动及分析
典例1 (2023·广东卷)催化剂Ⅰ和Ⅱ均能催化反应R(g) P(g)。反应历程(如图)中,M为中间产物。其他条件相同时,下列说法不正确的是( )
A.使用Ⅰ和Ⅱ,反应历程都分4步进行
B.反应达平衡时,升高温度,R的浓度增大
C.使用Ⅱ时,反应体系更快达到平衡
D.使用Ⅰ时,反应过程中M所能达到的
最高浓度更大
精研核心命题
C
解析 由题图可知,使用催化剂Ⅰ和Ⅱ,均存在四个能垒,故反应历程都分为4步进行,A正确;由题图可知,该反应是放热反应,平衡后升高温度,平衡逆向移动,R的浓度增大,B正确;使用Ⅱ时,R→M转化的活化能更大,反应速率比使用Ⅰ更慢,故反应体系达到平衡所需时间更长,C错误;使用Ⅰ时,中间产物M转化为P的活化能更大,反应比使用Ⅱ慢,故反应过程中M所能达到的最高浓度更大,D正确。
变式演练(2023·宁夏吴忠一轮联考)甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.01 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) ΔH3=-90.77 kJ·mol-1
回答下列问题:
(1)反应Ⅲ能够自发进行的条件是 (填“较低温度”“较高温度”或“任何温度”)。
较低温度
(2)恒温恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是 。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.甲醇的百分含量不再变化
BD
(3)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是 。
A.其他条件不变,若不使用催化剂,则250 ℃时CO2的平衡转化率可能位于M1
B.温度低于250 ℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
ABD
解析 (1)该反应的ΔS<0,ΔH<0,当反应能自发时,必有ΔG=ΔH-TΔS<0,此时要求温度较低。
(2)由于气体的质量、体积不变,则混合气体的密度始终不变,密度不变不能用来判断该反应是否达到平衡,A错误;该反应是一个正向气体分子总数减小的反应,反应向右进行,混合气体的平均相对分子质量将变大,因此平均相对分子质量不变可说明该反应已达到平衡状态,B正确;平衡时是各物质的浓度或含量不变,不是浓度相等,也不是成比例,C错误;甲醇的百分含量不再变化,可说明该反应达到平衡状态,D正确;故选BD。
(3)催化剂不影响平衡移动,所以其他条件不变,若不使用催化剂,则250 ℃时CO2平衡转化率也一定位于曲线上的M点,不可能在M1点,A错误;温度低于250 ℃时,随温度升高二氧化碳转化率降低,则甲醇的产率减小,B错误;该反应正向放热,升温使平衡左移,平衡常数将减小,即M点平衡常数比N点平衡常数大,C正确;温度越低反应越慢,对生产不利,且催化剂有活性温度(250 ℃左右),D错误;故选ABD。
【思维建模】解答化学平衡移动及分析类题目的思维模型
命题点2化工生产条件的分析及选择
典例2 (2023·辽宁卷,18节选)接触法制硫酸的关键反应为SO2的催化氧化:
(1)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是
(填字母)。
a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同α下的最大速率,选择最佳生产温度
cd
(2)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是 (填字母)。
d
解析 (1)该反应为放热反应。从图像看,随着温度升高,反应速率先增大后减小,a错误;随着温度升高,反应的转化率应逐渐减小,图像中曲线为不同温度下的等转化率下的反应速率曲线,b错误;由题图可知,转化率越高对应的反应速率最高的温度越低,c正确;结合图像的转化率与速率最高的温度可选取最佳生产温度,d正确。
(2)结合图像可知,相对于a、b、c,d对应的催化剂随着温度的升高,SO2的转化率升高得快,达到一定温度后趋于平缓。
变式演练(2023·北京东城区一模)CH4/CO2催化重整的反应为①CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1,其中积炭是导致催化剂失活的主要原因。产生积炭的反应有:
②CH4(g) C(s)+2H2(g) ΔH2=+74.6 kJ·mol-1
③2CO(g) C(s)+CO2(g) ΔH3=-172.5 kJ·mol-1
科研人员研究压强对催化剂活性的影响,在1 073 K时,将恒定组成的CO2、CH4混合气体,以恒定流速通过反应器,测得数据如图。
科研人员研究压强对催化剂活性的影响,在1 073 K时,将恒定组成的CO2、CH4混合气体,以恒定流速通过反应器,测得数据如图。
A.ΔH1=+247.1 kJ·mol-1
B.压强越大,Ra降低越快,其主要原因是反应①平衡逆向移动
C.保持其他条件不变,适当增大投料时 ,可减缓Ra的衰减
D.研究表明“通入适量O2有利于重整反应”,因为O2能与C反应并放出热量
答案 B
解析 根据盖斯定律,由反应②-③可得①,则有ΔH1=ΔH2-ΔH3
=(+74.6 kJ·mol-1)-(-172.5 kJ·mol-1)=+247.1 kJ·mol-1,A正确;压强越大,Ra降低越快,说明催化剂活性降低越快,积炭越多,其主要原因是反应③为气体体积减小的反应,加压平衡正向移动,使得积炭增多,B错误;保持其他条件不变,适当增大投料时 ,增大CO2浓度,使反应③平衡逆向移动,减少积炭,可减缓Ra的衰减,C正确;通入适量O2,O2能与C反应并放出大量的热,可减少积炭减缓Ra的衰减,同时反应放热使得反应①正向移动,有利于重整反应,D正确。
练真题·明考向
1.(2023·北京卷)下列事实能用平衡移动原理解释的是( )
A.H2O2溶液中加入少量MnO2固体,促进H2O2分解
B.密闭烧瓶内的NO2和N2O4的混合气体,受热后颜色加深
C.铁钉放入浓硝酸中,待不再变化后,加热能产生大量红棕色气体
D.锌片与稀硫酸反应过程中,加入少量CuSO4固体,促进H2的产生
训练分层落实
B
解析 MnO2作催化剂会催化H2O2分解,与平衡移动无关,A错误;NO2转化为N2O4的反应是放热反应,升温平衡逆向移动,NO2浓度增大,混合气体颜色加深,B正确;铁在浓硝酸中钝化,加热会使表面的氧化膜溶解,铁与浓硝酸反应生成大量红棕色气体,与平衡移动无关,C错误;加入硫酸铜以后,锌置换出铜,构成原电池,从而使反应速率加快,与平衡移动无关,D错误。
2.(2022·浙江6月选考卷)关于反应Cl2(g)+H2O(l) HClO(aq)+H+(aq)+Cl-(aq) ΔH<0,达到平衡后,下列说法不正确的是( )
A.升高温度,氯水中的c(HClO)减小
B.氯水中加入少量醋酸钠固体,上述平衡正向移动,c(HClO)增大
C.取氯水稀释, 增大
D.取两份氯水,分别滴加AgNO3溶液和淀粉KI溶液,若前者有白色沉淀,后者溶液变蓝色,可以证明上述反应存在限度
D
解析 HClO受热易分解,升高温度,HClO分解,平衡正向移动,c(HClO)减小,A正确;氯水中加入少量醋酸钠固体,CH3COO-和H+结合生成CH3COOH,c(H+)减小,平衡正向移动,c(HClO)增大,B正确;氯水稀释,平衡正向移动,而c(HClO)和c(Cl-)均减小,但HClO本身存在电离平衡HClO H++ClO-,稀释促进了HClO的电离,使c(HClO)减少更多,故 增大,C正确;氯水中加AgNO3溶液产生白色沉淀,证明溶液中有Cl-,氯水中加淀粉KI溶液,溶液变蓝,证明溶液中有强氧化性物质,而Cl2和HClO都有强氧化性,不能证明反应物和生成物共存,即不能证明上述反应存在限度,D错误。
3.(2022·江苏卷)乙醇-水催化重整可获得H2。其主要反应为
C2H5OH(g)+3H2O(g) ══ 2CO2(g)+6H2(g) ΔH=+173.3 kJ·mol-1
CO2(g)+H2(g) ══ CO(g)+H2O(g)
ΔH=+41.2 kJ·mol-1
在1.0×105 Pa、n始(C2H5OH)∶n始(H2O)=1∶3时,若仅考虑上述反应,平衡时CO2和CO的选择性及H2的产率随温度的变化如图所示。
下列说法正确的是( )
A.图中曲线①表示平衡时H2产率随温度的变化
B.升高温度,平衡时CO的选择性增大
C.一定温度下,增大 可提高乙醇平衡转化率
D.一定温度下,加入CaO(s)或选用高效催化剂,均能提高平衡时H2产率
答案 B
解析 两个反应均为吸热反应,升高温度均使平衡正向移动。根据信息可知,CO与CO2的选择性之和为100%,二者变化趋势相反,只有第二个反应生成CO,故升高温度,CO的选择性升高(曲线③),CO2的选择性降低(曲线①),表示氢气产率的应该是曲线②,A错误,B正确;增大乙醇与水的投料比,可提高水的平衡转化率,但乙醇的平衡转化率会降低,C错误;加CaO(s)能吸收CO2,促进第一个反应正向进行,第二个反应逆向进行,可以提高H2产率,但使用催化剂不能提高平衡时H2产率,D错误。
练易错·避陷阱
4.(2023·天津十二区重点校联考)对于可逆反应2NO2(g) N2O4(g),下列说法错误的是( )
A.当2v正(N2O4)=v逆(NO2)时,该反应达到平衡状态
B.该反应在一定条件下能自发进行,则ΔH<0
C.恒温恒容条件下,若混合气体的颜色保持不变,则该反应达到平衡状态
D.恒温恒容条件下,达平衡状态后,再充入一定量的NO2,NO2转化率将减小
D
解析 v正(N2O4)代表正反应速率,v逆(NO2)代表逆反应速率,当2v正(N2O4)=v逆(NO2)时,正、逆反应速率之比等于其化学计量数之比,该反应达到平衡状态,A正确;该反应的ΔS<0,在一定条件下能自发进行,应满足ΔH-TΔS<0,推知ΔH<0,B正确;恒温恒容条件下,若混合气体的颜色保持不变,说明c(NO2)不变,则该反应达到平衡状态,C正确;恒温恒容条件下,达平衡状态后,再充入一定量的NO2,相当于增大压强,而增大压强,平衡正向移动,NO2的转化率增大,D错误。
5.(2023·辽宁沈阳一模)某温度下,恒容密闭容器内加入等物质的量H2和I2发生反应H2(g)+I2(g) 2HI(g),v(正)=k(正)c(H2)·c(I2),k为速率常数。反应一段时间后达到平衡。下列说法中错误的是( )
B.加入一定量HI,混合气体颜色变深
C.加入一定量氩气,容器内压强增大,反应速率不变
D.加入等物质的量的H2和I2,H2转化率不变
A
解析 若 =8.99,则有k正(308 K)>k正(298 K),k为速率常数,升高温
度,k(正)原本就增大,故不能判断该反应是吸热反应还是放热反应,A错误;加入一定量HI(g),平衡逆向移动,I2浓度增大,混合气体颜色变深,B正确;加入一定量氩气,容器容积和各反应物的浓度不变,则反应速率不变,C正确;加入等物质的量的H2和I2相当于增大压强,该反应是气体体积不变的反应,增大压强,平衡不移动,故H2转化率不变,D正确。
练预测·押考向
6.(2023·陕西榆林二模)丙烯是制备聚丙烯塑料的单体,工业上可用丙烷和CO2制取丙烯:
反应1:C3H8(g) C3H6(g)+H2(g) ΔH1=+246 kJ·mol-1。
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41 kJ·mol-1。
回答下列问题。
(1)反应3:C3H8(g)+CO2(g) C3H6(g)+CO(g)+H2O(g)
ΔH= kJ·mol-1。
+287
(2)向恒温恒容密闭容器中充入C3H8(g)和CO2(g),只发生反应3,不能说明反应3达到平衡状态的是 (填字母)。
A.混合气体密度不随时间变化
B.混合气体总压强不随时间变化
C.混合气体平均相对分子质量不随时间变化
D.丙烷的消耗速率等于丙烯的生成速率
AD
(3)向密闭容器中充入C3H8(g)只发生反应1,测得速率方程为v=kc(C3H8)(k为速率常数,只与温度、催化剂有关)。已知:Rln k= +C(R、C为常数,T为温度,Ea为活化能)。实验测得其他条件相同,不同催化剂Cat1、Cat2对速率常数的影响如图1所示。其中,催化效能较高的是 (填“Cat1”或“Cat2”),判断的依据是 。
图1
Cat2
直线斜率小,活化能小
(4)向密闭容器中充入1 mol C3H8(g)和1 mol CO2(g),发生上述反应1和反应2,测得丙烷的平衡转化率与温度、压强的关系如图2所示。
图2
①X代表 (填“温度”或“压强”), Y2 (填“>”“<”或“=”)Y1。
②M点时,C3H8(g)和H2(g)的浓度相等。则M点对应的反应2的平衡常数
K= 。
温度
<
(5)向总压强恒定为76 kPa的密闭容器中充入C3H8(g)和Ar(g),只发生反应1,C3H8(g)的平衡转化率与 的关系如图3所示。其他条件不变,随着增大,C3H8的平衡转化率减小,其原因是_________________________________
_______________________________________________________________________________;当 等于2时,经10 min达到平衡,丙烯的分压变化速率为 kPa· min-1。
图3
其他条件不变,当总压一定时,C3H8的投料增加,占比越大分压越大,导致平衡向左移动,使得C3H8的平衡转化率减小
1.6
解析 (1)已知,反应1:C3H8(g) C3H6(g)+H2(g) ΔH1=+246 kJ·mol-1
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
由盖斯定律可知,反应1+反应2得反应3:C3H8(g)+CO2(g) C3H6(g)+CO(g)+H2O(g) ΔH=ΔH1+ΔH2=+287 kJ·mol-1。
(2)A.容器容积和气体质量始终不变,则混合气体的密度始终不变,因此不能说明反应已达平衡;B.反应为气体分子数增大的反应,混合气体总压强不随时间变化,说明已经达到平衡;C.气体总质量始终不变、反应为气体分子数增大的反应,则混合气体平均相对分子质量不随时间变化,说明已经达到平衡;D.丙烷的消耗速率等于丙烯的生成速率,描述的都是正反应,不能说明反应已达平衡;故选AD。
(3)已知:Rln k= +C,则Rln k=-Ea× +C,斜率越大说明Ea越大。活化能越小反应越快,活化能越大反应越慢,结合图像可知,Cat2反应的活化能小,催化效能较高,依据为直线斜率小,活化能小。
(4)①反应1和反应2均为吸热反应,升高温度平衡正向移动,丙烷转化率增大;反应1为气体分子数增加的反应,反应2为气体分子数不变的反应,增大压强导致反应1逆向移动,丙烷转化率下降;结合图像可知,X代表温度,相同条件下,增大压强导致反应1逆向移动,丙烷转化率下降,故Y2
C3H8(g) C3H6(g)+H2(g)
起始/mol 1 0 0
转化/mol 0.6 0.6 0.6
平衡/mol 0.4 0.6
CO2(g)+H2(g) CO(g)+H2O(g)
起始/mol 1
转化/mol a a a a
平衡/mol
C3H8(g)和H2(g)的浓度相等,则0.4=0.6-a,a=0.2;则平衡时二氧化碳、氢气、一氧化碳、水分别为0.8 mol、0.4 mol、0.2 mol、0.2 mol,反应2为等分子数的反应,则M点对应的反应2的平衡常数
(5)其他条件不变,当总压一定时,C3H8的投料增加,占比越大分压越大,导致平衡向左移动,使得C3H8的平衡转化率减小。当 等于2时,经10 min达到平衡,C3H8(g)的转化率为40%,假设丙烷投料2 mol、氩气1 mol,则反应的丙烷为0.8 mol。
C3H8(g) C3H6(g)+H2(g)
起始/mol 2 0 0
转化/mol 0.8 0.8 0.8
平衡/mol 1.2 0.8 0.8
则平衡时总的物质的量为3.8 mol,丙烯的分压变化速率为 kPa·min-1 =1.6 kPa·min-1。
7.草酸二甲酯[(COOCH3)2]催化加氢制乙二醇的反应体系中,发生的主要反应为
反应Ⅰ:(COOCH3)2(g)+2H2(g) CH3OOCCH2OH(g)+CH3OH(g) ΔH1<0
反应Ⅱ:(COOCH3)2(g)+4H2(g) HOCH2CH2OH(g)+2CH3OH(g) ΔH2<0
压强一定的条件下,将(COOCH3)2、H2按一定比例、流速通过装有催化剂的反应管,测得(COOCH3)2的转化率及CH3OOCCH2OH、HOCH2CH2OH的选择性
与温度的关系如图所示。下列说法正确的是( )
A.曲线B表示HOCH2CH2OH的选择性随温度变化
B.190~198 ℃范围内,温度升高,(COOCH3)2的平衡转化率增大
C.190~198 ℃范围内,温度升高, 逐渐减小
D.192 ℃时,其他条件一定,加快气体的流速可以提高(COOCH3)2的转化率
答案 C
解析 曲线A上CH3OOCCH2OH选择性为50%时,曲线C表示HOCH2CH2OH的选择性恰好为50%,则曲线C表示HOCH2CH2OH的选择性随温度变化,A错误;两反应均为放热反应,升高温度,平衡逆向移动,190~198 ℃范围内,温度升高,(COOCH3)2的平衡转化率减小,B错误;190~198 ℃范围内,温度升高,反应Ⅱ的选择性增大,升高温度,对于放热反应,平衡逆向移动,每减少2 mol CH3OH,只减少1 mol HOCH2CH2OH,HOCH2CH2OH减小的幅度小于
CH3OH,故 逐渐减小,C正确;192 ℃时,其他条件一定,加快气体的流速,反应物(COOCH3)2转化率降低,D错误。
考点3化学平衡常数和转化率
聚焦核心要点
要点1化学平衡常数及应用
课标指引:1.认识化学平衡常数是表征反应限度的物理量,知道化学平衡常数的含义。 2.能书写平衡常数表达式,能进行平衡常数的简单计算。
1.高考常考的三种化学平衡常数[以反应mA(g)+nB(g) pC(g)+qD(g)为例]
2.结合化学方程式计算平衡常数
(1)同一可逆反应中,K(正)·K(逆)=1,其中K(正)表示正反应平衡常数,K(逆)表示逆反应平衡常数。
(2)若两个可逆反应的方程式相加,得到总反应方程式,如反应①+反应②=反应③,则总反应的平衡常数等于各分步反应的平衡常数之积,则有K3=K1·K2。
(3)若两个可逆反应的方程式相减,得到总反应方程式,如反应①-反应②=反应③,则总反应的平衡常数等于各分步反应的平衡常数之商,则有
要点2转化率和产率的计算
课标指引:1.能运用浓度、压强、温度对化学平衡的影响规律,推测平衡移动方向及浓度、转化率等相关物理量的变化。 2.能进行转化率、产率的简单计算。
1.掌握常考的四种计算关系
变化量可以是物质的量或物质的量浓度
计算理论产量时,要注意过量计算
2.掌握常用的两个定量关系
易错辨析
1.减小反应物的浓度,平衡逆向移动,化学平衡常数减小。( )
2.化学平衡常数表达式中应含有参加反应的所有物质。( )
3.化学平衡常数能体现可逆反应进行的程度。( )
4.平衡常数发生变化,化学平衡必定发生移动。( )
×
K值只受温度影响,与物质的浓度、压强变化无关。
×
固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中。
√
K值越大,反应进行的程度越大。
√
平衡常数发生变化,说明温度发生改变,故化学平衡必定发生移动。
精研核心命题
命题点1化学平衡常数及计算
典例1 (2023·全国乙卷,28节选)(1)将FeSO4置入抽空的刚性容器中,升高温度发生分解反应:
2FeSO4(s) Fe2O3(s)+SO2(g)+SO3(g)(Ⅰ)
平衡时 的关系如下图所示。660 K时,
该反应的平衡总压p总= kPa、
平衡常数Kp(Ⅰ)= (kPa)2。Kp(Ⅰ)
随反应温度升高而 (填“增大”
“减小”或“不变”)。
3
2.25
增大
46.26
(2)此体系为恒容体系,压强之比等于物质的量之比。开始时,SO2和SO3的压强相同,升高温度,三氧化硫进一步分解得到二氧化硫与氧气,设反应(Ⅰ)平衡时SO2的压强为a kPa,反应(Ⅱ)达到平衡时,SO3的转化压强为y kPa,根据反应方程式分析:
2SO3(g) 2SO2(g) + O2(g)
开始/kPa a a 0
转化/kPa y y
平衡/kPa a-y a+y
变式演练(2022·全国甲卷,28节选)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途。目前生产钛的方法之一是将金红石(TiO2)转化为TiCl4,再进一步还原得到钛。回答下列问题:
(1)TiO2转化为TiCl4有直接氯化法和碳氯化法。在1 000 ℃时反应的热化学方程式及其平衡常数如下:
(ⅰ)直接氯化:TiO2(s)+2Cl2(g) ══ TiCl4(g)+O2(g) ΔH1=+172 kJ·mol-1,
=1.0×10-2
(ⅱ)碳氯化:TiO2(s)+2Cl2(g)+2C(s) ══TiCl4(g)+2CO(g)ΔH2=-51 kJ·mol-1,
=1.2×1012 Pa
则反应2C(s)+O2(g) ══ 2CO(g)的Kp= Pa。
1.2×1014
(2)在1.0×105 Pa,将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
则反应C(s)+CO2(g)══2CO(g)
的平衡常数Kp(1 400 ℃)=
Pa。
7.2×105
【思维建模】
计算压强平衡常数(Kp)的思维模型
在化学平衡体系中,用各气体物质的平衡分压替代平衡浓度计算的平衡常数叫压强平衡常数(Kp),计算步骤如下:
命题点2平衡转化率和平衡浓度的计算
典例2 (2021·全国甲卷,28节选)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。其总反应可表示为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49 kJ·mol-1。回答下列问题:
合成总反应在起始物 =3时,
在不同条件下达到平衡,设体系中
甲醇的物质的量分数为x(CH3OH),
在t=250 ℃下的x(CH3OH)~p、在
p=5×105 Pa下的x(CH3OH)~t如图所示。
(1)用各物质的平衡分压表示总反应的平衡常数,表达式
Kp= ;
(2)图中对应等压过程的曲线是 ,判断的理由是
;
(3)当x(CH3OH)=0.10时,CO2的平衡转化率α= ,反应条件可能为 或 。
b
总反应ΔH<0,升高温度时平衡向逆反应方向移动,甲醇的物质的量分数变小
33.3%
5×105 Pa,210 ℃
9×105 Pa,250 ℃
解析 (1)二氧化碳加氢制甲醇的总反应为CO2(g)+3H2(g) ══ CH3OH(g)+H2O(g),因此利用各物质的平衡分压表示总反应的平衡常数,表达式
(2)该反应正向为放热反应,升高温度时平衡逆向移动,体系中x(CH3OH)将减小,因此图中对应等压过程的曲线是b。
(3)设起始n(CO2)=1 mol,n(H2)=3 mol,则
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始/mol 1 3 0 0
转化/mol x 3x x x
平衡/mol 1-x 3-3x x x
变式演练(2023·全国甲卷,28节选)电喷雾电离等方法得到的M+(Fe+、Co+、Ni+等)与O3反应可得MO+。MO+与CH4反应能高选择性地生成甲醇。分别在300 K和310 K下(其他反应条件相同)进行反应MO++CH4 M++CH3OH,结果如下图所示。图中300 K的曲线是 (填“a”或“b”)。300 K、60 s时MO+的转化率为 (列出算式)。
b
(1-10-0.1)×100%
训练分层落实
练真题·明考向
1.(2022·重庆卷)两种酸式碳酸盐的分解反应如下,某温度平衡时总压强分别为p1和p2。
反应1:NH4HCO3(s) NH3(g)+H2O(g)+CO2(g) p1=3.6×104 Pa
反应2:2NaHCO3(s) Na2CO3(s)+H2O(g)+CO2(g) p2=4×103 Pa
该温度下,刚性密闭容器中放入NH4HCO3和Na2CO3固体,平衡后以上3种固体均大量存在。下列说法错误的是( )
A.反应2的平衡常数为4×106 Pa2
B.通入NH3,再次平衡后,总压强增大
C.平衡后总压强为4.36×105 Pa
D.缩小容积,再次平衡后总压强不变
B
2.(2022·湖南卷,16节选)在一定温度下,向容积固定的密闭容器中加入足量的C(s)和1 mol H2O(g),起始压强为0.2 MPa时,发生下列反应生成水煤气:
Ⅰ.C(s)+H2O(g) CO(g)+H2(g) ΔH1=+131.4 kJ·mol-1
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
(1)下列说法正确的是 。
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
B.混合气体的密度保持不变时,说明反应体系已达到平衡
C.平衡时H2的体积分数可能大于
D.将炭块粉碎,可加快反应速率
BD
(2)反应平衡时,H2O(g)的转化率为50%,CO的物质的量为0.1 mol。此时,整个体系 (填“吸收”或“放出”)热量 kJ,反应Ⅰ的平衡常数Kp= (以分压表示,分压=总压×物质的量分数)。
吸收
31.2
0.02 MPa
解析 (2)反应平衡时,H2O(g)的转化率为50%,则消耗H2O(g)的物质的量为
1 mol×50%=0.5 mol。CO的物质的量为0.1 mol,据O原子守恒可知,n(CO2)=
0.2 mol,生成0.2 mol CO2时消耗0.2 mol CO,故反应Ⅰ实际生成0.3 mol CO。据热化学方程式可知,生成0.3 mol CO要吸收热量39.42 kJ,生成0.2 mol CO2要放出热量8.22 kJ,此时整个体系吸收热量为39.42 kJ-8.22 kJ=31.2 kJ。
由H原子守恒可知,平衡时n(H2)=0.5 mol,n(CO)=0.1 mol,n(CO2)=0.2 mol,n(H2O)=0.5 mol,则平衡时气体的总物质的量为0.5 mol+0.1 mol+0.2 mol+
0.5 mol=1.3 mol。在同温同体积条件下,气体的总压之比等于气体的总物质的量之比,则平衡体系的总压为0.2 MPa×1.3=0.26 MPa,故反应Ⅰ的平衡常数
练易错·避陷阱
3.(2023·北京丰台区一模)下列三个化学反应焓变、平衡常数与温度的关系分别如下表所示。下列说法正确的是( )
化学反应 平衡常数 温度 973 K 1 173 K
①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1 K1 1.47 2.15
②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH2 K2 2.38 1.67
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3 K3 a b
A.1 173 K时,反应①起始c(CO2)=0.6 mol·L-1,平衡时c(CO2)约为0.4 mol·L-1
B.反应②是吸热反应,ΔH2>0
C.反应③达平衡后,升高温度或缩小反应容器的容积平衡逆向移动
D.相同温度下,K3= ;ΔH3=ΔH2-ΔH1
D
解析 1 173 K时,反应①起始c(CO2)=0.6 mol·L-1,设CO2的转化量为x mol·L-1,列出三段式:
Fe(s)+CO2(g) FeO(s)+CO(g)
起始/(mol·L-1) 0.6 0
转化/(mol·L-1) x x
平衡/(mol·L-1) 0.6-x x
4.(2022·海南卷,16节选)已知:CO2(g)+4H2(g) 2H2O(g)+CH4(g)的平衡常数(K)与反应温度(t)之间的关系如图所示。
某研究小组模拟该反应,温度t ℃下,向容积为10 L的抽空的密闭容器中通入0.1 mol CO2和0.4 mol H2,反应平衡后测得容器中n(CH4)=0.05 mol,则CO2的转化率为 ,反应温度t约为 ℃。
50%
660.2
解析 反应平衡后测得容器中n(CH4)=0.05 mol,列出“三段式”如下:
CO2(g)+4H2(g) 2H2O(g) + CH4(g)
起始/mol 0.1 0.4 0 0
转化/mol 0.05 0.2 0.1 0.05
平衡/mol 0.05 0.2 0.1 0.05
练预测·押考向
5.氨气去除NO的反应原理为4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH<0,反应速率与浓度之间存在如下关系:v(正)=k(正)·c4(NH3)·c6(NO), v(逆)=k(逆)·c5(N2)·c6(H2O),k(正)、k(逆)为速率常数,只受温度影响。350 ℃时,在2 L恒容密闭容器中,通入0.45 mol NH3(g)和0.6 mol NO(g)发生反应,保持温度不变,5 min后反应达平衡,NO的转化率为50%。下列说法正确的是( )
A.用NH3表示的化学反应速率为0.06 mol·L-1·min-1
B.350 ℃时,该反应的平衡常数为0.5
C.其他条件不变,往反应后的容器中再通入0.45 mol NH3(g)和0.6 mol NO(g),重新达平衡时NO的体积分数减小
D.当温度改变为T ℃时,若k(正)=k(逆),则T<350
D
解析 由题意可列如下三段式:
4NH3(g)+6NO(g) 5N2(g)+6H2O(g)
起始/mol 0.45 0.6 0 0
转化/mol 0.2 0.3 0.25 0.3
平衡/mol 0.25 0.3 0.25 0.3
6.我国科学家开发铜催化剂实现由N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]制备三甲胺[N(CH3)3],反应方程式如下:(CH3)2NCHO(g)+2H2(g) N(CH3)3(g)+H2O(g) ΔH=-144 kJ·mol-1。向容积相等的Ⅰ、Ⅱ两个恒容密闭容器中分别充入1 mol DMF(g)和2 mol H2(g)发生上述反应,其中一个容器中是绝热过程,另一个容器中是恒温过程。反应体系中压强随时间变化关系如图所示。
(1)容器Ⅰ中为 (填“绝热”或“恒温”)过程,判断的依据是 。
(2)若该反应是在恒温恒容的密闭容器中发生,以下能说明该反应达到化学平衡状态的是 (填字母)。
A.混合气体的密度不再发生改变
B.反应容器中H2的质量分数不变
C.2v正(H2)=v逆(H2O)
D.平均相对分子质量不变
E.该反应的焓变,即ΔH不变
(3)n点时反应的平衡常数Kp= kPa-1(提示:用分压计算的平衡常数为Kp,分压=总压×物质的量分数)。
绝热
容器Ⅰ中的压强比容器Ⅱ中的压强大
BD
0.562 5
解析 (1)该反应是放热反应,若容器绝热,则反应过程中温度升高,不利于平衡正向移动;又知该反应的正反应是气体体积减小的反应,容器的压强大于恒温容器中平衡时的压强,题图中容器Ⅰ中的压强比容器Ⅱ中的压强大,则容器Ⅰ中为绝热过程。
(2)该反应中气体总质量和总体积都不变,则混合气体的密度是定值,不能说明反应达到平衡,A错误;反应容器中H2的质量分数不变,其浓度不变,则该反应达到平衡,B正确;达到平衡时,v正(H2)=2v逆(H2O),C错误;该反应中气体平均相对分子质量增大,当混合气体平均相对分子质量不变时,则反应达到平衡,D正确;该反应的焓变是定值,ΔH不变,不能判断反应是否平衡,E错误。③n点反应达到平衡,此时体系压强为36 kPa,起始压强是48 kPa,设(CH3)2NCHO的转化量为x mol,根据已知条件列出三段式:
(CH3)2NCHO(g) + 2H2(g) N(CH3)3(g)+H2O(g)
起始/mol 1 2 0 0
转化/mol x 2x x x
平衡/mol 1-x 2-2x x x
考点4化学反应速率和平衡图像
聚焦核心要点
要点化学平衡图像及分析
1.浓度(转化率、百分含量)-时间图像及分析
C%指生成物的百分含量,B%指反应物的百分含量。
微点拨
解题“秘钥”——“先拐先平,数值大”。即曲线先出现拐点的首先达到平衡,反应速率快,以此判断温度或压强的高低,再依据外界条件对平衡的影响分析判断反应的热效应及反应前后气体体积的变化。
2.转化率(或质量分数)与压强-温度图像
(1)恒压线图像
(2)恒温线图像
微点拨
表示两个外界条件同时变化时,反应物A的转化率变化情况,解决这类图像一般采用“定一议二”的方法,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。
3.两类特殊图像
(1)对于化学反应mA(g)+nB(g) pC(g)+qD(g),M点前,表示从反应开始,v(正)>v(逆);M点为刚达到平衡点;M点后为平衡受温度的影响情况,即升高温度,A%增加或C%减少,平衡逆向移动,则有ΔH<0。
(2)对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点。L线的上方(E点),A%大于此压强时平衡体系中A%,则E点满足v(正)>v(逆);同理L线的下方(F点)满足v(正)
命题点1浓度(速率、转化率)-时间图像及分析
典例1 (2023·湖南卷)向一恒容密闭容器中加入1 mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比 随温度的变化曲线如图所示。下列说法错误的是( )
A.x1
反应达到平衡状态
B
解析 加入1 mol CH4和一定量的H2O发生反应,增大n(H2O)时,x= 减小,但CH4的平衡转化率增大,结合图像知x1
A.曲线M表示B容器中N2O的转化率随时间的变化
B.用CO的浓度变化表示曲线N在0~100 s内的反应速率为1×10-4 mol·L-1·s-1
C.Q点v(正)大于P点v(逆)
D
解析 该反应是放热反应,B(绝热)容器中温度高于A(恒温),又起始加入反应物量相同,则相同时间内B中速率大,先达到平衡,故M线表示B容器中N2O的转化率随时间的变化,A正确;曲线N在0~100 s N2O转化率为10%,则消耗N2O为0.1 mol,同时消耗0.1 mol CO,则有v(CO)= =1×10-4 mol·L-1·s-1,B正确;P点和Q点N2O转化率相同且均未达平衡,即P点v(正)>v(逆),又Q点温度高于P点,则Q点v(正)>P点v(正),故Q点v(正)>P点v(逆),C正确;曲线N达到平衡时N2O转化率为25%,即消耗0.25 mol N2O和0.25 mol CO,则平衡时N2O为0.75 mol、CO为3.75 mol、N2为0.25 mol、CO2为0.25 mol,由于平衡时有v(正)=v(逆),则
命题点2温度(或压强)-时间图像及分析
典例2 (2022·湖南卷,14改编)向容积均为1 L的两恒容容器中分别充入2 mol X和1 mol Y发生反应:2X(g)+Y(g) Z(g) ΔH,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
A.ΔH>0
B.气体的总物质的量:na
D.反应速率:va正
解析 甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程pV=nRT可知,刚开始压强增大的原因是容器内的温度升高,则上述反应放热,即ΔH<0,A错误。该反应为放热反应,图中a点和c点的压强相等,甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,说明a点气体总物质的量小于c点时气体总物质的量,即na
起始/(mol·L-1) 2 1 0
转化/(mol·L-1) 2x x x
平衡/(mol·L-1) 2-2x 1-x x
变式演练(2023·广东佛山一模)一定温度下,在刚性容器中加入等物质的量的H2(g)与NO(g)发生反应:2H2(g)+2NO(g) N2(g)+2H2O(g) ΔH<0,测得H2(g)与H2O(g)的分压随时间变化如图所示。下列说法正确的是( )
A.当气体密度不再变化时,反应达到平衡
B.体系中气体总物质的量n初始∶n平衡=5∶4
C.升高温度,反应速率:v(正)减小,v(逆)增大
D.该反应的活化能:E(正)>E(逆)
B
解析 反应过程中气体总质量不变,容器容积不变,则气体密度保持不变,不能判断反应是否达到平衡,A错误;根据题意,列出三段式:
2H2(g)+2NO(g) N2(g)+2H2O(g) 总压强
起始/kPa 2.5p0 2.5p0 0 0 5p0
变化/kPa 2p0 2p0 p0 2p0
平衡/kPa 0.5p0 0.5p0 p0 2p0 4p0
则体系中气体总物质的量:n初始∶n平衡=p初始∶p平衡=5p0∶4p0=5∶4,B正确;升高温度,正、逆反应速率都增大,C错误;该反应为放热反应,则正反应活化能小于逆反应活化能,D错误。
【思维建模】解答化学反应速率和平衡图像类题目的思维模型
练真题·明考向
1.(2022·浙江1月选考卷)在恒温恒容条件下,发生反应A(s)+2B(g) 3X(g), c(B)随时间的变化如图中曲线甲所示。下列说法不正确的是( )
A.从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率
B.从b点切线的斜率可求得该化学反应在反应开始时的瞬时速率
C.在不同时刻都存在关系:2v(B)=3v(X)
训练分层落实
D.维持温度、容积、反应物的起始量不变,向反应
体系中加入催化剂,c(B)随时间变化关系如图中曲线乙所示
C
解析 题图中可以得到单位时间内的浓度变化,反应速率是单位时间内物质的浓度变化计算得到,从a、c两点坐标可求得从a到c时间间隔内该化学反应的平均速率,A正确;b点处的切线的斜率是CO的瞬时速率,B正确;化学反应速率之比等于化学方程式中各物质的化学计量数之比,则有3v(B)=2v(X),C错误;维持温度、容积不变,向反应体系中加入催化剂,平衡不移动,反应速率增大,达到新的平衡状态,平衡状态与原来的平衡状态相同,D正确。
2.(2021·重庆卷)甲异腈(CH3NC)在恒容密闭容器中发生异构化反应: CH3NC(g) ―→ CH3CN(g),反应过程中甲异腈浓度c随时间t的变化曲线如图所示(图中T为温度)。该反应的反应速率v与c的关系为v=kc,k为速率常数(常温下为常数),a点和b点反应速率相等,即v(a)=v(b)。下列说法错误的是( )
A.b~f段的平均反应速率为
1.0×10-4 mol·L-1·min-1
B.a点反应物的活化分子数多于d点
C.T1>T2
D.3v(d)=2v(e)
C
练易错·避陷阱
3.(2023·河北沧州一模)T ℃时,向容积为2 L的刚性容器中充入1 mol CO2和一定量的H2发生反应:CO2(g)+2H2(g) HCHO(g)+H2O(g),达到平衡时,HCHO的分压(分压=总压×物质的量分数)与起始 的关系如图所示。已知:初始加入2 mol H2时,容器内气体的总压强为1.2p kPa。下列说法错误的是( )
A.5 min时反应到达c点,v(H2)=0.1 mol·L-1·min-1
D.c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.2p kPa,平衡不移动
B
4.(2023·陕西西安统考二模)恒温密闭容器中,发生反应:2CO2(g)+6H2(g)
C2H4(g)+4H2O(g) ΔH<0。起始时,若按照n(CO2)∶n(H2)=1∶3的投料比充入容器,测得平衡时n(H2)和n(H2O)随温度的变化如图所示。下列说法中正确的是( )
A.L线表示平衡时n(H2O)随温度的变化
B.其他条件不变时,若扩大容器容积,则
v正减小,v逆增大
C.x=5.16
D.使用催化剂,可降低反应的活化能,减小ΔH的值
C
解析 由于ΔH<0,随着温度的升高,平衡逆向移动,n(H2)增大,n(H2O)减小,故L为n(H2)随温度的变化曲线,A错误;其他条件不变时,若扩大容器容积,浓度均减小,则v正、v逆均减小,B错误;由图知,在393 K时,n(H2)=4.2 mol, n(H2O)=5.8 mol,升高温度,反应将向逆反应方向移动,在a点时, n(H2)=n(H2O),设由393 K升温到460 K时,H2O(g)反应的物质的量为b mol,由关系式6H2(g)~4H2O(g),得4.2+ b=5.8-b,b=0.64,x=5.16,C正确;使用催化剂,降低反应的活化能,但不能减小ΔH的值,D错误。
练预测·押考向
5.T ℃时,含等浓度的AgNO3与Fe(NO3)2的混合溶液中发生反应Fe2+(aq)+Ag+(aq) Fe3+(aq)+Ag(s) ΔH<0,t1时刻,改变某一外界条件继续反应至t2(t2=4t1)时刻,溶液中c(Ag+)和c(Fe3+)随时间的变化关系如图所示。下列说法正确的是( )
已知:T ℃时,该反应的化学平衡常数K=1。
A.若t1时刻未改变外界条件,则此时该反应处于平衡状态
B.若t2时刻反应达到平衡,则t1时刻改变的条件可能为升温
C.若始终保持温度不变,则平均反应速率: 表示0~t1 s内Fe2+的平均反应速率, 表示0~t2 s内Fe2+的平均反应速率)
D.0~t2 s内Ag+的平均反应速率为 mol·L-1·s-1
答案 A
6.水煤气变换:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)将一定量的CO(g)和H2O(g)充入某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO的转化率与温度的变化如图1所示:点1~3中,达到平衡状态的点是 ;降低水煤气变换反应活化能效果最差的催化剂是 (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
图1
3
Ⅲ
(2)对于反应CO(g)+H2O(g) CO2(g)+H2(g),采用催化剂Ⅰ,在1 073 K和973 K时,在恒容密闭容器中充入等物质的量的CO(g)、H2O(g),CO的转化率随时间变化的结果如图2所示。
图2
①下列能表示该反应达到化学平衡状态的
是 (填字母)。
A.容器内压强不再变化
B.容器内气体的密度不再变化
C.混合气体的平均摩尔质量不再变化
D.v正(CO)=v逆(CO2)
D
②973 K时CO的平衡转化率α= %,1 073 K时该反应的平衡常数K= (写成分数形式,下同)。
③已知反应速率v=v(正)-v(逆)=k(正)x(CO)·x(H2O)-k(逆)x(CO2)·x(H2),k(正)、k(逆)分别为正、逆向反应速率常数,x为物质的量分数,计算点a处的
27
解析 (1)从题图中可知,同等条件下,在催化剂Ⅰ的作用下,相同时间内CO的转化率是最高的,所以催化剂Ⅰ的催化效果是最好的,催化剂Ⅲ效果最差,速率最慢,所以降低活化能的效果最差;该反应在点3达到平衡状态。
(2)①该反应为气体分子数不变的反应,故反应过程中,容器内压强始终不变,A项错误;恒容则容器容积不变,容器内气体的质量不变,故混合气体的密度始终不变,B项错误;气体的质量不变,气体的物质的量也不变,混合气体的平均摩尔质量也一直保持不变,C项错误;该反应过程中始终存在v正(CO)=v正(CO2),所以v正(CO2)=v逆(CO2)时,同一种物质的反应速率v(正)=v(逆),反应达到平衡状态,故D项正确。②该反应为放热反应,降低温度,平衡正向移动,CO的平衡转化率增大,973 K时反应的平衡转化率是27%。设CO(g)、H2O(g)的浓度均为1 mol·L-1,由题图知,1 073 K时CO的平衡转化率为25%。由三段式可知:
CO(g)+H2O(g) CO2(g)+H2(g)
起始/(mol·L-1) 1 1 0 0
转化/(mol·L-1) 0.25 0.25 0.25 0.25
平衡/(mol·L-1) 0.75 0.75 0.25 0.25
③由v=v(正)-v(逆)=k(正)x(CO)·x(H2O)-k(逆)x(CO2)·x(H2)可知v(正)=k(正)x(CO)·x(H2O);v(逆)=k(逆)x(CO2)·x(H2)。平衡时有v(正)=v(逆),即 ,点a处CO的转化率为20%。由三段式可知:
CO(g)+H2O(g) CO2(g)+H2(g)
起始/(mol·L-1) 1 1 0 0
转化/(mol·L-1) 0.20 0.20 0.20 0.20
a点/(mol·L-1) 0.80 0.80 0.20 0.20
突破高考题型(七)化学反应原理综合题
高考指引:近几年,全国及各省市化学试题都考查了化学反应原理综合题,大多以工业生产、环境保护等为命题载体,考查点主要集中在反应热的计算和盖斯定律的应用、化学平衡图像及分析、化学平衡的计算、电化学及应用等,侧重考查考生的“理解与辨析能力”“分析与推测能力”“归纳与论证能力”等关键能力。
突破点1 反应热的计算
核心归纳
1.化学反应原理综合题的考查角度
2.利用盖斯定律计算反应热的思维模型
3.利用键能(或活化能)计算反应热
(1)反应热ΔH=反应物的总键能-生成物的总键能。
(2)反应热ΔH=Ea(正反应)-Ea(逆反应)(Ea代表活化能)。
真题感悟
1.(2022·海南卷,16节选)某空间站的生命保障系统功能之一是实现氧循环,其中涉及反应:CO2(g)+4H2(g) 2H2O(g)+CH4(g)。
已知:电解液态水制备1 mol O2(g),电解反应的ΔH=+572 kJ·mol-1。由此计算H2(g)的燃烧热(焓)ΔH= kJ·mol-1。
-286
解析 根据题意,写出电解反应的热化学方程式:2H2O(l) ══ 2H2(g)+O2(g) ΔH=+572 kJ·mol-1,据此可得热化学方程式:2H2(g)+O2(g) ══ 2H2O(l) ΔH=-572 kJ·mol-1,结合燃烧热的概念推知,H2(g)的燃烧热(焓)
ΔH=-572 kJ·mol-1× =-286 kJ·mol-1。
2.(2021·江苏卷,18节选)CH4与CO2重整的主要反应的热化学方程式为
反应Ⅰ:CH4(g)+CO2(g) ══ 2CO(g)+2H2(g) ΔH=+246.5 kJ·mol-1
反应Ⅱ:H2(g)+CO2(g) ══ CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
反应Ⅲ:2CO(g) ══ CO2(g)+C(s) ΔH=-172.5 kJ·mol-1
在CH4与CO2重整体系中通入适量H2O(g),可减少C(s)的生成,反应3CH4(g)+CO2(g)+2H2O(g) ══ 4CO(g)+8H2(g)的ΔH= 。
+657.1 kJ·mol-1
解析 分析已知热化学方程式,根据盖斯定律,由反应Ⅰ×3-Ⅱ×2可得反应3CH4(g)+CO2(g)+2H2O(g) ══ 4CO(g)+8H2(g),则有ΔH=(+246.5 kJ·mol-1) ×3-(+41.2 kJ·mol-1)×2=+657.1 kJ·mol-1。
突破点2 化学平衡图像分析及最佳条件的选择
核心归纳
1.化学平衡图像中信息加工处理的方法
2.化学平衡移动的定性分析与定量计算
3.化工生产中最佳反应条件的选择
化工生产中反应条件的选择,除应考虑反应速率、反应限度等反应本身的因素外,还必须考虑生产成本,如动力设备要求、原料和能量的充分利用等。
条件 原则
从化学反应速率分析 既不能过快,又不能太慢
从化学反应限度分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
从实际生产能力分析 如设备承受高温、高压能力等
从催化剂的使用活性分析 注意温度对催化剂活性的限制
真题感悟
3.(2020·全国Ⅲ卷,28节选)二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)= 。当反应达到平衡时,若增大压强,则n(C2H4) (填“变大”“变小”或“不变”)。
1∶4
变大
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1 MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
图中,表示C2H4、CO2变化的曲线分别是 、 。CO2催化加氢合成C2H4反应的ΔH (填“大于”或“小于”)0。
d
c
小于
(3)根据图中点A(440 K,0.39),计算该温度时反应的平衡常数
Kp= (MPa)-3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
选择合适的催化剂
解析 (1)二氧化碳催化加氢合成乙烯的反应方程式为2CO2+6H2 C2H4+4H2O,所以产物的物质的量之比n(C2H4)∶n(H2O)=1∶4,由于该反应是气体分子总数减少的反应,根据勒夏特列原理可知,加压平衡向正反应方向移动,所以增大压强,n(C2H4)变大。
(2)由于原料初始组成n(CO2)∶n(H2)=1∶3,且温度升高时二者变化趋势相同(即均增大或均减小),而生成的n(C2H4)∶n(H2O)=1∶4,且温度升高时二者变化趋势相同(即均增大或均减小),所以根据390 K平衡时各物质的质量分数之间的关系可知:c、a分别表示的是CO2和H2,b、d分别表示H2O与C2H4,所以表示C2H4、CO2变化的曲线分别是d和c;由图可知升高温度CO2和H2的物质的量分数增大,即平衡向逆反应方向移动,根据勒夏特列原理可知该反应为放热反应,即ΔH小于0。
(3)根据图中点A(440 K,0.39)可知此时H2和H2O的物质的量分数均为0.39,即二者分压均为0.039 MPa,由于原料初始组成n(CO2)∶n(H2)=1∶3,而且二者反应过程中也是按照物质的量1∶3的比例生成或者消耗,所以二者的物
(4)由于该反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃,由于不同的催化剂在不同的温度下对反应的选择性不同,所以要想提高反应速率和乙烯选择性,应该选择合适的催化剂。
突破点3 有关化学平衡的计算
核心归纳
1.计算化学平衡常数和转化率的思维模型
2.速率常数(k)与平衡常数(K)之间的关系
(1)建立关系的依据是达到平衡状态时,v(正)=v(逆)。
(2)T ℃时,可逆反应:aA(g)+bB(g) gG(g)+hH(g), v(正)=k(正)ca(A)·cb(B),v(逆)=k(逆)cg(G)·ch(H)。达到平衡状态时v(正)=v(逆),则有k(正)ca(A)·cb(B)=k(逆)cg(G)·ch(H),故化学平衡常数
真题感悟
4.(2023·湖北卷,19节选)纳米碗C40H10是一种奇特的碗状共轭体系。
(1)1 200 K时,假定体系内只有反应C40H12(g) C40H10(g)+H2(g)发生,反应过程中压强恒定为p0(即C40H12的初始压强),平衡转化率为α,该反应的平
衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
两个反应的化学键变化相似,使得ΔH数值相近,ln K的斜率取决于ΔH,所以两条线几乎平行
解析 (1)起始C40H12为整体1,平衡转化率为α,列出三段式:
C40H12(g) C40H10(g)+H2(g)
起始: 1 0 0
转化: α α α
平衡: 1-α α α
(2)因两个反应的化学键变化相似,使得ΔH数值相近,ln K的斜率取决于ΔH,所以两条线几乎平行。
5.(2021·全国乙卷,28节选)一氯化碘(ICl)是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
McMorris测定和计算了在136~180 ℃范围内下列反应的平衡常数Kp:
(1)由图可知,NOCl分解为NO和Cl2反应的ΔH (填“大于”或“小于”)0。
(2)反应2ICl(g) Cl2(g)+I2(g)的K= (用 表示);该反应的ΔH (填“大于”或“小于”)0,写出推理过程 。
大于
大于
解析 (1)由图可知, 随着温度的升高而增大,说明升高温度,平衡正向移动,则NOCl分解为NO和Cl2反应为吸热反应,ΔH大于0。(2)Ⅰ:2NO(g)+2ICl(g) 2NOCl(g)+I2(g),Ⅱ:2NOCl(g) 2NO(g)+Cl2(g),
根据盖斯定律Ⅰ+Ⅱ得2ICl(g) Cl2(g)+I2(g),则反应2ICl(g) Cl2(g)+I2(g)的K= ;假设T1>T2,通过分析lg K(T1)与lg K(T2)的相对大小判断ΔH的正负。
突破点4 电极反应式的书写及计算
核心归纳
1.书写电极反应式的思维模型
2.电化学装置图的分析方法
(1)判断物质类别:箭头一般指向生成物;箭尾一般指向反应物;
(2)判断方向:电子、离子、电流;
(3)判断电极反应:靠近电极的箭头曲线;
(4)判断物质进出:箭头曲线指向装置——进物质;箭头曲线背离装置——出物质。
3.电化学计算的方法
真题感悟
6.(2022·重庆卷,17节选)反应CO(g)+H2O(g) CO2(g)+H2(g)在工业上有重要应用,该反应可采用电化学方法实现,反应装置如图所示。
(1)固体电解质采用 (填“氧离子导体”或“质子导体”)。
(2)阴极的电极反应式为 。
(3)同温同压下,相同时间内,若进口Ⅰ处n(CO)∶n(H2O)=a∶b,出口Ⅰ处气
体体积为进口Ⅰ处的y倍,则CO的转化率为 (用a、b、y表示)。
氧离子导体
H2O+2e- ══ H2+O2-
解析 (2)电解时,阴极发生还原反应,电极反应式为H2O+2e- ══ H2+O2-。
(3)根据题给信息,列出三段式:
CO(g)+H2O(g) CO2(g)+H2(g)
起始/mol a b 0 0
转化/mol x x x x
平衡/mol a-x b-x x x
出口Ⅰ处气体为CO2,其物质的量为x mol,进口Ⅰ处的气体物质的量为
(a+b) mol,则x=(a+b)y,CO的转化率为
7.(2022·河北卷,16节选)氢能是极具发展潜力的清洁能源,以氢燃料为代表的燃料电池有良好的应用前景。
(1)氢氧燃料电池中氢气在 (填“正”或“负”)极发生反应。
(2)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为 。
负
CnH2n+2+(3n+1)O2--(6n+2)e- ══ nCO2↑+(n+1)H2O
解析 (2)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2在负极发生氧化反应生成CO2和H2O。
考向预测演练
(2023·四川泸州二诊)铁的化合物在工业中有重要价值。回答下列问题:
(1)Fe(CO)5是一种重要的催化剂,制取反应为Fe(s)+5CO(g) Fe(CO)5(g) ΔH<0。在1 L恒容密闭容器中加入足量铁粉和0.24 mol CO。
①0~30 min内在T温度下进行反应,测得c(CO)、c[Fe(CO)5]随时间的变化关系,以及30 min和40 min开始随条件的变化关系如图甲所示。0~20 min内用Fe(CO)5表示的平均反应速率为
mol·L-1·min-1;若平衡时体系总压强为p,则用气体分压表示的压强平衡常
数Kp= 。
图甲
2×10-3
②曲线Ⅰ代表 [填“CO”或“Fe(CO)5”]浓度的变化,30 min时改变的条件是 。40 min后曲线Ⅱ下降的原因是 。
图甲
CO
增大CO浓度或向体系中通入CO
平衡后升高温度,平衡逆向移动
(2)高铁酸钾(K2FeO4)被称为“绿色化学”净水剂,K2FeO4在水解过程中,铁元素形成的微粒分布分数与pH的关系如图乙所示,H2FeO4的一级电离平衡常数 = 。向pH=6的溶液中加入KOH溶液,发生反应的离子方程式为 。
图乙
10-3.8
(3)复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解制氢气,原理如下:
①MnFe2O4(s) ══ MnFe2O(4-x)(s)+ O2(g) ΔH1
②MnFe2O(4-x)(s)+xH2O(g) ══ MnFe2O4(s)+xH2(g) ΔH2=a kJ·mol-1
③2H2O(g) ══ 2H2(g)+O2(g) ΔH3=+483.6 kJ·mol-1
则H2的燃烧热ΔH (填“>”“=”或“<”)-241.8 kJ·mol-1,
ΔH1= kJ·mol-1(用含a的代数式表示)。
<
+(241.8x-a)或-(a-241.8x)
解析 (1)①由图可知,0~20 min内,Fe(CO)5的浓度由0变化到0.04 mol·L-1,用Fe(CO)5表示的平均反应速率为 mol·L-1·min-1=
0.002 mol·L-1·min-1;若平衡时体系总压强为p,列三段式进行计算:
Fe(s)+5CO(g) Fe(CO)5(g)
起始/mol 0.24 0
转化/mol 0.2 0.04
平衡/mol 0.04 0.04
平衡时气体总物质的量为0.08 mol,则用气体分压表示的压强平衡常数
②曲线Ⅰ和Ⅱ对比,相同时间内,Ⅰ的变化量的绝对值大于Ⅱ,说明曲线Ⅰ对应物质的系数更大,即曲线Ⅰ代表CO浓度的变化;30 min时,CO浓度突然增大,而Fe(CO)5的浓度保持不变,说明30 min时改变的条件是增大CO浓度或向体系中通入CO;40 min后Fe(CO)5的浓度下降的原因是该反应达到平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,从而使Fe(CO)5的浓度下降。
同课章节目录
