1.2离子反应 课件(共22张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2离子反应 课件(共22张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 21.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-24 21:37:09 | ||
图片预览







文档简介
(共22张PPT)
第一章 物质及其变化
第二节 离子反应
第2课时 离子反应
视频播放
硫酸铜和氢氧化钠反应
视频播放
硫酸铜和氢氧化钾反应
视频播放
硫酸铜和氢氧化钡反应
交流思考
1、观察几个实验现象,思考不同的物质和硫酸铜发生反应时,都生成了蓝色沉淀,这是为什么?生成的产物有什么?
2、写出视频中三个反应方程式,并分析生成物,并写出相关物质的电离方程式。
教学目标
1.理解离子反应的概念,会书离子方程式并能进行简单的正误判断;
2.掌握复分解型离子反应发生的条件及意义,了解离子反应的实质。
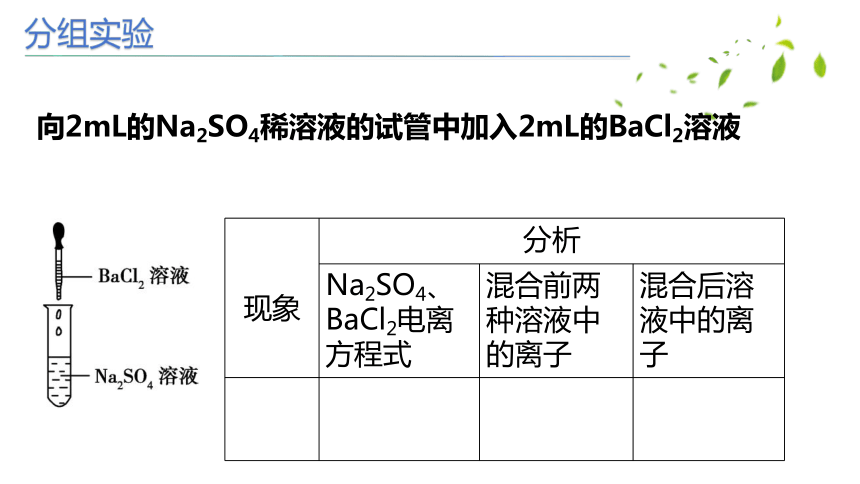
分组实验
向2mL的Na2SO4稀溶液的试管中加入2mL的BaCl2溶液
现象 分析 Na2SO4、BaCl2电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
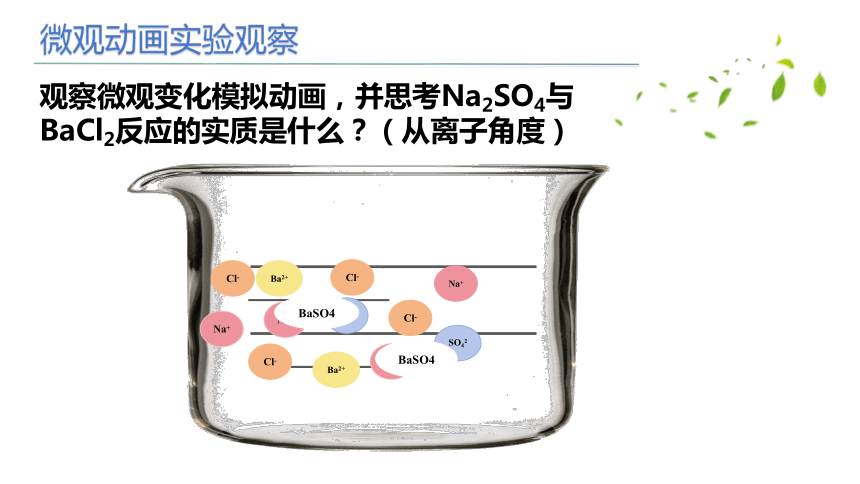
观察微观变化模拟动画,并思考Na2SO4与BaCl2反应的实质是什么?(从离子角度)
Na+
SO42
Na+
Na+
Na+
SO42
Cl-
Cl-
Cl-
Cl-
Ba2+
Ba2+
BaSO4
BaSO4
微观动画实验观察
实验结论
Na+、 Cl-没有发生化学反应,Ba2+ 、SO42-发生了化学反应,生成BaSO4白色沉淀
从微观角度看,反应的实质:
1、概念:有离子参加的反应,这样的反应属于离子反应。
离子方程式:Ba2+ + SO42-= BaSO4 ↓
一、离子反应
2、 离子方程式
用实际参加反应的离子符号表示离子反应的式子。
化学方程式:BaCl2+ Na2SO4= BaSO4 ↓+2NaCl
如何正确书写上述实验的离子方程式,离子方程式的书写步骤是怎样的?
思考
二、离子方程式的书写
1、写
: 写出反应的化学方程式 (以Na2SO4 和BaCl2反应为例)
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
2、拆
:把易溶于水且易电离的物质(强酸、强碱、可溶性盐)写成离子形式
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
3、删
4、查
:删去方程式两边不参加反应的离子,并将方程化为最简
:检查方程式两边各元素的原子个数和电荷总数是否相等
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
SO42- + Ba2+ = BaSO4↓
不拆:弱酸、弱碱、难溶的物质、单质、氧化物、气体和水等仍用化学式表示。
(1)对于微溶物:
①作生成物时,统一写成化学式;
②作反应物时:
a :如是澄清溶液,则澄清石灰水可拆成离子Ca2+和OH-,
b :若为浓溶液时,则以化学式表示。【如石灰乳不可拆,写成Ca(OH)2 】
(2)对于易分解的物质(如H2CO3)作生成物时,写成分解形式CO2、H2O;若产物生成NH3●H2O,反应条件为加热,则拆成NH3、H2O。
离子方程式的书写注意事项
实战演练
1、写出开始上课的三个视频的离子方程式;
2、写出石灰乳和碳酸钠的离子方程式;
3、写出硫酸和氯化钡的离子方程式;
4、写出碳酸钙和稀盐酸的离子方程式;
5、澄清石灰水和氯化铵溶液在加热条件下的离子方程式;
是不是所有的电解质溶液混合都会发生离子反应呢?
⑤Zn+ CuSO4
④NaCl+ CuSO4
③AgNO3+ BaCl2
① HNO3+ KOH
②H2SO4+ Na2CO3
复分解型
离子反应发生的条件
(1)生成难溶性的物质
(2)生成气体: 2H+ + CO32- ==== H2O+CO2↑
(3)生成弱电解质(水、弱酸、弱碱):H++OH-====H2O
三、离子反应发生的条件
反应物 化学方程式 离子方程式 两种方程式的不同
HCl+NaOH ______________________ ________________ 4个反应的化学方程式_____,但其离子方程式却________
HCl+KOH ______________________ ________________ H2SO4+NaOH _____________________ ________________ H2SO4+KOH ______________________ ________________ HCl+NaOH=NaCl+H2O
H++OH-=H2O
HCl+KOH=KCl+H2O
H++OH-=H2O
H2SO4+2NaOH= Na2SO4+2H2O
H++OH-=H2O
H2SO4+2KOH= K2SO4+2H2O
H++OH-=H2O
不同
相同
思考与讨论
离子方程式不仅可以表示某个具体的化学反应,而且可表示某一类型的反应。
思考:
是否所有的酸碱中和反应都能用:
H+ + OH- = H2O 表示
不能,①因为弱酸、弱碱不能拆开 ②酸碱生成难溶性盐也不能拆;
表示:强酸和强碱生成可溶性盐的这一类化学反应
四、离子方程式的意义
H+ + OH- = H2O 表示只能强酸和强碱的反应 ?
也可以表示强酸的酸式盐(NaHSO4)和强碱的反应
四、思考
书写下列离子方程式所表示的化学方程式(写一个即可)
(1) H+ + OH- = H2O
(2)CO32- + H+ =CO2 + H2O
(3)SO42- + Ba2+ = BaSO4
(4)2Al + 6H+ =2Al3+ + H2
(5)Fe + 2 Ag+ = Fe2+ + 2Ag
谢谢
第一章 物质及其变化
第二节 离子反应
第2课时 离子反应
视频播放
硫酸铜和氢氧化钠反应
视频播放
硫酸铜和氢氧化钾反应
视频播放
硫酸铜和氢氧化钡反应
交流思考
1、观察几个实验现象,思考不同的物质和硫酸铜发生反应时,都生成了蓝色沉淀,这是为什么?生成的产物有什么?
2、写出视频中三个反应方程式,并分析生成物,并写出相关物质的电离方程式。
教学目标
1.理解离子反应的概念,会书离子方程式并能进行简单的正误判断;
2.掌握复分解型离子反应发生的条件及意义,了解离子反应的实质。
分组实验
向2mL的Na2SO4稀溶液的试管中加入2mL的BaCl2溶液
现象 分析 Na2SO4、BaCl2电离方程式 混合前两种溶液中的离子 混合后溶液中的离子
观察微观变化模拟动画,并思考Na2SO4与BaCl2反应的实质是什么?(从离子角度)
Na+
SO42
Na+
Na+
Na+
SO42
Cl-
Cl-
Cl-
Cl-
Ba2+
Ba2+
BaSO4
BaSO4
微观动画实验观察
实验结论
Na+、 Cl-没有发生化学反应,Ba2+ 、SO42-发生了化学反应,生成BaSO4白色沉淀
从微观角度看,反应的实质:
1、概念:有离子参加的反应,这样的反应属于离子反应。
离子方程式:Ba2+ + SO42-= BaSO4 ↓
一、离子反应
2、 离子方程式
用实际参加反应的离子符号表示离子反应的式子。
化学方程式:BaCl2+ Na2SO4= BaSO4 ↓+2NaCl
如何正确书写上述实验的离子方程式,离子方程式的书写步骤是怎样的?
思考
二、离子方程式的书写
1、写
: 写出反应的化学方程式 (以Na2SO4 和BaCl2反应为例)
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
2、拆
:把易溶于水且易电离的物质(强酸、强碱、可溶性盐)写成离子形式
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
3、删
4、查
:删去方程式两边不参加反应的离子,并将方程化为最简
:检查方程式两边各元素的原子个数和电荷总数是否相等
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
SO42- + Ba2+ = BaSO4↓
不拆:弱酸、弱碱、难溶的物质、单质、氧化物、气体和水等仍用化学式表示。
(1)对于微溶物:
①作生成物时,统一写成化学式;
②作反应物时:
a :如是澄清溶液,则澄清石灰水可拆成离子Ca2+和OH-,
b :若为浓溶液时,则以化学式表示。【如石灰乳不可拆,写成Ca(OH)2 】
(2)对于易分解的物质(如H2CO3)作生成物时,写成分解形式CO2、H2O;若产物生成NH3●H2O,反应条件为加热,则拆成NH3、H2O。
离子方程式的书写注意事项
实战演练
1、写出开始上课的三个视频的离子方程式;
2、写出石灰乳和碳酸钠的离子方程式;
3、写出硫酸和氯化钡的离子方程式;
4、写出碳酸钙和稀盐酸的离子方程式;
5、澄清石灰水和氯化铵溶液在加热条件下的离子方程式;
是不是所有的电解质溶液混合都会发生离子反应呢?
⑤Zn+ CuSO4
④NaCl+ CuSO4
③AgNO3+ BaCl2
① HNO3+ KOH
②H2SO4+ Na2CO3
复分解型
离子反应发生的条件
(1)生成难溶性的物质
(2)生成气体: 2H+ + CO32- ==== H2O+CO2↑
(3)生成弱电解质(水、弱酸、弱碱):H++OH-====H2O
三、离子反应发生的条件
反应物 化学方程式 离子方程式 两种方程式的不同
HCl+NaOH ______________________ ________________ 4个反应的化学方程式_____,但其离子方程式却________
HCl+KOH ______________________ ________________ H2SO4+NaOH _____________________ ________________ H2SO4+KOH ______________________ ________________ HCl+NaOH=NaCl+H2O
H++OH-=H2O
HCl+KOH=KCl+H2O
H++OH-=H2O
H2SO4+2NaOH= Na2SO4+2H2O
H++OH-=H2O
H2SO4+2KOH= K2SO4+2H2O
H++OH-=H2O
不同
相同
思考与讨论
离子方程式不仅可以表示某个具体的化学反应,而且可表示某一类型的反应。
思考:
是否所有的酸碱中和反应都能用:
H+ + OH- = H2O 表示
不能,①因为弱酸、弱碱不能拆开 ②酸碱生成难溶性盐也不能拆;
表示:强酸和强碱生成可溶性盐的这一类化学反应
四、离子方程式的意义
H+ + OH- = H2O 表示只能强酸和强碱的反应 ?
也可以表示强酸的酸式盐(NaHSO4)和强碱的反应
四、思考
书写下列离子方程式所表示的化学方程式(写一个即可)
(1) H+ + OH- = H2O
(2)CO32- + H+ =CO2 + H2O
(3)SO42- + Ba2+ = BaSO4
(4)2Al + 6H+ =2Al3+ + H2
(5)Fe + 2 Ag+ = Fe2+ + 2Ag
谢谢
