专题3 化学实验方案的设计及评价(共30张PPT)
文档属性
| 名称 | 专题3 化学实验方案的设计及评价(共30张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 11:25:17 | ||
图片预览










文档简介
(共30张PPT)
专题3 化学实验方案的设计及评价
考题统计
化学实验方案及评价:
辽宁卷(2022、2021),重庆卷(2022),湖北卷(2022、2021),广东卷(2023、2022、2021),湖南卷(2022、2021),江苏卷(2022、2021),海南卷(2022、2021),河北卷(2022),北京卷(2022、2020),山东卷(2020),浙江卷(2023、2022、2021、2020),全国新课标卷(2023)
聚焦核心要点
课标指引:1.了解科学探究过程包括提出问题和假设、设计方案、实施实验、获取证据、分析解释或建构模型、形成结论及交流评价等核心要素。 2.理解从问题和假设出发确定研究目的、依据研究目的设计方案、基于证据进行分析和推理等对于科学探究的重要性。
1.化学实验方案的设计与评价
2.解答表格型实验分析题的思维模型
3.解答化学实验装置图评价题的思维要点
(1)查实验装置中的仪器的使用和连接是否正确。
(2)查所用反应试剂是否符合实验原理。
(3)查气体收集方法是否正确。
(4)查尾气吸收装置、安全装置是否正确。
(5)查实验目的与相应操作是否相符,现象、结论是否正确。
4.解答化学实验操作现象及结论评价类题的思维要点
(1)副反应或带出的杂质可能导致实验结论不准确。
(2)实验现象掩盖事实导致的结论不准确。
(3)实验操作错误导致的结论不准确。
(4)原理应用错误导致所得结论不准确。
易错辨析
1.制取无水乙醇可向乙醇中加入CaO之后过滤。( )
2.向食盐溶液中滴加淀粉溶液,可检验食盐中是否含碘元素。( )
3.检验Na2O2是否变质的方法:向久置的Na2O2粉末中滴加过量的盐酸,产生无色气体。( )
×
加入CaO后应蒸馏分离乙醇。
×
加淀粉溶液是检验碘单质,而不能检验食盐中的碘元素,不能达到相应实验目的。
×
过氧化钠能和盐酸反应生成氧气,故不能检验Na2O2是否变质,不能达到相应实验目的。
4.用pH计测同浓度的CH3COONa溶液和NaClO溶液的pH,可比较CH3COOH和HClO的酸性强弱。( )
√
用pH计测同浓度的CH3COONa溶液和NaClO溶液的pH,根据越弱越水解原理,可以比较CH3COOH和HClO的酸性强弱,能达到相应实验目的。
精研核心命题
命题点1化学实验装置图及评价
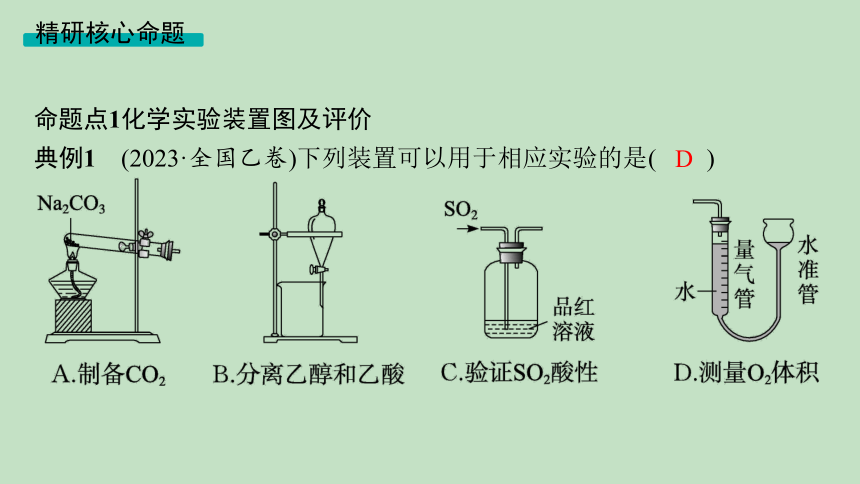
典例1 (2023·全国乙卷)下列装置可以用于相应实验的是( )
D
解析 Na2CO3不易分解,不能通过加热Na2CO3的方法制取CO2,A错误;乙醇和乙酸互溶,不能通过分液的方法分离,B错误;SO2通入品红溶液使其褪色,体现了SO2的漂白性,C错误;通过移动水准管使左右两侧液面相平,然后读取示数差,可以测量O2的体积,D正确。
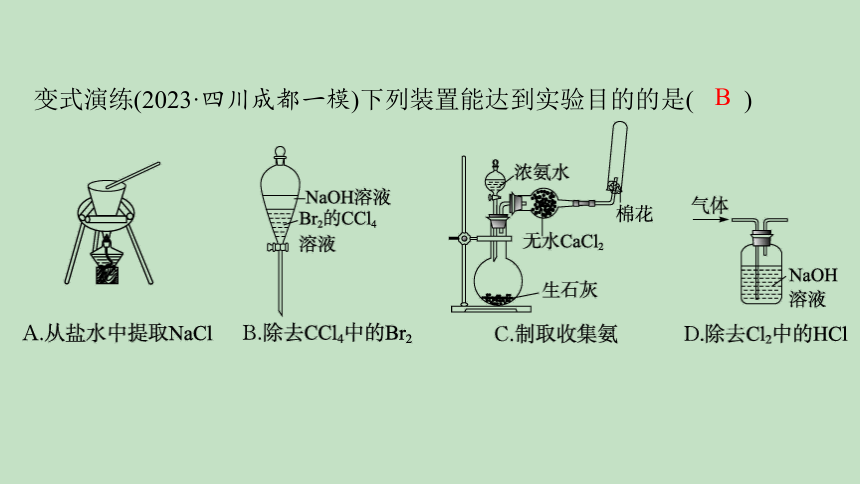
变式演练(2023·四川成都一模)下列装置能达到实验目的的是( )
B
解析 盐水中提取NaCl,用蒸发结晶的方法,需要用蒸发皿,坩埚是用于灼烧的,A错误;Br2能与NaOH反应,且NaOH溶液与CCl4不互溶,所以可以用NaOH除去Br2后,再用分液的方法将NaOH溶液与CCl4分离,B正确;浓氨水与生石灰混合,生石灰溶于水放热且生成氢氧化钙,使NH3·H2O的电离平衡逆向移动,从而产生氨气,氨气会与氯化钙反应,不能用无水氯化钙干燥,C错误;用NaOH除去HCl但Cl2可以与NaOH反应,D错误。
命题点2化学实验目的、操作、结论及评价
典例2 (2022·辽宁卷)下列实验能达到目的的是( )
选项 实验目的 实验方法或操作
A 测定中和反应的反应热 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度
B 探究浓度对化学反应速率的影响 量取同体积不同浓度的NaClO溶液,分别加入等体积等浓度的Na2SO3溶液,对比现象
C 判断反应后Ba2+是否沉淀完全 将Na2CO3溶液与BaCl2溶液混合,反应后静置,向上层清液中再加1滴Na2CO3溶液
D 检验淀粉是否发生了水解 向淀粉水解液中加入碘水
C
解析 酸碱中和滴定操作没有采取保温措施,热量损失较多,不能用于测定中和反应的反应热,A错误;NaClO溶液和Na2SO3溶液反应生成NaCl和Na2SO4,无明显实验现象,不能用于探究浓度对化学反应速率的影响,B错误;取上层清液,加入1滴Na2CO3溶液,若生成白色沉淀,证明Ba2+未完全沉淀,否则,沉淀完全,C正确;检验淀粉是否发生了水解,应检验其水解液中是否含葡萄糖,要选用新制的Cu(OH)2或银氨溶液,不能加入碘水,D错误。
变式演练(2023·江西鹰潭一模)根据实验操作、现象得到的结论正确的是( )
选项 实验操作 实验现象 实验结论
A 向某无色溶液中滴加稀硫酸 产生的气体能使品红溶液褪色,加热后溶液又恢复红色 原溶液中必含
或
B 将甲醇和过量酸性高锰酸钾溶液混合 紫红色褪去或变浅 甲醇被氧化成甲酸
C 向双氧水中滴加FeCl2溶液 起始没有气泡,一段时间后产生大量气泡 可能是Fe3+催化了H2O2的分解
D 向2 mL 0.1 mol·L-1的AgNO3溶液中滴加3滴相同浓度的NaCl溶液,然后滴加3滴相同浓度的KI溶液 先出现白色沉淀,然后产生黄色沉淀 Ksp(AgI)<
Ksp(AgCl)
C
解析 向某无色溶液中滴加稀硫酸,产生的气体能使品红溶液褪色,加热后溶液又恢复红色,该气体为SO2,则溶液中含有 ,A错误;将甲醇和过量酸性高锰酸钾溶液混合,溶液的紫红色褪去或变浅,可能是甲醇被氧化成甲酸,也可能是过量的高锰酸钾继续将甲酸氧化为二氧化碳,B错误;Fe2+被H2O2氧化为Fe3+进而催化H2O2分解,C正确;向2 mL 0.1 mol·L-1的AgNO3溶液中滴加3滴相同浓度的NaCl溶液,AgNO3过量,然后滴加3滴相同浓度的KI溶液,直接生成AgI沉淀,不能证明Ksp(AgI)训练分层落实
练真题·明考向
1.(2023·全国新课标卷)根据实验操作及现象,下列结论中正确的是( )
选项 实验操作及现象 结论
A 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
B 取一定量Na2SO3样品,溶解后加入BaCl2溶液,产生白色沉淀。加入浓硝酸,仍有沉淀 此样品中含有
C 将银和AgNO3溶液与铜和Na2SO4溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 Cu的金属性比Ag强
D 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
C
解析 浓硝酸的氧化性比稀硝酸强,常温下使铁片发生钝化,A错误;Na2SO3与BaCl2反应产生白色沉淀为BaSO3,浓硝酸会将BaSO3氧化为BaSO4,无法确定样品中是否含有 ,B错误;根据实验现象,铜电极为负极,银电极为正极,铜置换了银,能够说明铜的金属性比银强,C正确;苯不能与溴水反应,能够萃取溴水中的溴,使水层颜色变浅,D错误。
2.(2023·北京卷)完成下述实验,装置或试剂不正确的是( )
A.实验室制Cl2
B.实验室收集C2H4
C.验证NH3易溶于水且溶液呈碱性
D.除去CO2中混有的少量HCl
D
解析 MnO2固体加热条件下将HCl氧化为Cl2,固液加热的反应该装置可用于制备Cl2,A正确;C2H4不溶于水,可选择排水收集,B正确;挤压胶头滴管,水进入烧瓶将NH3溶解,烧瓶中气体大量减少,压强急剧降低,打开活塞,水迅速被压入烧瓶中形成红色喷泉,红色喷泉证明NH3与水形成碱性物质,C正确;Na2CO3与HCl、CO2发生反应,不能达到除杂的目的,应该选用饱和NaHCO3溶液,D错误。
3.(2023·浙江6月选考卷)下列说法正确的是( )
A.图①装置可用于制取并收集氨气
B.图②操作可排出盛有KMnO4溶液滴定管尖嘴内的气泡
C.图③操作俯视刻度线定容会导致所配溶液浓度偏大
D.图④装置盐桥中阳离子向ZnSO4溶液中迁移
C
解析 氯化铵受热分解生成氨气和氯化氢,遇冷又化合生成氯化铵,则直接加热氯化铵无法制得氨气,实验室用加热氯化铵和氢氧化钙固体的方法制备氨气,A错误;高锰酸钾溶液具有强氧化性,会腐蚀橡胶管,所以高锰酸钾溶液应盛放在酸式滴定管中,不能盛放在碱式滴定管中,B错误;配制一定物质的量浓度的溶液时,俯视刻度线定容会使溶液的体积偏小,导致所配溶液浓度偏大,C正确;锌铜原电池中,锌电极为原电池的负极,铜为正极,盐桥中阳离子向硫酸铜溶液中迁移,D错误。
练易错·避陷阱
4.(2022·辽宁丹东一模)下列装置能达到相应实验目的的是( )
答案 C
解析 溴水具有酸的性质可与碱发生反应,因此应该使用酸式滴定管盛装溴水,A错误;酸性高锰酸钾能将乙二醇氧化生成二氧化碳,B错误;乙酸和乙醇在浓硫酸加热的条件下生成乙酸乙酯,C正确;反应过程中能生成二氧化硫,也能使溴水褪色,应先除去二氧化硫再检验消去反应的产物乙烯,D错误。
5.(2023·山东德州一模)下列由实验操作、现象所得结论正确的是( )
选项 实验操作和现象 实验结论
A 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 铁锈中含有二价铁
B 用毛皮摩擦过的带电橡胶靠近CF2Cl2液流,液流方向改变 CF2Cl2是极性分子
C 石蜡油加强热,将产生的气体通入溴水,溴水颜色褪去 气体中含有乙烯
D 用pH计分别测0.1 mol·L-1 NaClO和CH3COONa溶液的pH,前者pH大 Ka(HClO)>
Ka(CH3COOH)
B
解析 二价铁和浓盐酸均可以被酸性KMnO4溶液氧化,A错误;由于毛皮摩擦过的橡胶棒带负电,CF2Cl2是极性分子,故当橡胶棒靠近水流时,液流方向改变,B正确;气体通入溴水,溴水颜色褪去,只能说明气体中含有不饱和烃,C错误;用pH计分别测0.1 mol·L-1 NaClO和CH3COONa溶液的pH,前者pH大,说明ClO-的水解程度大于CH3COO-,则酸性:HClO练预测·押考向
6.利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3·6H2O的主要步骤:用H2O2氧化废蚀刻液、制备氨气、制备碱性蚀刻液[CuCl2+4NH3 ══ Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3·6H2O。下列有关实验说法不正确的是( )
A.用装置甲制备氨气
B.用装置丁由FeCl3溶液制备FeCl3·6H2O需要经蒸发浓缩、冷却结晶、过滤洗涤等步骤
C.用装置丙可以分离Cu(NH3)4Cl2溶液和Fe(OH)3
D.用装置乙可以制备Cu(NH3)4Cl2并沉铁
答案 B
解析 用H2O2氧化废蚀刻液,使Fe2+转化为Fe3+,用甲装置制备氨气,生成的氨气通入乙装置,A正确;由FeCl3溶液制备FeCl3·6H2O需要在蒸发皿中蒸干,不能在烧杯中进行,B错误;用装置丙可以分离可溶性Cu(NH3)4Cl2溶液和难溶性的Fe(OH)3,C正确;氨气易溶于水,注意防止倒吸,所以要选用乙装置,氨气与溶液反应生成Cu(NH3)4Cl2和Fe(OH)3,D正确。
专题3 化学实验方案的设计及评价
考题统计
化学实验方案及评价:
辽宁卷(2022、2021),重庆卷(2022),湖北卷(2022、2021),广东卷(2023、2022、2021),湖南卷(2022、2021),江苏卷(2022、2021),海南卷(2022、2021),河北卷(2022),北京卷(2022、2020),山东卷(2020),浙江卷(2023、2022、2021、2020),全国新课标卷(2023)
聚焦核心要点
课标指引:1.了解科学探究过程包括提出问题和假设、设计方案、实施实验、获取证据、分析解释或建构模型、形成结论及交流评价等核心要素。 2.理解从问题和假设出发确定研究目的、依据研究目的设计方案、基于证据进行分析和推理等对于科学探究的重要性。
1.化学实验方案的设计与评价
2.解答表格型实验分析题的思维模型
3.解答化学实验装置图评价题的思维要点
(1)查实验装置中的仪器的使用和连接是否正确。
(2)查所用反应试剂是否符合实验原理。
(3)查气体收集方法是否正确。
(4)查尾气吸收装置、安全装置是否正确。
(5)查实验目的与相应操作是否相符,现象、结论是否正确。
4.解答化学实验操作现象及结论评价类题的思维要点
(1)副反应或带出的杂质可能导致实验结论不准确。
(2)实验现象掩盖事实导致的结论不准确。
(3)实验操作错误导致的结论不准确。
(4)原理应用错误导致所得结论不准确。
易错辨析
1.制取无水乙醇可向乙醇中加入CaO之后过滤。( )
2.向食盐溶液中滴加淀粉溶液,可检验食盐中是否含碘元素。( )
3.检验Na2O2是否变质的方法:向久置的Na2O2粉末中滴加过量的盐酸,产生无色气体。( )
×
加入CaO后应蒸馏分离乙醇。
×
加淀粉溶液是检验碘单质,而不能检验食盐中的碘元素,不能达到相应实验目的。
×
过氧化钠能和盐酸反应生成氧气,故不能检验Na2O2是否变质,不能达到相应实验目的。
4.用pH计测同浓度的CH3COONa溶液和NaClO溶液的pH,可比较CH3COOH和HClO的酸性强弱。( )
√
用pH计测同浓度的CH3COONa溶液和NaClO溶液的pH,根据越弱越水解原理,可以比较CH3COOH和HClO的酸性强弱,能达到相应实验目的。
精研核心命题
命题点1化学实验装置图及评价
典例1 (2023·全国乙卷)下列装置可以用于相应实验的是( )
D
解析 Na2CO3不易分解,不能通过加热Na2CO3的方法制取CO2,A错误;乙醇和乙酸互溶,不能通过分液的方法分离,B错误;SO2通入品红溶液使其褪色,体现了SO2的漂白性,C错误;通过移动水准管使左右两侧液面相平,然后读取示数差,可以测量O2的体积,D正确。
变式演练(2023·四川成都一模)下列装置能达到实验目的的是( )
B
解析 盐水中提取NaCl,用蒸发结晶的方法,需要用蒸发皿,坩埚是用于灼烧的,A错误;Br2能与NaOH反应,且NaOH溶液与CCl4不互溶,所以可以用NaOH除去Br2后,再用分液的方法将NaOH溶液与CCl4分离,B正确;浓氨水与生石灰混合,生石灰溶于水放热且生成氢氧化钙,使NH3·H2O的电离平衡逆向移动,从而产生氨气,氨气会与氯化钙反应,不能用无水氯化钙干燥,C错误;用NaOH除去HCl但Cl2可以与NaOH反应,D错误。
命题点2化学实验目的、操作、结论及评价
典例2 (2022·辽宁卷)下列实验能达到目的的是( )
选项 实验目的 实验方法或操作
A 测定中和反应的反应热 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度
B 探究浓度对化学反应速率的影响 量取同体积不同浓度的NaClO溶液,分别加入等体积等浓度的Na2SO3溶液,对比现象
C 判断反应后Ba2+是否沉淀完全 将Na2CO3溶液与BaCl2溶液混合,反应后静置,向上层清液中再加1滴Na2CO3溶液
D 检验淀粉是否发生了水解 向淀粉水解液中加入碘水
C
解析 酸碱中和滴定操作没有采取保温措施,热量损失较多,不能用于测定中和反应的反应热,A错误;NaClO溶液和Na2SO3溶液反应生成NaCl和Na2SO4,无明显实验现象,不能用于探究浓度对化学反应速率的影响,B错误;取上层清液,加入1滴Na2CO3溶液,若生成白色沉淀,证明Ba2+未完全沉淀,否则,沉淀完全,C正确;检验淀粉是否发生了水解,应检验其水解液中是否含葡萄糖,要选用新制的Cu(OH)2或银氨溶液,不能加入碘水,D错误。
变式演练(2023·江西鹰潭一模)根据实验操作、现象得到的结论正确的是( )
选项 实验操作 实验现象 实验结论
A 向某无色溶液中滴加稀硫酸 产生的气体能使品红溶液褪色,加热后溶液又恢复红色 原溶液中必含
或
B 将甲醇和过量酸性高锰酸钾溶液混合 紫红色褪去或变浅 甲醇被氧化成甲酸
C 向双氧水中滴加FeCl2溶液 起始没有气泡,一段时间后产生大量气泡 可能是Fe3+催化了H2O2的分解
D 向2 mL 0.1 mol·L-1的AgNO3溶液中滴加3滴相同浓度的NaCl溶液,然后滴加3滴相同浓度的KI溶液 先出现白色沉淀,然后产生黄色沉淀 Ksp(AgI)<
Ksp(AgCl)
C
解析 向某无色溶液中滴加稀硫酸,产生的气体能使品红溶液褪色,加热后溶液又恢复红色,该气体为SO2,则溶液中含有 ,A错误;将甲醇和过量酸性高锰酸钾溶液混合,溶液的紫红色褪去或变浅,可能是甲醇被氧化成甲酸,也可能是过量的高锰酸钾继续将甲酸氧化为二氧化碳,B错误;Fe2+被H2O2氧化为Fe3+进而催化H2O2分解,C正确;向2 mL 0.1 mol·L-1的AgNO3溶液中滴加3滴相同浓度的NaCl溶液,AgNO3过量,然后滴加3滴相同浓度的KI溶液,直接生成AgI沉淀,不能证明Ksp(AgI)
练真题·明考向
1.(2023·全国新课标卷)根据实验操作及现象,下列结论中正确的是( )
选项 实验操作及现象 结论
A 常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 稀硝酸的氧化性比浓硝酸强
B 取一定量Na2SO3样品,溶解后加入BaCl2溶液,产生白色沉淀。加入浓硝酸,仍有沉淀 此样品中含有
C 将银和AgNO3溶液与铜和Na2SO4溶液组成原电池。连通后银表面有银白色金属沉积,铜电极附近溶液逐渐变蓝 Cu的金属性比Ag强
D 向溴水中加入苯,振荡后静置,水层颜色变浅 溴与苯发生了加成反应
C
解析 浓硝酸的氧化性比稀硝酸强,常温下使铁片发生钝化,A错误;Na2SO3与BaCl2反应产生白色沉淀为BaSO3,浓硝酸会将BaSO3氧化为BaSO4,无法确定样品中是否含有 ,B错误;根据实验现象,铜电极为负极,银电极为正极,铜置换了银,能够说明铜的金属性比银强,C正确;苯不能与溴水反应,能够萃取溴水中的溴,使水层颜色变浅,D错误。
2.(2023·北京卷)完成下述实验,装置或试剂不正确的是( )
A.实验室制Cl2
B.实验室收集C2H4
C.验证NH3易溶于水且溶液呈碱性
D.除去CO2中混有的少量HCl
D
解析 MnO2固体加热条件下将HCl氧化为Cl2,固液加热的反应该装置可用于制备Cl2,A正确;C2H4不溶于水,可选择排水收集,B正确;挤压胶头滴管,水进入烧瓶将NH3溶解,烧瓶中气体大量减少,压强急剧降低,打开活塞,水迅速被压入烧瓶中形成红色喷泉,红色喷泉证明NH3与水形成碱性物质,C正确;Na2CO3与HCl、CO2发生反应,不能达到除杂的目的,应该选用饱和NaHCO3溶液,D错误。
3.(2023·浙江6月选考卷)下列说法正确的是( )
A.图①装置可用于制取并收集氨气
B.图②操作可排出盛有KMnO4溶液滴定管尖嘴内的气泡
C.图③操作俯视刻度线定容会导致所配溶液浓度偏大
D.图④装置盐桥中阳离子向ZnSO4溶液中迁移
C
解析 氯化铵受热分解生成氨气和氯化氢,遇冷又化合生成氯化铵,则直接加热氯化铵无法制得氨气,实验室用加热氯化铵和氢氧化钙固体的方法制备氨气,A错误;高锰酸钾溶液具有强氧化性,会腐蚀橡胶管,所以高锰酸钾溶液应盛放在酸式滴定管中,不能盛放在碱式滴定管中,B错误;配制一定物质的量浓度的溶液时,俯视刻度线定容会使溶液的体积偏小,导致所配溶液浓度偏大,C正确;锌铜原电池中,锌电极为原电池的负极,铜为正极,盐桥中阳离子向硫酸铜溶液中迁移,D错误。
练易错·避陷阱
4.(2022·辽宁丹东一模)下列装置能达到相应实验目的的是( )
答案 C
解析 溴水具有酸的性质可与碱发生反应,因此应该使用酸式滴定管盛装溴水,A错误;酸性高锰酸钾能将乙二醇氧化生成二氧化碳,B错误;乙酸和乙醇在浓硫酸加热的条件下生成乙酸乙酯,C正确;反应过程中能生成二氧化硫,也能使溴水褪色,应先除去二氧化硫再检验消去反应的产物乙烯,D错误。
5.(2023·山东德州一模)下列由实验操作、现象所得结论正确的是( )
选项 实验操作和现象 实验结论
A 将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去 铁锈中含有二价铁
B 用毛皮摩擦过的带电橡胶靠近CF2Cl2液流,液流方向改变 CF2Cl2是极性分子
C 石蜡油加强热,将产生的气体通入溴水,溴水颜色褪去 气体中含有乙烯
D 用pH计分别测0.1 mol·L-1 NaClO和CH3COONa溶液的pH,前者pH大 Ka(HClO)>
Ka(CH3COOH)
B
解析 二价铁和浓盐酸均可以被酸性KMnO4溶液氧化,A错误;由于毛皮摩擦过的橡胶棒带负电,CF2Cl2是极性分子,故当橡胶棒靠近水流时,液流方向改变,B正确;气体通入溴水,溴水颜色褪去,只能说明气体中含有不饱和烃,C错误;用pH计分别测0.1 mol·L-1 NaClO和CH3COONa溶液的pH,前者pH大,说明ClO-的水解程度大于CH3COO-,则酸性:HClO
6.利用废蚀刻液(含FeCl2、CuCl2及FeCl3)制备碱性蚀刻液[Cu(NH3)4Cl2溶液]和FeCl3·6H2O的主要步骤:用H2O2氧化废蚀刻液、制备氨气、制备碱性蚀刻液[CuCl2+4NH3 ══ Cu(NH3)4Cl2]、固液分离,用盐酸溶解沉淀并制备FeCl3·6H2O。下列有关实验说法不正确的是( )
A.用装置甲制备氨气
B.用装置丁由FeCl3溶液制备FeCl3·6H2O需要经蒸发浓缩、冷却结晶、过滤洗涤等步骤
C.用装置丙可以分离Cu(NH3)4Cl2溶液和Fe(OH)3
D.用装置乙可以制备Cu(NH3)4Cl2并沉铁
答案 B
解析 用H2O2氧化废蚀刻液,使Fe2+转化为Fe3+,用甲装置制备氨气,生成的氨气通入乙装置,A正确;由FeCl3溶液制备FeCl3·6H2O需要在蒸发皿中蒸干,不能在烧杯中进行,B错误;用装置丙可以分离可溶性Cu(NH3)4Cl2溶液和难溶性的Fe(OH)3,C正确;氨气易溶于水,注意防止倒吸,所以要选用乙装置,氨气与溶液反应生成Cu(NH3)4Cl2和Fe(OH)3,D正确。
同课章节目录
