3.1 铁及其化合物 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1 铁及其化合物 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 325.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 14:41:46 | ||
图片预览


文档简介
3.1 铁及其化合物 同步练习题
一、选择题
1.检验浸泡过覆铜板的“腐蚀液”是否有剩余,可选用的试剂是
A.氯水 B.酸性溶液 C.KSCN溶液 D.双氧水
2.下列离子方程式书写正确的是
A.盐酸中滴入碳酸钠溶液:CO+ 2H+ =H2O + CO2↑
B.铁粉与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl + OH-=H2O + C1-
D.稀硫酸滴入氢氧化钡溶液:SO+ H+ + Ba2+ + OH-=BaSO4↓+ H2O
3.金属材料研究机构中测试工程师利用化学检测方法对金属材料组成进行分析,下列试剂可用来与金属材料反应检测出有铁单质的是
A.溶液 B.NaOH溶液
C.KSCN溶液 D.稀硫酸、溶液
4.下列说法中正确的是
A.铁丝和铜丝都可以在氯气中燃烧 B.钠粒投入硫酸铝溶液中,可置换出铝
C.铁丝在空气中燃烧生成黑色的四氧化三铁 D.久置的氯水,其剩余成分只有水
5.青矾矿石在《唐本草》中有记载:“本来绿色,新出窑未见风者,正如琉璃……烧之赤色……”。明末学者方以智所著《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽树不茂。”有关说法正确的是
A.青矾矿石主要成分是
B.烧之赤色,是发生了分解反应生成的缘故
C.青矾应密封保存,主要目的是防止风化
D.熏人的“厂气”是、
6.含Fe3+的盐溶液遇KSCN溶液会变红。据此原理可设计“水写红字”魔术(如图),其中的纸张需经某溶液浸泡、干燥后使用,该溶液是
A.FeCl3溶液 B.KCl溶液 C.KNO3溶液 D.K2SO4溶液
7.下列反应的离子方程式书写正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:
B.用溶液腐蚀覆铜板制作电路板:
C.相同物质的量浓度相同体积的溶液与NaOH溶液混合:
D.大理石用醋酸溶解:
8.某补铁剂每片含硫酸亚铁0.3g(相当于铁60mg),为测定含铁量是否达标,某兴趣小组用实验室常用试剂将铁元素通过氧化、碱化等步骤转化为Fe2O3,该过程不需要的操作为
A. B. C. D.
二、非选择题
9.晒制蓝图时,用K3[Fe(C2O4)3] 3H2O作感光剂,其光解反应有FeC2O4生成。432gFeC2O4在一定条件下分解可以得到一种具有磁性的黑色固体和两种含有相同元素的气体,根据信息写出反应的化学方程式 ,则两种气体质量的最简整数比为 。
10.Fe与非金属单质反应
(1)与O2反应
点燃(化学方程式): ;现象:剧烈燃烧,火星四射。
常温:铁在潮湿的空气中易被腐蚀,生成铁锈,其主要成分为Fe2O3·xH2O。
(2)与Cl2反应(化学方程式): ;现象:剧烈燃烧,棕褐色烟。
注意:铁在氯气中燃烧,只生成FeCl3,与反应物量比无关。
(3)与S反应(化学方程式): 。
11.现有CuO和Fe2O3组成的混合物若干克,向其中加入一定浓度的硝酸溶液50.0mL,恰好完全反应。向反应后的溶液中不断加入铁粉,加入铁粉的质量与充分反应后剩余固体的质量关系如图所示(A为拐点)。
请回答下列问题:
(1)氧化铁与氧化铜的物质的量之比 。
(2)硝酸溶液的物质的量浓度为 mol/L。
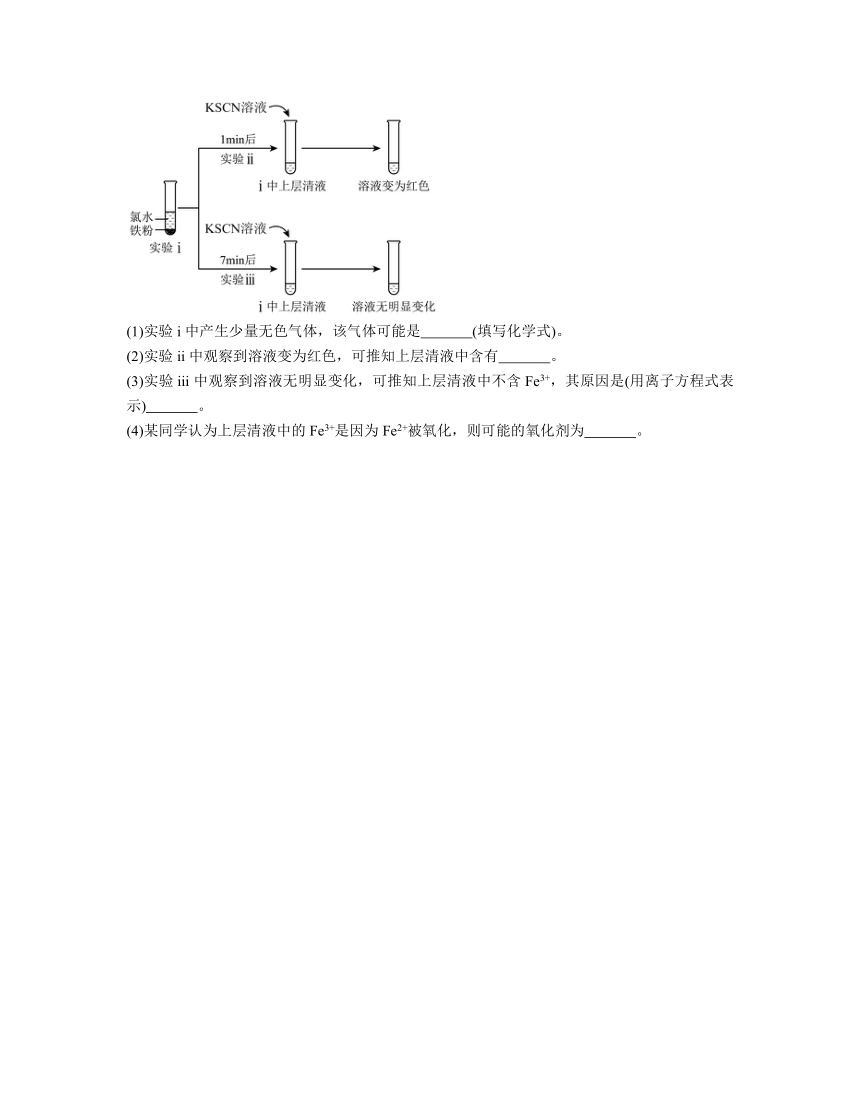
12.某实验小组探究氯水与铁的反应。
(1)实验i中产生少量无色气体,该气体可能是 (填写化学式)。
(2)实验ii中观察到溶液变为红色,可推知上层清液中含有 。
(3)实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+,其原因是(用离子方程式表示) 。
(4)某同学认为上层清液中的Fe3+是因为Fe2+被氧化,则可能的氧化剂为 。
【参考答案】
一、选择题
1.C
解析:检验选用的试剂是KSCN溶液,溶液出现血红色,故选:C。
2.A
解析:A.HCl与Na2CO3反应,实质是H+与反应,对应离子方程式为:2H++=CO2↑+H2O,A正确;
B.Fe与稀硫酸反应生成Fe2+,对应离子方程式为:Fe+2H+=Fe2++H2↑,B错误;
C.HCl属于强酸,书写离子方程式时应拆写为离子形式,正确离子方程式为:H++OH-=H2O,C错误;
D.Ba(OH)2与H2SO4反应时,Ba2+、、BaSO4系数为1,对应H+、OH-、H2O系数应为2,正确离子方程式为:2H++2OH-+Ba2++=BaSO4↓+2H2O,D错误;
故答案选A。
3.D
解析:Fe单质检验操作为加稀硫酸反应,有气泡产生,得到含的溶液,然后加溶液观察到有蓝色沉淀生成,故选D项。
4.A
解析:A.铁丝和铜丝都可以在氯气中燃烧生成氯化铁和氯化铜,A正确;
B.钠粒投入硫酸铝溶液中,钠先与水反应,生成的氢氧化钠再与盐反应,所以钠粒投入硫酸铝溶液中不能置换出铝,B错误;
C.铁丝在空气中不能燃烧,在纯氧中燃烧生成,C错误;
D.新制氯水主要成分是和HClO,久置后发生分解,故久置的氯水剩余成分是盐酸,D错误;
故选A。
5.D
解析:A. “青砚”的描述为:“本来绿色,新出窑未见风者,正如琉璃,烧之赤色”,说明“青砚”的颜色为绿色,所以应为,A错误;
B. “烧之赤色”说明经煅烧后,分解成颗粒度非常细而活性又很强的,同时生成,受热分解的化学方程式是:,B错误;
C.青矾含易被氧化,故需密封保存防氧化,C错误;
D.根据上述分析可知,熏人的“厂气”是 SO2、SO3,D正确;
故答案为;D。
6.A
解析:含Fe3+的盐溶液遇KSCN溶液会变红,说明纸张上浸有含铁离子的溶液,根据选项得到溶液为FeCl3溶液,故A符合题意。
综上所述,答案为A。
7.D
解析:A.硫酸铜溶液与氢氧化钡溶液反应的离子方程式为:,故A错误;
B.用溶液腐蚀覆铜板制作电路板的离子方程式为:,故B错误;
C.相同物质的量浓度相同体积的溶液与NaOH溶液混合的离子方程式为:,故C错误;
D.大理石用醋酸溶解的离子方程式为:,故D正确;
故选D。
8.C
解析:测定补铁剂中的含铁量将补铁剂在烧杯中进行溶解后加氧化剂充分氧化,将铁转化成三价铁离子后再加碱将铁离子完全沉淀,然后过滤出氢氧化铁,在坩埚中进行灼烧,得到氧化铁后用天平称量,由此装置可知A为溶解、B为过滤、C为蒸发、D为称量,不需要的操作是C蒸发,
故选:C。
二、非选择题
9. 3FeC2O4=Fe3O4+4CO↑+2CO2↑ 14∶11或11∶14
解析:432gFeC2O4在一定条件下分解可以得到一种具有磁性的黑色固体为Fe3O4,按元素质量守恒,分解所得的两种含有相同元素的气体为CO和CO2,则根据信息写出反应的化学方程式为3FeC2O4=Fe3O4+4CO↑+2CO2↑,化学方程式中化学计量数之比为物质的量之比,则两种气体CO与CO2的物质的量之比为2:1,则CO与CO2的质量之比为(2mol×28g/mol)∶(1mol×44g/mol)=14∶11。
10.(1)3Fe+2O2Fe3O4
(2)2Fe+3Cl22FeCl3
(3)Fe+SFeS
解析:(1)Fe与O2在点燃的条件下反应化学方程式为3Fe+2O2Fe3O4;
(2)Fe与Cl2反应的化学方程式为2Fe+3Cl22FeCl3;
(3)Fe与S反应化学方程式为Fe+SFeS。
11.(1)3:1 (2)4.00
【分析】CuO和Fe2O3分别与硝酸溶液反应的化学方程式为:、,恰好完全反应所得溶液的溶质为和,再加入铁粉,由于Fe3+比Cu2+的氧化性强,先发生反应:,后发生反应:。由图像知,当加入2.24gFe时,第二个反应恰好完全进行,析出金属铜的质量为0.640g,根据铜原子守恒,,0.010molCuO生成0.010mol,与0.010mol反应需要消耗0.010molFe,则与反应的铁的物质的量为:,溶液中的物质的量为0.060mol,原混合物中Fe2O3的物质的量为0.03mol。
解析:(1)根据分析可知,氧化铁与氧化铜的物质的量之比为0.03mol:0.010mol=3:1,故答案为:3:1;
(2)0.010molCuO消耗0.020molHNO3,0.03molFe2O3消耗0.180mol HNO3,50.0mL硝酸溶液中共含有0.020+0.180=0.200mol HNO3,该硝酸溶液的物质的量浓度为:,故答案为:4.00。
12.(1)H2
(2)Fe3+
(3)2Fe3+ + Fe = 3Fe2+
(4)Cl2、HClO
解析:氯水中含氯气、HClO和HCl,铁与HCl反应生成氯化亚铁和氢气,氯气、HClO具有强氧化性能将Fe2+氧化为Fe3+,Fe3+可用KSCN溶液检验,若铁粉过量,能将Fe3+还原成Fe2+,据此回答。
(1)氯气与水反应生成HClO和HCl,铁与HCl反应生成氢气,故实验i中产生少量无色气体,该气体可能是H2。
(2)KSCN遇到Fe3+可生成血红色溶液,NaCl与Fe3+不发生反应,则实验ii中观察到溶液变为红色,可推知上层清液中含有Fe3+。
(3)实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+,可能的原因是铁粉过量,将生成的Fe3+还原成了Fe2+,故离子方程式:2Fe3++ Fe=3Fe2+。
(4)氯水中除氯气具有强氧化性外,氯气与水反应生成的HClO也具有强氧化性能将Fe2+氧化为Fe3+,故溶液中可能的氧化剂为Cl2、HClO
一、选择题
1.检验浸泡过覆铜板的“腐蚀液”是否有剩余,可选用的试剂是
A.氯水 B.酸性溶液 C.KSCN溶液 D.双氧水
2.下列离子方程式书写正确的是
A.盐酸中滴入碳酸钠溶液:CO+ 2H+ =H2O + CO2↑
B.铁粉与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl + OH-=H2O + C1-
D.稀硫酸滴入氢氧化钡溶液:SO+ H+ + Ba2+ + OH-=BaSO4↓+ H2O
3.金属材料研究机构中测试工程师利用化学检测方法对金属材料组成进行分析,下列试剂可用来与金属材料反应检测出有铁单质的是
A.溶液 B.NaOH溶液
C.KSCN溶液 D.稀硫酸、溶液
4.下列说法中正确的是
A.铁丝和铜丝都可以在氯气中燃烧 B.钠粒投入硫酸铝溶液中,可置换出铝
C.铁丝在空气中燃烧生成黑色的四氧化三铁 D.久置的氯水,其剩余成分只有水
5.青矾矿石在《唐本草》中有记载:“本来绿色,新出窑未见风者,正如琉璃……烧之赤色……”。明末学者方以智所著《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽树不茂。”有关说法正确的是
A.青矾矿石主要成分是
B.烧之赤色,是发生了分解反应生成的缘故
C.青矾应密封保存,主要目的是防止风化
D.熏人的“厂气”是、
6.含Fe3+的盐溶液遇KSCN溶液会变红。据此原理可设计“水写红字”魔术(如图),其中的纸张需经某溶液浸泡、干燥后使用,该溶液是
A.FeCl3溶液 B.KCl溶液 C.KNO3溶液 D.K2SO4溶液
7.下列反应的离子方程式书写正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:
B.用溶液腐蚀覆铜板制作电路板:
C.相同物质的量浓度相同体积的溶液与NaOH溶液混合:
D.大理石用醋酸溶解:
8.某补铁剂每片含硫酸亚铁0.3g(相当于铁60mg),为测定含铁量是否达标,某兴趣小组用实验室常用试剂将铁元素通过氧化、碱化等步骤转化为Fe2O3,该过程不需要的操作为
A. B. C. D.
二、非选择题
9.晒制蓝图时,用K3[Fe(C2O4)3] 3H2O作感光剂,其光解反应有FeC2O4生成。432gFeC2O4在一定条件下分解可以得到一种具有磁性的黑色固体和两种含有相同元素的气体,根据信息写出反应的化学方程式 ,则两种气体质量的最简整数比为 。
10.Fe与非金属单质反应
(1)与O2反应
点燃(化学方程式): ;现象:剧烈燃烧,火星四射。
常温:铁在潮湿的空气中易被腐蚀,生成铁锈,其主要成分为Fe2O3·xH2O。
(2)与Cl2反应(化学方程式): ;现象:剧烈燃烧,棕褐色烟。
注意:铁在氯气中燃烧,只生成FeCl3,与反应物量比无关。
(3)与S反应(化学方程式): 。
11.现有CuO和Fe2O3组成的混合物若干克,向其中加入一定浓度的硝酸溶液50.0mL,恰好完全反应。向反应后的溶液中不断加入铁粉,加入铁粉的质量与充分反应后剩余固体的质量关系如图所示(A为拐点)。
请回答下列问题:
(1)氧化铁与氧化铜的物质的量之比 。
(2)硝酸溶液的物质的量浓度为 mol/L。
12.某实验小组探究氯水与铁的反应。
(1)实验i中产生少量无色气体,该气体可能是 (填写化学式)。
(2)实验ii中观察到溶液变为红色,可推知上层清液中含有 。
(3)实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+,其原因是(用离子方程式表示) 。
(4)某同学认为上层清液中的Fe3+是因为Fe2+被氧化,则可能的氧化剂为 。
【参考答案】
一、选择题
1.C
解析:检验选用的试剂是KSCN溶液,溶液出现血红色,故选:C。
2.A
解析:A.HCl与Na2CO3反应,实质是H+与反应,对应离子方程式为:2H++=CO2↑+H2O,A正确;
B.Fe与稀硫酸反应生成Fe2+,对应离子方程式为:Fe+2H+=Fe2++H2↑,B错误;
C.HCl属于强酸,书写离子方程式时应拆写为离子形式,正确离子方程式为:H++OH-=H2O,C错误;
D.Ba(OH)2与H2SO4反应时,Ba2+、、BaSO4系数为1,对应H+、OH-、H2O系数应为2,正确离子方程式为:2H++2OH-+Ba2++=BaSO4↓+2H2O,D错误;
故答案选A。
3.D
解析:Fe单质检验操作为加稀硫酸反应,有气泡产生,得到含的溶液,然后加溶液观察到有蓝色沉淀生成,故选D项。
4.A
解析:A.铁丝和铜丝都可以在氯气中燃烧生成氯化铁和氯化铜,A正确;
B.钠粒投入硫酸铝溶液中,钠先与水反应,生成的氢氧化钠再与盐反应,所以钠粒投入硫酸铝溶液中不能置换出铝,B错误;
C.铁丝在空气中不能燃烧,在纯氧中燃烧生成,C错误;
D.新制氯水主要成分是和HClO,久置后发生分解,故久置的氯水剩余成分是盐酸,D错误;
故选A。
5.D
解析:A. “青砚”的描述为:“本来绿色,新出窑未见风者,正如琉璃,烧之赤色”,说明“青砚”的颜色为绿色,所以应为,A错误;
B. “烧之赤色”说明经煅烧后,分解成颗粒度非常细而活性又很强的,同时生成,受热分解的化学方程式是:,B错误;
C.青矾含易被氧化,故需密封保存防氧化,C错误;
D.根据上述分析可知,熏人的“厂气”是 SO2、SO3,D正确;
故答案为;D。
6.A
解析:含Fe3+的盐溶液遇KSCN溶液会变红,说明纸张上浸有含铁离子的溶液,根据选项得到溶液为FeCl3溶液,故A符合题意。
综上所述,答案为A。
7.D
解析:A.硫酸铜溶液与氢氧化钡溶液反应的离子方程式为:,故A错误;
B.用溶液腐蚀覆铜板制作电路板的离子方程式为:,故B错误;
C.相同物质的量浓度相同体积的溶液与NaOH溶液混合的离子方程式为:,故C错误;
D.大理石用醋酸溶解的离子方程式为:,故D正确;
故选D。
8.C
解析:测定补铁剂中的含铁量将补铁剂在烧杯中进行溶解后加氧化剂充分氧化,将铁转化成三价铁离子后再加碱将铁离子完全沉淀,然后过滤出氢氧化铁,在坩埚中进行灼烧,得到氧化铁后用天平称量,由此装置可知A为溶解、B为过滤、C为蒸发、D为称量,不需要的操作是C蒸发,
故选:C。
二、非选择题
9. 3FeC2O4=Fe3O4+4CO↑+2CO2↑ 14∶11或11∶14
解析:432gFeC2O4在一定条件下分解可以得到一种具有磁性的黑色固体为Fe3O4,按元素质量守恒,分解所得的两种含有相同元素的气体为CO和CO2,则根据信息写出反应的化学方程式为3FeC2O4=Fe3O4+4CO↑+2CO2↑,化学方程式中化学计量数之比为物质的量之比,则两种气体CO与CO2的物质的量之比为2:1,则CO与CO2的质量之比为(2mol×28g/mol)∶(1mol×44g/mol)=14∶11。
10.(1)3Fe+2O2Fe3O4
(2)2Fe+3Cl22FeCl3
(3)Fe+SFeS
解析:(1)Fe与O2在点燃的条件下反应化学方程式为3Fe+2O2Fe3O4;
(2)Fe与Cl2反应的化学方程式为2Fe+3Cl22FeCl3;
(3)Fe与S反应化学方程式为Fe+SFeS。
11.(1)3:1 (2)4.00
【分析】CuO和Fe2O3分别与硝酸溶液反应的化学方程式为:、,恰好完全反应所得溶液的溶质为和,再加入铁粉,由于Fe3+比Cu2+的氧化性强,先发生反应:,后发生反应:。由图像知,当加入2.24gFe时,第二个反应恰好完全进行,析出金属铜的质量为0.640g,根据铜原子守恒,,0.010molCuO生成0.010mol,与0.010mol反应需要消耗0.010molFe,则与反应的铁的物质的量为:,溶液中的物质的量为0.060mol,原混合物中Fe2O3的物质的量为0.03mol。
解析:(1)根据分析可知,氧化铁与氧化铜的物质的量之比为0.03mol:0.010mol=3:1,故答案为:3:1;
(2)0.010molCuO消耗0.020molHNO3,0.03molFe2O3消耗0.180mol HNO3,50.0mL硝酸溶液中共含有0.020+0.180=0.200mol HNO3,该硝酸溶液的物质的量浓度为:,故答案为:4.00。
12.(1)H2
(2)Fe3+
(3)2Fe3+ + Fe = 3Fe2+
(4)Cl2、HClO
解析:氯水中含氯气、HClO和HCl,铁与HCl反应生成氯化亚铁和氢气,氯气、HClO具有强氧化性能将Fe2+氧化为Fe3+,Fe3+可用KSCN溶液检验,若铁粉过量,能将Fe3+还原成Fe2+,据此回答。
(1)氯气与水反应生成HClO和HCl,铁与HCl反应生成氢气,故实验i中产生少量无色气体,该气体可能是H2。
(2)KSCN遇到Fe3+可生成血红色溶液,NaCl与Fe3+不发生反应,则实验ii中观察到溶液变为红色,可推知上层清液中含有Fe3+。
(3)实验iii中观察到溶液无明显变化,可推知上层清液中不含Fe3+,可能的原因是铁粉过量,将生成的Fe3+还原成了Fe2+,故离子方程式:2Fe3++ Fe=3Fe2+。
(4)氯水中除氯气具有强氧化性外,氯气与水反应生成的HClO也具有强氧化性能将Fe2+氧化为Fe3+,故溶液中可能的氧化剂为Cl2、HClO
