选择题专项练(13)(共32张PPT)
文档属性
| 名称 | 选择题专项练(13)(共32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 20:33:55 | ||
图片预览











文档简介
(共32张PPT)
选择题专项练(上)
1
2
3
4
5
6
7
1.(2023·辽宁丹东一模)2023年3月17日,科技部高技术研发中心发布了2022年度中国科学十大进展,涉及化学、材料、能源等领域。下列相关理解错误的是( )
选项 发布内容 相关理解
A 利用全新原理实现海水直接电解制氢 海水电解制氢是将电能转化为化学能
B 温和压力条件下实现乙二醇合成 乙二醇和丙三醇互为同系物
C 在钠钾基态分子和钾原子混合气中实现超冷三原子分子的合成 钠钾合金室温下呈液态,可用作核反应堆的传热介质
D 实现高效率的全钙钛矿叠层太阳能电池和组件 钛合金是新型合金,可广泛应用于航空航天领域
B
1
2
3
4
5
6
7
解析 乙二醇分子式为C2H6O2,丙三醇的分子式为C3H8O3,二者在分子组成上不是相差若干个CH2原子团,不互为同系物,B错误。
1
2
3
4
5
6
7
2.(2023·北京朝阳区二模)甲醛水溶液久置会发生聚合,生成低聚甲醛,反应如下(均为放热反应):
下列说法不正确的是( )
A.生成低聚甲醛的过程中,发生了加成、缩聚反应
B.低聚甲醛的生成可能导致甲醛溶液出现浑浊
C.在回流装置中加热久置的甲醛溶液到一定温度,甲醛可再生
D.向久置的甲醛溶液中加入酸性KMnO4溶液,若褪色证明甲醛有剩余
D
解析 生成低聚甲醛的过程中发生的反应为甲醛与水发生加成反应生成HO—CH2—OH,HO—CH2—OH发生缩聚反应生成低聚甲醛,A正确;甲醛能与水分子形成分子间氢键,而低聚甲醛分子中含有的醚键与水分子形成的分子间氢键弱于甲醛,故低聚甲醛的生成可能导致甲醛溶液出现浑浊,B正确;生成低聚甲醛的反应都是放热反应,升高温度,平衡向逆反应方向移动,在回流装置中加热久置的甲醛溶液到一定温度,有利于甲醛再生,C正确;低聚甲醛也能与酸性高锰酸钾溶液发生氧化反应使溶液褪色,向久置的甲醛溶液中加入酸性高锰酸钾溶液,溶液褪色不能证明甲醛有剩余,D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
3.(2023·山东聊城二模)植物对氮元素的吸收过程如下,下列说法错误的
是( )
B
1
2
3
4
5
6
7
1
2
3
4
5
6
7
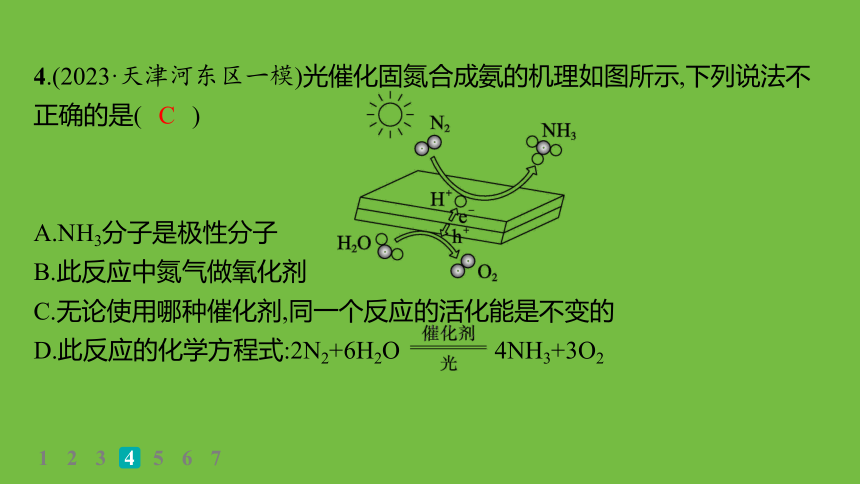
4.(2023·天津河东区一模)光催化固氮合成氨的机理如图所示,下列说法不正确的是( )
A.NH3分子是极性分子
B.此反应中氮气做氧化剂
C.无论使用哪种催化剂,同一个反应的活化能是不变的
D.此反应的化学方程式:2N2+6H2O 4NH3+3O2
C
1
2
3
4
5
6
7
解析 NH3分子呈三角锥形,故为极性分子,A正确;此反应中N由0价变为NH3中-3价,N2为氧化剂,B正确;催化剂改变反应的过程从而降低该反应的活化能,不同催化剂催化过程不同,活化能不同,C错误。
1
2
3
4
5
6
7
5.(2023·山东泰安二模)工业上以甲醇、亚硝酸钠等为原料制备NaN3流程如图:
已知水合肼(N2H4·H2O)不稳定,具有强还原性。下列描述正确的是( )
A.反应①和反应③中浓硫酸均做催化剂
B.反应②中,消耗3 mol N2H4·H2O时,N2H4·H2O失去10 mol电子
C.反应④制备水合肼时应将氨水逐滴滴入NaClO溶液中
D. 的空间结构为V形
B
1
2
3
4
5
6
7
1
2
3
4
5
6
7
6.(2023·河北邢台一模)Fe氧簇MOF催化CH4与N2O反应的机理如图所示。下列说法错误的是( )
C.该反应中存在极性键的断裂和非极性键
的形成
D.根据N2O分子的结构推测其电子式为
D
1
2
3
4
5
6
7
1
2
3
4
5
6
7
7.(2023·辽宁鞍山二模)NaCl是中学化学常见的药品之一,其相图(101 kPa时,用于描述NaCl-H2O体系共存形式的平衡曲线)见图,已知NaCl溶解度随温度变化不大,则下列有关说法错误的是( )
A.0 ℃时,NaCl的溶解度约为35.7 g
B.对海水进行冷冻,可获取淡水资源
C.由饱和NaCl溶液中析出的晶体是否带
结晶水主要由结晶速率决定
D.5 ℃时,取适量20%的NaCl溶液于洁净试管中,用玻璃棒刮擦试管内壁后无明显现象
C
1
2
3
4
5
6
7
选择题专项练(下)
1
2
3
4
5
6
7
1.(2023·广东广州二模)氮化硅可通过在高温下由石英与炭在氮气流中制备:3SiO2+6C+2N2 ══ Si3N4+6CO,关于该反应中相关微粒的说法正确的是( )
A.N2和CO共价键极性和分子极性相同
B.五种微粒固态时,属于共价晶体的可能有三种
C.基态硅原子的价电子轨道表示式为
D.二氧化硅的空间填充模型是
C
解析 N2含有非极性键,正负电荷中心重合,为非极性分子;CO含有极性键,正负电荷中心不重合,为极性分子,A错误。该反应涉及的微粒中,属于共价晶体的有SiO2、Si3N4,共2种,B错误。基态硅原子的价电子排布式为3s23p2,C正确。二氧化硅是正四面体网状结构,Si结构类似于金刚石,每个Si原子以sp3杂化和其余3个Si原子形成Si—Si共价键,SiO2结构就是在Si空间结构的基础上,每两个Si原子之间以O原子连接,D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
2.(2023·湖南教研联盟二模)泽兰素来源于泽兰属植物,具有抗肿瘤、抗炎、杀菌和抗氧化等多种生物活性,其结构如图所示,下列关于泽兰素的说法正确的是( )
A.泽兰素中含有三种官能团
B.1 mol泽兰素与H2加成最多消耗5 mol H2
C.泽兰素可以发生取代、氧化、加成、加聚反应
D.泽兰素中所有原子共平面
C
1
2
3
4
5
6
7
解析 泽兰素中含有酮羰基、羟基、醚键和碳碳双键四种官能团,A错误;1 mol泽兰素中羰基可加成1 mol H2,苯环可以加成3 mol H2,碳碳双键可以加成2 mol H2,与H2加成最多消耗6 mol H2,B错误;泽兰素中含有甲基可以发生取代反应、羰基可以发生氧化反应、碳碳双键和苯环可以发生加成反应、碳碳双键可以发生加聚反应,C正确;泽兰素中含有—CH3,所有原子不共平面,D错误。
1
2
3
4
5
6
7
3.(2022·江苏南京、盐城二模)氮化硅(Si3N4)是一种重要的结构陶瓷材料。用石英砂和原料气(含N2和少量O2)制备Si3N4的操作流程如下(粗硅中含少量Fe、Cu的单质及化合物):
下列叙述不正确的是( )
A.“还原”过程中焦炭被氧化为CO2
B.“高温氮化”反应的化学方程式为3Si+2N2 Si3N4
C.“操作X”可将原料气通过灼热的铜粉
D.“稀酸Y”可选用稀硝酸
A
1
2
3
4
5
6
7
解析 焦炭与石英砂在高温下发生反应SiO2+2C Si+2CO,焦炭被氧化成CO,A错误;“高温氮化”是Si与氮气反应,该反应的化学方程式为3Si+2N2
Si3N4,B正确;原料气中含有N2和少量的O2,氧气能与Cu反应生成CuO,N2不与Cu反应,故操作X可以是将原料气通过灼热的铜粉,从而得到纯净的氮气,C正确;粗硅中含有少量Fe和Cu,即得到的Si3N4中含有少量Fe和Cu,Fe、Cu均能与稀硝酸反应,得到可溶于水的Fe(NO3)3和Cu(NO3)2,则稀硝酸可以除去Si3N4中Fe和Cu,D正确。
1
2
3
4
5
6
7
4.(2023·河北保定一模)工业合成氨常选择N2+3H2 2NH3,NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol N2完全反应,转移的电子数为3NA
B.混合气中物质的沸点由高到低的顺序为NH3>N2>H2
C.物质的量之比为1∶1的N2和H2的混合气体所含原子数目为4NA
D.反应物断裂NA个σ键同时生成物断裂NA个σ键,反应达到平衡状态
B
1
2
3
4
5
6
7
解析 反应中氮元素化合价由0价变为-3价,则1 mol N2完全反应,转移的电子数为6NA,A错误。氨气分子间存在氢键,导致沸点最高;氮气的相对分子质量大于氢气,其沸点高于氢气,故混合气中物质的沸点由高到低的顺序为NH3>N2>H2,B正确。不确定混合气体的总物质的量,不能计算N2和H2的混合气体所含原子数目,C错误。单键均为σ键,三键含有1个σ键、2个π键;1个氮气分子含有2个π键和1个σ键,1分子氢气含有1个σ键,1分子氨气含有3个σ键,则反应物断裂NA个σ键同时生成物断裂NA个σ键,说明正逆反应速率不同,反应没有达到平衡状态,D错误。
1
2
3
4
5
6
7
5.(2023·辽宁抚顺4月模拟)如图所示是利用并联电解槽从铝废料(含Si、Mg、Fe、Cu、Mn和Zn杂质)中回收金属铝的固态电解工艺,利用熔融LiCl、KCl和AlCl3三种盐做电解液,电解过程中在阴、阳两极发生 和 的转化。下列叙述正确的是( )
A.固态电解工艺有利于金属铝的回收利用
B.当电路中转移1 mol电子时,理论上一块阴极板可回收9 g金属铝
C.阴极的电极反应为 +6e- ══ 2Al+7Cl-
D.阳极泥中可回收的金属有Mg、Fe、Cu、Mn和Zn
A
1
2
3
4
5
6
7
1
2
3
4
5
6
7
6.(2023·山东潍坊二模)
CO吸附在不同催化剂(HCN、HCN-A)上转化为CH3CHO的反应过程和能量变化如图所示。
下列说法正确的是( )
A.步骤Ⅰ→Ⅱ过程中存在C—H的形成
B.Ⅰ与Ⅸ相对能量的差值等于总反应的焓变
C.反应过程中的决速步是Ⅱ→Ⅲ
D.Ⅰ→Ⅷ的反应为*OCHCH2+H++e-→*OCHCH3
A
1
2
3
4
5
6
7
解析 由题图可知,步骤Ⅰ→Ⅱ过程中存在C—H的形成,A正确;Ⅰ中是*CO,不是CO,则Ⅰ与Ⅸ相对能量的差值不可能等于总反应的焓变,B错误;反应的活化能越大,反应速率越慢,反应过程中的决速步为慢反应,由题图可知,反应过程中Ⅴ→Ⅵ的活化能最大,则反应过程中的决速步是Ⅴ→Ⅵ,C错误;由题图可知,Ⅶ→Ⅷ的反应为*OCHCH2+H++e-→*OCHCH3,D错误。
1
2
3
4
5
6
7
7.(2023·安徽安庆示范高中4月联考)甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图,下列说法错误的是( )
A.该回收利用的原理是R3N粒子对HCOO-的静电吸附
B.pH=5的废水中c(HCOO-)∶c(HCOOH)=18∶1,则甲酸电离平衡常数K的数量级为10-4
C.废水初始2.4D.废水初始pH<2.4时,甲酸的电离程度对回收率影响显著
答案 A
1
2
3
4
5
6
7
1
2
3
4
5
6
7
本 课 结 束
选择题专项练(上)
1
2
3
4
5
6
7
1.(2023·辽宁丹东一模)2023年3月17日,科技部高技术研发中心发布了2022年度中国科学十大进展,涉及化学、材料、能源等领域。下列相关理解错误的是( )
选项 发布内容 相关理解
A 利用全新原理实现海水直接电解制氢 海水电解制氢是将电能转化为化学能
B 温和压力条件下实现乙二醇合成 乙二醇和丙三醇互为同系物
C 在钠钾基态分子和钾原子混合气中实现超冷三原子分子的合成 钠钾合金室温下呈液态,可用作核反应堆的传热介质
D 实现高效率的全钙钛矿叠层太阳能电池和组件 钛合金是新型合金,可广泛应用于航空航天领域
B
1
2
3
4
5
6
7
解析 乙二醇分子式为C2H6O2,丙三醇的分子式为C3H8O3,二者在分子组成上不是相差若干个CH2原子团,不互为同系物,B错误。
1
2
3
4
5
6
7
2.(2023·北京朝阳区二模)甲醛水溶液久置会发生聚合,生成低聚甲醛,反应如下(均为放热反应):
下列说法不正确的是( )
A.生成低聚甲醛的过程中,发生了加成、缩聚反应
B.低聚甲醛的生成可能导致甲醛溶液出现浑浊
C.在回流装置中加热久置的甲醛溶液到一定温度,甲醛可再生
D.向久置的甲醛溶液中加入酸性KMnO4溶液,若褪色证明甲醛有剩余
D
解析 生成低聚甲醛的过程中发生的反应为甲醛与水发生加成反应生成HO—CH2—OH,HO—CH2—OH发生缩聚反应生成低聚甲醛,A正确;甲醛能与水分子形成分子间氢键,而低聚甲醛分子中含有的醚键与水分子形成的分子间氢键弱于甲醛,故低聚甲醛的生成可能导致甲醛溶液出现浑浊,B正确;生成低聚甲醛的反应都是放热反应,升高温度,平衡向逆反应方向移动,在回流装置中加热久置的甲醛溶液到一定温度,有利于甲醛再生,C正确;低聚甲醛也能与酸性高锰酸钾溶液发生氧化反应使溶液褪色,向久置的甲醛溶液中加入酸性高锰酸钾溶液,溶液褪色不能证明甲醛有剩余,D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
3.(2023·山东聊城二模)植物对氮元素的吸收过程如下,下列说法错误的
是( )
B
1
2
3
4
5
6
7
1
2
3
4
5
6
7
4.(2023·天津河东区一模)光催化固氮合成氨的机理如图所示,下列说法不正确的是( )
A.NH3分子是极性分子
B.此反应中氮气做氧化剂
C.无论使用哪种催化剂,同一个反应的活化能是不变的
D.此反应的化学方程式:2N2+6H2O 4NH3+3O2
C
1
2
3
4
5
6
7
解析 NH3分子呈三角锥形,故为极性分子,A正确;此反应中N由0价变为NH3中-3价,N2为氧化剂,B正确;催化剂改变反应的过程从而降低该反应的活化能,不同催化剂催化过程不同,活化能不同,C错误。
1
2
3
4
5
6
7
5.(2023·山东泰安二模)工业上以甲醇、亚硝酸钠等为原料制备NaN3流程如图:
已知水合肼(N2H4·H2O)不稳定,具有强还原性。下列描述正确的是( )
A.反应①和反应③中浓硫酸均做催化剂
B.反应②中,消耗3 mol N2H4·H2O时,N2H4·H2O失去10 mol电子
C.反应④制备水合肼时应将氨水逐滴滴入NaClO溶液中
D. 的空间结构为V形
B
1
2
3
4
5
6
7
1
2
3
4
5
6
7
6.(2023·河北邢台一模)Fe氧簇MOF催化CH4与N2O反应的机理如图所示。下列说法错误的是( )
C.该反应中存在极性键的断裂和非极性键
的形成
D.根据N2O分子的结构推测其电子式为
D
1
2
3
4
5
6
7
1
2
3
4
5
6
7
7.(2023·辽宁鞍山二模)NaCl是中学化学常见的药品之一,其相图(101 kPa时,用于描述NaCl-H2O体系共存形式的平衡曲线)见图,已知NaCl溶解度随温度变化不大,则下列有关说法错误的是( )
A.0 ℃时,NaCl的溶解度约为35.7 g
B.对海水进行冷冻,可获取淡水资源
C.由饱和NaCl溶液中析出的晶体是否带
结晶水主要由结晶速率决定
D.5 ℃时,取适量20%的NaCl溶液于洁净试管中,用玻璃棒刮擦试管内壁后无明显现象
C
1
2
3
4
5
6
7
选择题专项练(下)
1
2
3
4
5
6
7
1.(2023·广东广州二模)氮化硅可通过在高温下由石英与炭在氮气流中制备:3SiO2+6C+2N2 ══ Si3N4+6CO,关于该反应中相关微粒的说法正确的是( )
A.N2和CO共价键极性和分子极性相同
B.五种微粒固态时,属于共价晶体的可能有三种
C.基态硅原子的价电子轨道表示式为
D.二氧化硅的空间填充模型是
C
解析 N2含有非极性键,正负电荷中心重合,为非极性分子;CO含有极性键,正负电荷中心不重合,为极性分子,A错误。该反应涉及的微粒中,属于共价晶体的有SiO2、Si3N4,共2种,B错误。基态硅原子的价电子排布式为3s23p2,C正确。二氧化硅是正四面体网状结构,Si结构类似于金刚石,每个Si原子以sp3杂化和其余3个Si原子形成Si—Si共价键,SiO2结构就是在Si空间结构的基础上,每两个Si原子之间以O原子连接,D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
2.(2023·湖南教研联盟二模)泽兰素来源于泽兰属植物,具有抗肿瘤、抗炎、杀菌和抗氧化等多种生物活性,其结构如图所示,下列关于泽兰素的说法正确的是( )
A.泽兰素中含有三种官能团
B.1 mol泽兰素与H2加成最多消耗5 mol H2
C.泽兰素可以发生取代、氧化、加成、加聚反应
D.泽兰素中所有原子共平面
C
1
2
3
4
5
6
7
解析 泽兰素中含有酮羰基、羟基、醚键和碳碳双键四种官能团,A错误;1 mol泽兰素中羰基可加成1 mol H2,苯环可以加成3 mol H2,碳碳双键可以加成2 mol H2,与H2加成最多消耗6 mol H2,B错误;泽兰素中含有甲基可以发生取代反应、羰基可以发生氧化反应、碳碳双键和苯环可以发生加成反应、碳碳双键可以发生加聚反应,C正确;泽兰素中含有—CH3,所有原子不共平面,D错误。
1
2
3
4
5
6
7
3.(2022·江苏南京、盐城二模)氮化硅(Si3N4)是一种重要的结构陶瓷材料。用石英砂和原料气(含N2和少量O2)制备Si3N4的操作流程如下(粗硅中含少量Fe、Cu的单质及化合物):
下列叙述不正确的是( )
A.“还原”过程中焦炭被氧化为CO2
B.“高温氮化”反应的化学方程式为3Si+2N2 Si3N4
C.“操作X”可将原料气通过灼热的铜粉
D.“稀酸Y”可选用稀硝酸
A
1
2
3
4
5
6
7
解析 焦炭与石英砂在高温下发生反应SiO2+2C Si+2CO,焦炭被氧化成CO,A错误;“高温氮化”是Si与氮气反应,该反应的化学方程式为3Si+2N2
Si3N4,B正确;原料气中含有N2和少量的O2,氧气能与Cu反应生成CuO,N2不与Cu反应,故操作X可以是将原料气通过灼热的铜粉,从而得到纯净的氮气,C正确;粗硅中含有少量Fe和Cu,即得到的Si3N4中含有少量Fe和Cu,Fe、Cu均能与稀硝酸反应,得到可溶于水的Fe(NO3)3和Cu(NO3)2,则稀硝酸可以除去Si3N4中Fe和Cu,D正确。
1
2
3
4
5
6
7
4.(2023·河北保定一模)工业合成氨常选择N2+3H2 2NH3,NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 mol N2完全反应,转移的电子数为3NA
B.混合气中物质的沸点由高到低的顺序为NH3>N2>H2
C.物质的量之比为1∶1的N2和H2的混合气体所含原子数目为4NA
D.反应物断裂NA个σ键同时生成物断裂NA个σ键,反应达到平衡状态
B
1
2
3
4
5
6
7
解析 反应中氮元素化合价由0价变为-3价,则1 mol N2完全反应,转移的电子数为6NA,A错误。氨气分子间存在氢键,导致沸点最高;氮气的相对分子质量大于氢气,其沸点高于氢气,故混合气中物质的沸点由高到低的顺序为NH3>N2>H2,B正确。不确定混合气体的总物质的量,不能计算N2和H2的混合气体所含原子数目,C错误。单键均为σ键,三键含有1个σ键、2个π键;1个氮气分子含有2个π键和1个σ键,1分子氢气含有1个σ键,1分子氨气含有3个σ键,则反应物断裂NA个σ键同时生成物断裂NA个σ键,说明正逆反应速率不同,反应没有达到平衡状态,D错误。
1
2
3
4
5
6
7
5.(2023·辽宁抚顺4月模拟)如图所示是利用并联电解槽从铝废料(含Si、Mg、Fe、Cu、Mn和Zn杂质)中回收金属铝的固态电解工艺,利用熔融LiCl、KCl和AlCl3三种盐做电解液,电解过程中在阴、阳两极发生 和 的转化。下列叙述正确的是( )
A.固态电解工艺有利于金属铝的回收利用
B.当电路中转移1 mol电子时,理论上一块阴极板可回收9 g金属铝
C.阴极的电极反应为 +6e- ══ 2Al+7Cl-
D.阳极泥中可回收的金属有Mg、Fe、Cu、Mn和Zn
A
1
2
3
4
5
6
7
1
2
3
4
5
6
7
6.(2023·山东潍坊二模)
CO吸附在不同催化剂(HCN、HCN-A)上转化为CH3CHO的反应过程和能量变化如图所示。
下列说法正确的是( )
A.步骤Ⅰ→Ⅱ过程中存在C—H的形成
B.Ⅰ与Ⅸ相对能量的差值等于总反应的焓变
C.反应过程中的决速步是Ⅱ→Ⅲ
D.Ⅰ→Ⅷ的反应为*OCHCH2+H++e-→*OCHCH3
A
1
2
3
4
5
6
7
解析 由题图可知,步骤Ⅰ→Ⅱ过程中存在C—H的形成,A正确;Ⅰ中是*CO,不是CO,则Ⅰ与Ⅸ相对能量的差值不可能等于总反应的焓变,B错误;反应的活化能越大,反应速率越慢,反应过程中的决速步为慢反应,由题图可知,反应过程中Ⅴ→Ⅵ的活化能最大,则反应过程中的决速步是Ⅴ→Ⅵ,C错误;由题图可知,Ⅶ→Ⅷ的反应为*OCHCH2+H++e-→*OCHCH3,D错误。
1
2
3
4
5
6
7
7.(2023·安徽安庆示范高中4月联考)甲酸(HCOOH)是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图,下列说法错误的是( )
A.该回收利用的原理是R3N粒子对HCOO-的静电吸附
B.pH=5的废水中c(HCOO-)∶c(HCOOH)=18∶1,则甲酸电离平衡常数K的数量级为10-4
C.废水初始2.4
答案 A
1
2
3
4
5
6
7
1
2
3
4
5
6
7
本 课 结 束
同课章节目录
