专题 选择题专项练 课件(共33张PPT)
文档属性
| 名称 | 专题 选择题专项练 课件(共33张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 20:33:22 | ||
图片预览










文档简介
(共33张PPT)
选择题专项练(上)
1
2
3
4
5
6
7
1.(2023·北京海淀区二模)下列化学用语或图示表达正确的是( )
A
1
2
3
4
5
6
7
1
2
3
4
5
6
7
2.(2023·广东江门一模)设NA为阿伏加德罗常数的值。下列说法正确的
是( )
A.标准状况下,22.4 L乙炔中σ键数为2NA,π键数为2NA
B.0.1 mol·L-1 KAl(SO4)2溶液中, 的个数为0.2NA
C.常温常压下,7.8 g Na2O2中含有共价键的数目为0.1NA
D.18 g重水(D2O)中含有的质子数为10NA
C
解析 乙炔结构式为H—C≡C—H,一个分子中含有3个σ键、2个π键,故标准状况下,22.4 L乙炔中σ键数为3NA,π键数为2NA,A错误;未知溶液体积,无法得知 的个数,B错误;7.8 g Na2O2为0.1 mol,含有共价键的数目为0.1NA,C正确;D2O相对分子质量为20,分子中质子数为10,故18 g重水(D2O)中含有的质子数为9NA,D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
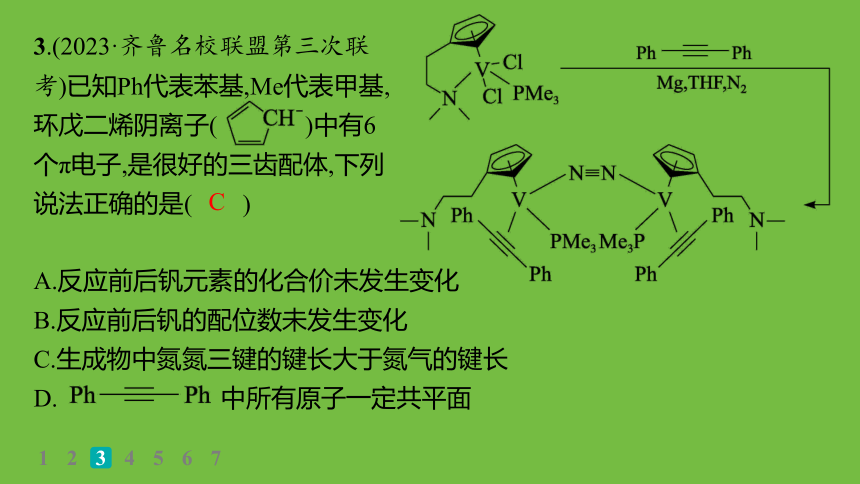
3.(2023·齐鲁名校联盟第三次联考)已知Ph代表苯基,Me代表甲基,环戊二烯阴离子( )中有6个π电子,是很好的三齿配体,下列说法正确的是( )
A.反应前后钒元素的化合价未发生变化
B.反应前后钒的配位数未发生变化
C.生成物中氮氮三键的键长大于氮气的键长
D. 中所有原子一定共平面
C
解析 反应前后钒形成的化学键数目改变,其元素的化合价发生变化,A错误;反应前后钒的配位数分别为5、4,发生变化,B错误;氮氮三键一端的氮和钒形成配位键,导致氮氮三键中电子云密度减小,结合力减弱,键长增加,故生成物中氮氮三键的键长大于氮气的键长,C正确;单键可以旋转,故两个苯环不一定在同一平面,D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
4.(2023·山东潍坊二模)一种阴离子的结构如图所示,X、Y、Z、W为原子序数依次增大的短周期元素,基态W原子中有3个未成对电子,下列说法正确的是( )
A.电负性:W>Z
B.简单氢化物的沸点:Y>Z
C.最高价氧化物对应水化物的酸性:X>W
D.单质的氧化性:W>Y
B
1
2
3
4
5
6
7
解析 X、Y、Z、W为原子序数依次增大的短周期元素,基态W原子中有3个未成对电子,由阴离子的结构示意图可知,X、Y、Z、W形成共价键的数目分别为4、2、1、6,则W形成的化学键中含有配位键,X为C元素、Y为O元素、Z为F元素、W为P元素。元素的非金属性越强,电负性越大,氟元素的非金属性强于磷元素,则电负性大于磷元素,A错误;水分子间形成氢键的数目多于氟化氢,分子间作用力大于氟化氢,则沸点高于氟化氢,B正确;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,磷元素的非金属性强于碳元素,则磷酸的酸性强于碳酸,C错误;元素的非金属性越强,单质的氧化性越强,氧元素的非金属性强于磷元素,则氧气的氧化性强于磷单质,D错误。
1
2
3
4
5
6
7
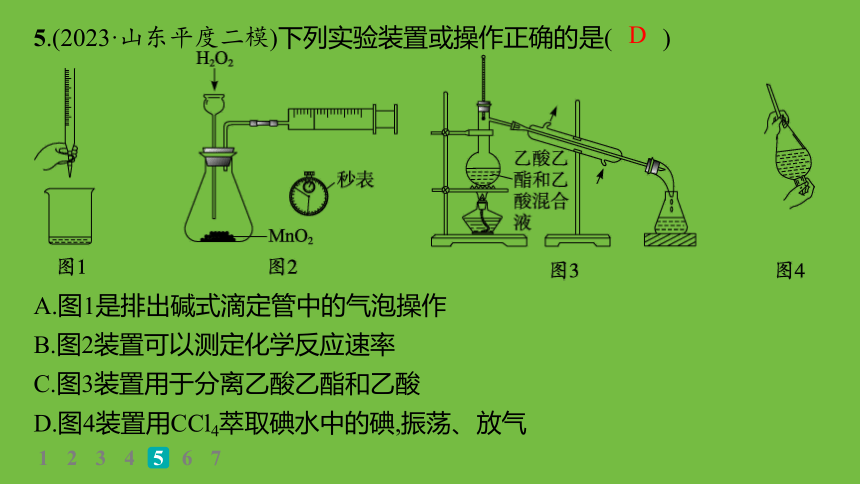
5.(2023·山东平度二模)下列实验装置或操作正确的是( )
A.图1是排出碱式滴定管中的气泡操作
B.图2装置可以测定化学反应速率
C.图3装置用于分离乙酸乙酯和乙酸
D.图4装置用CCl4萃取碘水中的碘,振荡、放气
D
1
2
3
4
5
6
7
解析 排出碱式滴定管中的气泡应该用手挤压玻璃球且滴定管下端管口斜向上,A错误;生成的氧气易从长颈漏斗逸出,应选分液漏斗,用于测定反应速率,B错误;乙酸乙酯和乙酸的分离应利用饱和碳酸钠溶液让它们分层后分液,C错误;图4装置用CCl4萃取碘水中的碘,振荡、放气,操作正确,D正确。
1
2
3
4
5
6
7
6.(2022·湖南卷)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
C
1
2
3
4
5
6
7
解析 陶瓷的成分中含有SiO2,SiO2在高温下与Na2CO3反应生成Na2SiO3,不宜用陶瓷作吸收塔内衬材料,A正确;采用溶液喷淋法可增大反应物的接触面积,提高吸收塔内烟气吸收效率,B正确;合成槽内发生反应6NaF+Na[Al(OH)4]+2CO2 ══ Na3AlF6+2Na2CO3+2H2O,产物主要是Na3AlF6和Na2CO3,C错误;滤液的主要成分为Na2CO3,可进入吸收塔循环利用,D正确。
1
2
3
4
5
6
7
7.(2023·湖北鄂州二模)硫酸工业中,将SO2氧化为SO3是生产工艺中的重要环节。在温度为T1条件下,在三个容积均为1 L的恒容密闭容器中仅发生反应: 2SO2(g)+O2(g) 2SO3(g) ΔH<0,实验测得:v(正)=k正·c2(SO2)·c(O2),
v(逆)=k逆·c2(SO3)。
容器编号 起始浓度/(mol·L-1) 平衡浓度/(mol·L-1)
c(SO2) c(O2) c(SO3) c(O2)
Ⅰ 0.6 0.3 0 0.2
Ⅱ 0.5 x 0.3
Ⅲ 0.3 0.25 0.2
已知:k正、k逆为速率常数,仅受温度的影响。
下列说法错误的是( )
C.容器Ⅲ中达到平衡时,c(O2)<0.25 mol·L-1
D.当温度升高为T2时,k正、k逆分别增大m倍和n倍,则mC
1
2
3
4
5
6
7
2SO2(g) + O2(g) 2SO3(g)
起始(mol·L-1) 0.5 x 0.3
变化(mol·L-1) 2(x-0.8) x-0.8 2(x-0.8)
平衡(mol·L-1) 0.5-2(x-0.8) 0.8 0.3+2(x-0.8)
0.5-2(x-0.8)=0.3+2(x-0.8),x=0.85,B正确。
1
2
3
4
5
6
7
选择题专项练(下)
1
2
3
4
5
6
7
1.(2023·北京房山区二模)下列离子检验利用了氧化还原反应的是( )
选项 待检验离子 检验试剂
A Fe3+ KSCN溶液
B I- Cl2、淀粉溶液
C 稀盐酸、氯化钡溶液
D 浓NaOH溶液、湿润的红色石蕊试纸
B
1
2
3
4
5
6
7
1
2
3
4
5
6
7
2.(2023·河北邢台一模)一氯乙酸可用作除锈剂,其制备原理为CH3COOH+Cl2 ClCH2COOH+HCl。下列说法错误的是( )
A.还可能生成二氯乙酸、三氯乙酸等副产物
B.CH3COOH中所含化学键只有σ键
C.Cl—Cl的键长比I—I的键长短
D.ClCH2COOH的酸性比CH3COOH强
B
1
2
3
4
5
6
7
解析 乙酸和氯气发生取代反应,若两个氢原子被氯原子取代则生成二氯乙酸,三个氢原子被氯原子取代则生成三氯乙酸,A正确;乙酸中的羧基有C=O,双键中有一个σ键,还有一个π键,B错误;Cl原子半径小于I原子,故Cl—Cl的键长比I—I的键长短,C正确;Cl的电负性比较强,对电子的吸引力比较强,Cl—C的极性大于H—C的极性,使ClCH2—的极性大于—CH3的极性,导致一氯乙酸的羧基中的羟基的极性大于乙酸中的羟基的极性,一氯乙酸更易电离出氢离子,故ClCH2COOH的酸性比CH3COOH强,D正确。
1
2
3
4
5
6
7
3.(2023·天津河东区一模)如图是人体含量较多元素的质量分数图,下列有关这些元素的说法不正确的是( )
A.原子半径:NB.第一电离能:K>Ca
C.基态O原子的价层电子轨道表示式:
D.图中的七种元素中有2种元素位于周期表第四周期
B
1
2
3
4
5
6
7
解析 K和Ca为同周期元素且左右相邻,Ca的4s轨道全充满,原子的能量低,则第一电离能:K1
2
3
4
5
6
7
4.(2023·广东湛江二模)东南大学课题组合成了一种新型具有平面分子结构的醌类聚合物PPPA,PPPA可作为有机锌离子电池的正极材料。下列叙述正确的是( )
已知:AlCl3作该反应的催化剂,AlCl3升华温度为178 ℃,NaCl的熔点为801 ℃。
A.吩嗪和PMDA是PPPA的链节
B.为了提高反应速率,可将反应温度由150 ℃升至160 ℃
C.上述反应中,断裂了σ键和π键,也形成了σ键和π键
D.n mol吩嗪和n mol PMDA完全合成PPPA时,生成n mol水
答案 B
1
2
3
4
5
6
7
1
2
3
4
5
6
7
解析 由题图可知,吩嗪和PMDA发生缩聚反应生成了PPPA,吩嗪和PMDA是单体,A错误;升高温度,可加快反应速率,但是温度要低于AlCl3的升华温度,B正确;上述反应中,吩嗪和PMDA中的π键并没有断裂,C错误;1个吩嗪分子和1个PMDA分子反应时,可形成2个水分子,故n mol吩嗪和n mol PMDA完全合成PPPA时,生成2n mol水,D错误。
1
2
3
4
5
6
7
5.(2022·河北卷)下列图示装置不能达到实验目的的是( )
A.装置甲用CCl4萃取溴水中的Br2
B.装置乙除去Cl2中的HCl并干燥
C.装置丙验证铁的吸氧腐蚀
D.装置丁实验室制备少量NH3
D
1
2
3
4
5
6
7
解析 Br2在CCl4中的溶解度远大于在水中的溶解度,且CCl4难溶于水,故可用CCl4萃取溴水中的Br2,A正确;用饱和NaCl溶液除去Cl2中的HCl,用浓硫酸进行干燥,B正确;食盐水呈中性,铁丝在食盐水中发生吸氧腐蚀,试管中气体压强减小,导管中红墨水液面上升,C正确;实验室利用NH4Cl和Ca(OH)2固体混合物加热制取NH3,收集NH3采用向下排空气法,导管要插入试管底部,且管口不能塞橡胶塞,D错误。
1
2
3
4
5
6
7
6.(2023·广东湛江二模)某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高选择性吸附NO2。废气中的NO2被吸附后,经处理能全部转化为HNO3。原理示意图如下。
D
1
2
3
4
5
6
7
1
2
3
4
5
6
7
7.(2023·河北名校联盟4月联考)Mg2C具有反萤石结构,晶胞如图所示,熔融的碳化镁具有良好的导电性。已知晶胞边长为a nm,阿伏加德罗常数的值为NA。下列叙述错误的是( )
A.该晶体中碳的配位数为8
B.基态镁原子s、p能级上的电子数之比为1∶1
C
1
2
3
4
5
6
7
解析 距晶胞面心上C最近的Mg有4个,一个面心两个晶胞共用,所以距离C最近的Mg有8个,则碳的配位数为8,A正确;基态镁的电子排布式为1s22s22p63s2,s、p能级上的电子数之比为1∶1,B正确;晶胞中两个碳原子间的最短距离为顶点到面心的距离,顶点到面心的距离为面对角线的一半,即
本 课 结 束
选择题专项练(上)
1
2
3
4
5
6
7
1.(2023·北京海淀区二模)下列化学用语或图示表达正确的是( )
A
1
2
3
4
5
6
7
1
2
3
4
5
6
7
2.(2023·广东江门一模)设NA为阿伏加德罗常数的值。下列说法正确的
是( )
A.标准状况下,22.4 L乙炔中σ键数为2NA,π键数为2NA
B.0.1 mol·L-1 KAl(SO4)2溶液中, 的个数为0.2NA
C.常温常压下,7.8 g Na2O2中含有共价键的数目为0.1NA
D.18 g重水(D2O)中含有的质子数为10NA
C
解析 乙炔结构式为H—C≡C—H,一个分子中含有3个σ键、2个π键,故标准状况下,22.4 L乙炔中σ键数为3NA,π键数为2NA,A错误;未知溶液体积,无法得知 的个数,B错误;7.8 g Na2O2为0.1 mol,含有共价键的数目为0.1NA,C正确;D2O相对分子质量为20,分子中质子数为10,故18 g重水(D2O)中含有的质子数为9NA,D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
3.(2023·齐鲁名校联盟第三次联考)已知Ph代表苯基,Me代表甲基,环戊二烯阴离子( )中有6个π电子,是很好的三齿配体,下列说法正确的是( )
A.反应前后钒元素的化合价未发生变化
B.反应前后钒的配位数未发生变化
C.生成物中氮氮三键的键长大于氮气的键长
D. 中所有原子一定共平面
C
解析 反应前后钒形成的化学键数目改变,其元素的化合价发生变化,A错误;反应前后钒的配位数分别为5、4,发生变化,B错误;氮氮三键一端的氮和钒形成配位键,导致氮氮三键中电子云密度减小,结合力减弱,键长增加,故生成物中氮氮三键的键长大于氮气的键长,C正确;单键可以旋转,故两个苯环不一定在同一平面,D错误。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
4.(2023·山东潍坊二模)一种阴离子的结构如图所示,X、Y、Z、W为原子序数依次增大的短周期元素,基态W原子中有3个未成对电子,下列说法正确的是( )
A.电负性:W>Z
B.简单氢化物的沸点:Y>Z
C.最高价氧化物对应水化物的酸性:X>W
D.单质的氧化性:W>Y
B
1
2
3
4
5
6
7
解析 X、Y、Z、W为原子序数依次增大的短周期元素,基态W原子中有3个未成对电子,由阴离子的结构示意图可知,X、Y、Z、W形成共价键的数目分别为4、2、1、6,则W形成的化学键中含有配位键,X为C元素、Y为O元素、Z为F元素、W为P元素。元素的非金属性越强,电负性越大,氟元素的非金属性强于磷元素,则电负性大于磷元素,A错误;水分子间形成氢键的数目多于氟化氢,分子间作用力大于氟化氢,则沸点高于氟化氢,B正确;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,磷元素的非金属性强于碳元素,则磷酸的酸性强于碳酸,C错误;元素的非金属性越强,单质的氧化性越强,氧元素的非金属性强于磷元素,则氧气的氧化性强于磷单质,D错误。
1
2
3
4
5
6
7
5.(2023·山东平度二模)下列实验装置或操作正确的是( )
A.图1是排出碱式滴定管中的气泡操作
B.图2装置可以测定化学反应速率
C.图3装置用于分离乙酸乙酯和乙酸
D.图4装置用CCl4萃取碘水中的碘,振荡、放气
D
1
2
3
4
5
6
7
解析 排出碱式滴定管中的气泡应该用手挤压玻璃球且滴定管下端管口斜向上,A错误;生成的氧气易从长颈漏斗逸出,应选分液漏斗,用于测定反应速率,B错误;乙酸乙酯和乙酸的分离应利用饱和碳酸钠溶液让它们分层后分液,C错误;图4装置用CCl4萃取碘水中的碘,振荡、放气,操作正确,D正确。
1
2
3
4
5
6
7
6.(2022·湖南卷)铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A.不宜用陶瓷作吸收塔内衬材料
B.采用溶液喷淋法可提高吸收塔内烟气吸收效率
C.合成槽中产物主要有Na3AlF6和CO2
D.滤液可回收进入吸收塔循环利用
C
1
2
3
4
5
6
7
解析 陶瓷的成分中含有SiO2,SiO2在高温下与Na2CO3反应生成Na2SiO3,不宜用陶瓷作吸收塔内衬材料,A正确;采用溶液喷淋法可增大反应物的接触面积,提高吸收塔内烟气吸收效率,B正确;合成槽内发生反应6NaF+Na[Al(OH)4]+2CO2 ══ Na3AlF6+2Na2CO3+2H2O,产物主要是Na3AlF6和Na2CO3,C错误;滤液的主要成分为Na2CO3,可进入吸收塔循环利用,D正确。
1
2
3
4
5
6
7
7.(2023·湖北鄂州二模)硫酸工业中,将SO2氧化为SO3是生产工艺中的重要环节。在温度为T1条件下,在三个容积均为1 L的恒容密闭容器中仅发生反应: 2SO2(g)+O2(g) 2SO3(g) ΔH<0,实验测得:v(正)=k正·c2(SO2)·c(O2),
v(逆)=k逆·c2(SO3)。
容器编号 起始浓度/(mol·L-1) 平衡浓度/(mol·L-1)
c(SO2) c(O2) c(SO3) c(O2)
Ⅰ 0.6 0.3 0 0.2
Ⅱ 0.5 x 0.3
Ⅲ 0.3 0.25 0.2
已知:k正、k逆为速率常数,仅受温度的影响。
下列说法错误的是( )
C.容器Ⅲ中达到平衡时,c(O2)<0.25 mol·L-1
D.当温度升高为T2时,k正、k逆分别增大m倍和n倍,则m
1
2
3
4
5
6
7
2SO2(g) + O2(g) 2SO3(g)
起始(mol·L-1) 0.5 x 0.3
变化(mol·L-1) 2(x-0.8) x-0.8 2(x-0.8)
平衡(mol·L-1) 0.5-2(x-0.8) 0.8 0.3+2(x-0.8)
0.5-2(x-0.8)=0.3+2(x-0.8),x=0.85,B正确。
1
2
3
4
5
6
7
选择题专项练(下)
1
2
3
4
5
6
7
1.(2023·北京房山区二模)下列离子检验利用了氧化还原反应的是( )
选项 待检验离子 检验试剂
A Fe3+ KSCN溶液
B I- Cl2、淀粉溶液
C 稀盐酸、氯化钡溶液
D 浓NaOH溶液、湿润的红色石蕊试纸
B
1
2
3
4
5
6
7
1
2
3
4
5
6
7
2.(2023·河北邢台一模)一氯乙酸可用作除锈剂,其制备原理为CH3COOH+Cl2 ClCH2COOH+HCl。下列说法错误的是( )
A.还可能生成二氯乙酸、三氯乙酸等副产物
B.CH3COOH中所含化学键只有σ键
C.Cl—Cl的键长比I—I的键长短
D.ClCH2COOH的酸性比CH3COOH强
B
1
2
3
4
5
6
7
解析 乙酸和氯气发生取代反应,若两个氢原子被氯原子取代则生成二氯乙酸,三个氢原子被氯原子取代则生成三氯乙酸,A正确;乙酸中的羧基有C=O,双键中有一个σ键,还有一个π键,B错误;Cl原子半径小于I原子,故Cl—Cl的键长比I—I的键长短,C正确;Cl的电负性比较强,对电子的吸引力比较强,Cl—C的极性大于H—C的极性,使ClCH2—的极性大于—CH3的极性,导致一氯乙酸的羧基中的羟基的极性大于乙酸中的羟基的极性,一氯乙酸更易电离出氢离子,故ClCH2COOH的酸性比CH3COOH强,D正确。
1
2
3
4
5
6
7
3.(2023·天津河东区一模)如图是人体含量较多元素的质量分数图,下列有关这些元素的说法不正确的是( )
A.原子半径:N
C.基态O原子的价层电子轨道表示式:
D.图中的七种元素中有2种元素位于周期表第四周期
B
1
2
3
4
5
6
7
解析 K和Ca为同周期元素且左右相邻,Ca的4s轨道全充满,原子的能量低,则第一电离能:K
2
3
4
5
6
7
4.(2023·广东湛江二模)东南大学课题组合成了一种新型具有平面分子结构的醌类聚合物PPPA,PPPA可作为有机锌离子电池的正极材料。下列叙述正确的是( )
已知:AlCl3作该反应的催化剂,AlCl3升华温度为178 ℃,NaCl的熔点为801 ℃。
A.吩嗪和PMDA是PPPA的链节
B.为了提高反应速率,可将反应温度由150 ℃升至160 ℃
C.上述反应中,断裂了σ键和π键,也形成了σ键和π键
D.n mol吩嗪和n mol PMDA完全合成PPPA时,生成n mol水
答案 B
1
2
3
4
5
6
7
1
2
3
4
5
6
7
解析 由题图可知,吩嗪和PMDA发生缩聚反应生成了PPPA,吩嗪和PMDA是单体,A错误;升高温度,可加快反应速率,但是温度要低于AlCl3的升华温度,B正确;上述反应中,吩嗪和PMDA中的π键并没有断裂,C错误;1个吩嗪分子和1个PMDA分子反应时,可形成2个水分子,故n mol吩嗪和n mol PMDA完全合成PPPA时,生成2n mol水,D错误。
1
2
3
4
5
6
7
5.(2022·河北卷)下列图示装置不能达到实验目的的是( )
A.装置甲用CCl4萃取溴水中的Br2
B.装置乙除去Cl2中的HCl并干燥
C.装置丙验证铁的吸氧腐蚀
D.装置丁实验室制备少量NH3
D
1
2
3
4
5
6
7
解析 Br2在CCl4中的溶解度远大于在水中的溶解度,且CCl4难溶于水,故可用CCl4萃取溴水中的Br2,A正确;用饱和NaCl溶液除去Cl2中的HCl,用浓硫酸进行干燥,B正确;食盐水呈中性,铁丝在食盐水中发生吸氧腐蚀,试管中气体压强减小,导管中红墨水液面上升,C正确;实验室利用NH4Cl和Ca(OH)2固体混合物加热制取NH3,收集NH3采用向下排空气法,导管要插入试管底部,且管口不能塞橡胶塞,D错误。
1
2
3
4
5
6
7
6.(2023·广东湛江二模)某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高选择性吸附NO2。废气中的NO2被吸附后,经处理能全部转化为HNO3。原理示意图如下。
D
1
2
3
4
5
6
7
1
2
3
4
5
6
7
7.(2023·河北名校联盟4月联考)Mg2C具有反萤石结构,晶胞如图所示,熔融的碳化镁具有良好的导电性。已知晶胞边长为a nm,阿伏加德罗常数的值为NA。下列叙述错误的是( )
A.该晶体中碳的配位数为8
B.基态镁原子s、p能级上的电子数之比为1∶1
C
1
2
3
4
5
6
7
解析 距晶胞面心上C最近的Mg有4个,一个面心两个晶胞共用,所以距离C最近的Mg有8个,则碳的配位数为8,A正确;基态镁的电子排布式为1s22s22p63s2,s、p能级上的电子数之比为1∶1,B正确;晶胞中两个碳原子间的最短距离为顶点到面心的距离,顶点到面心的距离为面对角线的一半,即
本 课 结 束
同课章节目录
