7.3.2乙醇与乙酸 课件 (共23张PPT)2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 7.3.2乙醇与乙酸 课件 (共23张PPT)2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 20:50:27 | ||
图片预览






文档简介
(共23张PPT)
第三节乙醇与乙酸(2)
醇类与乙醇分子结构的探究
学习目标
学习重、难点
1. 理解醇的定义、分类。
2. 掌握醇的物理性质和化学性质。
3. 掌握醇的催化氧化规律。
4. 理解乙醇分子结构的探究实验。
醇的催化氧化规律
通过阅读本节知识清单:
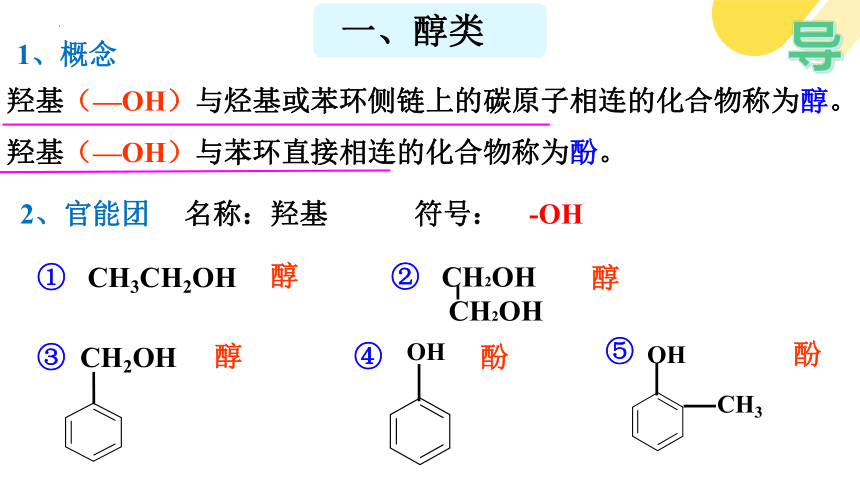
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
醇
酚
醇
① CH3CH2OH
酚
CH2OH
③
OH
④
OH
CH3
⑤
② CH2OH
CH2OH
醇
1、概念
2、官能团
名称:羟基 符号: -OH
一、醇类
导
①根据醇分子中羟基的个数分类
一元醇: CH3OH
甲醇(木精、木醇)
剧毒
用于能源领域
如汽车燃料
工业酒精有毒!
配制化妆品
3、分类
汽车用抗冻剂
CH2CH2
OH OH
乙二醇
二元醇:
CH2 CH CH2
OH OH OH
丙三醇(甘油)
吸湿性
,护肤
三元醇:
导
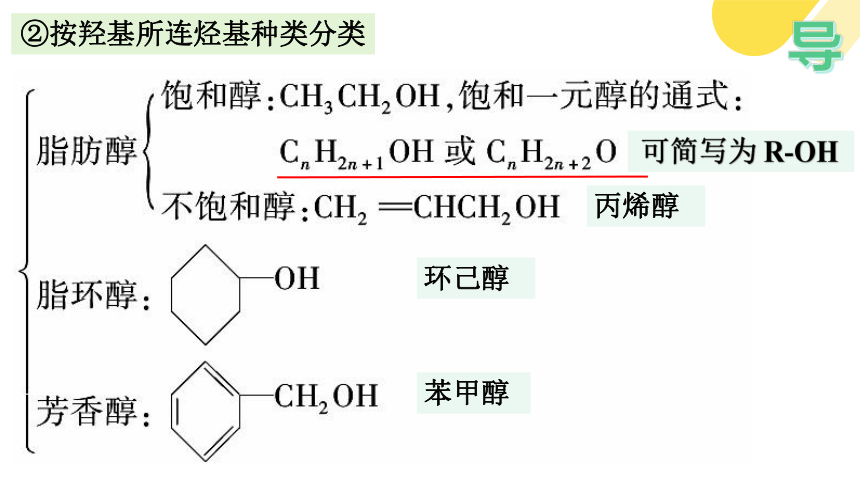
苯甲醇
环己醇
丙烯醇
②按羟基所连烃基种类分类
可简写为 R-OH
导
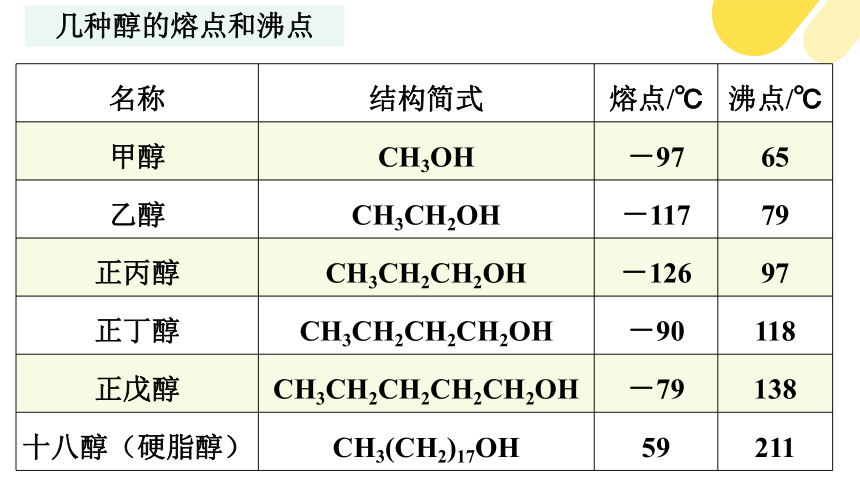
几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
4、物理性质
(1) 溶解性:
①醇在水中的溶解度一般随碳原子数的增加而降低。
②醇的碳原子数相同时,羟基越多,溶解度越大。
③醇的溶解度大于含有相同碳原子数烃类的溶解度。
(2) 沸点:
①饱和一元醇随碳原子数增多,沸点增大。
②醇的沸点远高于相对分子质量相近的烷。
③碳原子数相同的醇,羟基个数越多,沸点越高。
(3)密度:醇的密度小于水。
(1) 醇类同分异构体:等于其烃基的同分异构体数
如:-C3H7 有2种,C3H7-OH有2种;
-C4H9 有4种,C4H9-OH有4种;
-C5H11有8种,C5H11-OH有8种。
5、一元醇的同分异构体
思
完成导学提纲的深入学习和迁移应用;
存在的疑问写在【我有问题要问】
前8分钟
阅读本节知识清单,回答下列问题:
1、醇的催化氧化有什么规律?
2、乙醇的分子式可以通过测定什么来进行推断?
3、分子式为C5H12O的醇的同分异构体有几种?
后5分钟
1、下列物质的沸点由高到低的排列顺序正确的是( )
①丙三醇 ②丙烷 ③乙二醇 ④乙醇
A.①②③④ B.④③②① C.①③④② D.①③②④
C
2、为缓解能源紧张,部分省市开始试点推广乙醇汽油。下列有关乙醇的叙述,正确的是( )
A.乙醇和甲醇互为同系物 B.乙醇不能用玉米生产
C.乙醇的结构简式为C2H6O D.乙醇只能发生取代反应
A
小试牛刀
3、下列物质不属于醇类的是( )
A、C3H7OH B、C6H5CH2OH C、C6H5OH D、CH3OH
C
4、比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子都以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
B
乙二醇与钠反应化学方程式:
CH2OH
CH2OH
CH2ONa
CH2ONa
+ 2Na + H2↑
通过与金属钠的反应可测定醇分子中羟基的个数
结论:2-OH——H2可用于快速确定醇中羟基数目
(1) 置换反应
6、化学性质
评
(2)氧化反应
①燃烧:
2CO2 +3H2O
C2H5OH + 3O2
点燃
CO2 +H2O
ROH +O2
点燃
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:本C有H
②催化氧化:
评
醇的催化氧化规律
醇催化氧化条件:
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
O
=
2CH3-C-CH3 + 2H2O
丙酮
与-OH相连的C原子上有2个H原子的,氧化成醛
与—OH相连的C原子上有1个H原子的,氧化成酮
去羟基上的氢和羟基所连碳上的氢,碳原子和氧原子形成碳氧双键
-OH所在的碳原子上要有氢原子才可以被氧化
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
与—OH相连的C原子上没有H原子的,不能催化氧化
③与强氧化剂反应:
醇能使酸性高锰酸钾褪色,但不与溴水反应
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
Cr2O72- →Cr3+
由橙色变为绿色,检验酒驾
酸性高锰酸钾褪色
ROH RCOOH
K2Cr2O7(H+)
或KMnO4(H+)
(3)分子间脱水生成醚
乙醇在浓硫酸作用下加热至140 ℃时,生成乙醚,反应方程式:
一个脱羟基,一个脱羟基氢
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
H C C O C C H
H
H
H
H
H
H
H
H
H C C O H
H
H
H
H
评
测定乙醇分子式为:C2H6O
说明:分子中每个碳原子可连接四个原子、每个氧原子可连接两个原子、每个氢原子只连接一个原子。
评
乙醇的结构是前者还是后者?
提示:与金属钠反应时,C—O键不断裂,其他键可能会断裂。
断C—H键
断C—H键
断O—H键
断C—H键
断O—H键
设计实验来测定1 mol 乙醇产生H2的量
评
1种
等效氢
3种
等效氢
1、实验原理:
用足量金属钠与一定量的乙醇反应,通过测定产生氢气的量来推测乙醇的分子结构
2、实验装置:通过量筒中水的体积,间接得出反应生成的H2的体积
评
1 mol C2H6O与足量的 Na 反应生成0.5 mol H2,则说明在1个 C2H6O分子中只有1个 H 可以被 Na 置换出来,即在1个C2H6O分子中有1个 H 原子与其他5个 H 原子不同。
由此确定乙醇的结构式为:
3、实验结果
氧化反应:加氧去氢
还原反应:加氢去氧
结
1、下列各醇,能发生催化氧化的是( )
CH3—C—CH2OH
CH3
A.
CH3
C.CH3—CH—CH2CH3
∣
OH
CH3
∣
D.C6H5—C—CH3
∣
OH
AC
CH2CH3
∣
B. CH3—C—OH
∣
CH3
课堂检测
2、A、B、C三种醇同足量金属钠完全反应,在相同条件下产生相同体积的氢气,若消耗三种醇的物质的量之比是3:6:2,
则A、B、C三种醇的分子里羟基数之比是( )
A、3:2:1 B、2:6:3
C、3:1:2 D、2:1:3
D
下节提示:
乙醇与乙酸(第3课时)
第三节乙醇与乙酸(2)
醇类与乙醇分子结构的探究
学习目标
学习重、难点
1. 理解醇的定义、分类。
2. 掌握醇的物理性质和化学性质。
3. 掌握醇的催化氧化规律。
4. 理解乙醇分子结构的探究实验。
醇的催化氧化规律
通过阅读本节知识清单:
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
醇
酚
醇
① CH3CH2OH
酚
CH2OH
③
OH
④
OH
CH3
⑤
② CH2OH
CH2OH
醇
1、概念
2、官能团
名称:羟基 符号: -OH
一、醇类
导
①根据醇分子中羟基的个数分类
一元醇: CH3OH
甲醇(木精、木醇)
剧毒
用于能源领域
如汽车燃料
工业酒精有毒!
配制化妆品
3、分类
汽车用抗冻剂
CH2CH2
OH OH
乙二醇
二元醇:
CH2 CH CH2
OH OH OH
丙三醇(甘油)
吸湿性
,护肤
三元醇:
导
苯甲醇
环己醇
丙烯醇
②按羟基所连烃基种类分类
可简写为 R-OH
导
几种醇的熔点和沸点
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
4、物理性质
(1) 溶解性:
①醇在水中的溶解度一般随碳原子数的增加而降低。
②醇的碳原子数相同时,羟基越多,溶解度越大。
③醇的溶解度大于含有相同碳原子数烃类的溶解度。
(2) 沸点:
①饱和一元醇随碳原子数增多,沸点增大。
②醇的沸点远高于相对分子质量相近的烷。
③碳原子数相同的醇,羟基个数越多,沸点越高。
(3)密度:醇的密度小于水。
(1) 醇类同分异构体:等于其烃基的同分异构体数
如:-C3H7 有2种,C3H7-OH有2种;
-C4H9 有4种,C4H9-OH有4种;
-C5H11有8种,C5H11-OH有8种。
5、一元醇的同分异构体
思
完成导学提纲的深入学习和迁移应用;
存在的疑问写在【我有问题要问】
前8分钟
阅读本节知识清单,回答下列问题:
1、醇的催化氧化有什么规律?
2、乙醇的分子式可以通过测定什么来进行推断?
3、分子式为C5H12O的醇的同分异构体有几种?
后5分钟
1、下列物质的沸点由高到低的排列顺序正确的是( )
①丙三醇 ②丙烷 ③乙二醇 ④乙醇
A.①②③④ B.④③②① C.①③④② D.①③②④
C
2、为缓解能源紧张,部分省市开始试点推广乙醇汽油。下列有关乙醇的叙述,正确的是( )
A.乙醇和甲醇互为同系物 B.乙醇不能用玉米生产
C.乙醇的结构简式为C2H6O D.乙醇只能发生取代反应
A
小试牛刀
3、下列物质不属于醇类的是( )
A、C3H7OH B、C6H5CH2OH C、C6H5OH D、CH3OH
C
4、比较乙烷和乙醇的结构,下列说法错误的是( )
A.两个碳原子都以单键相连
B.分子里都含6个相同的氢原子
C.乙基与一个氢原子相连就是乙烷分子
D.乙基与一个羟基相连就是乙醇分子
B
乙二醇与钠反应化学方程式:
CH2OH
CH2OH
CH2ONa
CH2ONa
+ 2Na + H2↑
通过与金属钠的反应可测定醇分子中羟基的个数
结论:2-OH——H2可用于快速确定醇中羟基数目
(1) 置换反应
6、化学性质
评
(2)氧化反应
①燃烧:
2CO2 +3H2O
C2H5OH + 3O2
点燃
CO2 +H2O
ROH +O2
点燃
2CH3CH2OH + O2 2CH3CHO+2H2O
Cu或Ag
△
2CH3—C
Cu 或Ag
△
+ O2
+ 2 H2O
2CH3—C—H
O—H
H
O
H
乙醛
结构条件:本C有H
②催化氧化:
评
醇的催化氧化规律
醇催化氧化条件:
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
O
=
2CH3-C-CH3 + 2H2O
丙酮
与-OH相连的C原子上有2个H原子的,氧化成醛
与—OH相连的C原子上有1个H原子的,氧化成酮
去羟基上的氢和羟基所连碳上的氢,碳原子和氧原子形成碳氧双键
-OH所在的碳原子上要有氢原子才可以被氧化
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
与—OH相连的C原子上没有H原子的,不能催化氧化
③与强氧化剂反应:
醇能使酸性高锰酸钾褪色,但不与溴水反应
C2H5OH CH3COOH
K2Cr2O7(H+)
或KMnO4(H+)
Cr2O72- →Cr3+
由橙色变为绿色,检验酒驾
酸性高锰酸钾褪色
ROH RCOOH
K2Cr2O7(H+)
或KMnO4(H+)
(3)分子间脱水生成醚
乙醇在浓硫酸作用下加热至140 ℃时,生成乙醚,反应方程式:
一个脱羟基,一个脱羟基氢
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
H C C O C C H
H
H
H
H
H
H
H
H
H C C O H
H
H
H
H
评
测定乙醇分子式为:C2H6O
说明:分子中每个碳原子可连接四个原子、每个氧原子可连接两个原子、每个氢原子只连接一个原子。
评
乙醇的结构是前者还是后者?
提示:与金属钠反应时,C—O键不断裂,其他键可能会断裂。
断C—H键
断C—H键
断O—H键
断C—H键
断O—H键
设计实验来测定1 mol 乙醇产生H2的量
评
1种
等效氢
3种
等效氢
1、实验原理:
用足量金属钠与一定量的乙醇反应,通过测定产生氢气的量来推测乙醇的分子结构
2、实验装置:通过量筒中水的体积,间接得出反应生成的H2的体积
评
1 mol C2H6O与足量的 Na 反应生成0.5 mol H2,则说明在1个 C2H6O分子中只有1个 H 可以被 Na 置换出来,即在1个C2H6O分子中有1个 H 原子与其他5个 H 原子不同。
由此确定乙醇的结构式为:
3、实验结果
氧化反应:加氧去氢
还原反应:加氢去氧
结
1、下列各醇,能发生催化氧化的是( )
CH3—C—CH2OH
CH3
A.
CH3
C.CH3—CH—CH2CH3
∣
OH
CH3
∣
D.C6H5—C—CH3
∣
OH
AC
CH2CH3
∣
B. CH3—C—OH
∣
CH3
课堂检测
2、A、B、C三种醇同足量金属钠完全反应,在相同条件下产生相同体积的氢气,若消耗三种醇的物质的量之比是3:6:2,
则A、B、C三种醇的分子里羟基数之比是( )
A、3:2:1 B、2:6:3
C、3:1:2 D、2:1:3
D
下节提示:
乙醇与乙酸(第3课时)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
