化学人教版(2019)必修第二册7.1.2甲烷及烷烃(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.1.2甲烷及烷烃(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 21:08:05 | ||
图片预览








文档简介
(共26张PPT)
含碳的化合物一定是有机物吗?_________。
常温下,碳原子的性质______,常以__________与其他非金属原子成键。
碳原子间的成键方式为______、_______、_______;
有机化合物碳原子间所成的骨架为_______、_______
甲烷空间结构_____________;C—H间键角_________
烃的定义___________________;烷烃定义(三个强调点)
_____________________________________________
烷烃通式_________;研究对象是________烷烃
碳碳单键之间可以旋转吗?_______
碳原子超过两个的直链烷烃呈现________状。
知识回顾
稳定
不一定
共用电子对
单键
双键
三键
链状
环状
正四面体形
只含有C、H;碳碳之间单键、碳化合价达到饱和的化合物
只含有C、H的化合物
CnH2n+2
链状
可以
锯齿
109°28′
知识回顾
甲烷分子中个原子都达到最外层8电子稳定结构吗?________
放热反应可以看作_____能转化为____能;
吸热反应可以看作_____能转化为____能被生成物“储存”
吸热反应:反应物的总能量___生成物的总能量;
放热反应:生成物的总能量___反应物的总能量
不是
化学
热
热
化学
<
<
A(s) 2B(g) + 3C(g)
单一物质的质量、物质的量不变时,可以判断达到平衡
物质的质量分数不变时,可以判断达到平衡
当物质的量分数、体积分数不变时,不可以判断达到平衡
第一节 认识有机化合物(2)
甲烷、烷烃的性质及用途
第七章 有机化合物
【学习目标】
1. 通过阅读课本64页,了解甲烷和烷烃的物理性质、化学性质;
2. 通过阅读课本64页,了解甲烷与氯气的实验;
3. 通过阅读课本64页,理解甲烷的取代反应以及产物的
性质;
4. 通过阅读课本65页,掌握甲烷取代反应的有关计算;
【重难点】
1.甲烷的取代反应;
2.甲烷的取代有关计算
甲烷的性质
一、物理性质
甲烷是一种无色,无味的气体,密度比空气小,难溶于水。
二、化学性质
1、稳定性
通常情况下,烷烃比较稳定;
与强酸、强碱以及高锰酸钾等强氧化剂不反应。
导
生活中使用的天然气、沼气、以及煤矿坑道气(煤层气)、瓦斯、油田气等主要成分都是 CH4
煤气的主要成分是H2、CO
2、可燃性
CH4 + O2 CO2 + H2O
点燃
甲烷可燃烧,放出大量的热,产生淡蓝色火焰
燃烧实验前要验纯
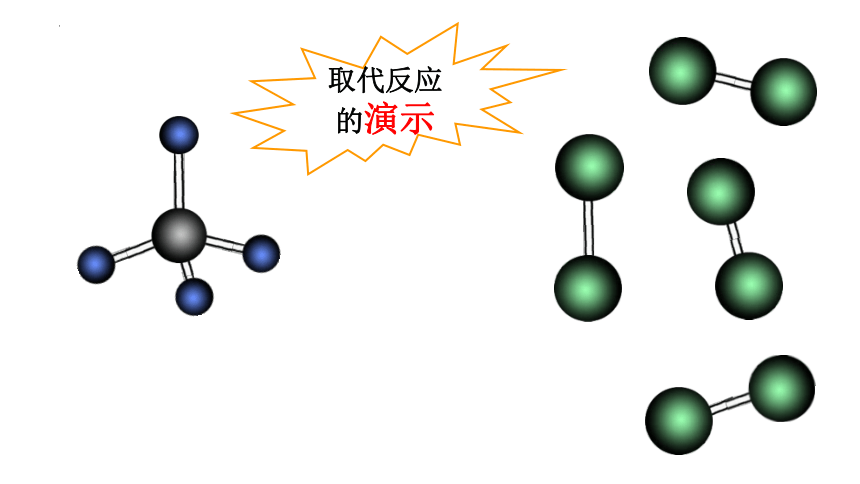
3、取代反应
导
CH4 与 Cl2 可以发生反应,即取代反应
取代反应:
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应
前8分钟
后5分钟:完成导学提纲
存在的疑问写在【我有问题要问】
阅读课本第64-65页,回答下列问题:
1、如何区别甲烷、一氧化碳、氢气这三种气体?
2、四氯化碳有什么化学性质?
3、甲烷的四种氯代产物都是正四面体结构吗?
4、烷烃的物理性质和化学性质有哪些?
思
套上铝箔的试管无明显现象。
光亮处的试管气体颜色逐渐变浅,试管壁出现油状液滴,同时出现少量白雾,试管内液面上升,饱和食盐水中有少量固体析出;
实验现象
实验探究—甲烷与氯气反应
实验操作
取代反应
的演示
(1) C4H10的熔、沸点比CH4的熔、沸点高。 ( )
(2) 在通常情况下,烷烃和硫酸、氢氧化钠、酸性高锰酸钾溶液均不反应。( )
(3) 乙烷也可以和氯气在光照条件下发生取代反应。( )
(4) CH4和Cl2按物质的量1:1混合,发生取代反应生成的产物
只有两种。( )
(5) 在做甲烷、乙烷燃烧实验前,气体一定要验纯。( )
【判断正误】
√
√
√
×
√
小试牛刀
实验结论
H
C
H
H
Cl
H Cl
光
H
C
H
H
H
Cl Cl
+
+
一氯甲烷(气态)
其实,一氯甲烷还可以继续跟 Cl2 发生取代反应
CH4 与 Cl2 可以发生反应,即:取代反应
评
H
C
H
Cl
Cl
H Cl
光
H
C
H
H
Cl
Cl Cl
+
+
H
C
Cl
Cl
Cl
H Cl
光
H
C
H
Cl
Cl
Cl Cl
+
+
Cl
C
Cl
Cl
Cl
H Cl
光
H
C
Cl
Cl
Cl
Cl Cl
+
+
二氯甲烷
三氯甲烷
四氯甲烷
液态
(氯仿)
(四氯化碳)
实验原理
① CH4 + Cl2 CH3Cl + HCl
光照
② CH3Cl + Cl2 CH2Cl2 + HCl
光照
③ CH2Cl2 + Cl2 CHCl3 + HCl
光照
④ CHCl3 + Cl2 CCl4 + HCl
光照
CH4 与 Cl2 的取代反应
5 种产物,4 种有机物 CH3Cl、CH2Cl2、CHCl3、CCl4 均不溶于水;1 种无机物 HCl
含量最多的产物是哪一种?
HCl
甲烷取代反应的规律:
① 光照,采用漫射光,如果用强光易爆炸。
② 甲烷可以与卤素单质发生取代反应;如:氯气、溴蒸气;与氯水、溴水等不反应;与氟反应产物一般是C和HF。
③ CH4 中的 H 原子是逐步被 Cl 取代,各步反应同时发生,
产物为 4 种有机物和 HCl 的混合物。
④ CH4 分子中每有 1mol H 原子被取代,则消耗 1mol Cl2,
同时生成 1mol HCl;
所以 1mol CH4 与 Cl2 发生取代反应,最多需要消耗 4mol Cl2
取代反应的特点:
① 反应物类型:反应物至少有一种是有机物;
② 反应形式:“上一下一,取而代之” ;
③ 断键特点:反应中旧化学键不一定全断开,可能部分断开;
④ 反应条件:一般都需要加热、光照或催化剂等
取代反应的计算方法:
① 定量关系:每有 1mol H 原子被取代,则消耗 1mol Cl2,
同时生成 1mol HCl;
② 守恒关系:“原子守恒”,反应前后 C、H、Cl 数目不变 ;
二、甲烷可能的空间构型
哪一种模型最合理?为什么?
各原子间形成的共价键时,彼此离的越远,则斥力越小,结构越稳定。
正四面体中各原子间价键离的最远。
历史上科学家认为CH2Cl2有两种:
其实,二氯甲烷只有一种,从而证明了甲烷是正四面体形
甲烷空间构型的确定
烷烃的性质
1、烷烃的物理性质
状态:C1-4 气态(新戊烷为液态);C5-16 液态;C17- 固态
熔沸点: ① 烷烃的相对分子质量越大,烷烃的熔、沸点越高
② 相对分子质量相同时,支链越多,熔、沸点越低
密度:ρ烷烃 < ρ水,但随着碳原子的增多而逐渐增大
溶解性:烷烃不溶于水
(1) 稳定性
通常情况下,烷烃比较稳定,与强酸、强碱或酸性高锰酸钾等强氧化剂都不发生反应。
2、烷烃的化学性质
(2) 氧化反应:烷烃都具有可燃性,可用作燃料。
烷烃燃烧通式为:
CH4 + 2O2 CO2 + 2H2O
点燃
C3H8 + 5O2 3CO2 + 4H2O
点燃
点燃
(3)分解反应
烷烃在较高温度下会发生分解。
CH4 C + 2H2
C4H10 CH2== CH2 + CH3CH3
(乙烯)
高温
高温
石油化工和天然气化工生产
烷烃 → 化工基本原料和燃料
(4)取代反应
(1)有机物分子里的某些原子或原子团被其他原子或原子团所替
代的反应。
(2)在光照条件下,烷烃可与卤素单质发生取代反应:
CnH2n+2 + X2
CnH2n+1X + HX
光
A-B + C-D → A-D + C-B
调虎离山、取而代之
甲烷 CH4
乙烷 CH3CH3
丙烷 CH3CH2CH3
丁烷 CH3CH2CH2CH3
戊烷 CH3(CH2)3CH3
癸烷 CH3(CH2)8CH3
十七烷 CH3(CH2)15CH3
同系物:
判断:
结构相似,分子组成上相差一个
或若干个CH2原子团
一同:同类物质
一似:结构相似
一差:组成差若干个CH2
饱和食盐水
CH4 和 Cl2
1、将漫射光照射到混合气体( 体积比 1: 4 )的装置上,
如下图,下列现象正确的是( )
① 试管内黄绿色逐渐变浅 ② 试管内黄绿色逐渐加深
③ 无任何现象 ④ 试管内液面上升 ⑤ 试管内壁有油状物生成
A. ① B. ①④⑤
C. ①⑤ D. ②⑤
B
小试牛刀
2、下列物质中属于同系物的是_________
① CH2=CH-CH3
② CH4
③ H2
④ CH3(CH2)5CH(CH3)CH3
⑤
②和④
下节提示:
烷烃的同分异构体
(第3课时)
含碳的化合物一定是有机物吗?_________。
常温下,碳原子的性质______,常以__________与其他非金属原子成键。
碳原子间的成键方式为______、_______、_______;
有机化合物碳原子间所成的骨架为_______、_______
甲烷空间结构_____________;C—H间键角_________
烃的定义___________________;烷烃定义(三个强调点)
_____________________________________________
烷烃通式_________;研究对象是________烷烃
碳碳单键之间可以旋转吗?_______
碳原子超过两个的直链烷烃呈现________状。
知识回顾
稳定
不一定
共用电子对
单键
双键
三键
链状
环状
正四面体形
只含有C、H;碳碳之间单键、碳化合价达到饱和的化合物
只含有C、H的化合物
CnH2n+2
链状
可以
锯齿
109°28′
知识回顾
甲烷分子中个原子都达到最外层8电子稳定结构吗?________
放热反应可以看作_____能转化为____能;
吸热反应可以看作_____能转化为____能被生成物“储存”
吸热反应:反应物的总能量___生成物的总能量;
放热反应:生成物的总能量___反应物的总能量
不是
化学
热
热
化学
<
<
A(s) 2B(g) + 3C(g)
单一物质的质量、物质的量不变时,可以判断达到平衡
物质的质量分数不变时,可以判断达到平衡
当物质的量分数、体积分数不变时,不可以判断达到平衡
第一节 认识有机化合物(2)
甲烷、烷烃的性质及用途
第七章 有机化合物
【学习目标】
1. 通过阅读课本64页,了解甲烷和烷烃的物理性质、化学性质;
2. 通过阅读课本64页,了解甲烷与氯气的实验;
3. 通过阅读课本64页,理解甲烷的取代反应以及产物的
性质;
4. 通过阅读课本65页,掌握甲烷取代反应的有关计算;
【重难点】
1.甲烷的取代反应;
2.甲烷的取代有关计算
甲烷的性质
一、物理性质
甲烷是一种无色,无味的气体,密度比空气小,难溶于水。
二、化学性质
1、稳定性
通常情况下,烷烃比较稳定;
与强酸、强碱以及高锰酸钾等强氧化剂不反应。
导
生活中使用的天然气、沼气、以及煤矿坑道气(煤层气)、瓦斯、油田气等主要成分都是 CH4
煤气的主要成分是H2、CO
2、可燃性
CH4 + O2 CO2 + H2O
点燃
甲烷可燃烧,放出大量的热,产生淡蓝色火焰
燃烧实验前要验纯
3、取代反应
导
CH4 与 Cl2 可以发生反应,即取代反应
取代反应:
有机物分子里的某些原子或原子团被其他原子或原子团所替代的反应
前8分钟
后5分钟:完成导学提纲
存在的疑问写在【我有问题要问】
阅读课本第64-65页,回答下列问题:
1、如何区别甲烷、一氧化碳、氢气这三种气体?
2、四氯化碳有什么化学性质?
3、甲烷的四种氯代产物都是正四面体结构吗?
4、烷烃的物理性质和化学性质有哪些?
思
套上铝箔的试管无明显现象。
光亮处的试管气体颜色逐渐变浅,试管壁出现油状液滴,同时出现少量白雾,试管内液面上升,饱和食盐水中有少量固体析出;
实验现象
实验探究—甲烷与氯气反应
实验操作
取代反应
的演示
(1) C4H10的熔、沸点比CH4的熔、沸点高。 ( )
(2) 在通常情况下,烷烃和硫酸、氢氧化钠、酸性高锰酸钾溶液均不反应。( )
(3) 乙烷也可以和氯气在光照条件下发生取代反应。( )
(4) CH4和Cl2按物质的量1:1混合,发生取代反应生成的产物
只有两种。( )
(5) 在做甲烷、乙烷燃烧实验前,气体一定要验纯。( )
【判断正误】
√
√
√
×
√
小试牛刀
实验结论
H
C
H
H
Cl
H Cl
光
H
C
H
H
H
Cl Cl
+
+
一氯甲烷(气态)
其实,一氯甲烷还可以继续跟 Cl2 发生取代反应
CH4 与 Cl2 可以发生反应,即:取代反应
评
H
C
H
Cl
Cl
H Cl
光
H
C
H
H
Cl
Cl Cl
+
+
H
C
Cl
Cl
Cl
H Cl
光
H
C
H
Cl
Cl
Cl Cl
+
+
Cl
C
Cl
Cl
Cl
H Cl
光
H
C
Cl
Cl
Cl
Cl Cl
+
+
二氯甲烷
三氯甲烷
四氯甲烷
液态
(氯仿)
(四氯化碳)
实验原理
① CH4 + Cl2 CH3Cl + HCl
光照
② CH3Cl + Cl2 CH2Cl2 + HCl
光照
③ CH2Cl2 + Cl2 CHCl3 + HCl
光照
④ CHCl3 + Cl2 CCl4 + HCl
光照
CH4 与 Cl2 的取代反应
5 种产物,4 种有机物 CH3Cl、CH2Cl2、CHCl3、CCl4 均不溶于水;1 种无机物 HCl
含量最多的产物是哪一种?
HCl
甲烷取代反应的规律:
① 光照,采用漫射光,如果用强光易爆炸。
② 甲烷可以与卤素单质发生取代反应;如:氯气、溴蒸气;与氯水、溴水等不反应;与氟反应产物一般是C和HF。
③ CH4 中的 H 原子是逐步被 Cl 取代,各步反应同时发生,
产物为 4 种有机物和 HCl 的混合物。
④ CH4 分子中每有 1mol H 原子被取代,则消耗 1mol Cl2,
同时生成 1mol HCl;
所以 1mol CH4 与 Cl2 发生取代反应,最多需要消耗 4mol Cl2
取代反应的特点:
① 反应物类型:反应物至少有一种是有机物;
② 反应形式:“上一下一,取而代之” ;
③ 断键特点:反应中旧化学键不一定全断开,可能部分断开;
④ 反应条件:一般都需要加热、光照或催化剂等
取代反应的计算方法:
① 定量关系:每有 1mol H 原子被取代,则消耗 1mol Cl2,
同时生成 1mol HCl;
② 守恒关系:“原子守恒”,反应前后 C、H、Cl 数目不变 ;
二、甲烷可能的空间构型
哪一种模型最合理?为什么?
各原子间形成的共价键时,彼此离的越远,则斥力越小,结构越稳定。
正四面体中各原子间价键离的最远。
历史上科学家认为CH2Cl2有两种:
其实,二氯甲烷只有一种,从而证明了甲烷是正四面体形
甲烷空间构型的确定
烷烃的性质
1、烷烃的物理性质
状态:C1-4 气态(新戊烷为液态);C5-16 液态;C17- 固态
熔沸点: ① 烷烃的相对分子质量越大,烷烃的熔、沸点越高
② 相对分子质量相同时,支链越多,熔、沸点越低
密度:ρ烷烃 < ρ水,但随着碳原子的增多而逐渐增大
溶解性:烷烃不溶于水
(1) 稳定性
通常情况下,烷烃比较稳定,与强酸、强碱或酸性高锰酸钾等强氧化剂都不发生反应。
2、烷烃的化学性质
(2) 氧化反应:烷烃都具有可燃性,可用作燃料。
烷烃燃烧通式为:
CH4 + 2O2 CO2 + 2H2O
点燃
C3H8 + 5O2 3CO2 + 4H2O
点燃
点燃
(3)分解反应
烷烃在较高温度下会发生分解。
CH4 C + 2H2
C4H10 CH2== CH2 + CH3CH3
(乙烯)
高温
高温
石油化工和天然气化工生产
烷烃 → 化工基本原料和燃料
(4)取代反应
(1)有机物分子里的某些原子或原子团被其他原子或原子团所替
代的反应。
(2)在光照条件下,烷烃可与卤素单质发生取代反应:
CnH2n+2 + X2
CnH2n+1X + HX
光
A-B + C-D → A-D + C-B
调虎离山、取而代之
甲烷 CH4
乙烷 CH3CH3
丙烷 CH3CH2CH3
丁烷 CH3CH2CH2CH3
戊烷 CH3(CH2)3CH3
癸烷 CH3(CH2)8CH3
十七烷 CH3(CH2)15CH3
同系物:
判断:
结构相似,分子组成上相差一个
或若干个CH2原子团
一同:同类物质
一似:结构相似
一差:组成差若干个CH2
饱和食盐水
CH4 和 Cl2
1、将漫射光照射到混合气体( 体积比 1: 4 )的装置上,
如下图,下列现象正确的是( )
① 试管内黄绿色逐渐变浅 ② 试管内黄绿色逐渐加深
③ 无任何现象 ④ 试管内液面上升 ⑤ 试管内壁有油状物生成
A. ① B. ①④⑤
C. ①⑤ D. ②⑤
B
小试牛刀
2、下列物质中属于同系物的是_________
① CH2=CH-CH3
② CH4
③ H2
④ CH3(CH2)5CH(CH3)CH3
⑤
②和④
下节提示:
烷烃的同分异构体
(第3课时)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
