山东省滨州市2023-2024学年高三上学期11月期中考试化学试题(含答案)
文档属性
| 名称 | 山东省滨州市2023-2024学年高三上学期11月期中考试化学试题(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 916.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 00:00:00 | ||
图片预览




文档简介
滨州市2023-2024学年高三上学期11月期中考试
化学
第I卷(选择题)
可能用到的相对原子质量:H1 O16 Na23 Mn55 Cu64 Fe56 Ag108
一、单选题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列之物具有典型的淄博特色,据其主要化学成分不能与其它三种归为一类的是( )
A.周村丝绸 B.博山琉璃 C.齐国蹴鞠 D.桓台草编
2.下列有关实验的说法正确的是( )
A.溴水应保存在带磨口玻璃塞的棕色细口试剂瓶中
B.使用分液漏斗前,应向分液漏斗中加少量水,检查旋塞芯处是否漏水,待确认不漏水后即可使用
C.蒸发操作中,将蒸发亚放在铁架台的铁圈上,并垫上石棉网加热
D.配制一定物质的量浓度的溶液时,容量瓶中有少量的水会导致溶液浓度偏低
3.茶叶中铁元素的检验可经过以下四步完成:灼烧灰化硝酸溶解过滤检测滤液中的铁元素。下列说法正确的是( )
A.“灼烧灰化”选用的玻璃仪器有①②③ B.④用于配制硝酸时需洗净并烘干
C.“过滤”时需沿②向⑤中转移液体并小心搅拌 D.检测铁元素时,⑥悬垂于⑦的上方滴加溶液
4.氧化石墨烯是一种淡柠檬黄色、不稳定的新型化合物,其单层局部结构如图所示。下列关于该化合物的说法正确的是( )
A.氧化石墨烯的导电性优于石墨烯 B.氧化石墨烯的抗氧化能力比石墨烯弱
C.氧化石墨烯中键的键能比C—O键大 D.氧化石墨烯中所有原子均为杂化
5.“类比”是预测物质性质与化学反应的重要方法之一,但“类比”不能违背客观事实,下列“类比”合理的是( )
A.能与缓慢氧化生成致密氧化膜保护,则与也缓慢氧化生成氧化膜保护
B.在空气中燃烧生成,则同族的在空气中燃烧也生成
C.溶于溶液生成,则也能溶于溶液生成
D.与在水溶液中因水解无法大量共存,则与在水溶液中也因水解无法大量共存
6.中医的急救三宝分别是安宫牛黄丸、紫雪丹、至宝丹。安宫牛黄丸的主要药材是黄芩,黄芩素能抑制新冠病毒的活性。黄芩素结构如图所示,下列说法正确的是( )
A.黄芩素的核磁共振氢谱显示有八组峰
B.分子中有三种官能团
C.黄芩素最多能够消耗的
D.黄芩素与足量氢气加成后,连有氧原子的碳原于中有5个手性碳原子
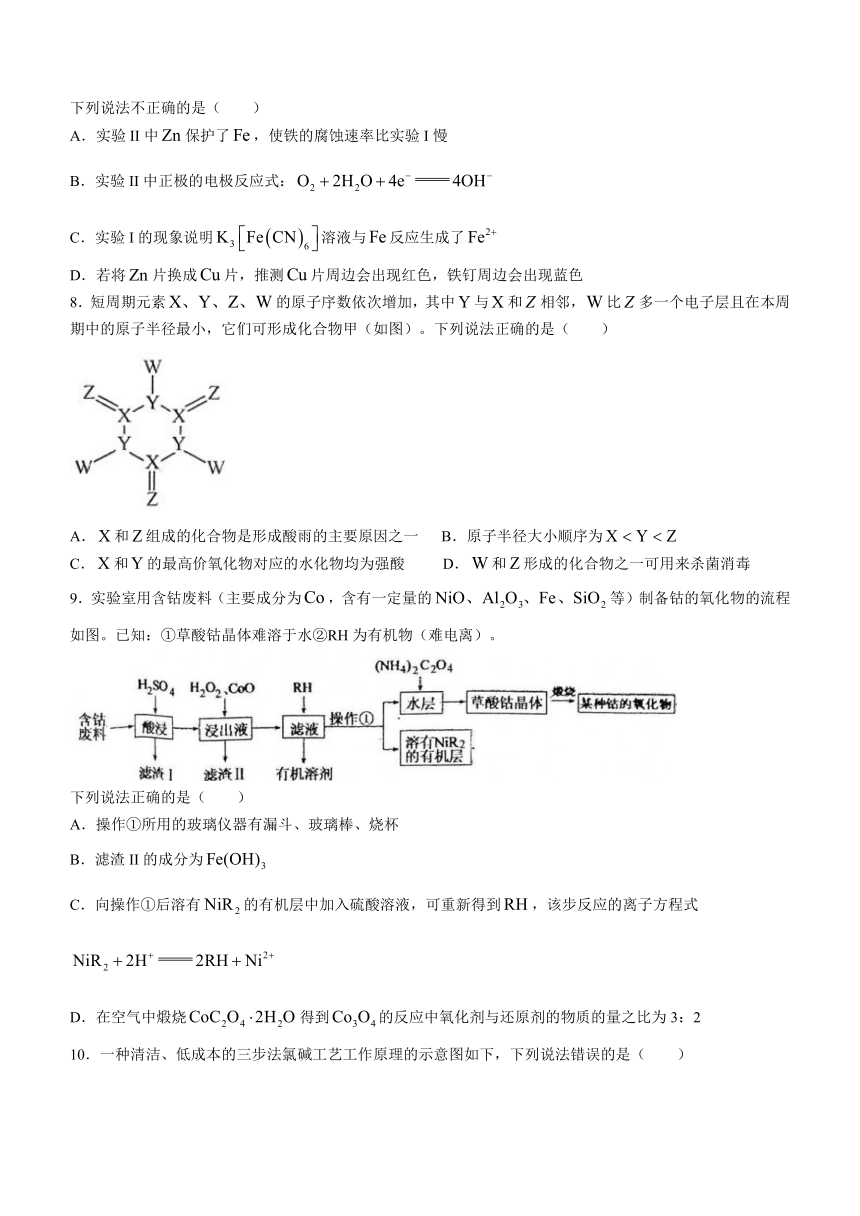
7.实验小组研究金属电化学腐蚀,实验如下:
实验I
时的现象:铁钉表面及周边来见明显变化。
时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验II
时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是( )
A.实验II中保护了,使铁的腐蚀速率比实验I慢
B.实验II中正极的电极反应式:
C.实验I的现象说明溶液与反应生成了
D.若将片换成片,推测片周边会出现红色,铁钉周边会出现蓝色
8.短周期元素的原子序数依次增加,其中与和相邻,比多一个电子层且在本周期中的原子半径最小,它们可形成化合物甲(如图)。下列说法正确的是( )
A.和组成的化合物是形成酸雨的主要原因之一 B.原子半径大小顺序为
C.和的最高价氧化物对应的水化物均为强酸 D.和形成的化合物之一可用来杀菌消毒
9.实验室用含钴废料(主要成分为,含有一定量的等)制备钴的氧化物的流程如图。已知:①草酸钴晶体难溶于水②RH为有机物(难电离)。
下列说法正确的是( )
A.操作①所用的玻璃仪器有漏斗、玻璃棒、烧杯
B.滤渣II的成分为
C.向操作①后溶有的有机层中加入硫酸溶液,可重新得到,该步反应的离子方程式
D.在空气中煅烧得到的反应中氧化剂与还原剂的物质的量之比为3:2
10.一种清洁、低成本的三步法氯碱工艺工作原理的示意图如下,下列说法错误的是( )
A.第一步中阳极的电极反应式为
B.与传统氯碱工艺相比,该方法不需要使用离子交换膜
C.第二步中正极质量每增加,负极质量减少
D.理论上每消耗,产生(标准状况下)
二、不定项选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分)
11.下列实验操作能达到相应实验目的的是( )
选项 实验目的 实验操作
A 提纯Mg(OH)2 将含少量Cu(OH)2的Mg(OH)2固体溶于足量浓氨水中,过滤、洗涤、干燥
B 探究Fe2+、I-的还原性强弱 在FeI2溶液中滴加酸化的双氧水,观察溶液颜色变化
C 判断KCI的化学键类型 将KCI固体加热融化,进行导电性实验
D 探究不同价态硫元素的转化 向Na2S与Na2SO3的混合溶液中加入硝酸
12.实验室以二氧化钟(CeO2)废渣为原料制备Ce2(CO3)3的流程如下:
已知被有机萃取剂萃取原理为(水层)(有机层(有机层)(水层)。下列说法正确的是( )
A.“酸漫”时,可用代替
B.“萃取”时,振荡分液漏斗应下口倾斜向上,并从下口放气
C.“反萃取”时,为了提高的反萃取率,应一次性加入大量的稀硫酸
D.“沉淀”时,加入足量的离子方程式为
13.城市污水中含有一定量的,向污水中加入菌体和溶液,在菌体的作用下依次发生过程I、过程II,从而实现的脱除,其过程如图所示。下列说法正确的是( )
A.“过程”中为催化剂
B.的氧化性强于
C.“过程II”中氧化产物和还原产物的质量之比为
D.“过程”中和的物质的量之比为,则氧化剂与还原剂物质的量之比为
14.有机物烯醇式与酮式的互变异构原理如图所示,下列说法错误的是( )
A.与水发生加成反应后会生成
B.二者互变过程中碳原子的杂化类型均保持不变
C.水解的最终产物为、CO2和CH3COOH
D.中存在具有分子内氢键的顺式异构体
15.钠硒电池是一类以单质唒或含硒化合物为正极、金属钠为负极的新型电池,具有能量密度大、导电率高、成本低等优点。以填充碳纳米管作为正极材料的一种钠硒电池工作原理如图所示,充放电过程中正极材料立方晶胞内未标出因放电产生的0价原子。下列说法错误的是( )
A.每个晶胞中个数为
B.在晶胞结构中,占据的位置是顶点和面心
C.充分放电时,正极的电极反应式为
D.充电时外电路中转移电子,两极质量变化差为
第II卷(非选择题)
16.铀氮化合物是核燃料循环系统中的重要材料。
已知。回答下列问题:
(1)基态氮原子价电子轨道表示式为______。
(2)反应中断裂的化学键有______(填标号)。
a.氢键b.极性键c.非极性键d.离子键e.配位键
(3)反应所得的气态产物中属于非极性分子的是______(填化学式,下同);氢化物中更易与形成配离子的是______,解释原因______。
(4)基态原子的外围电子排布式为,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是______(填标号)。
A. B. C. D.
(5)的空间构型为______,其结构中存在大键,可表示为______(用表示,代表参与形成大键的原子数,代表参与形成大键的电子数)。
(6)某种铀氮化物的晶胞如图。已知晶胞密度为原子半径为原子半径为,设为阿伏加德罗常数的值,则该晶胞的空间利用率为______(用含的式子表示)。
17.铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含锌盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如图所示。
已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为______(填化学式)。
(2)水浸渣中主要有和______。
(3)“沉淀”步骤调到弱碱性,主要除去的杂质是______。
(4)“除硅磷”步骤中,使硅、磷分别以和的形式沉淀。该步需要控制溶液的以达到最好的除杂效果。若时,会导致______;时,会导致______。
(5)“分离钒”步骤中,将溶液调到1.8左右得到沉淀。在时,溶解为或:在瑊性条件下,溶解为或。上述性质说明具有______(填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠溶液,反应的离子方程式为______。
18.实验室利用甘氨酸与硫酸亚铁制备补铁剂甘氨酸亚铁,装置如图所示(夹持仪器省略)。
已知:I.有关物质性质如下表所示:
甘氨酸 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中的溶解度大于在乙醇中的溶解度
柠檬酸 易溶于水和乙醇,酸性较强,有强还原性
甘氨酸亚铁 易溶于水,难溶于乙醇、冰醋酸
II.甘氨酸亚铁摩尔质量为
III.氨基能被酸性溶液氧化为硝基:
(1)连接好装置,装入药品,进行的操作为:
①打开,反应一段时间,将装置中空气排净;
②______,使中溶液进入中;
③在恒温条件下用磁力搅拌器不断搅拌,然后向中滴加溶液,调溶液至,使反应物充分反应;
④反应完成后,向中反应混合液中加入乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品。
(2)仪器的名称是______,其中加入柠檬酸的作用是______,步骤④中加入乙醇,溶液的极性______(填“增强”、“减弱”或“不变”)。
(3)生成甘氨酸亚铁的化学方程式是______。
(4)体系与产率之间的关系如下表
体系 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5
产率(%) 65.70 74.92 78.67 86.65 88.07 74.97 62.31 55.98
过高或过低,产品产率均下降的原因是:______。
(5)产品纯度测定。已知粗产品通常混有甘氨酸,称取粗产品2.2克,先加入______,搅拌、过滤、洗涤得沉淀,将沉淀配成溶液,取溶液置于锥形瓶,用的溶液滴定至终点,三次平均消耗体积为,则该样品的纯度为______。
19.党的二十大报告指出“绿水青山就是金山银山”,用化学技术治理环境问题中显得尤为重要。
(1)将和两种气体转化为合成气和,可以实现能量综合利用,对环境保护具有十分重要的意义。甲烷及二氧化碳重整涉及以下反应:
I.
II.
反应______。(用表示)
(2)一种基于吸收剂区分的同时脱硫脱硝反应的装置如图所示.反应器I吸收,反应器II吸收NO,隔绝空气反应一段时间.
①当观察到反应器I中悬浊液变澄清时,反应的离子方程式______。
②反应器II中所发生的反应为,盛有溶液最多能吸收(标准状况下)的体积为______。
(3)日本政府于2023年8月24日下午一点启动福岛核污染废水排海,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料。核废料中+6价的铀可以通过电化学还原法处理,还原为的电化学装置如图所示:
阴极发生的反应为:
阴极区溶液中发生反应:、
①阴极上发生的副反应为:______。
②阴极区溶液中加入的目的是______。
③电还原处理+6价的铀转移,阴极区减少______mol。
20.异甘草素(VII)具有抗肿瘤、抗病毒等药物功效。合成路线如下,回答下列问题:
已知:①氯甲基甲醚结构简式为:
②
(1)化合物I的名称是______,化合物II所含的官能团名称是______。
(2)IV转化为V的反应类型是______,氯甲基甲醚在全合成过程中的作用是______。
(3)写出V与新制的氢氧化铜悬浊液共热的化学反应方程式______。
(4)由化合物III、V合成化合物VI,生成的中间产物的结构简式是______。
(5)符合下列条件的分子II的同分异构体数目有______种。
①能使溶液显色;②既能发生银镜反应,又能发生水解反应
(6)结合题给信息,设计由为原料制备的合成路线(其他无机试剂任选)______。
化学参考答案
1.B 2.A 3.D 4.B 5.C 6.A 7.C 8.D 9.C 10.C 11.AC 12.B. 13.C 14.BC 15.D
16.(1) (2)bde (3)CO2、N2 NH3
电负性N(4)A (5)平面三角形
(6)或
17.(1) (2) (3)
(4)与反应,使其浓度降低,导致无法完全沉淀,同时可能产生硅酸胶状沉淀,不宜处理
生成沉淀,不能形成沉淀,导致产品中混有杂质,同时溶液中降低,导致无法完全沉淀
(5)C (6)
18.(1)打开,关闭
(2)三预烧瓶 防止亚铁离子被氧化且能抑制亚铁离子水解 减弱
(3)
(4)过高会生成,过低时很小,难以生成甘氨酸亚铁
(5)冰醋酸 92.7%
19.(1)
(2)① ②
(3)①
②消耗反应中生成的,防止与反应 ③1
20.(1)间苯二酚或1,3-苯二酚 (酚)羟基和酮羰基
(2)取代反应 保护酚羟基,防止其被破坏
(3)
(4)
(5)13
(6)
化学
第I卷(选择题)
可能用到的相对原子质量:H1 O16 Na23 Mn55 Cu64 Fe56 Ag108
一、单选题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列之物具有典型的淄博特色,据其主要化学成分不能与其它三种归为一类的是( )
A.周村丝绸 B.博山琉璃 C.齐国蹴鞠 D.桓台草编
2.下列有关实验的说法正确的是( )
A.溴水应保存在带磨口玻璃塞的棕色细口试剂瓶中
B.使用分液漏斗前,应向分液漏斗中加少量水,检查旋塞芯处是否漏水,待确认不漏水后即可使用
C.蒸发操作中,将蒸发亚放在铁架台的铁圈上,并垫上石棉网加热
D.配制一定物质的量浓度的溶液时,容量瓶中有少量的水会导致溶液浓度偏低
3.茶叶中铁元素的检验可经过以下四步完成:灼烧灰化硝酸溶解过滤检测滤液中的铁元素。下列说法正确的是( )
A.“灼烧灰化”选用的玻璃仪器有①②③ B.④用于配制硝酸时需洗净并烘干
C.“过滤”时需沿②向⑤中转移液体并小心搅拌 D.检测铁元素时,⑥悬垂于⑦的上方滴加溶液
4.氧化石墨烯是一种淡柠檬黄色、不稳定的新型化合物,其单层局部结构如图所示。下列关于该化合物的说法正确的是( )
A.氧化石墨烯的导电性优于石墨烯 B.氧化石墨烯的抗氧化能力比石墨烯弱
C.氧化石墨烯中键的键能比C—O键大 D.氧化石墨烯中所有原子均为杂化
5.“类比”是预测物质性质与化学反应的重要方法之一,但“类比”不能违背客观事实,下列“类比”合理的是( )
A.能与缓慢氧化生成致密氧化膜保护,则与也缓慢氧化生成氧化膜保护
B.在空气中燃烧生成,则同族的在空气中燃烧也生成
C.溶于溶液生成,则也能溶于溶液生成
D.与在水溶液中因水解无法大量共存,则与在水溶液中也因水解无法大量共存
6.中医的急救三宝分别是安宫牛黄丸、紫雪丹、至宝丹。安宫牛黄丸的主要药材是黄芩,黄芩素能抑制新冠病毒的活性。黄芩素结构如图所示,下列说法正确的是( )
A.黄芩素的核磁共振氢谱显示有八组峰
B.分子中有三种官能团
C.黄芩素最多能够消耗的
D.黄芩素与足量氢气加成后,连有氧原子的碳原于中有5个手性碳原子
7.实验小组研究金属电化学腐蚀,实验如下:
实验I
时的现象:铁钉表面及周边来见明显变化。
时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验II
时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是( )
A.实验II中保护了,使铁的腐蚀速率比实验I慢
B.实验II中正极的电极反应式:
C.实验I的现象说明溶液与反应生成了
D.若将片换成片,推测片周边会出现红色,铁钉周边会出现蓝色
8.短周期元素的原子序数依次增加,其中与和相邻,比多一个电子层且在本周期中的原子半径最小,它们可形成化合物甲(如图)。下列说法正确的是( )
A.和组成的化合物是形成酸雨的主要原因之一 B.原子半径大小顺序为
C.和的最高价氧化物对应的水化物均为强酸 D.和形成的化合物之一可用来杀菌消毒
9.实验室用含钴废料(主要成分为,含有一定量的等)制备钴的氧化物的流程如图。已知:①草酸钴晶体难溶于水②RH为有机物(难电离)。
下列说法正确的是( )
A.操作①所用的玻璃仪器有漏斗、玻璃棒、烧杯
B.滤渣II的成分为
C.向操作①后溶有的有机层中加入硫酸溶液,可重新得到,该步反应的离子方程式
D.在空气中煅烧得到的反应中氧化剂与还原剂的物质的量之比为3:2
10.一种清洁、低成本的三步法氯碱工艺工作原理的示意图如下,下列说法错误的是( )
A.第一步中阳极的电极反应式为
B.与传统氯碱工艺相比,该方法不需要使用离子交换膜
C.第二步中正极质量每增加,负极质量减少
D.理论上每消耗,产生(标准状况下)
二、不定项选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分)
11.下列实验操作能达到相应实验目的的是( )
选项 实验目的 实验操作
A 提纯Mg(OH)2 将含少量Cu(OH)2的Mg(OH)2固体溶于足量浓氨水中,过滤、洗涤、干燥
B 探究Fe2+、I-的还原性强弱 在FeI2溶液中滴加酸化的双氧水,观察溶液颜色变化
C 判断KCI的化学键类型 将KCI固体加热融化,进行导电性实验
D 探究不同价态硫元素的转化 向Na2S与Na2SO3的混合溶液中加入硝酸
12.实验室以二氧化钟(CeO2)废渣为原料制备Ce2(CO3)3的流程如下:
已知被有机萃取剂萃取原理为(水层)(有机层(有机层)(水层)。下列说法正确的是( )
A.“酸漫”时,可用代替
B.“萃取”时,振荡分液漏斗应下口倾斜向上,并从下口放气
C.“反萃取”时,为了提高的反萃取率,应一次性加入大量的稀硫酸
D.“沉淀”时,加入足量的离子方程式为
13.城市污水中含有一定量的,向污水中加入菌体和溶液,在菌体的作用下依次发生过程I、过程II,从而实现的脱除,其过程如图所示。下列说法正确的是( )
A.“过程”中为催化剂
B.的氧化性强于
C.“过程II”中氧化产物和还原产物的质量之比为
D.“过程”中和的物质的量之比为,则氧化剂与还原剂物质的量之比为
14.有机物烯醇式与酮式的互变异构原理如图所示,下列说法错误的是( )
A.与水发生加成反应后会生成
B.二者互变过程中碳原子的杂化类型均保持不变
C.水解的最终产物为、CO2和CH3COOH
D.中存在具有分子内氢键的顺式异构体
15.钠硒电池是一类以单质唒或含硒化合物为正极、金属钠为负极的新型电池,具有能量密度大、导电率高、成本低等优点。以填充碳纳米管作为正极材料的一种钠硒电池工作原理如图所示,充放电过程中正极材料立方晶胞内未标出因放电产生的0价原子。下列说法错误的是( )
A.每个晶胞中个数为
B.在晶胞结构中,占据的位置是顶点和面心
C.充分放电时,正极的电极反应式为
D.充电时外电路中转移电子,两极质量变化差为
第II卷(非选择题)
16.铀氮化合物是核燃料循环系统中的重要材料。
已知。回答下列问题:
(1)基态氮原子价电子轨道表示式为______。
(2)反应中断裂的化学键有______(填标号)。
a.氢键b.极性键c.非极性键d.离子键e.配位键
(3)反应所得的气态产物中属于非极性分子的是______(填化学式,下同);氢化物中更易与形成配离子的是______,解释原因______。
(4)基态原子的外围电子排布式为,则处于下列状态的铀原子或离子失去一个电子所需能量最高的是______(填标号)。
A. B. C. D.
(5)的空间构型为______,其结构中存在大键,可表示为______(用表示,代表参与形成大键的原子数,代表参与形成大键的电子数)。
(6)某种铀氮化物的晶胞如图。已知晶胞密度为原子半径为原子半径为,设为阿伏加德罗常数的值,则该晶胞的空间利用率为______(用含的式子表示)。
17.铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含锌盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如图所示。
已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为______(填化学式)。
(2)水浸渣中主要有和______。
(3)“沉淀”步骤调到弱碱性,主要除去的杂质是______。
(4)“除硅磷”步骤中,使硅、磷分别以和的形式沉淀。该步需要控制溶液的以达到最好的除杂效果。若时,会导致______;时,会导致______。
(5)“分离钒”步骤中,将溶液调到1.8左右得到沉淀。在时,溶解为或:在瑊性条件下,溶解为或。上述性质说明具有______(填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠溶液,反应的离子方程式为______。
18.实验室利用甘氨酸与硫酸亚铁制备补铁剂甘氨酸亚铁,装置如图所示(夹持仪器省略)。
已知:I.有关物质性质如下表所示:
甘氨酸 易溶于水,微溶于乙醇、冰醋酸,在冰醋酸中的溶解度大于在乙醇中的溶解度
柠檬酸 易溶于水和乙醇,酸性较强,有强还原性
甘氨酸亚铁 易溶于水,难溶于乙醇、冰醋酸
II.甘氨酸亚铁摩尔质量为
III.氨基能被酸性溶液氧化为硝基:
(1)连接好装置,装入药品,进行的操作为:
①打开,反应一段时间,将装置中空气排净;
②______,使中溶液进入中;
③在恒温条件下用磁力搅拌器不断搅拌,然后向中滴加溶液,调溶液至,使反应物充分反应;
④反应完成后,向中反应混合液中加入乙醇,生成白色沉淀,将沉淀过滤、洗涤得粗产品。
(2)仪器的名称是______,其中加入柠檬酸的作用是______,步骤④中加入乙醇,溶液的极性______(填“增强”、“减弱”或“不变”)。
(3)生成甘氨酸亚铁的化学方程式是______。
(4)体系与产率之间的关系如下表
体系 4.0 4.5 5.0 5.5 6.0 6.5 7.0 7.5
产率(%) 65.70 74.92 78.67 86.65 88.07 74.97 62.31 55.98
过高或过低,产品产率均下降的原因是:______。
(5)产品纯度测定。已知粗产品通常混有甘氨酸,称取粗产品2.2克,先加入______,搅拌、过滤、洗涤得沉淀,将沉淀配成溶液,取溶液置于锥形瓶,用的溶液滴定至终点,三次平均消耗体积为,则该样品的纯度为______。
19.党的二十大报告指出“绿水青山就是金山银山”,用化学技术治理环境问题中显得尤为重要。
(1)将和两种气体转化为合成气和,可以实现能量综合利用,对环境保护具有十分重要的意义。甲烷及二氧化碳重整涉及以下反应:
I.
II.
反应______。(用表示)
(2)一种基于吸收剂区分的同时脱硫脱硝反应的装置如图所示.反应器I吸收,反应器II吸收NO,隔绝空气反应一段时间.
①当观察到反应器I中悬浊液变澄清时,反应的离子方程式______。
②反应器II中所发生的反应为,盛有溶液最多能吸收(标准状况下)的体积为______。
(3)日本政府于2023年8月24日下午一点启动福岛核污染废水排海,引发了国际社会的广泛关注和担忧。铀(U)可用作核燃料。核废料中+6价的铀可以通过电化学还原法处理,还原为的电化学装置如图所示:
阴极发生的反应为:
阴极区溶液中发生反应:、
①阴极上发生的副反应为:______。
②阴极区溶液中加入的目的是______。
③电还原处理+6价的铀转移,阴极区减少______mol。
20.异甘草素(VII)具有抗肿瘤、抗病毒等药物功效。合成路线如下,回答下列问题:
已知:①氯甲基甲醚结构简式为:
②
(1)化合物I的名称是______,化合物II所含的官能团名称是______。
(2)IV转化为V的反应类型是______,氯甲基甲醚在全合成过程中的作用是______。
(3)写出V与新制的氢氧化铜悬浊液共热的化学反应方程式______。
(4)由化合物III、V合成化合物VI,生成的中间产物的结构简式是______。
(5)符合下列条件的分子II的同分异构体数目有______种。
①能使溶液显色;②既能发生银镜反应,又能发生水解反应
(6)结合题给信息,设计由为原料制备的合成路线(其他无机试剂任选)______。
化学参考答案
1.B 2.A 3.D 4.B 5.C 6.A 7.C 8.D 9.C 10.C 11.AC 12.B. 13.C 14.BC 15.D
16.(1) (2)bde (3)CO2、N2 NH3
电负性N
(6)或
17.(1) (2) (3)
(4)与反应,使其浓度降低,导致无法完全沉淀,同时可能产生硅酸胶状沉淀,不宜处理
生成沉淀,不能形成沉淀,导致产品中混有杂质,同时溶液中降低,导致无法完全沉淀
(5)C (6)
18.(1)打开,关闭
(2)三预烧瓶 防止亚铁离子被氧化且能抑制亚铁离子水解 减弱
(3)
(4)过高会生成,过低时很小,难以生成甘氨酸亚铁
(5)冰醋酸 92.7%
19.(1)
(2)① ②
(3)①
②消耗反应中生成的,防止与反应 ③1
20.(1)间苯二酚或1,3-苯二酚 (酚)羟基和酮羰基
(2)取代反应 保护酚羟基,防止其被破坏
(3)
(4)
(5)13
(6)
同课章节目录
