山东省日照市2023-2024学年高三上学期期中考试化学试题(含答案)
文档属性
| 名称 | 山东省日照市2023-2024学年高三上学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 982.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 21:09:36 | ||
图片预览



文档简介
日照市2023-2024学年高三上学期期中考试
化学试题2023.11
注意事项:
1.答题前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
可能用到的相对原子质量:H1 Li7 C12 O16 Si28 Cl35.5 Mn55
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.杭州亚运会备受世界瞩目。下列说法错误的是( )
A.火炬“薪火”使用的铝合金属于金属材料
B.“亚运莲花尊”的青瓷载体主要成分是二氧化硅
C.会馆使用的防滑剂主要成分石墨烯与互为同素异形体
D.主火炬塔的燃料首次使用废碳再生的绿色甲醇,有利于实现碳中和
2.实验室中下列做法错误的是( )
A.用冷水贮存白磷
B.用棕色细口试剂瓶水封保存液溴
C.用二氧化碳灭火器扑灭金属钠引发的火灾
D.用热的NaOH浓溶液洗涤试管内壁的硫单质
3.海带提碘流程如下:
上述过程中用到的玻璃仪器有( )
①酒精灯②烧杯③坩埚④分液漏斗⑤250 mL容量瓶⑥玻璃棒⑦漏斗⑧蒸发皿
A.①②④⑥⑦ B.①②③④⑤⑦ C.①②④⑥⑦⑧ D.①②③④⑥⑦
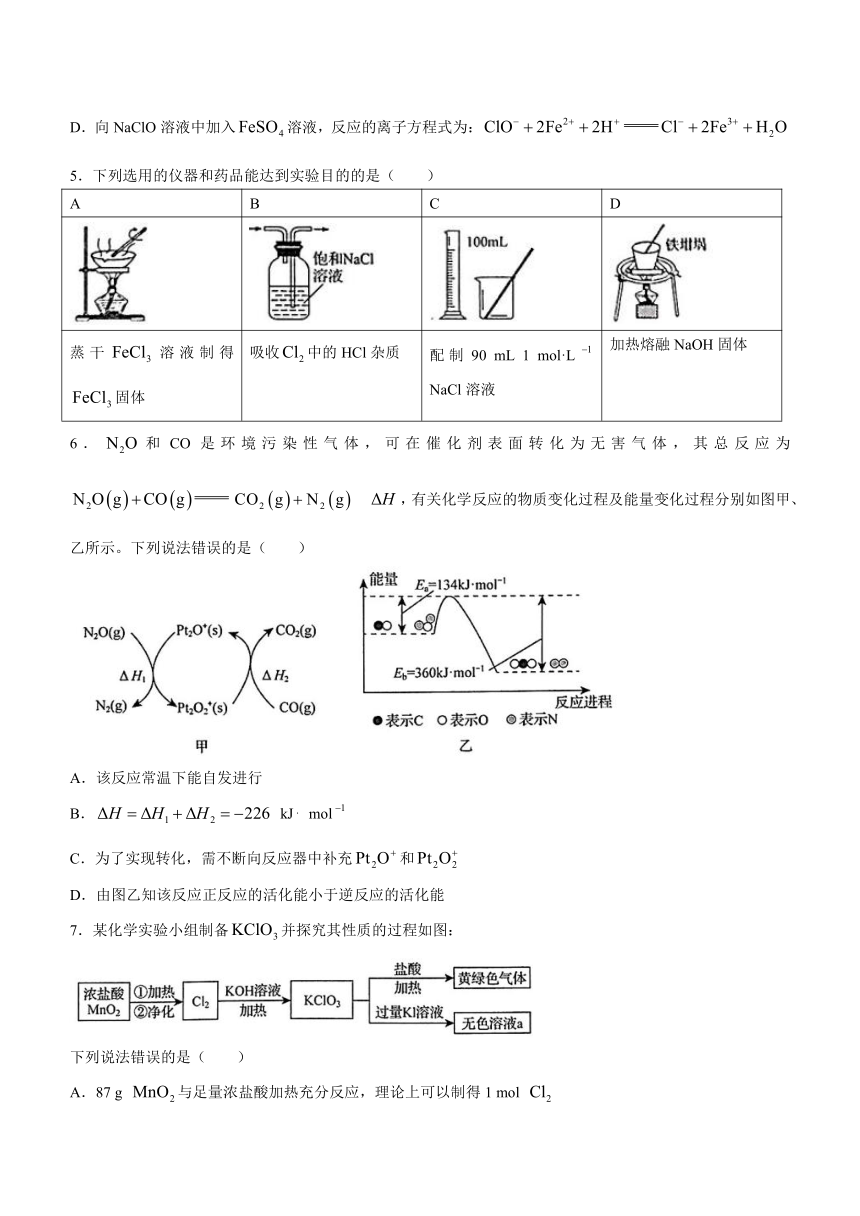
4.已知25℃时,,。下列说法正确的( )
A.0.01 mol L的NaClO溶液中,的数目小于
B.相同pH的NaClO溶液和溶液中,
C.的和的混合溶液中,
D.向NaClO溶液中加入溶液,反应的离子方程式为:
5.下列选用的仪器和药品能达到实验目的的是( )
A B C D
蒸干溶液制得固体 吸收中的HCl杂质 配制90 mL 1 mol·L NaCl溶液 加热熔融NaOH固体
6.和CO是环境污染性气体,可在催化剂表面转化为无害气体,其总反应为 ,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法错误的是( )
A.该反应常温下能自发进行
B. kJ mol
C.为了实现转化,需不断向反应器中补充和
D.由图乙知该反应正反应的活化能小于逆反应的活化能
7.某化学实验小组制备并探究其性质的过程如图:
下列说法错误的是( )
A.87 g 与足量浓盐酸加热充分反应,理论上可以制得1 mol
B.在反应中生成3 mol ,则转移电子数目为
C.上述实验说明碱性条件下氧化性:,酸性条件下氧化性:
D.取少量无色溶液a于试管中,滴加稀后,溶液呈现黄色原因是:
阅读下列材料,完成8~10题。
2023年8月29日,华为在官网宣布发售手机Mate60Pro,其芯片技术实现突破。高纯晶硅是典型的无机非金属材料,又称“半导体材料”,它的发现和使用曾引起计算机领经济建设和日常生活等方面有广泛的用途。
8.测定和混合物中的质量分数,下列实验方案不可行的是( )
A.取m g混合物充分加热,质量减少n g
B.取m g混合物与足量稀盐酸反应,加热蒸干,灼烧,得到n g固体
C.取m g混合物与足量稀硫酸反应,逸出气体用碱石灰吸收,质量增加n g
D.取m g混合物与足量溶液反应,过滤,洗涤,干燥,得到n g固体
9.高纯硅可以采用下列方法制备,下列说法正确的是( )
(纯)
A.光导纤维主要成分为Si晶体,传导光的能力非常强
B.实验室中用塑料瓶盛装HF溶液,贮存NaOH溶液的试剂瓶使用玻璃塞
C.步骤①的反应为,说明碳的非金属性比硅强
D.已知电负性,则与NaOH反应的化学方程式为
10.常温常压下为无色液体,制取过程中有少量HCl溶于其中,采用如下方法测定其纯度。取g样品经水解、干燥等预处理过程得硅酸水合物后,进行高温灼烧、冷却、称量等操作,测得所得固体氧化物质量为g。则样品中的纯度为()
A. B.
C. D.
二、选择题:本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
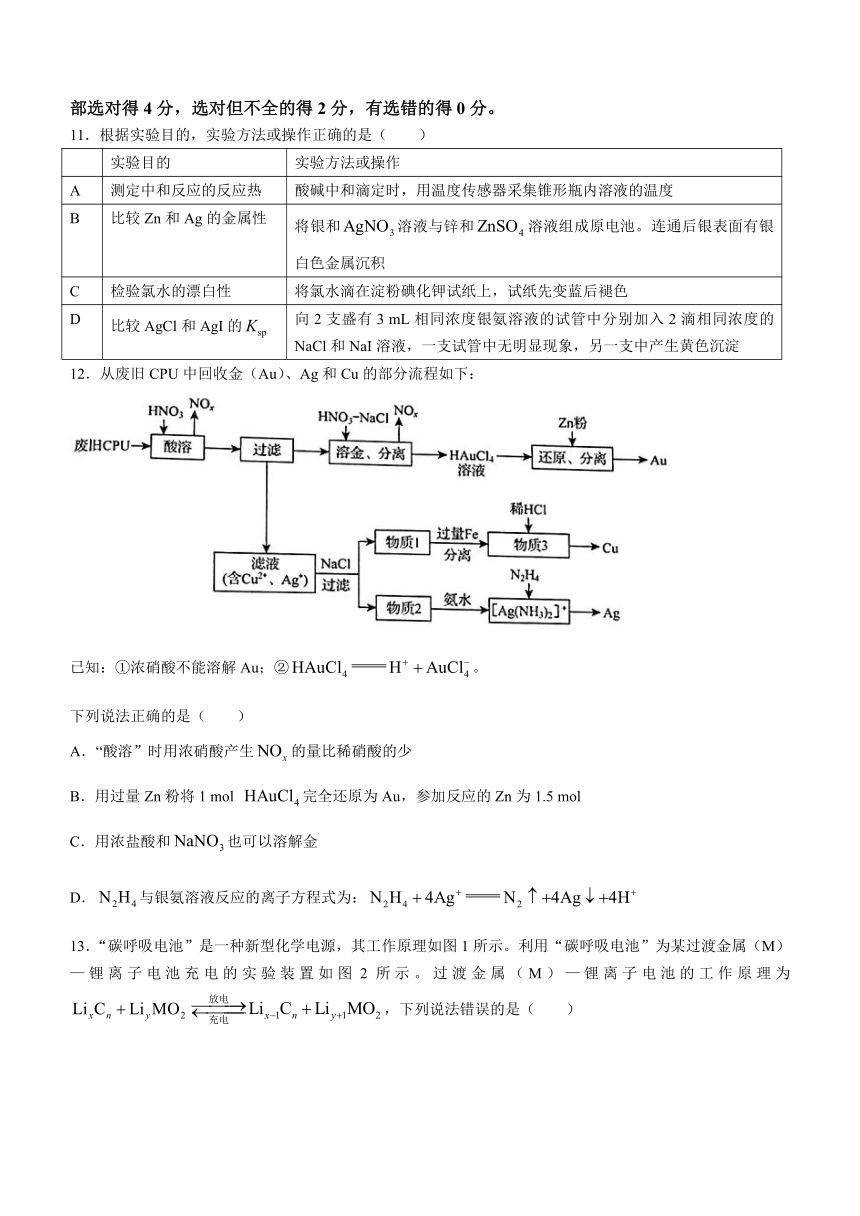
11.根据实验目的,实验方法或操作正确的是( )
实验目的 实验方法或操作
A 测定中和反应的反应热 酸碱中和滴定时,用温度传感器采集锥形瓶内溶液的温度
B 比较Zn和Ag的金属性 将银和溶液与锌和溶液组成原电池。连通后银表面有银白色金属沉积
C 检验氯水的漂白性 将氯水滴在淀粉碘化钾试纸上,试纸先变蓝后褪色
D 比较AgCl和AgI的 向2支盛有3 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液,一支试管中无明显现象,另一支中产生黄色沉淀
12.从废旧CPU中回收金(Au)、Ag和Cu的部分流程如下:
已知:①浓硝酸不能溶解Au;②。
下列说法正确的是( )
A.“酸溶”时用浓硝酸产生的量比稀硝酸的少
B.用过量Zn粉将1 mol 完全还原为Au,参加反应的Zn为1.5 mol
C.用浓盐酸和也可以溶解金
D.与银氨溶液反应的离子方程式为:
13.“碳呼吸电池”是一种新型化学电源,其工作原理如图1所示。利用“碳呼吸电池”为某过渡金属(M)—锂离子电池充电的实验装置如图2所示。过渡金属(M)—锂离子电池的工作原理为,下列说法错误的是( )
图1 图2
A.b接“呼吸电池”的铝电极
B.电极q的反应式为:
C.过渡金属(M)一锂离子电池的电解质不能用水溶液,但可用离子液体
D.“碳呼吸电池”得到1 mol 时,电极p质量减少21 g
14.向一绝热恒容密闭容器中通入和发生反应:,反应速率随时间的变化如图所示。下列说法错误的是( )
A.该反应
B.甲醇的浓度:c>d
C.若,则甲醇的生成量段小于段
D.体系平均摩尔质量不再变化时,说明反应达到平衡状态
15.乙二胺(,简写为X)为二元弱碱。25时,向0.1 mol L其盐酸盐溶液中加入等浓度的NaOH溶液(溶液体积变化忽略不计),体系中、、X三种粒子的物质的量浓度及pH变化如图所示。下列说法正确的是( )
A.该二元弱碱的第一步电离常数约为
B.时,
C. L时,
D. L时,
三、非选择题:本题共5小题,共60分。
16.(12分)25℃时,某些物质的常数如下表:
物质
常数
回答下列问题:
(1)为证明HClO是弱酸,甲、乙、丙三位同学分别设计如下实验:
①甲同学取10mL未知浓度的HClO溶液,测其pH为a,稀释至100 mL,再测其pH为b。若HClO为弱酸,则a、b应满足的关系是a②乙同学用pH计测得室温下0.01 mol L的HClO溶液的pH为4.70,则室温下HClO的电离平衡常数为______。
③丙同学用pH计测NaClO溶液的pH,若______,则说明HClO是弱酸。向NaClO溶液中通入少量的化学方程式为____________。
(2)25℃时,向20 mL 0.10 mol L 溶液中滴加0.10 mol L 溶液,发生反应的离子方程式为____________。
(3)25℃时,向20 mL 0.10 mol L 溶液中加入80 mL 0.10 mol L 溶液(混合后溶液体积变化忽略不计),此时溶液中的______。
17.(12分)可以用于治疗急性早幼粒细胞白血病。由废料(主要成分为、GaAs、)提取回收和单质Ga的部分工艺流程如下:
已知:镓与铝均为第IIIA族元素,化学性质类似。
回答下列问题:
(1)“焙烧”操作中,转化为,则1 mol ,转移电子的数目为______。
(2)“滤渣I”的主要成分为______。
(3)“碱浸氧化”操作中发生反应的化学方程式为____________。
(4)“酸溶”操作中发生反应的离子方程式为____________。
(5)“旋流电积”所得“尾液”可循环利用的是______。
(6)“还原”过程中转化为,加热使其分解为。“还原”制得0.99 kg ,则消耗标准状况下气体X的体积为______。
18.(12分)砷酸钠()可用于可逆电池,其反应原理为。以砷酸钠可逆电池为电源,用苯酚制环己酮和对苯醌的工作原理如图所示。
图1 图2 图3
回答下列问题:
(1)探究pH对氧化性的影响,测得输出电流与pH的关系如图2所示。a点时,甲池发生______反应,盐桥中______(填“向左”“向右”或“不”)移动,c点时,乙池中电极反应为____________。
(2)丙池中,催化电极p为______极(填“阴”或“阳”),电极反应式为____________。
(3)当电路中转移1 mol电子时,丙池理论上消耗苯酚的总物质的量为______。
19.(12分)四氯化锡()是合成有机锡化合物的原料,制备的装置如图所示。
有关信息如表:
化学式 Sn
熔点/℃ 232 246 -33
沸点/℃ 2260 652 114
其他性质 银白色固体金属 无色晶体,易水解生成沉淀;易被、等氧化为 无色液体,易水解生成
回答下列问题:
(1)仪器a的名称为______。
(2)甲中发生反应的离子方程式为____________。
(3)丁中反应需要通入过量的,并控制温度在232~652℃,一段时间后可以通过______现象判断丁中的反应已经完成。
(4)产物有和少量,可选用______试剂(填序号)检验;的存在。
A.稀盐酸 B.酸性高锰酸钾 C.滴有KSCN的的混合液
(5)若缺少装置丙,丁处主要副反应的化学方程式为____________。
(6)利用沉淀滴定法测定产物中的含量,方案如下:准确称取m g产品,用蒸馏水溶解后,调pH6~8,用b mol L的硝酸银标准溶液滴定,以溶液为指示剂,当产生砖红色沉淀时,消耗V mL硝酸银溶液,则产品中的物质的量为______(用含字母的表达式表示,的式量为,的式量为),若测得的含量偏高,原因是______[已知;为砖红色沉淀,]。
20.(12分)催化加氢甲烷化技术,被认为是目前循环再利用中最实用最有效的技术之一。主要发生反应:
反应Ⅰ kJ mol
反应Ⅱ kJ mol
回答下列问题:
(1) ______kJ mol ______(用、表示)。
(2)在恒容密闭容器中,通入体积比1∶4的和,发生反应Ⅰ和反应Ⅱ,测得平衡时各物质的物质的量分数随温度的变化如图1所示。
图1 图2
①图1中a表示______(填化学式)的物质的量分数变化曲线。
②M点容器中分压之比______。
③下列说法错误的是______。
A.通入反应器的气体要避免混入氧气
B.通入氩气增加体系的压强,可提高甲烷的产率
C.通过控制反应温度,可提高产物中甲烷的产率
D.其他条件不变,压缩容器体积至原来的一半,图像中新M点位置可能出现在原M点左侧
(3)某温度时,向体积不变的密闭容器中,通入1 mol 和3 mol ,发生反应Ⅰ和反应Ⅱ,测得平衡时,此时容器内气体压强是初始容器内气体压强的0.9倍。则该温度下,反应Ⅱ的化学平衡常数______。
(4)甲烷化的催化剂的催化效率和的生成效率随温度的变化关系如图2所示。250~300℃之间,的生成效率减慢的原因是______。
日照市2023-2024学年高三上学期期中考试
化学试题参考答案
2023.11
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.B 2.C 3.A 4.B 5.D 6.C 7.B 8.C 9.D 10.A
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.BD 12.C 13.AD 14.BC 15.AB
16.(12分)
(1)①(2分)②(2分)③(2分) (2分)
(2)(2分)(3) mol L(2分)
17.(12分)
(1)18(2分)(2)(2分)(3)(2分)
(4)(2分)(5)硫酸(2分)(6)224(2分)
18.(12分)
(1)氧化(2分) 向右(2分) (2分)
(2)阳(2分) (2分)(3)0.5 mol(2分)
19.(12分)
(1)蒸馏烧瓶(1分)
(2)(2分)
(3)戊中牛角管处不再有液体滴下(1分)
(4)C(2分)
(5)(2分)
(6)或(2分) 易被氧化(2分)
20.(12分)
(1)-206.2(1分) (1分)
(2)①(2分)②3∶1(2分)③BD(2分)
(3)0.1(2分)
(4)250~300℃之间,温度升高,催化剂的活性降低,的生成效率减慢(2分)
化学试题2023.11
注意事项:
1.答题前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
可能用到的相对原子质量:H1 Li7 C12 O16 Si28 Cl35.5 Mn55
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.杭州亚运会备受世界瞩目。下列说法错误的是( )
A.火炬“薪火”使用的铝合金属于金属材料
B.“亚运莲花尊”的青瓷载体主要成分是二氧化硅
C.会馆使用的防滑剂主要成分石墨烯与互为同素异形体
D.主火炬塔的燃料首次使用废碳再生的绿色甲醇,有利于实现碳中和
2.实验室中下列做法错误的是( )
A.用冷水贮存白磷
B.用棕色细口试剂瓶水封保存液溴
C.用二氧化碳灭火器扑灭金属钠引发的火灾
D.用热的NaOH浓溶液洗涤试管内壁的硫单质
3.海带提碘流程如下:
上述过程中用到的玻璃仪器有( )
①酒精灯②烧杯③坩埚④分液漏斗⑤250 mL容量瓶⑥玻璃棒⑦漏斗⑧蒸发皿
A.①②④⑥⑦ B.①②③④⑤⑦ C.①②④⑥⑦⑧ D.①②③④⑥⑦
4.已知25℃时,,。下列说法正确的( )
A.0.01 mol L的NaClO溶液中,的数目小于
B.相同pH的NaClO溶液和溶液中,
C.的和的混合溶液中,
D.向NaClO溶液中加入溶液,反应的离子方程式为:
5.下列选用的仪器和药品能达到实验目的的是( )
A B C D
蒸干溶液制得固体 吸收中的HCl杂质 配制90 mL 1 mol·L NaCl溶液 加热熔融NaOH固体
6.和CO是环境污染性气体,可在催化剂表面转化为无害气体,其总反应为 ,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法错误的是( )
A.该反应常温下能自发进行
B. kJ mol
C.为了实现转化,需不断向反应器中补充和
D.由图乙知该反应正反应的活化能小于逆反应的活化能
7.某化学实验小组制备并探究其性质的过程如图:
下列说法错误的是( )
A.87 g 与足量浓盐酸加热充分反应,理论上可以制得1 mol
B.在反应中生成3 mol ,则转移电子数目为
C.上述实验说明碱性条件下氧化性:,酸性条件下氧化性:
D.取少量无色溶液a于试管中,滴加稀后,溶液呈现黄色原因是:
阅读下列材料,完成8~10题。
2023年8月29日,华为在官网宣布发售手机Mate60Pro,其芯片技术实现突破。高纯晶硅是典型的无机非金属材料,又称“半导体材料”,它的发现和使用曾引起计算机领经济建设和日常生活等方面有广泛的用途。
8.测定和混合物中的质量分数,下列实验方案不可行的是( )
A.取m g混合物充分加热,质量减少n g
B.取m g混合物与足量稀盐酸反应,加热蒸干,灼烧,得到n g固体
C.取m g混合物与足量稀硫酸反应,逸出气体用碱石灰吸收,质量增加n g
D.取m g混合物与足量溶液反应,过滤,洗涤,干燥,得到n g固体
9.高纯硅可以采用下列方法制备,下列说法正确的是( )
(纯)
A.光导纤维主要成分为Si晶体,传导光的能力非常强
B.实验室中用塑料瓶盛装HF溶液,贮存NaOH溶液的试剂瓶使用玻璃塞
C.步骤①的反应为,说明碳的非金属性比硅强
D.已知电负性,则与NaOH反应的化学方程式为
10.常温常压下为无色液体,制取过程中有少量HCl溶于其中,采用如下方法测定其纯度。取g样品经水解、干燥等预处理过程得硅酸水合物后,进行高温灼烧、冷却、称量等操作,测得所得固体氧化物质量为g。则样品中的纯度为()
A. B.
C. D.
二、选择题:本题共5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.根据实验目的,实验方法或操作正确的是( )
实验目的 实验方法或操作
A 测定中和反应的反应热 酸碱中和滴定时,用温度传感器采集锥形瓶内溶液的温度
B 比较Zn和Ag的金属性 将银和溶液与锌和溶液组成原电池。连通后银表面有银白色金属沉积
C 检验氯水的漂白性 将氯水滴在淀粉碘化钾试纸上,试纸先变蓝后褪色
D 比较AgCl和AgI的 向2支盛有3 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液,一支试管中无明显现象,另一支中产生黄色沉淀
12.从废旧CPU中回收金(Au)、Ag和Cu的部分流程如下:
已知:①浓硝酸不能溶解Au;②。
下列说法正确的是( )
A.“酸溶”时用浓硝酸产生的量比稀硝酸的少
B.用过量Zn粉将1 mol 完全还原为Au,参加反应的Zn为1.5 mol
C.用浓盐酸和也可以溶解金
D.与银氨溶液反应的离子方程式为:
13.“碳呼吸电池”是一种新型化学电源,其工作原理如图1所示。利用“碳呼吸电池”为某过渡金属(M)—锂离子电池充电的实验装置如图2所示。过渡金属(M)—锂离子电池的工作原理为,下列说法错误的是( )
图1 图2
A.b接“呼吸电池”的铝电极
B.电极q的反应式为:
C.过渡金属(M)一锂离子电池的电解质不能用水溶液,但可用离子液体
D.“碳呼吸电池”得到1 mol 时,电极p质量减少21 g
14.向一绝热恒容密闭容器中通入和发生反应:,反应速率随时间的变化如图所示。下列说法错误的是( )
A.该反应
B.甲醇的浓度:c>d
C.若,则甲醇的生成量段小于段
D.体系平均摩尔质量不再变化时,说明反应达到平衡状态
15.乙二胺(,简写为X)为二元弱碱。25时,向0.1 mol L其盐酸盐溶液中加入等浓度的NaOH溶液(溶液体积变化忽略不计),体系中、、X三种粒子的物质的量浓度及pH变化如图所示。下列说法正确的是( )
A.该二元弱碱的第一步电离常数约为
B.时,
C. L时,
D. L时,
三、非选择题:本题共5小题,共60分。
16.(12分)25℃时,某些物质的常数如下表:
物质
常数
回答下列问题:
(1)为证明HClO是弱酸,甲、乙、丙三位同学分别设计如下实验:
①甲同学取10mL未知浓度的HClO溶液,测其pH为a,稀释至100 mL,再测其pH为b。若HClO为弱酸,则a、b应满足的关系是a
③丙同学用pH计测NaClO溶液的pH,若______,则说明HClO是弱酸。向NaClO溶液中通入少量的化学方程式为____________。
(2)25℃时,向20 mL 0.10 mol L 溶液中滴加0.10 mol L 溶液,发生反应的离子方程式为____________。
(3)25℃时,向20 mL 0.10 mol L 溶液中加入80 mL 0.10 mol L 溶液(混合后溶液体积变化忽略不计),此时溶液中的______。
17.(12分)可以用于治疗急性早幼粒细胞白血病。由废料(主要成分为、GaAs、)提取回收和单质Ga的部分工艺流程如下:
已知:镓与铝均为第IIIA族元素,化学性质类似。
回答下列问题:
(1)“焙烧”操作中,转化为,则1 mol ,转移电子的数目为______。
(2)“滤渣I”的主要成分为______。
(3)“碱浸氧化”操作中发生反应的化学方程式为____________。
(4)“酸溶”操作中发生反应的离子方程式为____________。
(5)“旋流电积”所得“尾液”可循环利用的是______。
(6)“还原”过程中转化为,加热使其分解为。“还原”制得0.99 kg ,则消耗标准状况下气体X的体积为______。
18.(12分)砷酸钠()可用于可逆电池,其反应原理为。以砷酸钠可逆电池为电源,用苯酚制环己酮和对苯醌的工作原理如图所示。
图1 图2 图3
回答下列问题:
(1)探究pH对氧化性的影响,测得输出电流与pH的关系如图2所示。a点时,甲池发生______反应,盐桥中______(填“向左”“向右”或“不”)移动,c点时,乙池中电极反应为____________。
(2)丙池中,催化电极p为______极(填“阴”或“阳”),电极反应式为____________。
(3)当电路中转移1 mol电子时,丙池理论上消耗苯酚的总物质的量为______。
19.(12分)四氯化锡()是合成有机锡化合物的原料,制备的装置如图所示。
有关信息如表:
化学式 Sn
熔点/℃ 232 246 -33
沸点/℃ 2260 652 114
其他性质 银白色固体金属 无色晶体,易水解生成沉淀;易被、等氧化为 无色液体,易水解生成
回答下列问题:
(1)仪器a的名称为______。
(2)甲中发生反应的离子方程式为____________。
(3)丁中反应需要通入过量的,并控制温度在232~652℃,一段时间后可以通过______现象判断丁中的反应已经完成。
(4)产物有和少量,可选用______试剂(填序号)检验;的存在。
A.稀盐酸 B.酸性高锰酸钾 C.滴有KSCN的的混合液
(5)若缺少装置丙,丁处主要副反应的化学方程式为____________。
(6)利用沉淀滴定法测定产物中的含量,方案如下:准确称取m g产品,用蒸馏水溶解后,调pH6~8,用b mol L的硝酸银标准溶液滴定,以溶液为指示剂,当产生砖红色沉淀时,消耗V mL硝酸银溶液,则产品中的物质的量为______(用含字母的表达式表示,的式量为,的式量为),若测得的含量偏高,原因是______[已知;为砖红色沉淀,]。
20.(12分)催化加氢甲烷化技术,被认为是目前循环再利用中最实用最有效的技术之一。主要发生反应:
反应Ⅰ kJ mol
反应Ⅱ kJ mol
回答下列问题:
(1) ______kJ mol ______(用、表示)。
(2)在恒容密闭容器中,通入体积比1∶4的和,发生反应Ⅰ和反应Ⅱ,测得平衡时各物质的物质的量分数随温度的变化如图1所示。
图1 图2
①图1中a表示______(填化学式)的物质的量分数变化曲线。
②M点容器中分压之比______。
③下列说法错误的是______。
A.通入反应器的气体要避免混入氧气
B.通入氩气增加体系的压强,可提高甲烷的产率
C.通过控制反应温度,可提高产物中甲烷的产率
D.其他条件不变,压缩容器体积至原来的一半,图像中新M点位置可能出现在原M点左侧
(3)某温度时,向体积不变的密闭容器中,通入1 mol 和3 mol ,发生反应Ⅰ和反应Ⅱ,测得平衡时,此时容器内气体压强是初始容器内气体压强的0.9倍。则该温度下,反应Ⅱ的化学平衡常数______。
(4)甲烷化的催化剂的催化效率和的生成效率随温度的变化关系如图2所示。250~300℃之间,的生成效率减慢的原因是______。
日照市2023-2024学年高三上学期期中考试
化学试题参考答案
2023.11
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.B 2.C 3.A 4.B 5.D 6.C 7.B 8.C 9.D 10.A
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.BD 12.C 13.AD 14.BC 15.AB
16.(12分)
(1)①(2分)②(2分)③(2分) (2分)
(2)(2分)(3) mol L(2分)
17.(12分)
(1)18(2分)(2)(2分)(3)(2分)
(4)(2分)(5)硫酸(2分)(6)224(2分)
18.(12分)
(1)氧化(2分) 向右(2分) (2分)
(2)阳(2分) (2分)(3)0.5 mol(2分)
19.(12分)
(1)蒸馏烧瓶(1分)
(2)(2分)
(3)戊中牛角管处不再有液体滴下(1分)
(4)C(2分)
(5)(2分)
(6)或(2分) 易被氧化(2分)
20.(12分)
(1)-206.2(1分) (1分)
(2)①(2分)②3∶1(2分)③BD(2分)
(3)0.1(2分)
(4)250~300℃之间,温度升高,催化剂的活性降低,的生成效率减慢(2分)
同课章节目录
