第一章第一节 物质的分类及转化 课件 (共55页)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第一章第一节 物质的分类及转化 课件 (共55页)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 48.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 21:25:02 | ||
图片预览








文档简介
(共55张PPT)
第一章
化学物质及其变化
氧化物:氧元素与另外一种化学元素组成的二元化合物。
碱性氧化物:溶于水只生成一种碱或与酸反应生成盐和水的氧化物。均为金属氧化物。
酸性氧化物:一类能与水作用生成相应价态的酸或与碱作用只生成一种相应价态盐和水的氧化物。大多数非金属氧化物,某些过渡元素的高价氧化物,如Mn2O7。
酸:电解质电离时所生成的正离子全部是氢离子的化合物。
碱:电解质电离时所产生的负离子全部是氢氧根离子。
盐:金属离子或铵根离子与酸根离子或非金属离子所组成的化合物。
电解质:在水溶液里或熔融状态下能够导电的化合物叫作电解质。
酸根离子:酸电离时产生的阴离子。
有机化合物:主要是指碳元素,氢元素组成,一定是含碳的化合物。但是不包括碳的氧化物和硫化物,碳酸,碳酸盐等。
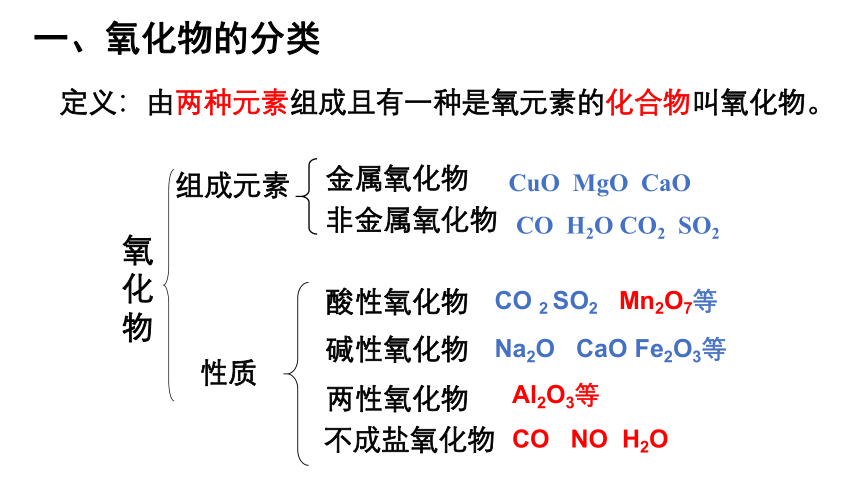
一、氧化物的分类
碱性氧化物
金属氧化物
非金属氧化物
氧化物
CuO MgO CaO
CO H2O CO2 SO2
组成元素
性质
酸性氧化物
两性氧化物
不成盐氧化物
定义:由两种元素组成且有一种是氧元素的化合物叫氧化物。
CO 2 SO2 Mn2O7等
Na2O CaO Fe2O3等
Al2O3等
CO NO H2O
思考1:H2O、CO、NO是酸性氧化物吗?
酸性氧化物一般都是非金属氧化物,还有少数金属氧化物(比如Mn2O7)
而非金属氧化物不一定都是酸性氧化物(比如H2O、CO、NO等)
思考2:碱性氧化物一般都是金属氧化物,
金属氧化物一定是碱性氧化物吗?
碱性氧化物都是金属氧化物,
而金属氧化物不一定都是碱性氧化物(比如Al2O3)
不是
不一定
思考:
(1)碱性氧化物和酸性氧化物的判断方法?
①酸性氧化物
①和H2O反应生成相应的酸
②和碱反应生成盐和H2O
②碱性氧化物
①和H2O反应生成碱
②和酸反应生成盐和H2O
CaO + 2HCl = CaCl2 + H2O
Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
CO2 + Ca(OH)2 (足量) = CaCO3↓ + H2O
CO2 + 2NaOH (足量) = Na2CO3 + H2O
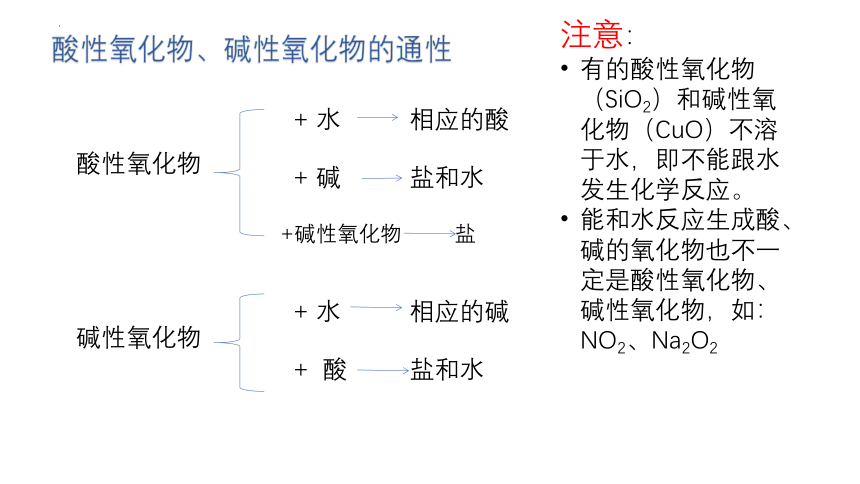
酸性氧化物、碱性氧化物的通性
酸性氧化物
碱性氧化物
+ 水 相应的酸
+ 碱 盐和水
+碱性氧化物 盐
+ 水 相应的碱
+ 酸 盐和水
注意:
有的酸性氧化物(SiO2)和碱性氧化物(CuO)不溶于水,即不能跟水发生化学反应。
能和水反应生成酸、碱的氧化物也不一定是酸性氧化物、碱性氧化物,如:NO2、Na2O2
③两性氧化物:
④不成盐氧化物
含义:不能与酸或碱反应生成盐和水的氧化物。
如CO、NO、H2O等
含义:既能与酸又能与碱反应生成盐和水的氧化物。
如Al2O3
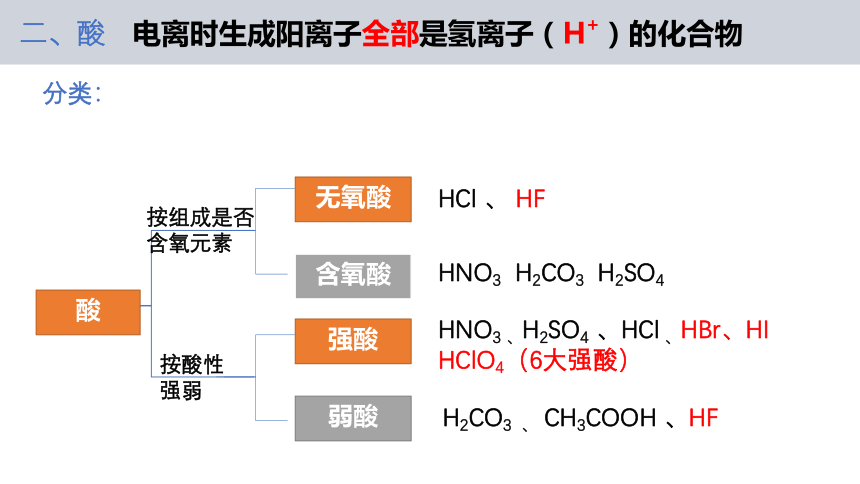
酸
强酸
弱酸
按组成是否含氧元素
按酸性强弱
无氧酸
含氧酸
HCl 、 HF
HNO3 H2CO3 H2SO4
HNO3 、H2SO4 、HCl 、HBr、HI
HClO4(6大强酸)
H2CO3 、 CH3COOH 、HF
二、酸
电离时生成阳离子全部是氢离子(H+)的化合物
分类:
1、已知NaHSO4在水中能电离出钠离子、氢离子和硫酸根离子,NaHSO4= Na+ +H++SO42-,问NaHSO4属于酸吗?
3、已知H3PO2(次磷酸)与足量的氢氧化钠中和,生成的盐的化学式为NaH2PO2.
问:H3PO2(次磷酸)属于几元酸? 元。
2、已知醋酸电离方程式为:CH3COOH CH3COO- + H+,问:醋酸属于几元酸? 元。
一
一
不是,因为电离出来的阳离子还有钠离子,故不符合酸的定义,不属于酸。像这样含有可电离氢离子的盐叫做酸式盐。
思考:
练一练
1、下列各组物质中按单质、化合物、混合物顺序排列的( )
A、氧气 碱式碳酸铜 空气
B、胆矾 矿泉水 氖气
C、水银 水煤气 冰水混合物
D、稀硫酸 火碱 金刚石
A
(CU2(OH)2CO3)
(主要成份H2,CO)
11
练习2、下列说法正确的是( )
(A)酸性氧化物一定是非金属氧化物
(B)非金属氧化物一定是酸性氧化物
(C)金属氧化物一定是碱性氧化物
(D)碱性氧化物一定是金属氧化物
注:酸酐与对应酸中的化合价必须一致。
练习3、找出下列含氧酸对应的酸酐(酸性氧化物):
①H2CO3 ② H2SO3 ③ H2SO4 ④HNO3 ⑤HNO2
D
CO2 SO2 SO3 N2 O5 N2 O3
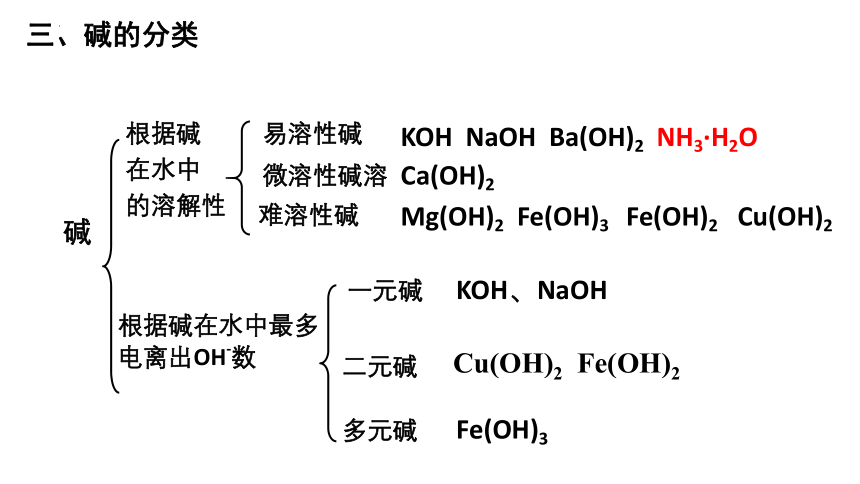
三、碱的分类
KOH NaOH Ba(OH)2 NH3·H2O
Mg(OH)2 Fe(OH)3 Fe(OH)2 Cu(OH)2
根据碱
在水中
的溶解性
碱
根据碱在水中最多电离出OH-数
一元碱
二元碱
多元碱
KOH、NaOH
Cu(OH)2 Fe(OH)2
Fe(OH)3
易溶性碱
难溶性碱
微溶性碱溶
Ca(OH)2
盐
根据酸根是否含氧元素
含氧酸盐
无氧酸盐
Na2CO3
NaCl
根据盐在水中的溶解性
可溶性盐
难溶性盐
根据组成盐的阴阳离子不同
酸式盐
碱式盐
正盐
四、盐的分类
钠盐、钾盐
BaSO4 AgCl
Na2CO3
NaHCO3 NaHSO4、KHCO3
Cu2(OH)2CO3
氧化物:氧元素与另外一种化学元素组成的二元化合物。
碱性氧化物:溶于水只生成一种碱或与酸反应生成盐和水的氧化物。均为金属氧化物。
酸性氧化物:一类能与水作用生成相应价态的酸或与碱作用只生成一种相应价态盐和水的氧化物。大多数非金属氧化物,某些过渡元素的高价氧化物,如Mn2O7。
酸:电解质电离时所生成的正离子全部是氢离子的化合物。
碱:电解质电离时所产生的负离子全部是氢氧根离子。
盐:金属离子或铵根离子与酸根离子或非金属离子所组成的化合物。
电解质:在水溶液里或熔融状态下能够导电的化合物叫作电解质。
酸根离子:酸电离时产生的阴离子。
有机化合物:主要是指碳元素,氢元素组成,一定是含碳的化合物。但是不包括碳的氧化物和硫化物,碳酸,碳酸盐等。
溶液是一种或几种物质分散到另一种物质里 ,形成的均一 、稳定的混合物
悬浊液是固体小颗粒分散在液体中形成的混合物
乳浊液是液体小液滴分散在液体里形成的混合物 。
回顾旧知
化学反应的四大基本反应类型
根据反应物、生成物的种类及数量分为:
1.化合反应:两种或两种以上物质反应生成一种化合物的反应。
2.分解反应:一种化合物反应生成两种或两种以上物质的反应。
3.置换反应:一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
4.复分解反应:两种化合物互相交换成分生成另外两种化合物的反应。
思考:化学反应的四种基本类型有哪些?分类标准是什么?
性质 反应方程式
(1)遇酸碱指示剂变色
(2)与活泼金属反应生成盐和氢气
(3)与碱性氧化物反应生成盐和水
(4)与碱反应生成相应的盐和水
(5)与某些盐反应生成新盐和新酸
1. 酸的通性
任务一 基于物质分类的物质性质模型建构
紫色石蕊试液—显红色,酚酞试液—显无色
H2SO4+Zn=ZnSO4+ H2↑
2HCl+CuO=CuCl2+ H2O
HCl+NaOH=NaCl+ H2O
HCl+AgNO3=AgCl↓+HNO3
性质 反应方程式
(1)遇酸碱指示剂变色
(2)与酸性氧化物反应生成盐和水
(3)与酸反应生成相应的盐和水
(4)与某些盐反应生成新盐和新碱
2. 碱的通性
任务一基于物质分类的物质性质模型建构
紫色石蕊试液变蓝,酚酞试液变红
2NaOH+CO2=Na2CO3+ H2O
NaOH+HNO3=NaNO3+ H2O
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
性质 反应方程式
(1)与金属反应生成新盐和新金属(除K、Ca、Na)
(2)与酸反应生成新盐和新酸
(3)与碱反应生成新盐和新碱
(4)与盐反应生成两种新盐
3. 盐的通性
任务一 基于物质分类的物质性质模型建构
Fe+CuSO4=Cu+FeSO4
Na2CO3+2HCl=2NaCl+H2O+CO2↑
MgCl2+2NaOH=2NaCl+Mg(OH)2↓
2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2
4. 酸性氧化物的通性
性质 反应方程式
(1)部分能与水反应生成酸
(2)能与碱性氧化物反应生成盐
(3)能与碱反应生成盐和水
(4)能与某些盐反应
任务一基于物质分类的物质性质模型建构
H2O+CO2=H2CO3
CaO+CO2=CaCO3
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+CaCO3+H2O=Ca(HCO3)2
5. 碱性氧化物的通性
性质 反应方程式
(1)部分能与水反应生成碱
(2)能与酸性氧化物反应生成盐
(3)能与酸反应生成盐和水
(4)能与某些盐反应
任务一基于物质分类的物质性质模型建构
H2O+CaO=Ca(OH)2
Na2O+CO2=Na2CO3
MgO+2HCl=MgCl2+ H2O
H2O+CaO+Na2CO3=2NaHCO3
任务二 基于模型认知的物质转化关系建构
活动1、写出下列物质之间转化的化学方程式,体会由金属单质到盐、非金属单质到盐的转化关系
Ca → CaO → Ca(OH)2 → CaSO4
C → CO2 → H2CO3 → CaCO3
对上述转化关系,从物质分类的角度看,你发现了什么规律?
将你的想法与同学交流。
活动2 Na及化合物与S及化合物两两之间哪些物质可能发生反应?
任务二 基于模型认知的物质转化关系建构
思考:根据上述转化图分析工业生产中我们如何制取NaOH
工业生产中的其他因素:
原料来源、成本高低、设备要求和环保要求等。
方案1:Na2O + H2O →NaOH
方案2:Na2CO3+Ca(OH) →NaOH
实际方案:NaCl + H2O NaOH
任务三 基于物质转化关系的物质制备
练习1 下列各组物质之间可以按如图所示关系直接转化的是
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
D
一、分散系
1. 定义:
把一种或多种物质分散在另一种或多种物质中得到的混合体系
2. 组成:分散质:分散系中___________的物质;
分散剂:分散系中_____________的物质。
被分散
容纳分散质
一般规律:
1.分散系中有水,水是分散剂;
2.分散系中是两种液体(没有水),量多的是分散剂。
固
气
液
固
思考!根据分散质和分散剂的所处状态分类,总共可以得到几种分散系?
气
液
9种
分散质
分散剂
一、分散系
(2)按粒子直径大小分:分散系分为
溶液、胶体和浊液的本质区别:
分散质粒子直径的大小
溶液、胶体和浊液
1nm=10-9m
(1)定义:分散质粒子直径介于1~100nm( 10-9~10-7m)之间的分散系。
注:胶体的分散质粒子又称胶粒。一般胶粒是若干个粒子组成的集合体
二、胶体
(2)、胶体的分类
二、胶体
胶体
根据分散剂的状态分类
根据胶体粒子的组成分类
气溶胶:烟,云,雾
液溶胶:豆浆,墨水
固溶胶:烟水晶,有色玻璃
粒子胶体:胶粒由许多小粒子聚集而成
如: Fe(OH)3胶体
分子胶体:胶粒为单个有机高分子
如:淀粉胶体
1个Fe(OH)3
粒子
1个Fe(OH)3
胶粒
Fe(OH)3胶体
*1.不写沉淀符号
2.不再与生成的HCl反应
①HCl浓度小;②加热时,HCl易挥发;③Fe(OH)3 胶粒的表面吸有其它粒子的膜,受保护
实验原理
3.需要带上加热符号
①用蒸馏水:不能用自来水,目的防止生成氢氧化铁沉淀
②用饱和溶液:不用稀溶液,目的制得浓度较大的氢氧化铁胶体
要加热:为了加快反应的速率,但当溶液呈红褐色时,要停止加热,目的防止生成氢氧化铁沉淀
不能搅拌:目的防止氢氧化铁胶体粒子碰撞大颗粒形成沉淀
不能用Fe(OH)3溶于水或向FeCl3溶液中加NaOH溶液制取
实验注意事项
胶体的其他性质
1、电泳(电学性质)
定义:在外加电场的条件下,胶体粒子向直流电源的正极或负极定向移动的现象
产生原因:胶体分散质粒子细小而具有较大的表面积,能较强地吸附离子,从而形成带电粒子,在外加电场的作用下会发生定向移动。
电泳的应用:
①静电除尘;
②电泳电镀:
利用电泳将油漆、乳胶、橡胶等粒子均匀地沉积在镀件上。
悬浮在水中的小颗粒做不停地、无秩序地运动,这种现象叫做布朗运动。
布朗运动
胶体粒子也做布朗运动。
3、胶体的介稳性
胶体在一定条件下能稳定存在,属于介稳体系;
胶体粒子可以通过吸附带电粒子而带有电荷,同种胶体粒子的电性相同,他们之间相互排斥阻碍了胶体粒子聚集成更大的颗粒,因此胶体具有介稳性
胶体的布朗运动也使得胶体粒子不易聚集成质量较大的颗粒而沉降下来,使其具有介稳性。
4、胶体的聚沉
定义:使胶体粒子凝聚成更大的颗粒,形成沉淀,从分散剂里析出的过程叫胶体的聚沉
要使胶体凝聚成沉淀,就要减少或消除胶体微粒表面吸附的电荷,使之减弱或失去电性排斥力作用,从而使胶粒在运动中碰撞结合成更大的颗粒。
Q1:胶体为什么能够稳定存在?
胶粒带电,互相排斥(介稳性)
Q2:如何破坏胶体的稳定状态?
胶体聚沉的方法:
1、加入电解质
向胶体中加入盐时,其中的阳离子或阴离子能中和分散质微粒所带的电荷,从而使分散质聚集成较大的微粒,在重力作用下形成沉淀析出。这种胶体形成沉淀析出的现象称为胶体的聚沉。
胶体聚沉的方法:
如由豆浆做豆腐时,在一定温度下,加入CaSO4(或其他电解质溶液),豆浆中的胶体粒子带的电荷被中和,其中的粒子很快聚集而形成胶冻状的豆腐(称为凝胶)。
想一想,为什么江河进入大海处容易形成沙洲?
也可以起到和加入电解质同样的作用,使胶体聚沉。
如把Fe(OH)3胶体加入硅酸胶体中,两种胶体均会发生凝聚。
胶体聚沉的方法:
2、加入带相反电荷的胶体
也可以起到和加入电解质同样的作用,使胶体聚沉。
如把Fe(OH)3胶体加入硅酸胶体中,两种胶体均会发生凝聚。
带正电荷胶粒 带负电荷胶粒
金属氢氧化物 金属氧化物 金属硫化物(如Sb2S3)
非金属硫化物(如As2S3)
非金属氧化物(如SiO2泥沙)
硅酸盐(土壤和水泥)
也可以起到和加入电解质同样的作用,使胶体聚沉。
如把Fe(OH)3胶体加入硅酸胶体中,两种胶体均会发生凝聚。
胶体聚沉的方法:
3、加热
加热胶体,能量升高,胶粒运动加剧,它们之间碰撞机会增多,而使胶核对离子的吸附作用减弱,即减弱胶体的稳定因素,导致胶体凝聚。
如长时间加热时,Fe(OH)3胶体就发生凝聚而出现红褐色沉淀。
过滤后的现象
Fe(OH)3胶体
泥水
滤纸上无滤渣,滤液颜色不变
由浑浊变澄清,滤纸上有不溶物
结论:胶体粒子能透过滤纸,而悬浊液的分散质粒子无法通过滤纸。
将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象。
二、胶体
科学探究
思考:如何分离胶体和溶液?
半透膜:半透膜是一种孔隙比滤纸更小,可以让小分子或离子通过,大分子不能通过的一类膜的总称
一定时间之后,
烧杯中能够检测出的是:
检测不出的是:
盛有淀粉胶体和食盐溶液的半透膜浸在蒸馏水中
氯化钠
淀粉
4、胶体的渗析
定义:
渗析就是利用小分子和小离子能透过半透膜,但胶体粒子不能透过半透膜的性质,从而将溶胶中除掉作为杂质的小分子或离子的过程。
化学中常见的半透膜:羊皮纸、膀胱膜;细胞膜、人工制造的胶棉薄膜等。
分散系 溶液 胶体 浊液
悬浊液 乳浊液
分散质粒子大小
分散质粒子组成
特点
稳定性
能否透过滤纸
能否透过半透膜
实例
1nm~100nm
>100nm
>100nm
巨大数目分子聚集成的小液滴
巨大数目分子聚集成的固体小颗粒
许多分子的集合体或大分子
分子、离子
均一
不均一、不透明
不均一、不透明
均一
不稳定
不稳定
较稳定
稳定
能
能
不能
不能
不能
不能
不能
能
食盐水
豆浆
泥水、石灰乳
油水混合物
<1nm
常见胶体:
Fe(OH)3胶体、AgI胶体、淀粉胶体(溶液)、蛋白质胶体(溶液)、牛奶、豆浆、土壤、有色玻璃、云、雾、烟、墨水、血液、肥皂水等
练一练
1、FeCl3溶液和Fe(OH)3胶体具有的共同性质是( )
A.都能透过滤纸 B.都呈红褐色
C.具有相同的颗粒直径 D.都存在布朗运动
A
练一练
2、下列事实与胶体性质无关的是( )
A.在豆浆里加入盐卤做豆腐
B.在河流入海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到 一束光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
D
练一练
3、胶体的最本质的特征是( )
A.丁达尔效应
B.可以通过滤纸
C.布朗运动
D.分散质颗粒的直径在1nm~100nm之间
D
练一练
4、区别溶液和胶体的最简单的方法是( )
A.观察外观 B.丁达尔效应
C.布朗运动 D.加热
B
练一练
1、下列物质属于混合物的是( )
A、蒸馏水
B、氯酸钾和二氧化锰混合加热完全反应后试管中剩余物质
C、含铁70% 的三氧化二铁样品
D、硫酸氢钠
B
酸 碱 盐
A H2SO4 CaCO3 BaCO3
B HClO KOH NaHCO3
C CH3COOH Na2CO3 CaCl2
D NaHSO4 NH3·H2O NaCl
2、下表中关于物质的分类正确的是( )
B
4、下列各物质的名称(或俗名)、化学式、分类都正确的是( )
A.氢氧化钙;Ca(OH)2 ;碱性氧化物
B.二氧化碳;CO2;酸性氧化物
C.硫酸;H2S;酸
D.烧碱;Na2CO3;盐
B
3.下列有关物质的分类或归类错误的是( )
A. 混合物:盐酸、生铁、空气
B. 化合物:烧碱,硫酸,氧化镁
C. 盐:氯化钠,生石灰,纯碱
D. 单质:铝,氧气,银
C
① ② ③ ④
A NaCl K2SO4 KCl (NH4)2SO4
B Na2SO4 K2SO4 KCl NH4Cl
C NaCl K2SO4 KCl NH4Cl
D Na2SO4 K2SO4 KCl (NH4)2SO4
5.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( )
练习
B
第一章
化学物质及其变化
氧化物:氧元素与另外一种化学元素组成的二元化合物。
碱性氧化物:溶于水只生成一种碱或与酸反应生成盐和水的氧化物。均为金属氧化物。
酸性氧化物:一类能与水作用生成相应价态的酸或与碱作用只生成一种相应价态盐和水的氧化物。大多数非金属氧化物,某些过渡元素的高价氧化物,如Mn2O7。
酸:电解质电离时所生成的正离子全部是氢离子的化合物。
碱:电解质电离时所产生的负离子全部是氢氧根离子。
盐:金属离子或铵根离子与酸根离子或非金属离子所组成的化合物。
电解质:在水溶液里或熔融状态下能够导电的化合物叫作电解质。
酸根离子:酸电离时产生的阴离子。
有机化合物:主要是指碳元素,氢元素组成,一定是含碳的化合物。但是不包括碳的氧化物和硫化物,碳酸,碳酸盐等。
一、氧化物的分类
碱性氧化物
金属氧化物
非金属氧化物
氧化物
CuO MgO CaO
CO H2O CO2 SO2
组成元素
性质
酸性氧化物
两性氧化物
不成盐氧化物
定义:由两种元素组成且有一种是氧元素的化合物叫氧化物。
CO 2 SO2 Mn2O7等
Na2O CaO Fe2O3等
Al2O3等
CO NO H2O
思考1:H2O、CO、NO是酸性氧化物吗?
酸性氧化物一般都是非金属氧化物,还有少数金属氧化物(比如Mn2O7)
而非金属氧化物不一定都是酸性氧化物(比如H2O、CO、NO等)
思考2:碱性氧化物一般都是金属氧化物,
金属氧化物一定是碱性氧化物吗?
碱性氧化物都是金属氧化物,
而金属氧化物不一定都是碱性氧化物(比如Al2O3)
不是
不一定
思考:
(1)碱性氧化物和酸性氧化物的判断方法?
①酸性氧化物
①和H2O反应生成相应的酸
②和碱反应生成盐和H2O
②碱性氧化物
①和H2O反应生成碱
②和酸反应生成盐和H2O
CaO + 2HCl = CaCl2 + H2O
Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
CO2 + Ca(OH)2 (足量) = CaCO3↓ + H2O
CO2 + 2NaOH (足量) = Na2CO3 + H2O
酸性氧化物、碱性氧化物的通性
酸性氧化物
碱性氧化物
+ 水 相应的酸
+ 碱 盐和水
+碱性氧化物 盐
+ 水 相应的碱
+ 酸 盐和水
注意:
有的酸性氧化物(SiO2)和碱性氧化物(CuO)不溶于水,即不能跟水发生化学反应。
能和水反应生成酸、碱的氧化物也不一定是酸性氧化物、碱性氧化物,如:NO2、Na2O2
③两性氧化物:
④不成盐氧化物
含义:不能与酸或碱反应生成盐和水的氧化物。
如CO、NO、H2O等
含义:既能与酸又能与碱反应生成盐和水的氧化物。
如Al2O3
酸
强酸
弱酸
按组成是否含氧元素
按酸性强弱
无氧酸
含氧酸
HCl 、 HF
HNO3 H2CO3 H2SO4
HNO3 、H2SO4 、HCl 、HBr、HI
HClO4(6大强酸)
H2CO3 、 CH3COOH 、HF
二、酸
电离时生成阳离子全部是氢离子(H+)的化合物
分类:
1、已知NaHSO4在水中能电离出钠离子、氢离子和硫酸根离子,NaHSO4= Na+ +H++SO42-,问NaHSO4属于酸吗?
3、已知H3PO2(次磷酸)与足量的氢氧化钠中和,生成的盐的化学式为NaH2PO2.
问:H3PO2(次磷酸)属于几元酸? 元。
2、已知醋酸电离方程式为:CH3COOH CH3COO- + H+,问:醋酸属于几元酸? 元。
一
一
不是,因为电离出来的阳离子还有钠离子,故不符合酸的定义,不属于酸。像这样含有可电离氢离子的盐叫做酸式盐。
思考:
练一练
1、下列各组物质中按单质、化合物、混合物顺序排列的( )
A、氧气 碱式碳酸铜 空气
B、胆矾 矿泉水 氖气
C、水银 水煤气 冰水混合物
D、稀硫酸 火碱 金刚石
A
(CU2(OH)2CO3)
(主要成份H2,CO)
11
练习2、下列说法正确的是( )
(A)酸性氧化物一定是非金属氧化物
(B)非金属氧化物一定是酸性氧化物
(C)金属氧化物一定是碱性氧化物
(D)碱性氧化物一定是金属氧化物
注:酸酐与对应酸中的化合价必须一致。
练习3、找出下列含氧酸对应的酸酐(酸性氧化物):
①H2CO3 ② H2SO3 ③ H2SO4 ④HNO3 ⑤HNO2
D
CO2 SO2 SO3 N2 O5 N2 O3
三、碱的分类
KOH NaOH Ba(OH)2 NH3·H2O
Mg(OH)2 Fe(OH)3 Fe(OH)2 Cu(OH)2
根据碱
在水中
的溶解性
碱
根据碱在水中最多电离出OH-数
一元碱
二元碱
多元碱
KOH、NaOH
Cu(OH)2 Fe(OH)2
Fe(OH)3
易溶性碱
难溶性碱
微溶性碱溶
Ca(OH)2
盐
根据酸根是否含氧元素
含氧酸盐
无氧酸盐
Na2CO3
NaCl
根据盐在水中的溶解性
可溶性盐
难溶性盐
根据组成盐的阴阳离子不同
酸式盐
碱式盐
正盐
四、盐的分类
钠盐、钾盐
BaSO4 AgCl
Na2CO3
NaHCO3 NaHSO4、KHCO3
Cu2(OH)2CO3
氧化物:氧元素与另外一种化学元素组成的二元化合物。
碱性氧化物:溶于水只生成一种碱或与酸反应生成盐和水的氧化物。均为金属氧化物。
酸性氧化物:一类能与水作用生成相应价态的酸或与碱作用只生成一种相应价态盐和水的氧化物。大多数非金属氧化物,某些过渡元素的高价氧化物,如Mn2O7。
酸:电解质电离时所生成的正离子全部是氢离子的化合物。
碱:电解质电离时所产生的负离子全部是氢氧根离子。
盐:金属离子或铵根离子与酸根离子或非金属离子所组成的化合物。
电解质:在水溶液里或熔融状态下能够导电的化合物叫作电解质。
酸根离子:酸电离时产生的阴离子。
有机化合物:主要是指碳元素,氢元素组成,一定是含碳的化合物。但是不包括碳的氧化物和硫化物,碳酸,碳酸盐等。
溶液是一种或几种物质分散到另一种物质里 ,形成的均一 、稳定的混合物
悬浊液是固体小颗粒分散在液体中形成的混合物
乳浊液是液体小液滴分散在液体里形成的混合物 。
回顾旧知
化学反应的四大基本反应类型
根据反应物、生成物的种类及数量分为:
1.化合反应:两种或两种以上物质反应生成一种化合物的反应。
2.分解反应:一种化合物反应生成两种或两种以上物质的反应。
3.置换反应:一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。
4.复分解反应:两种化合物互相交换成分生成另外两种化合物的反应。
思考:化学反应的四种基本类型有哪些?分类标准是什么?
性质 反应方程式
(1)遇酸碱指示剂变色
(2)与活泼金属反应生成盐和氢气
(3)与碱性氧化物反应生成盐和水
(4)与碱反应生成相应的盐和水
(5)与某些盐反应生成新盐和新酸
1. 酸的通性
任务一 基于物质分类的物质性质模型建构
紫色石蕊试液—显红色,酚酞试液—显无色
H2SO4+Zn=ZnSO4+ H2↑
2HCl+CuO=CuCl2+ H2O
HCl+NaOH=NaCl+ H2O
HCl+AgNO3=AgCl↓+HNO3
性质 反应方程式
(1)遇酸碱指示剂变色
(2)与酸性氧化物反应生成盐和水
(3)与酸反应生成相应的盐和水
(4)与某些盐反应生成新盐和新碱
2. 碱的通性
任务一基于物质分类的物质性质模型建构
紫色石蕊试液变蓝,酚酞试液变红
2NaOH+CO2=Na2CO3+ H2O
NaOH+HNO3=NaNO3+ H2O
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
性质 反应方程式
(1)与金属反应生成新盐和新金属(除K、Ca、Na)
(2)与酸反应生成新盐和新酸
(3)与碱反应生成新盐和新碱
(4)与盐反应生成两种新盐
3. 盐的通性
任务一 基于物质分类的物质性质模型建构
Fe+CuSO4=Cu+FeSO4
Na2CO3+2HCl=2NaCl+H2O+CO2↑
MgCl2+2NaOH=2NaCl+Mg(OH)2↓
2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2
4. 酸性氧化物的通性
性质 反应方程式
(1)部分能与水反应生成酸
(2)能与碱性氧化物反应生成盐
(3)能与碱反应生成盐和水
(4)能与某些盐反应
任务一基于物质分类的物质性质模型建构
H2O+CO2=H2CO3
CaO+CO2=CaCO3
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+CaCO3+H2O=Ca(HCO3)2
5. 碱性氧化物的通性
性质 反应方程式
(1)部分能与水反应生成碱
(2)能与酸性氧化物反应生成盐
(3)能与酸反应生成盐和水
(4)能与某些盐反应
任务一基于物质分类的物质性质模型建构
H2O+CaO=Ca(OH)2
Na2O+CO2=Na2CO3
MgO+2HCl=MgCl2+ H2O
H2O+CaO+Na2CO3=2NaHCO3
任务二 基于模型认知的物质转化关系建构
活动1、写出下列物质之间转化的化学方程式,体会由金属单质到盐、非金属单质到盐的转化关系
Ca → CaO → Ca(OH)2 → CaSO4
C → CO2 → H2CO3 → CaCO3
对上述转化关系,从物质分类的角度看,你发现了什么规律?
将你的想法与同学交流。
活动2 Na及化合物与S及化合物两两之间哪些物质可能发生反应?
任务二 基于模型认知的物质转化关系建构
思考:根据上述转化图分析工业生产中我们如何制取NaOH
工业生产中的其他因素:
原料来源、成本高低、设备要求和环保要求等。
方案1:Na2O + H2O →NaOH
方案2:Na2CO3+Ca(OH) →NaOH
实际方案:NaCl + H2O NaOH
任务三 基于物质转化关系的物质制备
练习1 下列各组物质之间可以按如图所示关系直接转化的是
A.Fe―→Fe2O3―→FeSO4―→Fe
B.CO―→CO2―→H2CO3―→CO
C.NaOH―→NaCl―→Na2CO3―→NaOH
D.HCl―→CuCl2―→BaCl2―→HCl
D
一、分散系
1. 定义:
把一种或多种物质分散在另一种或多种物质中得到的混合体系
2. 组成:分散质:分散系中___________的物质;
分散剂:分散系中_____________的物质。
被分散
容纳分散质
一般规律:
1.分散系中有水,水是分散剂;
2.分散系中是两种液体(没有水),量多的是分散剂。
固
气
液
固
思考!根据分散质和分散剂的所处状态分类,总共可以得到几种分散系?
气
液
9种
分散质
分散剂
一、分散系
(2)按粒子直径大小分:分散系分为
溶液、胶体和浊液的本质区别:
分散质粒子直径的大小
溶液、胶体和浊液
1nm=10-9m
(1)定义:分散质粒子直径介于1~100nm( 10-9~10-7m)之间的分散系。
注:胶体的分散质粒子又称胶粒。一般胶粒是若干个粒子组成的集合体
二、胶体
(2)、胶体的分类
二、胶体
胶体
根据分散剂的状态分类
根据胶体粒子的组成分类
气溶胶:烟,云,雾
液溶胶:豆浆,墨水
固溶胶:烟水晶,有色玻璃
粒子胶体:胶粒由许多小粒子聚集而成
如: Fe(OH)3胶体
分子胶体:胶粒为单个有机高分子
如:淀粉胶体
1个Fe(OH)3
粒子
1个Fe(OH)3
胶粒
Fe(OH)3胶体
*1.不写沉淀符号
2.不再与生成的HCl反应
①HCl浓度小;②加热时,HCl易挥发;③Fe(OH)3 胶粒的表面吸有其它粒子的膜,受保护
实验原理
3.需要带上加热符号
①用蒸馏水:不能用自来水,目的防止生成氢氧化铁沉淀
②用饱和溶液:不用稀溶液,目的制得浓度较大的氢氧化铁胶体
要加热:为了加快反应的速率,但当溶液呈红褐色时,要停止加热,目的防止生成氢氧化铁沉淀
不能搅拌:目的防止氢氧化铁胶体粒子碰撞大颗粒形成沉淀
不能用Fe(OH)3溶于水或向FeCl3溶液中加NaOH溶液制取
实验注意事项
胶体的其他性质
1、电泳(电学性质)
定义:在外加电场的条件下,胶体粒子向直流电源的正极或负极定向移动的现象
产生原因:胶体分散质粒子细小而具有较大的表面积,能较强地吸附离子,从而形成带电粒子,在外加电场的作用下会发生定向移动。
电泳的应用:
①静电除尘;
②电泳电镀:
利用电泳将油漆、乳胶、橡胶等粒子均匀地沉积在镀件上。
悬浮在水中的小颗粒做不停地、无秩序地运动,这种现象叫做布朗运动。
布朗运动
胶体粒子也做布朗运动。
3、胶体的介稳性
胶体在一定条件下能稳定存在,属于介稳体系;
胶体粒子可以通过吸附带电粒子而带有电荷,同种胶体粒子的电性相同,他们之间相互排斥阻碍了胶体粒子聚集成更大的颗粒,因此胶体具有介稳性
胶体的布朗运动也使得胶体粒子不易聚集成质量较大的颗粒而沉降下来,使其具有介稳性。
4、胶体的聚沉
定义:使胶体粒子凝聚成更大的颗粒,形成沉淀,从分散剂里析出的过程叫胶体的聚沉
要使胶体凝聚成沉淀,就要减少或消除胶体微粒表面吸附的电荷,使之减弱或失去电性排斥力作用,从而使胶粒在运动中碰撞结合成更大的颗粒。
Q1:胶体为什么能够稳定存在?
胶粒带电,互相排斥(介稳性)
Q2:如何破坏胶体的稳定状态?
胶体聚沉的方法:
1、加入电解质
向胶体中加入盐时,其中的阳离子或阴离子能中和分散质微粒所带的电荷,从而使分散质聚集成较大的微粒,在重力作用下形成沉淀析出。这种胶体形成沉淀析出的现象称为胶体的聚沉。
胶体聚沉的方法:
如由豆浆做豆腐时,在一定温度下,加入CaSO4(或其他电解质溶液),豆浆中的胶体粒子带的电荷被中和,其中的粒子很快聚集而形成胶冻状的豆腐(称为凝胶)。
想一想,为什么江河进入大海处容易形成沙洲?
也可以起到和加入电解质同样的作用,使胶体聚沉。
如把Fe(OH)3胶体加入硅酸胶体中,两种胶体均会发生凝聚。
胶体聚沉的方法:
2、加入带相反电荷的胶体
也可以起到和加入电解质同样的作用,使胶体聚沉。
如把Fe(OH)3胶体加入硅酸胶体中,两种胶体均会发生凝聚。
带正电荷胶粒 带负电荷胶粒
金属氢氧化物 金属氧化物 金属硫化物(如Sb2S3)
非金属硫化物(如As2S3)
非金属氧化物(如SiO2泥沙)
硅酸盐(土壤和水泥)
也可以起到和加入电解质同样的作用,使胶体聚沉。
如把Fe(OH)3胶体加入硅酸胶体中,两种胶体均会发生凝聚。
胶体聚沉的方法:
3、加热
加热胶体,能量升高,胶粒运动加剧,它们之间碰撞机会增多,而使胶核对离子的吸附作用减弱,即减弱胶体的稳定因素,导致胶体凝聚。
如长时间加热时,Fe(OH)3胶体就发生凝聚而出现红褐色沉淀。
过滤后的现象
Fe(OH)3胶体
泥水
滤纸上无滤渣,滤液颜色不变
由浑浊变澄清,滤纸上有不溶物
结论:胶体粒子能透过滤纸,而悬浊液的分散质粒子无法通过滤纸。
将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象。
二、胶体
科学探究
思考:如何分离胶体和溶液?
半透膜:半透膜是一种孔隙比滤纸更小,可以让小分子或离子通过,大分子不能通过的一类膜的总称
一定时间之后,
烧杯中能够检测出的是:
检测不出的是:
盛有淀粉胶体和食盐溶液的半透膜浸在蒸馏水中
氯化钠
淀粉
4、胶体的渗析
定义:
渗析就是利用小分子和小离子能透过半透膜,但胶体粒子不能透过半透膜的性质,从而将溶胶中除掉作为杂质的小分子或离子的过程。
化学中常见的半透膜:羊皮纸、膀胱膜;细胞膜、人工制造的胶棉薄膜等。
分散系 溶液 胶体 浊液
悬浊液 乳浊液
分散质粒子大小
分散质粒子组成
特点
稳定性
能否透过滤纸
能否透过半透膜
实例
1nm~100nm
>100nm
>100nm
巨大数目分子聚集成的小液滴
巨大数目分子聚集成的固体小颗粒
许多分子的集合体或大分子
分子、离子
均一
不均一、不透明
不均一、不透明
均一
不稳定
不稳定
较稳定
稳定
能
能
不能
不能
不能
不能
不能
能
食盐水
豆浆
泥水、石灰乳
油水混合物
<1nm
常见胶体:
Fe(OH)3胶体、AgI胶体、淀粉胶体(溶液)、蛋白质胶体(溶液)、牛奶、豆浆、土壤、有色玻璃、云、雾、烟、墨水、血液、肥皂水等
练一练
1、FeCl3溶液和Fe(OH)3胶体具有的共同性质是( )
A.都能透过滤纸 B.都呈红褐色
C.具有相同的颗粒直径 D.都存在布朗运动
A
练一练
2、下列事实与胶体性质无关的是( )
A.在豆浆里加入盐卤做豆腐
B.在河流入海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到 一束光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
D
练一练
3、胶体的最本质的特征是( )
A.丁达尔效应
B.可以通过滤纸
C.布朗运动
D.分散质颗粒的直径在1nm~100nm之间
D
练一练
4、区别溶液和胶体的最简单的方法是( )
A.观察外观 B.丁达尔效应
C.布朗运动 D.加热
B
练一练
1、下列物质属于混合物的是( )
A、蒸馏水
B、氯酸钾和二氧化锰混合加热完全反应后试管中剩余物质
C、含铁70% 的三氧化二铁样品
D、硫酸氢钠
B
酸 碱 盐
A H2SO4 CaCO3 BaCO3
B HClO KOH NaHCO3
C CH3COOH Na2CO3 CaCl2
D NaHSO4 NH3·H2O NaCl
2、下表中关于物质的分类正确的是( )
B
4、下列各物质的名称(或俗名)、化学式、分类都正确的是( )
A.氢氧化钙;Ca(OH)2 ;碱性氧化物
B.二氧化碳;CO2;酸性氧化物
C.硫酸;H2S;酸
D.烧碱;Na2CO3;盐
B
3.下列有关物质的分类或归类错误的是( )
A. 混合物:盐酸、生铁、空气
B. 化合物:烧碱,硫酸,氧化镁
C. 盐:氯化钠,生石灰,纯碱
D. 单质:铝,氧气,银
C
① ② ③ ④
A NaCl K2SO4 KCl (NH4)2SO4
B Na2SO4 K2SO4 KCl NH4Cl
C NaCl K2SO4 KCl NH4Cl
D Na2SO4 K2SO4 KCl (NH4)2SO4
5.奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是( )
练习
B
