天津市和平区部分中学2023-2024学年高三上学期期中考试化学试题(含答案)
文档属性
| 名称 | 天津市和平区部分中学2023-2024学年高三上学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 878.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-25 21:21:30 | ||
图片预览



文档简介
和平区部分中学2023-2024学年高三上学期期中考试
化学试卷
本试卷分为第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间60分钟。第I卷1至4页,第Ⅱ卷5至8页。
答卷前,考生务必将姓名、班级、考号填在答题卡上。答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效。考试结束后,将答题卡交回。
祝各位考生考试顺利!
第I卷(共36分)
注意事项:
1.每题选出答案后,用铅笔将答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。
以下数据可供解题时参考:
相对原子质量:H-1 C-12 N-14 O-16 I-127
1.下列物质性质与用途具有对应关系的是( )
A.石墨能导电,可用作润滑剂
B.单晶硅熔点高,可用作半导体材料
C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑
D.含铅化合物颜色丰富,可用作电极材料
2.常温下,下列各组离子在给定溶液中能大量共存的是( )
A.的溶液:、、、
B.的溶液:、、、
C.的溶液:、、、
D.的容液:、、、
3.下列事实不能说明C的非金属性大于的是( )
A.熔、沸点: B.酸性:
C.热稳定性: D.中C为价,中为价
4.常温常压下,电化学还原制氨气的总反应方程式:,设为阿伏加德罗常数的值,下列说法正确的是( )
A.水中含有的孤电子对数为
B.每产生,失去的电子数为
C.氨水中,含有的分子数少于
D.消耗(已折算为标况)时,产生的分子数为
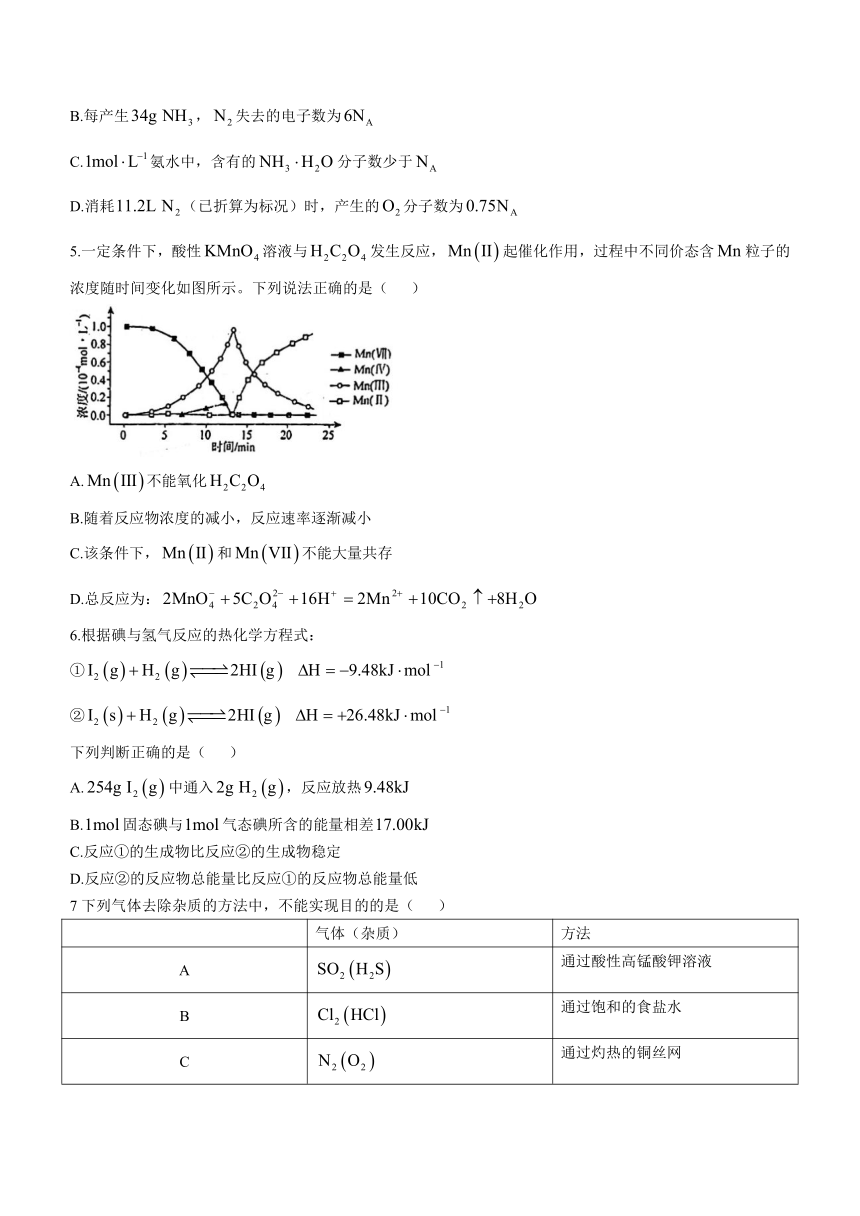
5.一定条件下,酸性溶液与发生反应,起催化作用,过程中不同价态含粒子的浓度随时间变化如图所示。下列说法正确的是( )
A.不能氧化
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,和不能大量共存
D.总反应为:
6.根据碘与氢气反应的热化学方程式:
①
②
下列判断正确的是( )
A.中通入,反应放热
B.固态碘与气态碘所含的能量相差
C.反应①的生成物比反应②的生成物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
7下列气体去除杂质的方法中,不能实现目的的是( )
气体(杂质) 方法
A 通过酸性高锰酸钾溶液
B 通过饱和的食盐水
C 通过灼热的铜丝网
D 通过氢氧化钠溶液
8.甲异腈()在恒容密闭容器中发生异构化反应:,反应过程中甲异腈浓度c随时间t的变化曲线如图所示(图中T为温度)。该反应的反应速率v与c的关系为,k为速率常数(常温下为常数),a点和b点反应速率相等,即。下列说法错误的是( )
A.bf段的平均反应速率为
B.a点反应物的活化分子数多于d点
C.
D.
9.光刻机是生成计算机芯片的机器。某光刻胶(X)的合成反应如图:
降冰片烯 马来酸酐 X
下列说法正确的是( )
A.马来酸酐中C原子有和两种杂化方式
B.最多可与反应
C.马来酸酐的某种同分异构体中所有碳原子共线
D.降冰片烯能发生加成反应,不能发生取代反应
10.下列四组物质中,不能用溴水鉴别的是( )
A.和 B.和
C.乙烷和乙烯 D.正戊烷和正己烷
11.负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是( )
A.作原电池正极
B.电子由经活性炭流向
C.表面发生的电极反应:
D.每消耗标准状况下的,最多去除
12.某温度下,在恒容密闭容器中加入一定量X,发生反应,一段时间后达到平衡。下列说法错误的是( )
A.升高温度,若增大,则 B.加入一定量Z,达新平衡后减小
C.加入等物质的量的Y和Z,达新平衡后增大 D.加入一定量氩气,平衡不移动
第II卷(共64分)
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共4题,共64分。
13.(16分)氮的很多化合物都是重要的化工原料。
(1)羟胺()可看成是氨分子内的一个氢原子被羟基取代的衍生物。的电子式为____________________。写出两种与羟胺的价电子数相同的双核分子的化学式_____________________。
纯羟胺很不稳定,受热即分解为、和,则分解反应的化学方程式:
_______________________________。
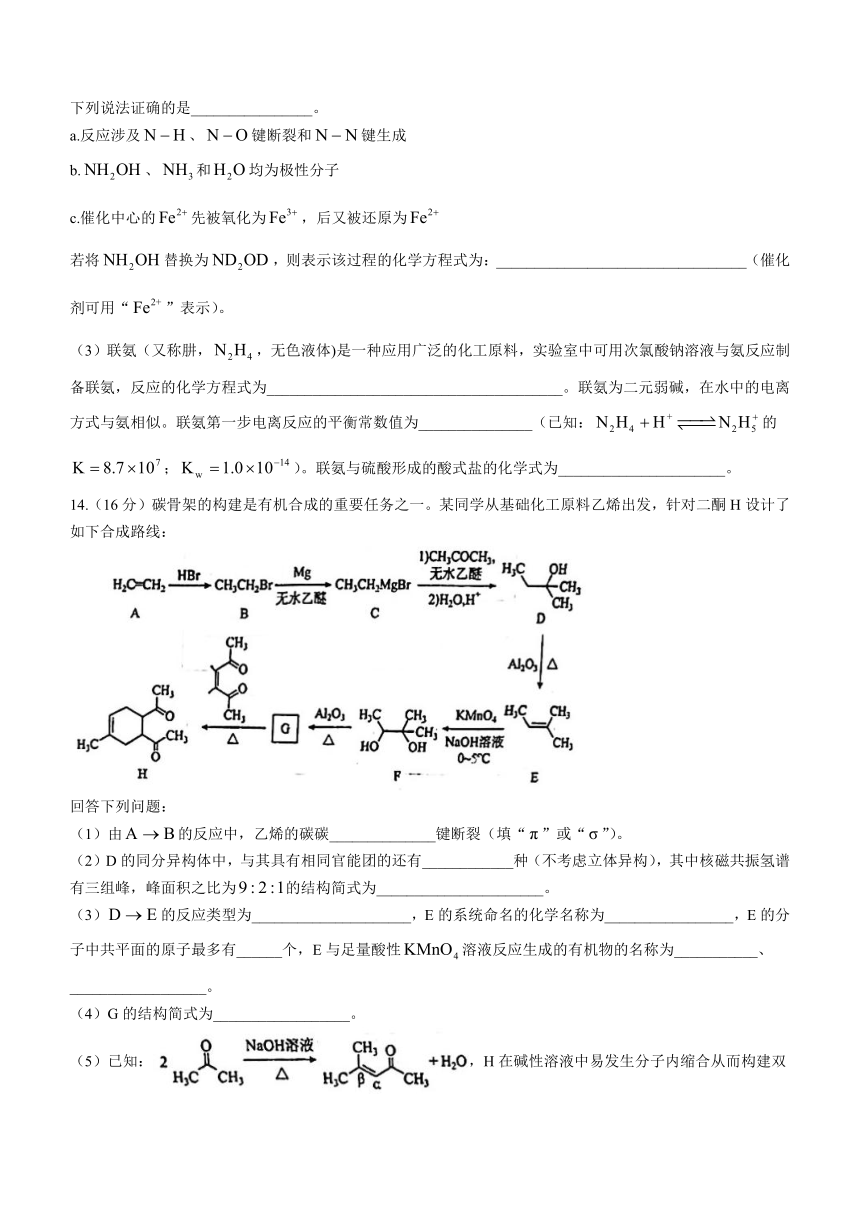
(2)“肼合成酶”以其中的配合物为催化中心,可将与转化为肼(),其反应历程如下所示。
下列说法证确的是________________。
a.反应涉及、键断裂和键生成
b.、和均为极性分子
c.催化中心的先被氧化为,后又被还原为
若将替换为,则表示该过程的化学方程式为:_________________________________(催化剂可用“”表示)。
(3)联氨(又称肼,,无色液体)是一种应用广泛的化工原料,实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_______________________________________。联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为_______________(已知:的;)。联氨与硫酸形成的酸式盐的化学式为______________________。
14.(16分)碳骨架的构建是有机合成的重要任务之一。某同学从基础化工原料乙烯出发,针对二酮H设计了如下合成路线:
回答下列问题:
(1)由的反应中,乙烯的碳碳______________键断裂(填“”或“”)。
(2)D的同分异构体中,与其具有相同官能团的还有____________种(不考虑立体异构),其中核磁共振氢谱有三组峰,峰面积之比为的结构简式为______________________。
(3)的反应类型为_____________________,E的系统命名的化学名称为_________________,E的分子中共平面的原子最多有______个,E与足量酸性溶液反应生成的有机物的名称为___________、__________________。
(4)G的结构简式为__________________。
(5)已知:,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I()和另一种,不饱和酮J,J的结构简式为_______________。若经此路线由H合成I,存在的问题有__________(填标号)。
a.原子利用率低 b.产物难以分离 c.反应条件苛刻 d.严重污染环境
15.(14分)纯遇热易发生分解,工业上通常制成固体以便运输和储存。制备的实验装置如图所示(夹持装置省略),其中A装置制备,C装置用于制备。回答下列问题:
(1)仪器a的名称是______________________。装置B的作用是______________________________。
(2)装置A中发生反应的离子方程式为_________________________________________。
向装置A中通入空气的目的是_________________________________________。
(3)装置C中发生反应的化学方程式为_________________________________________。
C装置采用“冰水浴”的目的是_________________________________________。
(4)研究测得C装置吸收液中的与对粗产品中含量的影响如图所示。则最佳条件为_____________,_______________。
16.(18分)
I.甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
反应③的__________,平衡常数___________(用、表示)。
II.反应在工业上有重要应用。
(2)该反应在不同温度下的平衡常数如表所示。
温度/℃ 700 800 830 1000
平衡常数 1.67 1.11 1.00 0.59
①反应的______________0(填“>”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是______________________________。
(3)该反应常在Pd膜反应器中进行,其工作原理如图所示。
①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是_________________________。
②某温度下,在Pd膜表面上的解离过程存在如下平衡:,其正反应的活化能远小于逆反应的活化能。下列说法错误的是___________。
A.Pd膜对气体分子的透过具有选择性
B.过程2的
C.加快Pd膜内H原子迁移有利于的解离
D.H原子在Pd膜表面上结合为的过程为放热反应
③同温同压下,等物质的量的CO和通入无Pd膜反应器,CO的平衡转化率为75%;若换成Pd膜反应器,CO的平衡转化率为90%,则相同时间内出口a和出口b中的质量比为___________________。
(4)恒定总压和水碳比投料,在不同条件下达到平衡时和的分压(某成分分压总压该成分的物质的量分数)如下表:
条件1 0.40 0.40 0
条件2 0.42 0.36 0.02
①在条件1下,水煤气变换反应的分压平衡常数____________________。
②对比条件1,条件2中产率下降是因为发生了一个不涉及的副反应,写出该反应方程式_____________________________________。
和平区部分中学2023-2024学年高三上学期期中考试
化学答案
1 2 3 4 5 6 7 8 9 10 11 12
C B A D C D A C C D B C
13.(16分)
(1) 等
(2)a b c.
(3)
(每空2分)
14.(16分)
(1) (1分)
(2)7 (1分)
(3)消去反应 (1分) 甲基丁烯 (1分)
9 (2分) 乙酸 (1分) 丙酮 (1分)
(4) (5) ab (每空2分)
15.(14分)
(1)三颈烧瓶 (1分) 安全瓶,防止倒吸 (1分)
(2)
赶出气体,使其进入装置C发生反应制取
(3)
防止温度过高,分解为和,同时可减少由于温度过高导致分解。
(4)4 0.8 (每空2分)
16.(18分)
(1)① ②或
(2)①
②优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平衡逆向移动,产物的转化率较低
(3)① Pd膜能选择性分离出,平衡正向移动,平衡转化率增大
② BD ③
(4)① 2 ② (每空2分)
化学试卷
本试卷分为第I卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试时间60分钟。第I卷1至4页,第Ⅱ卷5至8页。
答卷前,考生务必将姓名、班级、考号填在答题卡上。答卷时,考生务必将答案涂写在答题卡上,答在试卷上的无效。考试结束后,将答题卡交回。
祝各位考生考试顺利!
第I卷(共36分)
注意事项:
1.每题选出答案后,用铅笔将答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。
2.本卷共12题,每题3分,共36分。在每题给出的四个选项中,只有一项是最符合题目要求的。
以下数据可供解题时参考:
相对原子质量:H-1 C-12 N-14 O-16 I-127
1.下列物质性质与用途具有对应关系的是( )
A.石墨能导电,可用作润滑剂
B.单晶硅熔点高,可用作半导体材料
C.青铜比纯铜熔点低、硬度大,古代用青铜铸剑
D.含铅化合物颜色丰富,可用作电极材料
2.常温下,下列各组离子在给定溶液中能大量共存的是( )
A.的溶液:、、、
B.的溶液:、、、
C.的溶液:、、、
D.的容液:、、、
3.下列事实不能说明C的非金属性大于的是( )
A.熔、沸点: B.酸性:
C.热稳定性: D.中C为价,中为价
4.常温常压下,电化学还原制氨气的总反应方程式:,设为阿伏加德罗常数的值,下列说法正确的是( )
A.水中含有的孤电子对数为
B.每产生,失去的电子数为
C.氨水中,含有的分子数少于
D.消耗(已折算为标况)时,产生的分子数为
5.一定条件下,酸性溶液与发生反应,起催化作用,过程中不同价态含粒子的浓度随时间变化如图所示。下列说法正确的是( )
A.不能氧化
B.随着反应物浓度的减小,反应速率逐渐减小
C.该条件下,和不能大量共存
D.总反应为:
6.根据碘与氢气反应的热化学方程式:
①
②
下列判断正确的是( )
A.中通入,反应放热
B.固态碘与气态碘所含的能量相差
C.反应①的生成物比反应②的生成物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
7下列气体去除杂质的方法中,不能实现目的的是( )
气体(杂质) 方法
A 通过酸性高锰酸钾溶液
B 通过饱和的食盐水
C 通过灼热的铜丝网
D 通过氢氧化钠溶液
8.甲异腈()在恒容密闭容器中发生异构化反应:,反应过程中甲异腈浓度c随时间t的变化曲线如图所示(图中T为温度)。该反应的反应速率v与c的关系为,k为速率常数(常温下为常数),a点和b点反应速率相等,即。下列说法错误的是( )
A.bf段的平均反应速率为
B.a点反应物的活化分子数多于d点
C.
D.
9.光刻机是生成计算机芯片的机器。某光刻胶(X)的合成反应如图:
降冰片烯 马来酸酐 X
下列说法正确的是( )
A.马来酸酐中C原子有和两种杂化方式
B.最多可与反应
C.马来酸酐的某种同分异构体中所有碳原子共线
D.降冰片烯能发生加成反应,不能发生取代反应
10.下列四组物质中,不能用溴水鉴别的是( )
A.和 B.和
C.乙烷和乙烯 D.正戊烷和正己烷
11.负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是( )
A.作原电池正极
B.电子由经活性炭流向
C.表面发生的电极反应:
D.每消耗标准状况下的,最多去除
12.某温度下,在恒容密闭容器中加入一定量X,发生反应,一段时间后达到平衡。下列说法错误的是( )
A.升高温度,若增大,则 B.加入一定量Z,达新平衡后减小
C.加入等物质的量的Y和Z,达新平衡后增大 D.加入一定量氩气,平衡不移动
第II卷(共64分)
注意事项:
1.用黑色墨水的钢笔或签字笔将答案写在答题卡上。
2.本卷共4题,共64分。
13.(16分)氮的很多化合物都是重要的化工原料。
(1)羟胺()可看成是氨分子内的一个氢原子被羟基取代的衍生物。的电子式为____________________。写出两种与羟胺的价电子数相同的双核分子的化学式_____________________。
纯羟胺很不稳定,受热即分解为、和,则分解反应的化学方程式:
_______________________________。
(2)“肼合成酶”以其中的配合物为催化中心,可将与转化为肼(),其反应历程如下所示。
下列说法证确的是________________。
a.反应涉及、键断裂和键生成
b.、和均为极性分子
c.催化中心的先被氧化为,后又被还原为
若将替换为,则表示该过程的化学方程式为:_________________________________(催化剂可用“”表示)。
(3)联氨(又称肼,,无色液体)是一种应用广泛的化工原料,实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_______________________________________。联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为_______________(已知:的;)。联氨与硫酸形成的酸式盐的化学式为______________________。
14.(16分)碳骨架的构建是有机合成的重要任务之一。某同学从基础化工原料乙烯出发,针对二酮H设计了如下合成路线:
回答下列问题:
(1)由的反应中,乙烯的碳碳______________键断裂(填“”或“”)。
(2)D的同分异构体中,与其具有相同官能团的还有____________种(不考虑立体异构),其中核磁共振氢谱有三组峰,峰面积之比为的结构简式为______________________。
(3)的反应类型为_____________________,E的系统命名的化学名称为_________________,E的分子中共平面的原子最多有______个,E与足量酸性溶液反应生成的有机物的名称为___________、__________________。
(4)G的结构简式为__________________。
(5)已知:,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I()和另一种,不饱和酮J,J的结构简式为_______________。若经此路线由H合成I,存在的问题有__________(填标号)。
a.原子利用率低 b.产物难以分离 c.反应条件苛刻 d.严重污染环境
15.(14分)纯遇热易发生分解,工业上通常制成固体以便运输和储存。制备的实验装置如图所示(夹持装置省略),其中A装置制备,C装置用于制备。回答下列问题:
(1)仪器a的名称是______________________。装置B的作用是______________________________。
(2)装置A中发生反应的离子方程式为_________________________________________。
向装置A中通入空气的目的是_________________________________________。
(3)装置C中发生反应的化学方程式为_________________________________________。
C装置采用“冰水浴”的目的是_________________________________________。
(4)研究测得C装置吸收液中的与对粗产品中含量的影响如图所示。则最佳条件为_____________,_______________。
16.(18分)
I.甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①
②
反应③的__________,平衡常数___________(用、表示)。
II.反应在工业上有重要应用。
(2)该反应在不同温度下的平衡常数如表所示。
温度/℃ 700 800 830 1000
平衡常数 1.67 1.11 1.00 0.59
①反应的______________0(填“>”“<”或“=”)。
②反应常在较高温度下进行,该措施的优缺点是______________________________。
(3)该反应常在Pd膜反应器中进行,其工作原理如图所示。
①利用平衡移动原理解释反应器存在Pd膜时具有更高转化率的原因是_________________________。
②某温度下,在Pd膜表面上的解离过程存在如下平衡:,其正反应的活化能远小于逆反应的活化能。下列说法错误的是___________。
A.Pd膜对气体分子的透过具有选择性
B.过程2的
C.加快Pd膜内H原子迁移有利于的解离
D.H原子在Pd膜表面上结合为的过程为放热反应
③同温同压下,等物质的量的CO和通入无Pd膜反应器,CO的平衡转化率为75%;若换成Pd膜反应器,CO的平衡转化率为90%,则相同时间内出口a和出口b中的质量比为___________________。
(4)恒定总压和水碳比投料,在不同条件下达到平衡时和的分压(某成分分压总压该成分的物质的量分数)如下表:
条件1 0.40 0.40 0
条件2 0.42 0.36 0.02
①在条件1下,水煤气变换反应的分压平衡常数____________________。
②对比条件1,条件2中产率下降是因为发生了一个不涉及的副反应,写出该反应方程式_____________________________________。
和平区部分中学2023-2024学年高三上学期期中考试
化学答案
1 2 3 4 5 6 7 8 9 10 11 12
C B A D C D A C C D B C
13.(16分)
(1) 等
(2)a b c.
(3)
(每空2分)
14.(16分)
(1) (1分)
(2)7 (1分)
(3)消去反应 (1分) 甲基丁烯 (1分)
9 (2分) 乙酸 (1分) 丙酮 (1分)
(4) (5) ab (每空2分)
15.(14分)
(1)三颈烧瓶 (1分) 安全瓶,防止倒吸 (1分)
(2)
赶出气体,使其进入装置C发生反应制取
(3)
防止温度过高,分解为和,同时可减少由于温度过高导致分解。
(4)4 0.8 (每空2分)
16.(18分)
(1)① ②或
(2)①
②优点是升高温度,反应速率较快;缺点是正反应为放热反应,升高温度,平衡逆向移动,产物的转化率较低
(3)① Pd膜能选择性分离出,平衡正向移动,平衡转化率增大
② BD ③
(4)① 2 ② (每空2分)
同课章节目录
