2.1 钠及其化合物 课件(共24张PPT)
文档属性
| 名称 | 2.1 钠及其化合物 课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-26 17:18:52 | ||
图片预览








文档简介
(共24张PPT)
钠及其化合物 (第二课时)
Na O Na O
高中化学
1 氧化钠和过氧化钠
二、 钠的几种化合物
碱性氧化物
酸性氧化物 酸
任务一 氧化钠和氧化钙一样,属于碱性氧化物。请预测
氧化钠能与哪些物质发生反应。
Na O+H O==2NaOH
Na O+CO =Na CO
Na O+2HCl==H O+NaCl
高中化学
碱
H O
任务二预测过氧化钠与水反应会生成什么物质
高中化学
实验现象
结论
木条复燃
生成氧气
pH试纸变蓝
生成碱
试管外壁发烫
反应放热
2Na O +2H O =4NaOH +O 1
2Na O +2H O==4Na++40H-+O 1
高中化学
过氧化钠与水反应
-H O
-Na O
L
过氧化物及超氧化物(如KO )
与含有CO 和水蒸汽的空气接触时,
既能产生0 ,又能吸收空气中的
CO 。利用该技术将药板装备于潜
艇、宇宙飞船、呼吸面具等密闭
环境中,供人们呼吸应急使用。
其主要化学反应方程式(以Na O 为例)如下:
2Na O +2CO ==2Na CO +O
高中化学
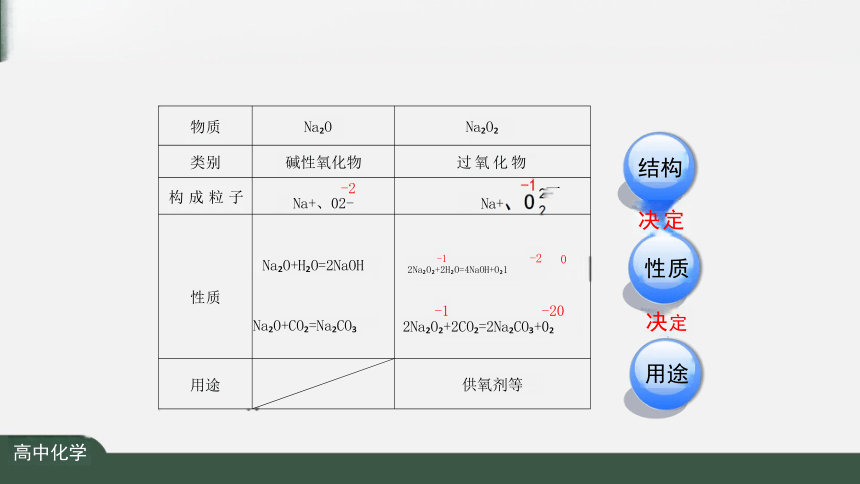
物质 Na O
Na O
类别 碱性氧化物
过氧化物
构 成 粒 子 -2 Na+、02-
一
Na+
性质 Na O+H O=2NaOH Na O+CO =Na CO
-1 -2 0
2Na O +2H O=4NaOH+O 1
-1 -20
2Na O +2CO =2Na CO +0
用途
供氧剂等
结构
决定
性质
决定
用途
高中化学
品名:食用纯碱
配料:碳酸钠
保质期:18个月 防止受潮
净含量:1000g
贮存条件:清洁卫生,请置于干燥通风处,,防止受潮。
高中化学
品名:食品添加剂碳酸氢钠(食用小苏打)
配料:碳酸氯钠
规格:200克/袋
生产日期: 见封口
保 质 期 : 十 二 个 月
贮存方法:通风干燥处避免高温受热
2 碳酸钠和碳酸氢钠
良 用 碱
区服现品
避免高温受热
区制作面条
M 码味上案 W 去称油污
勤道
临时
解缴 方便
制作面包类食品时,常用碳酸氢钠和固体酸性材料做
成的膨松剂,这种膨松剂在接触水时会产生气体,烘焙时会
产生更多气体,使面包更为松软。
配料:焦磷酸二氢二钠(38%),碳 酸氢钠(32%),玉米淀粉,磷酸 图 钙(5%),酒石酸氢钾(5%) 碳酸钙(5%)
使用范围:适合制作蛋糕、面包、糕 点等。
签些
Eaing Aucer t2mh 无铝富双效泡打努
复合影松剂
高中化学
任务三碳酸钠和碳酸氢钠的外观相似,如何鉴别
NaHCO
白色细小晶体
Na CO
白色粉末
(1)外观
高中化学
盐 Na CO
NaHCO
(2)向两支试管中分别滴入 几滴水,振荡,观察现象;用 手触摸试管壁,感受热量变化 加几滴水后, 结块变成晶体; 温度上升
结论与解释 无水碳酸钠遇水生成有结晶水的 碳酸钠晶体(Na CO · xH O), 并伴随放热现象。
在两支试管中分别加入少量Na CO 和NaHCO (各约1 g)
高中化学
盐 Na CO
NaHCO
(2)向两支试管中分别滴入 几滴水,振荡,观察现象;用 手触摸试管壁,感受热量变化 加几滴水后, 结块变成晶体; 温度上升
加几滴水后, 少部分溶解; 温度下降
结论与解释 无水碳酸钠遇水生成有结晶水的 碳酸钠晶体(Na CO · xH O),并 伴随放热现象。碳酸氢钠能溶于 水,并伴随吸热现象。
在两支试管中分别加入少量Na CO 和NaHCO (各约1 g)
高中化学
盐 Na CO
NaHCO
(3)继续向(2)的试管中 分别加入5 mL水,用力振荡。 振荡后可溶解
固体量有所减少
初步结论 碳酸钠和碳酸氢钠均能溶于水, 碳酸钠溶解性更强。
数据
溶解度(20℃)
Na CO :21.5 g
NaHCO :9.6 g
高中化学
盐 Na CO
NaHCO
(4)分别向(3)所得溶液 中滴入1~2滴酚酞溶液 溶 液 变 红 (较深)
溶 液 微 红
初步结论 两种物质的水溶液均呈碱性, 且碱性:Na CO >NaHCO 。
高中化学
盐 Na CO
NaHCO
(5)分别加热Na CO 和 NaHCO ,观察现象。 无明显现象
试管口有小液滴出 现,澄清石灰水变 浑浊
初步结论 碳酸钠较稳定,受热不易分解。 碳酸氢钠不稳定,受热易分解
2NaHCO △Na CO +H O+CO ↑
高中化学
NaHCO
或 N a C O
峇
澄清 石灰水
等质量的碳酸氢
钠和碳酸钠分别与足 量盐酸反应,NaHCO
产生CO 更多。
碳酸钠或碳酸氢钠与盐酸反应装置
(6)与酸反应
NaHCO +HCl=—NaCl+H O+CO T
Na CO +2HCl =2NaCI+H O+CO 1
高中化学
结构
决 定
性质
决定
用途
NaHCO
钠盐
碳酸氢盐
物质
类别
构成
粒子
Na CO
钠盐
碳酸盐
Na+、Co Na+ 、HCO
高中化学
任务四 请结合性质解释用途
(1)厨房去油污,为什么建议用碳酸钠而不是用碳酸氢钠
碳酸钠碱性强
食用小苏打
联酸氧 品 有
W 清洗果蒸蛇心
M 梦用多多实患
食 用 碱
碳酸纳登液市防
高中化学
团涨发干质
任务四 请结合性质解释用途
(2)治疗胃酸过多为什么选用碳酸氢钠而不用碳酸钠
NaHCO 碱性弱,对人体
伤害小,且见效迅速
碳酸氯钠片
HatFccagriscena )
FIFBFSNQEB*,QN
广照 药盖白图公司
高中化学
作作指用而制高物
造纸 制玻璃
高中化学
化工之母——纯碱
Na CO
纺织
制皂
科学史话
1940年中国科学家侯德榜发明了“侯氏制碱法”,成为世界上生 产纯碱的重要方法。其主要化学原理是:
1.CO +H O+NH +NaCl (饱和)——NH CI+NaHCO ↓
上述原理中应用了NaHCO 的哪些性质
碳酸氢钠的溶解性
和对热具有不稳定性
高中化学
侯德榜
课后任务
尝试设计钠及其化合物的转化路径,
并围绕转化关系书写相应的化学方程式。
高中化学
物质类别 代表物
单质 → Na
氧化物→ Na 0和Na O
氢氧化物 NaOH
盐 >Na CO 和 NaHCO
研究内容
物理性质
> 化学性质
制法 用途
■■
金属及其化合物的研究思路
高中化学
金属及其化合物的研究思路
物质类别 代表物 研究内容 研究视角
单质 → Na 物理性质
化学性质 物质分类
制法 元素化合价
氢氧化物— NaOH
用途 反应规律
盐 → Na CO 和NaHCO
比较法类比法实验法 观察法 归纳法
高中化学
■ ■
氧化物 → Na O和 Na O
钠及其化合物 (第二课时)
Na O Na O
高中化学
1 氧化钠和过氧化钠
二、 钠的几种化合物
碱性氧化物
酸性氧化物 酸
任务一 氧化钠和氧化钙一样,属于碱性氧化物。请预测
氧化钠能与哪些物质发生反应。
Na O+H O==2NaOH
Na O+CO =Na CO
Na O+2HCl==H O+NaCl
高中化学
碱
H O
任务二预测过氧化钠与水反应会生成什么物质
高中化学
实验现象
结论
木条复燃
生成氧气
pH试纸变蓝
生成碱
试管外壁发烫
反应放热
2Na O +2H O =4NaOH +O 1
2Na O +2H O==4Na++40H-+O 1
高中化学
过氧化钠与水反应
-H O
-Na O
L
过氧化物及超氧化物(如KO )
与含有CO 和水蒸汽的空气接触时,
既能产生0 ,又能吸收空气中的
CO 。利用该技术将药板装备于潜
艇、宇宙飞船、呼吸面具等密闭
环境中,供人们呼吸应急使用。
其主要化学反应方程式(以Na O 为例)如下:
2Na O +2CO ==2Na CO +O
高中化学
物质 Na O
Na O
类别 碱性氧化物
过氧化物
构 成 粒 子 -2 Na+、02-
一
Na+
性质 Na O+H O=2NaOH Na O+CO =Na CO
-1 -2 0
2Na O +2H O=4NaOH+O 1
-1 -20
2Na O +2CO =2Na CO +0
用途
供氧剂等
结构
决定
性质
决定
用途
高中化学
品名:食用纯碱
配料:碳酸钠
保质期:18个月 防止受潮
净含量:1000g
贮存条件:清洁卫生,请置于干燥通风处,,防止受潮。
高中化学
品名:食品添加剂碳酸氢钠(食用小苏打)
配料:碳酸氯钠
规格:200克/袋
生产日期: 见封口
保 质 期 : 十 二 个 月
贮存方法:通风干燥处避免高温受热
2 碳酸钠和碳酸氢钠
良 用 碱
区服现品
避免高温受热
区制作面条
M 码味上案 W 去称油污
勤道
临时
解缴 方便
制作面包类食品时,常用碳酸氢钠和固体酸性材料做
成的膨松剂,这种膨松剂在接触水时会产生气体,烘焙时会
产生更多气体,使面包更为松软。
配料:焦磷酸二氢二钠(38%),碳 酸氢钠(32%),玉米淀粉,磷酸 图 钙(5%),酒石酸氢钾(5%) 碳酸钙(5%)
使用范围:适合制作蛋糕、面包、糕 点等。
签些
Eaing Aucer t2mh 无铝富双效泡打努
复合影松剂
高中化学
任务三碳酸钠和碳酸氢钠的外观相似,如何鉴别
NaHCO
白色细小晶体
Na CO
白色粉末
(1)外观
高中化学
盐 Na CO
NaHCO
(2)向两支试管中分别滴入 几滴水,振荡,观察现象;用 手触摸试管壁,感受热量变化 加几滴水后, 结块变成晶体; 温度上升
结论与解释 无水碳酸钠遇水生成有结晶水的 碳酸钠晶体(Na CO · xH O), 并伴随放热现象。
在两支试管中分别加入少量Na CO 和NaHCO (各约1 g)
高中化学
盐 Na CO
NaHCO
(2)向两支试管中分别滴入 几滴水,振荡,观察现象;用 手触摸试管壁,感受热量变化 加几滴水后, 结块变成晶体; 温度上升
加几滴水后, 少部分溶解; 温度下降
结论与解释 无水碳酸钠遇水生成有结晶水的 碳酸钠晶体(Na CO · xH O),并 伴随放热现象。碳酸氢钠能溶于 水,并伴随吸热现象。
在两支试管中分别加入少量Na CO 和NaHCO (各约1 g)
高中化学
盐 Na CO
NaHCO
(3)继续向(2)的试管中 分别加入5 mL水,用力振荡。 振荡后可溶解
固体量有所减少
初步结论 碳酸钠和碳酸氢钠均能溶于水, 碳酸钠溶解性更强。
数据
溶解度(20℃)
Na CO :21.5 g
NaHCO :9.6 g
高中化学
盐 Na CO
NaHCO
(4)分别向(3)所得溶液 中滴入1~2滴酚酞溶液 溶 液 变 红 (较深)
溶 液 微 红
初步结论 两种物质的水溶液均呈碱性, 且碱性:Na CO >NaHCO 。
高中化学
盐 Na CO
NaHCO
(5)分别加热Na CO 和 NaHCO ,观察现象。 无明显现象
试管口有小液滴出 现,澄清石灰水变 浑浊
初步结论 碳酸钠较稳定,受热不易分解。 碳酸氢钠不稳定,受热易分解
2NaHCO △Na CO +H O+CO ↑
高中化学
NaHCO
或 N a C O
峇
澄清 石灰水
等质量的碳酸氢
钠和碳酸钠分别与足 量盐酸反应,NaHCO
产生CO 更多。
碳酸钠或碳酸氢钠与盐酸反应装置
(6)与酸反应
NaHCO +HCl=—NaCl+H O+CO T
Na CO +2HCl =2NaCI+H O+CO 1
高中化学
结构
决 定
性质
决定
用途
NaHCO
钠盐
碳酸氢盐
物质
类别
构成
粒子
Na CO
钠盐
碳酸盐
Na+、Co Na+ 、HCO
高中化学
任务四 请结合性质解释用途
(1)厨房去油污,为什么建议用碳酸钠而不是用碳酸氢钠
碳酸钠碱性强
食用小苏打
联酸氧 品 有
W 清洗果蒸蛇心
M 梦用多多实患
食 用 碱
碳酸纳登液市防
高中化学
团涨发干质
任务四 请结合性质解释用途
(2)治疗胃酸过多为什么选用碳酸氢钠而不用碳酸钠
NaHCO 碱性弱,对人体
伤害小,且见效迅速
碳酸氯钠片
HatFccagriscena )
FIFBFSNQEB*,QN
广照 药盖白图公司
高中化学
作作指用而制高物
造纸 制玻璃
高中化学
化工之母——纯碱
Na CO
纺织
制皂
科学史话
1940年中国科学家侯德榜发明了“侯氏制碱法”,成为世界上生 产纯碱的重要方法。其主要化学原理是:
1.CO +H O+NH +NaCl (饱和)——NH CI+NaHCO ↓
上述原理中应用了NaHCO 的哪些性质
碳酸氢钠的溶解性
和对热具有不稳定性
高中化学
侯德榜
课后任务
尝试设计钠及其化合物的转化路径,
并围绕转化关系书写相应的化学方程式。
高中化学
物质类别 代表物
单质 → Na
氧化物→ Na 0和Na O
氢氧化物 NaOH
盐 >Na CO 和 NaHCO
研究内容
物理性质
> 化学性质
制法 用途
■■
金属及其化合物的研究思路
高中化学
金属及其化合物的研究思路
物质类别 代表物 研究内容 研究视角
单质 → Na 物理性质
化学性质 物质分类
制法 元素化合价
氢氧化物— NaOH
用途 反应规律
盐 → Na CO 和NaHCO
比较法类比法实验法 观察法 归纳法
高中化学
■ ■
氧化物 → Na O和 Na O
