非金属及其化合物性质 课件(共15张PPT)
文档属性
| 名称 | 非金属及其化合物性质 课件(共15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 805.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-26 17:25:38 | ||
图片预览





文档简介
(共15张PPT)
非金属及其化合物性质
学习目标:
1.通过对元素周期律的复习, 能够对非金属性强弱进行判断并从结构上
进行解释。
2. 能够从物质分类入手, 认识非金属元素单质及化合物的通性及常见特
例, 并加以应用。
高中化学
高中化学
例题:
已知: 一 定条件下可发生H2 +X2 2HX ( X表示卤素)
(1 )X2都能与H2 反应生成HX, 用原子结构解释原因:
写出HX的电子式 。
(2 ) 在HX中的化学键为 (“ 离子键 ”“ 极性共价键 ”“ 非极
性共价键 ”) 共价键的极性随共用电子对偏移程度的增大而增强, HX共 价键的极性由强到弱的顺序是 。
(3 ) 从F2 到I2, 上述反应正向进行的程度越来越小, 用原子结构解释原
因:
例题:
已知: 一 定条件下可发生H2 +X2 2HX ( X表示卤素)
(1 )X2都能与H2 反应生成HX, 用原子结构解释原因: 卤素原 子 的 最 外层 电 子数均为7
主族序数 = 原子最外层电子数
。
写出HX的电子式
H ·
高中化学
· ·
X
··
· ·
X
··
H
· ·
· ·
· ·
·
高中化学
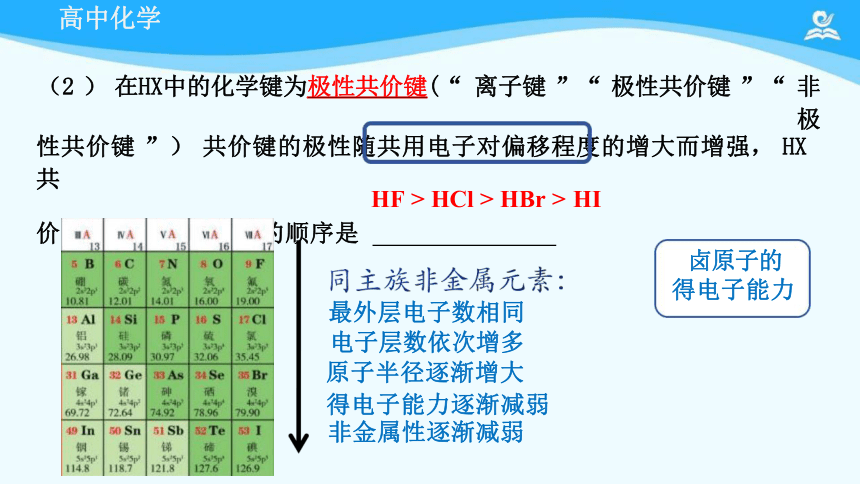
(2 ) 在HX中的化学键为极性共价键(“ 离子键 ”“ 极性共价键 ”“ 非极
性共价键 ”) 共价键的极性随共用电子对偏移程度的增大而增强, HX共
价键的极性由强到弱的顺序是
最外层电子数相同
电子层数依次增多
原子半径逐渐增大
得电子能力逐渐减弱 非金属性逐渐减弱
卤原子的
得电子能力
HF > HCl > HBr > HI
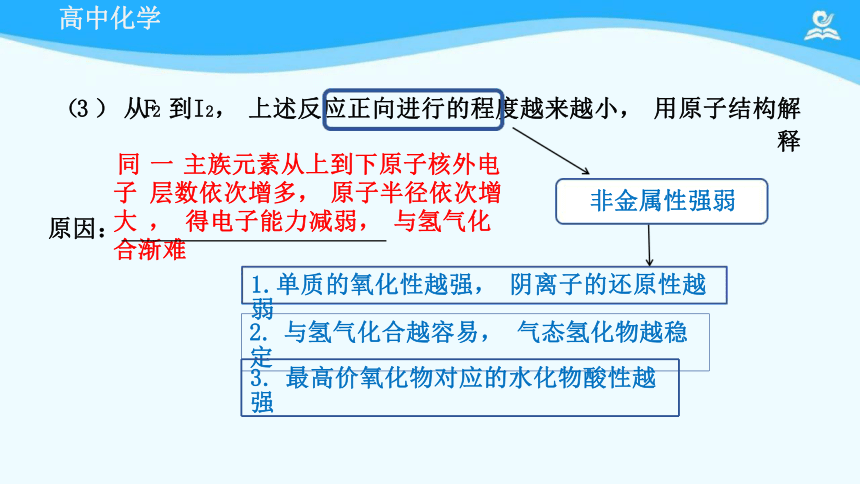
1.单质的氧化性越强, 阴离子的还原性越弱
同 一 主族元素从上到下原子核外电子 层数依次增多, 原子半径依次增大 , 得电子能力减弱, 与氢气化合渐难
(3 ) 从F2 到I2, 上述反应正向进行的程度越来越小, 用原子结构解释
2. 与氢气化合越容易, 气态氢化物越稳定
3. 最高价氧化物对应的水化物酸性越强
非金属性强弱
原因:
高中化学
高中化学
已知: 一 定条件下可发生H2 +X2 2HX ( X表示卤素)
(1 )X2都能与H2 反应生成HX, 用原子结构解释原因: 卤素原子的最
:
外层电子数均为7 写出HX的电子式 H:X:
:
(2 ) 在HX中的化学键为极性共价键(“ 离子键 ”“ 极性共价键 ”“ 非 极性共价键 ”) 共价键的极性随共用电子对偏移程度的增大而增强 , HX共价键的极性由强到弱的顺序是 HF > HCl > HBr > HI
(3 ) 从F2 到I2, 上述反应正向进行的程度越来越小, 用原子结构解释
原因: 同 一 主族元素从上到下原子核外电子层数依次增多, 原子半径依 次增大, 得电子能力减弱, 与氢气化合渐难
核电荷数(质子数)
反映
位置
核外电子数
决定
元素性质
单质性质
化合物性质
离子性质
利用递变规律推知性质
判断元素, 推知位置
电子层数
最外层
电子数
性质
结构
周期
族
高中化学
反映
决定
非金属单质 物质类别
1. 与金属单质反应 无氧酸盐
Cl2 , S , N2 与金属的反应各举 一例
2Fe + 3Cl2 2FeCl3
Fe + S FeS
3Mg + N2 Mg3N2
用来比较氧化剂的氧 化性强弱
高中化学
2. 与氧气反应 一→ 非金属氧化物
Si , S , N2 与氧气的反应
Si + O2 SiO2
S + O2 SO2
放电 2NO
高中化学
N2 + O2
非金属单质
3. 与H2 反应 —→ 气态氢化物
H2 + Cl2 2HCl
N2 + H2 Si +2H2 高温,高压 催化剂 SiH4
2NH3
Si + 4HF = SiF4 + 2H2↑
H2 + S
H2S
特殊性质
物质类别
高中化学
或光照
1. 与碱性氧化物反应 含氧酸盐
SO2 + CaO = CaSO3
SiO2 + CaO = CaSiO3
酸性氧化物:SO2 , SO3 , SiO2
SO2 + H2O = H2SO3 (SiO2 除外)
SiO2 + Na2CO3 Na2SiO3 + CO2
SO2 + 2NaOH = Na2SO3 + H2O
非金属氧化物
2. 与碱反应 盐和水
3. 与水反应 酸
物质类别
特殊反应
高中化学
不变价
含氧酸 物质类别
H2SO4 、HNO3 、 H2SiO3 、H2CO3
1. 与碱性氧化物反应 → 盐和水
CuO + 2HNO3= Cu(NO3)2 + H2O
2. 与碱反应 → 盐和水
H2SiO3 + 2NaOH = Na2SiO3 + H2OSiO3
3. 与盐反应 → 新盐和新酸(较强酸制较弱酸)
Ca(ClO)2 + H2O + CO2 = CaCO3 + HClO
Na2CO3 + H2O + CO2 = 2NaHCO3
4. 与金属反应 →盐和氢气(浓H2SO4,HNO3 除外)
高中化学
1. 与碱反应→新盐和新碱 (较强碱制较弱碱)
NH4Cl + NaOH = NaCl + NH3 ·H2O
NaHCO3 + NaOH = Na2CO3 + H2O
2. 与盐反应 两种新盐
Na2SO3 + BaCl2 = 2NaCl + BaSO3
物质类别
高中化学
盐
高中化学
感谢同学们的收看
祝同学们学业进步
非金属及其化合物性质
学习目标:
1.通过对元素周期律的复习, 能够对非金属性强弱进行判断并从结构上
进行解释。
2. 能够从物质分类入手, 认识非金属元素单质及化合物的通性及常见特
例, 并加以应用。
高中化学
高中化学
例题:
已知: 一 定条件下可发生H2 +X2 2HX ( X表示卤素)
(1 )X2都能与H2 反应生成HX, 用原子结构解释原因:
写出HX的电子式 。
(2 ) 在HX中的化学键为 (“ 离子键 ”“ 极性共价键 ”“ 非极
性共价键 ”) 共价键的极性随共用电子对偏移程度的增大而增强, HX共 价键的极性由强到弱的顺序是 。
(3 ) 从F2 到I2, 上述反应正向进行的程度越来越小, 用原子结构解释原
因:
例题:
已知: 一 定条件下可发生H2 +X2 2HX ( X表示卤素)
(1 )X2都能与H2 反应生成HX, 用原子结构解释原因: 卤素原 子 的 最 外层 电 子数均为7
主族序数 = 原子最外层电子数
。
写出HX的电子式
H ·
高中化学
· ·
X
··
· ·
X
··
H
· ·
· ·
· ·
·
高中化学
(2 ) 在HX中的化学键为极性共价键(“ 离子键 ”“ 极性共价键 ”“ 非极
性共价键 ”) 共价键的极性随共用电子对偏移程度的增大而增强, HX共
价键的极性由强到弱的顺序是
最外层电子数相同
电子层数依次增多
原子半径逐渐增大
得电子能力逐渐减弱 非金属性逐渐减弱
卤原子的
得电子能力
HF > HCl > HBr > HI
1.单质的氧化性越强, 阴离子的还原性越弱
同 一 主族元素从上到下原子核外电子 层数依次增多, 原子半径依次增大 , 得电子能力减弱, 与氢气化合渐难
(3 ) 从F2 到I2, 上述反应正向进行的程度越来越小, 用原子结构解释
2. 与氢气化合越容易, 气态氢化物越稳定
3. 最高价氧化物对应的水化物酸性越强
非金属性强弱
原因:
高中化学
高中化学
已知: 一 定条件下可发生H2 +X2 2HX ( X表示卤素)
(1 )X2都能与H2 反应生成HX, 用原子结构解释原因: 卤素原子的最
:
外层电子数均为7 写出HX的电子式 H:X:
:
(2 ) 在HX中的化学键为极性共价键(“ 离子键 ”“ 极性共价键 ”“ 非 极性共价键 ”) 共价键的极性随共用电子对偏移程度的增大而增强 , HX共价键的极性由强到弱的顺序是 HF > HCl > HBr > HI
(3 ) 从F2 到I2, 上述反应正向进行的程度越来越小, 用原子结构解释
原因: 同 一 主族元素从上到下原子核外电子层数依次增多, 原子半径依 次增大, 得电子能力减弱, 与氢气化合渐难
核电荷数(质子数)
反映
位置
核外电子数
决定
元素性质
单质性质
化合物性质
离子性质
利用递变规律推知性质
判断元素, 推知位置
电子层数
最外层
电子数
性质
结构
周期
族
高中化学
反映
决定
非金属单质 物质类别
1. 与金属单质反应 无氧酸盐
Cl2 , S , N2 与金属的反应各举 一例
2Fe + 3Cl2 2FeCl3
Fe + S FeS
3Mg + N2 Mg3N2
用来比较氧化剂的氧 化性强弱
高中化学
2. 与氧气反应 一→ 非金属氧化物
Si , S , N2 与氧气的反应
Si + O2 SiO2
S + O2 SO2
放电 2NO
高中化学
N2 + O2
非金属单质
3. 与H2 反应 —→ 气态氢化物
H2 + Cl2 2HCl
N2 + H2 Si +2H2 高温,高压 催化剂 SiH4
2NH3
Si + 4HF = SiF4 + 2H2↑
H2 + S
H2S
特殊性质
物质类别
高中化学
或光照
1. 与碱性氧化物反应 含氧酸盐
SO2 + CaO = CaSO3
SiO2 + CaO = CaSiO3
酸性氧化物:SO2 , SO3 , SiO2
SO2 + H2O = H2SO3 (SiO2 除外)
SiO2 + Na2CO3 Na2SiO3 + CO2
SO2 + 2NaOH = Na2SO3 + H2O
非金属氧化物
2. 与碱反应 盐和水
3. 与水反应 酸
物质类别
特殊反应
高中化学
不变价
含氧酸 物质类别
H2SO4 、HNO3 、 H2SiO3 、H2CO3
1. 与碱性氧化物反应 → 盐和水
CuO + 2HNO3= Cu(NO3)2 + H2O
2. 与碱反应 → 盐和水
H2SiO3 + 2NaOH = Na2SiO3 + H2OSiO3
3. 与盐反应 → 新盐和新酸(较强酸制较弱酸)
Ca(ClO)2 + H2O + CO2 = CaCO3 + HClO
Na2CO3 + H2O + CO2 = 2NaHCO3
4. 与金属反应 →盐和氢气(浓H2SO4,HNO3 除外)
高中化学
1. 与碱反应→新盐和新碱 (较强碱制较弱碱)
NH4Cl + NaOH = NaCl + NH3 ·H2O
NaHCO3 + NaOH = Na2CO3 + H2O
2. 与盐反应 两种新盐
Na2SO3 + BaCl2 = 2NaCl + BaSO3
物质类别
高中化学
盐
高中化学
感谢同学们的收看
祝同学们学业进步
