2024年中考化学专题复习热点突破:工艺流程题 课件(共46张PPT)
文档属性
| 名称 | 2024年中考化学专题复习热点突破:工艺流程题 课件(共46张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 740.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-26 10:36:32 | ||
图片预览








文档简介
(共46张PPT)
工艺流程题
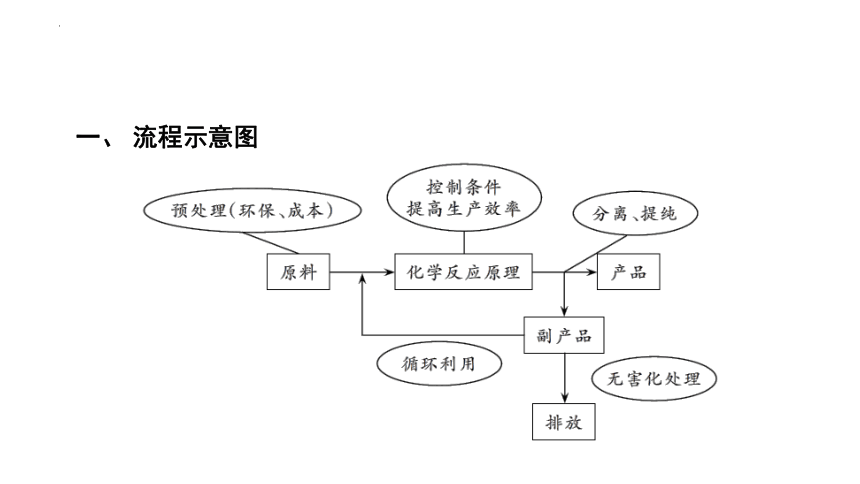
一、 流程示意图
二、 解题步骤
步骤 内容
写化学式 写出原料所有物质成分的化学式
写化学方程式 写出每一步反应的化学方程式,明确上一步哪些产物可以进入下一步反应中;省略哪些产物,可否循环等
注意加入试剂的量 思考为何是少量或过量,过量会进入到下一步反应中
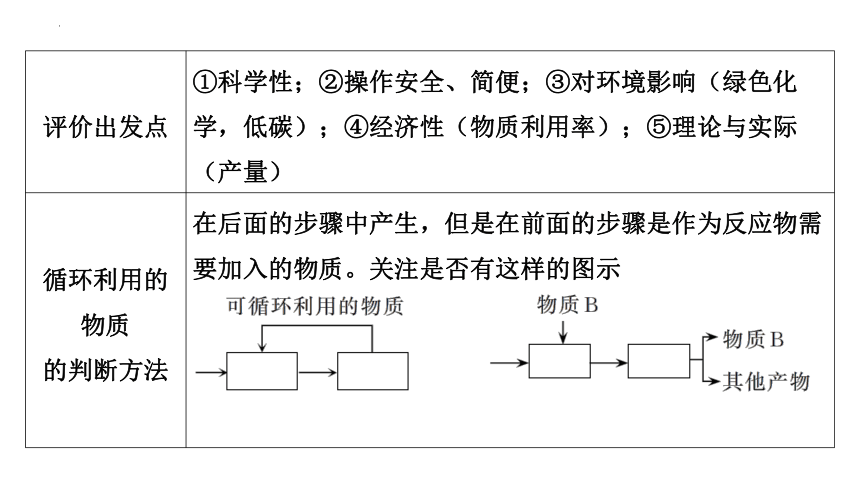
评价出发点 ①科学性;②操作安全、简便;③对环境影响(绿色化学,低碳);④经济性(物质利用率);⑤理论与实际(产量)
循环利用的物质 的判断方法 在后面的步骤中产生,但是在前面的步骤是作为反应物需要加入的物质。关注是否有这样的图示
1. 原料预处理的方法和作用
方法 作用
粉碎、研磨 增大反应物的接触面积,使反应更快、更充分
煅烧、灼烧、焙烧 使固体在高温下分解,增大转化率
加水溶解 增大离子间的接触机会,加快反应速率;分离可溶物与不溶物
酸浸、碱浸 溶解与酸或碱反应的物质
【注意】为了提高“浸取”步骤的反应速率,可采用:将固体原料研碎、增大酸或碱的浓度、升高温度、搅拌等
2. 流程中的分离、提纯等操作
(1)“ ”必然是经过了过滤操作。
(2)从溶液中获得晶体的方法有两种:蒸发结晶、降温结晶。
得到溶解度受温度影响变化不大的物质(如从氯化钠与硝酸钾混合溶液中提纯氯化钠) 蒸发结晶,趁热过滤
得到溶解度随温度升高而增大的物质 蒸发浓缩→降温结晶→过滤→洗涤→干燥
3. 流程中反应条件的控制
调节pH 调节溶液的酸碱度;使某些金属离子形成沉淀而分离等
控制温度在一定范围 防止某种物质温度过高时分解;控制物质的溶解与结晶等
加入过量(或适量)试剂 除去某物质或使某物质转化为目标产物等
通入保护气(氮气或稀有气体)的作用 防止主物质与空气中的氧气等发生反应
4. 利用信息书写流程中的化学方程式、反应类型的判断
寻找反应物和生成物 根据箭头方向判断,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)或不参与反应的杂质
查漏补缺 若从已知信息中找出的反应物和生成物不满足质量守恒定律:①考虑是否有水参与或生成;②若通入空气,则需考虑O2或CO2是否参加反应,然后根据题意写出反应条件并配平,最后根据反应特征判断基本反应类型
知识拓展
(1) 从金属盐溶液中获得金属单质常用的基本反应类型是 置换反应 。
(2) 从 NaCl溶液中获取 NaCl可以采用 蒸发结晶 方法。
(3) 提纯含有 NaCl杂质的 KNO3的步骤: 溶解、 蒸发浓缩、 降温结晶 、 过滤、 洗涤、 干燥。
(4) 很多题中加入的反应物要过量的原因是 将能使与其反应的物质反应完全 , 过量的结果是 导致加入的该反应物有剩余 。
(5) 分离 KCl 和 MnO2固体混合物的方法是向固体中加足量水溶解, 过滤 , 将滤渣 洗涤 、 干燥 得到 MnO2 ; 将滤液 蒸发结晶 得到 KCl 。
置换反
应
蒸发结晶
降
温结晶
将能使与其反应的物
质反应完全
导致加入的该反应物有剩余
过滤
洗涤
干燥
MnO2
蒸发结晶
KCl
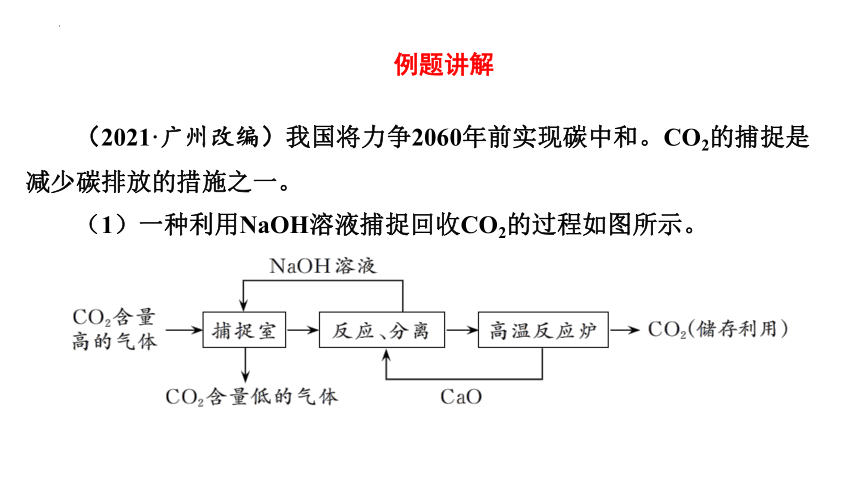
(2021·广州改编)我国将力争2060年前实现碳中和。CO2的捕捉是减少碳排放的措施之一。
(1)一种利用NaOH溶液捕捉回收CO2的过程如图所示。
例题讲解
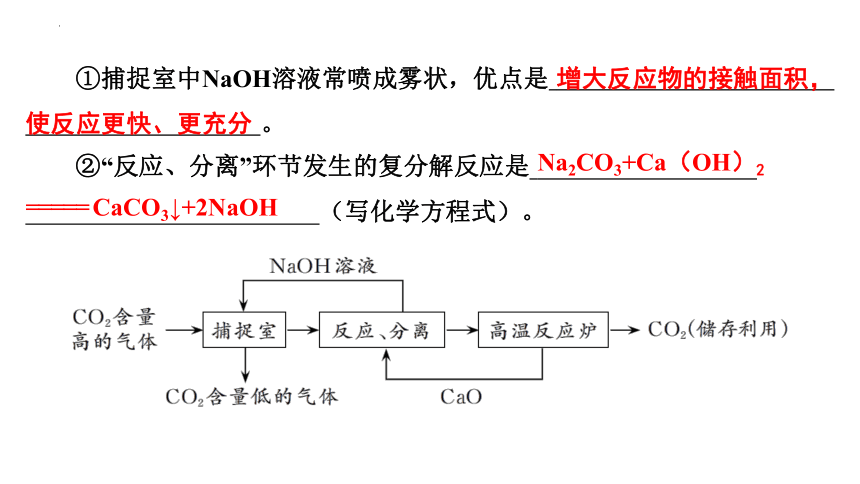
①捕捉室中NaOH溶液常喷成雾状,优点是 增大反应物的接触面积,使反应更快、更充分 。
②“反应、分离”环节发生的复分解反应是 Na2CO3+Ca(OH)2======= CaCO3↓+2NaOH (写化学方程式)。
增大反应物的接触面积,
使反应更快、更充分
Na2CO3+Ca(OH)2
===== CaCO3↓+2NaOH
③“反应、分离”环节分离物质采用的方法是 过滤 ,所用到的玻璃仪器有烧杯、漏斗和 玻璃棒 。
④“高温反应炉”中发生反应的基本反应类型是 分解反应 。
过滤
玻璃棒
分解反应
⑤CO2用途广泛,写出其中一种用途: 用作人工降雨(合理即可) 。
⑥整个流程中可循环利用的物质是 NaOH、CaO 。(填化学式)
用作人工降雨(合理即
可)
NaOH、CaO
(2)CaO固体也可以捕捉回收CO2。研究表明CaC2O4·H2O热分解制得的CaO疏松多孔,具有良好的CO2捕捉性能。取1.46 g CaC2O4·H2O进行加热,固体质量随温度变化如图。
①写出400~600 ℃范围内分解反应的化学方程式: CaC2O4 CaCO3+CO↑ (CaC2O4·H2O的相对分子质量:146)。
②据图分析,CaO捕捉CO2的反应温度应 低于 (填“高于”或“低于”)800 ℃。
CaC2O4
CaCO3+CO↑
低于
物质的制备、生产
1. (2023·广东)电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和。该新方法的示意图如图1所示。
达标训练
(1)传统方法:CaCO3在900 ℃以上完全分解生成CaO和 CO2 (填化学式)。
CO2
(2)新方法:
i. 电解水属于 分解 反应(填基本反应类型),反应前后氢元素的化合价 降低 (填“升高”“降低”或“不变”)。
分解
降低
ii. 反应器1:一定的H2环境及较低温度下,CaCO3可与H2反应生成CaO、CO和H2O,CO与H2O的分子个数比为 1∶1 。CaCO3还可以直接分解。反应器1中CO、CO2的含量随反应温度的变化如图2所示, 750 ℃时,抑制CO2生成的效果最好。
1∶1
750
iii. 反应器2:一定条件下,CO与H2发生化合反应生成甲醇(CH3OH),化学方程式为 CH3OH 。
CO+2H2
CH3OH
(3)与传统方法相比,新方法的优点有 降低了反应温度;减少了CO2生成(合理即可) (写两条)。
降低了反应温度;减少了
CO2生成(合理即可)
2. (2023·深圳)某同学以金泥(含有Au、CuS、ZnS等)为原料制备Au和Cu的流程如图所示:
某同学查阅资料已知:
①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将Cu、Zn转化为氧化物,并完全分离出ZnO烟尘。
(1)“预处理”中会产生SO2,若SO2直接排放会导致 空气污染(或酸雨) 。
(2)“过程Ⅱ”产生的固体a中,除CuO外一定还有的物质是 Au 。(填化学式)
(3)“过程Ⅲ”分离Au的操作是 过滤 ,加入过量稀硫酸的目的是 将CuO完全转化为CuSO4 。
空气污染(或
酸雨)
Au
过滤
将
CuO完全转化为CuSO4
(4)“系列过程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为 Fe+H2SO4======= FeSO4+H2↑ ,该反应属于 置换 反应(填基本反应类型)。
(5)ZnO烟尘可用NaOH溶液吸收,该反应生成偏锌酸钠(Na2ZnO2)和H2O的化学方程式为 ZnO+2NaOH=====Na2ZnO2+H2O 。
Fe+H2SO4===== FeSO4+H2↑
置换
ZnO+2NaOH=====
Na2ZnO2+H2O
环保与资源的回收利用
3. (2023·岳阳)为了防止环境污染,工厂废液需经过处理达标后才能排放。某电镀厂为了减少对水的污染并节约成本,从排放的废液(主要含ZnSO4、FeSO4和CuSO4)中回收金属铜、铁以及工业原料硫酸锌,设计了如图所示的工艺流程,请据图回答下列问题:
(1)步骤Ⅰ中分离固体A和溶液C的操作中用到的玻璃棒的作用是 引流 。
(2)物质Y的化学式为 H2SO4 。
引
流
H2SO4
(3)请写出步骤Ⅲ中生成Fe的化学方程式: Zn+FeSO4======= ZnSO4+Fe 。
(4)请写一条保护金属资源的有效途径: 废旧金属回收再利用(或寻找金属替代品等,合理即可) 。
Zn+FeSO4=====
ZnSO4+Fe
废旧金属回收再利用(或
寻找金属替代品等,合理即可)
4. (2023·烟台)海洋是巨大的资源宝库,人类应合理开发利用。以下是烟台市对海水综合利用的部分工艺流程图(部分过程和产物略),据图回答问题:
(1)海水淡化:蒸馏法淡化海水是利用海水中各成分的 沸点 不同进行分离的。
(2)海水晒盐:晒盐时,采用的结晶方法是 蒸发结晶 ;海水晒盐后得到的卤水是氯化钠的 饱和 (填“饱和”或“不饱和”)溶液。
沸点
蒸发结晶
饱和
(3)海水制镁:在用卤水制镁的过程中发生中和反应的化学方程式是 Mg(OH)2+2HCl======= MgCl2+2H2O 。
Mg(OH)2+2HCl===== MgCl2+2H2O
(4)海水制“碱”:在用粗盐(含MgCl2、CaCl2杂质)制纯碱过程中,除杂时,先后加入过量的NaOH溶液和Na2CO3溶液产生的沉淀是 Mg(OH)2、CaCO3 (填化学式)。由氯化钠制取纯碱,从元素守恒的角度看,还需要含有 碳、氧(或C、O) 元素的物质参加反应。
Mg(OH)2、CaCO3
碳、氧(或C、O)
物质的分离、提纯
5. (2023·广州改编)制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主要过程如图1:
(1)“除杂1”应依次加入的两种试剂是 Ca(OH)2 、 Na2CO3 ,“除杂2”应加入的试剂是 HCl 。[除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2]
Ca(OH)2
Na2CO3
HCl
(2)将“溶液A”在80 ℃蒸发浓缩,至有少量固体析出。
①该小组分析溶解度曲线,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释: 溶液中Na2SO4的含量高于NaCl,蒸发浓缩时Na2SO4先达到饱和状态而析出 。
溶液中Na2SO4的含量高于NaCl,蒸
发浓缩时Na2SO4先达到饱和状态而析出
②该小组停止蒸发浓缩,经 降温结晶 、过滤得到大量Na2SO4固体及母液;将母液中的NaCl分离出来,操作是 加热蒸发溶剂 至有较多晶体析出,趁热过滤,洗涤,干燥。
降温结晶
加热蒸发溶剂
(3)设计由硫磺(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式: S+O2 SO2、SO2+2NaOH======= Na2SO3+H2O、2Na2SO3+O2======= 2Na2SO4(合理即可) 。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
S+O2 SO2、SO2+2NaOH===== Na2SO3+H2O、
2Na2SO3+O2===== 2Na2SO4(合理即可)
创新类
6. [化学与技术](2023·山西)制作豆腐过程中用到了盐卤。盐卤是我国数千年来豆腐制作的传统凝固剂,有较好的溶解性和凝固性,主要成分为氯化钠(含量约2%~6%)和氯化钾(含量约2%~4%)等。豆腐的制作流程如下,请结合图文信息,分析思考,解决问题:
(1)研磨机将豆子研碎、研细的目的是 增大接触面积,使后续反应更快、更充分(合理即可) 。
(2)煮浆器内在煮沸过程中,可将有毒豆浆转化为无毒豆浆,发生的主要变化是 化学变化 。(填“化学变化”或“物理变化”)
增大接触面积,使后续反应
更快、更充分(合理即可)
化学变化
(3)为加快凝固速度,当把盐卤慢慢加入混合器时,需进行的操作是 搅拌 。
(4)向盐卤中滴加AgNO3溶液,发生反应的化学方程式为 AgNO3+NaCl======= AgCl↓+NaNO3 (写1个)。
(5)“花开富贵”是一道吃出咸辣味、品出世间美的豆腐制品,它有强筋骨、防贫血等功效,由此推知,这种食物含有的微量元素是 铁元素(或Fe) 。
搅拌
AgNO3+NaCl===== AgCl↓+NaNO3
铁元素
(或Fe)
7. [化学与科技](2023·潍坊)氢能助力“神舟十六”邀游太空,氢氧燃料电池技术在航海、航空、航天等方面发展迅速。图1是氢气的制取、储存、释放和应用的流程图。
请回答下列问题:
(1)利用太阳光和催化剂可实现水的高效分解。图2为光解制氢的微观模型图,写出反应Ⅰ的化学方程式 4H2O 2H2↑+2H2O2 。
4H2O 2H2↑+2H2O2
(2)气态储氢是将氢气压缩存储于高压罐中,请从微观角度分析氢气能被压缩的原因: 氢气分子之间有间隔 。
氢气分子之间有间隔
(3)固态储氢是通过合金材料在一定条件下的化学吸附储氢。图1利用镁镍合金(Mg2Ni)存储氢气,该储氢反应的化学方程式为 Mg2Ni+2H2 Mg2NiH4 。在熔炼镁镍合金时,需要通入氩气作保护气,目的是 防止镁、镍在高温下与氧气反应 。
Mg2Ni+2H2 Mg2NiH4
防止镁、镍在高温下与氧气反应
(4)氢氧燃料电池的总反应可表示为2H2+O22H2O,工作过程中的能量转化形式是 化学能转化为电能 。
化学能转化为电能
工艺流程题
一、 流程示意图
二、 解题步骤
步骤 内容
写化学式 写出原料所有物质成分的化学式
写化学方程式 写出每一步反应的化学方程式,明确上一步哪些产物可以进入下一步反应中;省略哪些产物,可否循环等
注意加入试剂的量 思考为何是少量或过量,过量会进入到下一步反应中
评价出发点 ①科学性;②操作安全、简便;③对环境影响(绿色化学,低碳);④经济性(物质利用率);⑤理论与实际(产量)
循环利用的物质 的判断方法 在后面的步骤中产生,但是在前面的步骤是作为反应物需要加入的物质。关注是否有这样的图示
1. 原料预处理的方法和作用
方法 作用
粉碎、研磨 增大反应物的接触面积,使反应更快、更充分
煅烧、灼烧、焙烧 使固体在高温下分解,增大转化率
加水溶解 增大离子间的接触机会,加快反应速率;分离可溶物与不溶物
酸浸、碱浸 溶解与酸或碱反应的物质
【注意】为了提高“浸取”步骤的反应速率,可采用:将固体原料研碎、增大酸或碱的浓度、升高温度、搅拌等
2. 流程中的分离、提纯等操作
(1)“ ”必然是经过了过滤操作。
(2)从溶液中获得晶体的方法有两种:蒸发结晶、降温结晶。
得到溶解度受温度影响变化不大的物质(如从氯化钠与硝酸钾混合溶液中提纯氯化钠) 蒸发结晶,趁热过滤
得到溶解度随温度升高而增大的物质 蒸发浓缩→降温结晶→过滤→洗涤→干燥
3. 流程中反应条件的控制
调节pH 调节溶液的酸碱度;使某些金属离子形成沉淀而分离等
控制温度在一定范围 防止某种物质温度过高时分解;控制物质的溶解与结晶等
加入过量(或适量)试剂 除去某物质或使某物质转化为目标产物等
通入保护气(氮气或稀有气体)的作用 防止主物质与空气中的氧气等发生反应
4. 利用信息书写流程中的化学方程式、反应类型的判断
寻找反应物和生成物 根据箭头方向判断,箭头进入的是反应物,出去的是生成物(包括主产物和副产物)或不参与反应的杂质
查漏补缺 若从已知信息中找出的反应物和生成物不满足质量守恒定律:①考虑是否有水参与或生成;②若通入空气,则需考虑O2或CO2是否参加反应,然后根据题意写出反应条件并配平,最后根据反应特征判断基本反应类型
知识拓展
(1) 从金属盐溶液中获得金属单质常用的基本反应类型是 置换反应 。
(2) 从 NaCl溶液中获取 NaCl可以采用 蒸发结晶 方法。
(3) 提纯含有 NaCl杂质的 KNO3的步骤: 溶解、 蒸发浓缩、 降温结晶 、 过滤、 洗涤、 干燥。
(4) 很多题中加入的反应物要过量的原因是 将能使与其反应的物质反应完全 , 过量的结果是 导致加入的该反应物有剩余 。
(5) 分离 KCl 和 MnO2固体混合物的方法是向固体中加足量水溶解, 过滤 , 将滤渣 洗涤 、 干燥 得到 MnO2 ; 将滤液 蒸发结晶 得到 KCl 。
置换反
应
蒸发结晶
降
温结晶
将能使与其反应的物
质反应完全
导致加入的该反应物有剩余
过滤
洗涤
干燥
MnO2
蒸发结晶
KCl
(2021·广州改编)我国将力争2060年前实现碳中和。CO2的捕捉是减少碳排放的措施之一。
(1)一种利用NaOH溶液捕捉回收CO2的过程如图所示。
例题讲解
①捕捉室中NaOH溶液常喷成雾状,优点是 增大反应物的接触面积,使反应更快、更充分 。
②“反应、分离”环节发生的复分解反应是 Na2CO3+Ca(OH)2======= CaCO3↓+2NaOH (写化学方程式)。
增大反应物的接触面积,
使反应更快、更充分
Na2CO3+Ca(OH)2
===== CaCO3↓+2NaOH
③“反应、分离”环节分离物质采用的方法是 过滤 ,所用到的玻璃仪器有烧杯、漏斗和 玻璃棒 。
④“高温反应炉”中发生反应的基本反应类型是 分解反应 。
过滤
玻璃棒
分解反应
⑤CO2用途广泛,写出其中一种用途: 用作人工降雨(合理即可) 。
⑥整个流程中可循环利用的物质是 NaOH、CaO 。(填化学式)
用作人工降雨(合理即
可)
NaOH、CaO
(2)CaO固体也可以捕捉回收CO2。研究表明CaC2O4·H2O热分解制得的CaO疏松多孔,具有良好的CO2捕捉性能。取1.46 g CaC2O4·H2O进行加热,固体质量随温度变化如图。
①写出400~600 ℃范围内分解反应的化学方程式: CaC2O4 CaCO3+CO↑ (CaC2O4·H2O的相对分子质量:146)。
②据图分析,CaO捕捉CO2的反应温度应 低于 (填“高于”或“低于”)800 ℃。
CaC2O4
CaCO3+CO↑
低于
物质的制备、生产
1. (2023·广东)电解水制氢联合碳酸钙分解制备氧化钙,能减少碳排放,助力碳中和。该新方法的示意图如图1所示。
达标训练
(1)传统方法:CaCO3在900 ℃以上完全分解生成CaO和 CO2 (填化学式)。
CO2
(2)新方法:
i. 电解水属于 分解 反应(填基本反应类型),反应前后氢元素的化合价 降低 (填“升高”“降低”或“不变”)。
分解
降低
ii. 反应器1:一定的H2环境及较低温度下,CaCO3可与H2反应生成CaO、CO和H2O,CO与H2O的分子个数比为 1∶1 。CaCO3还可以直接分解。反应器1中CO、CO2的含量随反应温度的变化如图2所示, 750 ℃时,抑制CO2生成的效果最好。
1∶1
750
iii. 反应器2:一定条件下,CO与H2发生化合反应生成甲醇(CH3OH),化学方程式为 CH3OH 。
CO+2H2
CH3OH
(3)与传统方法相比,新方法的优点有 降低了反应温度;减少了CO2生成(合理即可) (写两条)。
降低了反应温度;减少了
CO2生成(合理即可)
2. (2023·深圳)某同学以金泥(含有Au、CuS、ZnS等)为原料制备Au和Cu的流程如图所示:
某同学查阅资料已知:
①预处理的主要目的是将含硫化合物转化为氧化物。
②热空气流充分加热的目的是将Cu、Zn转化为氧化物,并完全分离出ZnO烟尘。
(1)“预处理”中会产生SO2,若SO2直接排放会导致 空气污染(或酸雨) 。
(2)“过程Ⅱ”产生的固体a中,除CuO外一定还有的物质是 Au 。(填化学式)
(3)“过程Ⅲ”分离Au的操作是 过滤 ,加入过量稀硫酸的目的是 将CuO完全转化为CuSO4 。
空气污染(或
酸雨)
Au
过滤
将
CuO完全转化为CuSO4
(4)“系列过程”中有一步是向滤液中加入过量铁粉,这一步生成气体的化学方程式为 Fe+H2SO4======= FeSO4+H2↑ ,该反应属于 置换 反应(填基本反应类型)。
(5)ZnO烟尘可用NaOH溶液吸收,该反应生成偏锌酸钠(Na2ZnO2)和H2O的化学方程式为 ZnO+2NaOH=====Na2ZnO2+H2O 。
Fe+H2SO4===== FeSO4+H2↑
置换
ZnO+2NaOH=====
Na2ZnO2+H2O
环保与资源的回收利用
3. (2023·岳阳)为了防止环境污染,工厂废液需经过处理达标后才能排放。某电镀厂为了减少对水的污染并节约成本,从排放的废液(主要含ZnSO4、FeSO4和CuSO4)中回收金属铜、铁以及工业原料硫酸锌,设计了如图所示的工艺流程,请据图回答下列问题:
(1)步骤Ⅰ中分离固体A和溶液C的操作中用到的玻璃棒的作用是 引流 。
(2)物质Y的化学式为 H2SO4 。
引
流
H2SO4
(3)请写出步骤Ⅲ中生成Fe的化学方程式: Zn+FeSO4======= ZnSO4+Fe 。
(4)请写一条保护金属资源的有效途径: 废旧金属回收再利用(或寻找金属替代品等,合理即可) 。
Zn+FeSO4=====
ZnSO4+Fe
废旧金属回收再利用(或
寻找金属替代品等,合理即可)
4. (2023·烟台)海洋是巨大的资源宝库,人类应合理开发利用。以下是烟台市对海水综合利用的部分工艺流程图(部分过程和产物略),据图回答问题:
(1)海水淡化:蒸馏法淡化海水是利用海水中各成分的 沸点 不同进行分离的。
(2)海水晒盐:晒盐时,采用的结晶方法是 蒸发结晶 ;海水晒盐后得到的卤水是氯化钠的 饱和 (填“饱和”或“不饱和”)溶液。
沸点
蒸发结晶
饱和
(3)海水制镁:在用卤水制镁的过程中发生中和反应的化学方程式是 Mg(OH)2+2HCl======= MgCl2+2H2O 。
Mg(OH)2+2HCl===== MgCl2+2H2O
(4)海水制“碱”:在用粗盐(含MgCl2、CaCl2杂质)制纯碱过程中,除杂时,先后加入过量的NaOH溶液和Na2CO3溶液产生的沉淀是 Mg(OH)2、CaCO3 (填化学式)。由氯化钠制取纯碱,从元素守恒的角度看,还需要含有 碳、氧(或C、O) 元素的物质参加反应。
Mg(OH)2、CaCO3
碳、氧(或C、O)
物质的分离、提纯
5. (2023·广州改编)制盐在我国有着悠久的历史。某盐湖水样品含有NaCl、Na2SO4及少量MgSO4和CaSO4,某小组从中获取NaCl和Na2SO4的主要过程如图1:
(1)“除杂1”应依次加入的两种试剂是 Ca(OH)2 、 Na2CO3 ,“除杂2”应加入的试剂是 HCl 。[除杂限选试剂:HCl、HNO3、Na2CO3、Ca(OH)2]
Ca(OH)2
Na2CO3
HCl
(2)将“溶液A”在80 ℃蒸发浓缩,至有少量固体析出。
①该小组分析溶解度曲线,推测析出的少量固体是NaCl,但检验后却发现是Na2SO4。请作出合理解释: 溶液中Na2SO4的含量高于NaCl,蒸发浓缩时Na2SO4先达到饱和状态而析出 。
溶液中Na2SO4的含量高于NaCl,蒸
发浓缩时Na2SO4先达到饱和状态而析出
②该小组停止蒸发浓缩,经 降温结晶 、过滤得到大量Na2SO4固体及母液;将母液中的NaCl分离出来,操作是 加热蒸发溶剂 至有较多晶体析出,趁热过滤,洗涤,干燥。
降温结晶
加热蒸发溶剂
(3)设计由硫磺(单质硫)生产Na2SO4的转化路径,依次写出反应的化学方程式: S+O2 SO2、SO2+2NaOH======= Na2SO3+H2O、2Na2SO3+O2======= 2Na2SO4(合理即可) 。(提示:常见+4价硫的化合物可与O2化合为+6价硫的化合物)
S+O2 SO2、SO2+2NaOH===== Na2SO3+H2O、
2Na2SO3+O2===== 2Na2SO4(合理即可)
创新类
6. [化学与技术](2023·山西)制作豆腐过程中用到了盐卤。盐卤是我国数千年来豆腐制作的传统凝固剂,有较好的溶解性和凝固性,主要成分为氯化钠(含量约2%~6%)和氯化钾(含量约2%~4%)等。豆腐的制作流程如下,请结合图文信息,分析思考,解决问题:
(1)研磨机将豆子研碎、研细的目的是 增大接触面积,使后续反应更快、更充分(合理即可) 。
(2)煮浆器内在煮沸过程中,可将有毒豆浆转化为无毒豆浆,发生的主要变化是 化学变化 。(填“化学变化”或“物理变化”)
增大接触面积,使后续反应
更快、更充分(合理即可)
化学变化
(3)为加快凝固速度,当把盐卤慢慢加入混合器时,需进行的操作是 搅拌 。
(4)向盐卤中滴加AgNO3溶液,发生反应的化学方程式为 AgNO3+NaCl======= AgCl↓+NaNO3 (写1个)。
(5)“花开富贵”是一道吃出咸辣味、品出世间美的豆腐制品,它有强筋骨、防贫血等功效,由此推知,这种食物含有的微量元素是 铁元素(或Fe) 。
搅拌
AgNO3+NaCl===== AgCl↓+NaNO3
铁元素
(或Fe)
7. [化学与科技](2023·潍坊)氢能助力“神舟十六”邀游太空,氢氧燃料电池技术在航海、航空、航天等方面发展迅速。图1是氢气的制取、储存、释放和应用的流程图。
请回答下列问题:
(1)利用太阳光和催化剂可实现水的高效分解。图2为光解制氢的微观模型图,写出反应Ⅰ的化学方程式 4H2O 2H2↑+2H2O2 。
4H2O 2H2↑+2H2O2
(2)气态储氢是将氢气压缩存储于高压罐中,请从微观角度分析氢气能被压缩的原因: 氢气分子之间有间隔 。
氢气分子之间有间隔
(3)固态储氢是通过合金材料在一定条件下的化学吸附储氢。图1利用镁镍合金(Mg2Ni)存储氢气,该储氢反应的化学方程式为 Mg2Ni+2H2 Mg2NiH4 。在熔炼镁镍合金时,需要通入氩气作保护气,目的是 防止镁、镍在高温下与氧气反应 。
Mg2Ni+2H2 Mg2NiH4
防止镁、镍在高温下与氧气反应
(4)氢氧燃料电池的总反应可表示为2H2+O22H2O,工作过程中的能量转化形式是 化学能转化为电能 。
化学能转化为电能
同课章节目录
