化学人教版(2019)必修第一册2.3物质的量、摩尔质量、气体摩尔体积(共42张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3物质的量、摩尔质量、气体摩尔体积(共42张ppt) | 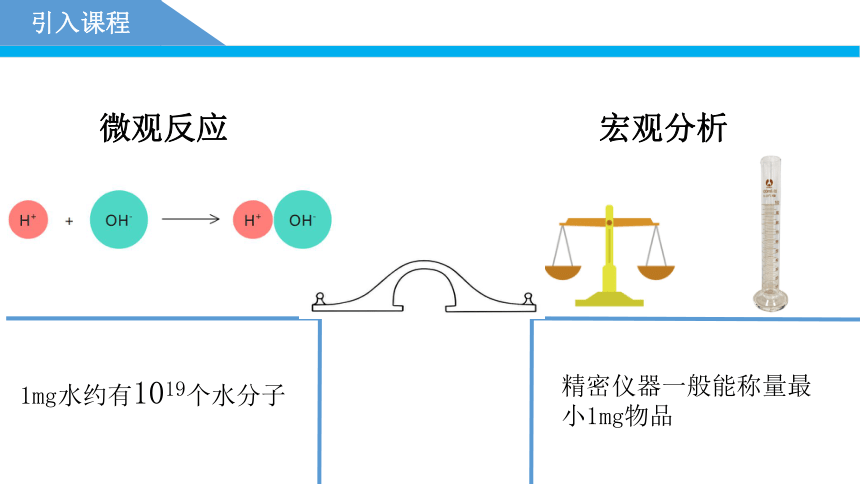 | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-26 18:02:38 | ||
图片预览







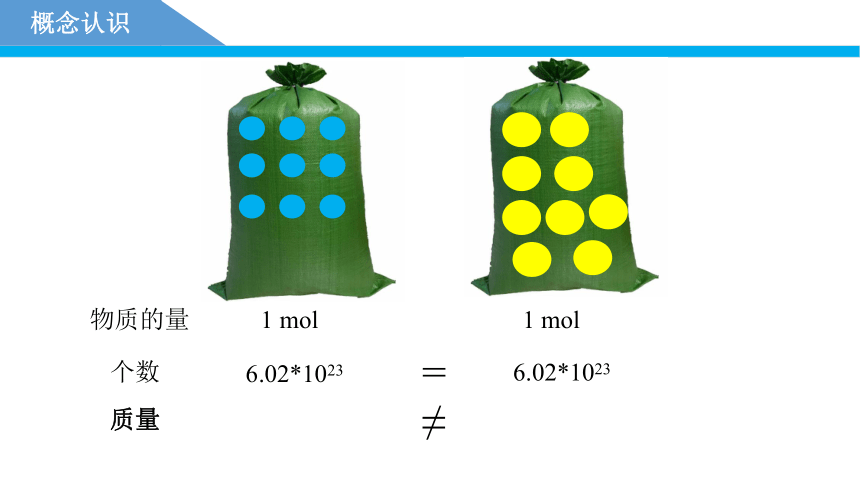

文档简介
(共42张PPT)
引入课程
微观反应
宏观分析
1mg水约有1019个水分子
精密仪器一般能称量最小1mg物品
引入课程
一袋米
一打鸡蛋
一箱牛奶
一坤年
一定数目的米
一定数目的鸡蛋
一定数目的牛奶
一定数目的时间
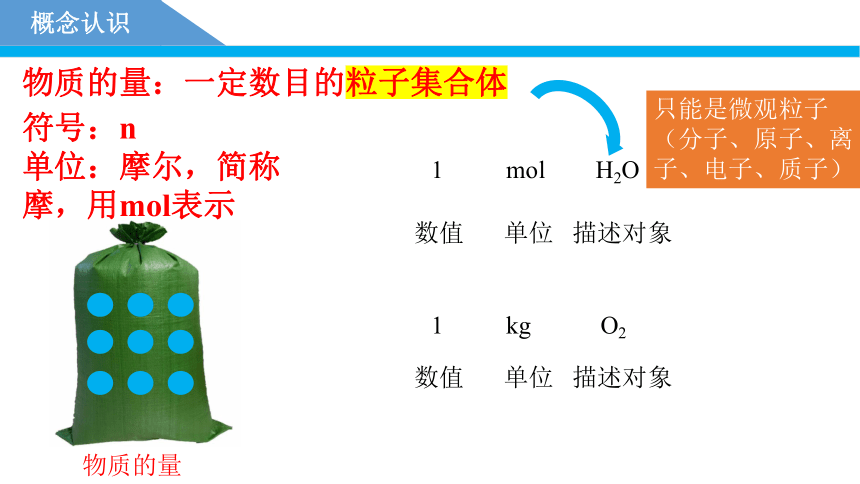
概念认识
物质的量:一定数目的粒子集合体
符号:n
单位:摩尔,简称摩,用mol表示
物质的量
1 mol H2O
1 kg O2
数值
数值
单位
描述对象
单位
描述对象
只能是微观粒子(分子、原子、离子、电子、质子)
概念认识
摩尔,来源于拉丁文moles,愿意为大量、堆积
练习
判断下列说法正误
(1)“物质的量”就是指物质的微粒个数
(2)摩尔是国际科学界建议采用的一种物理量
( )
( )
(3)2 mol 氢
( )
(4)2 mol Fe(OH)3胶体
( )
(5)1.5 mol Na+
( )
×
√
×
×
×
(6)1 mol H2中有2 mol H原子
( )
√
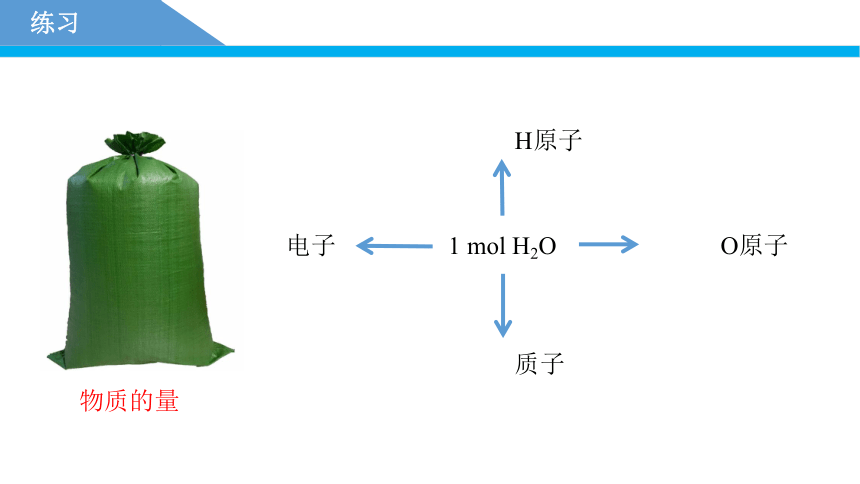
练习
1 mol H2O
H原子
O原子
质子
电子
物质的量
概念认识
阿伏伽德罗常数:1mol 任何粒子的粒子数
符号:NA
用 6.02*1023 mol-1 表示
近似值
问:1mol H2O 的分子数约为?
6.02 * 1023
NA
?
练习
计算下列物质中氧原子的个数
1 mol H2O2
0.1 mol CH3COOH
0.25 mol H2SO4
1.5 mol NaOH
2 mol NaHCO3
计算下列物质中氢原子的个数
1 mol H2O2
0.1 mol CH3COOH
0.25 mol H2SO4
1.5 mol NaOH
2 mol NaHCO3
练习
(1) 0.5 mol Na2SO4 中含有Na+个数约为 .
(3) 1 mol H2O 中含有原子个数约为 ,质子个数约为 .
(5) 1 mol Na与足量氯气反应转移的电子个数约为 .
(6) 等物质的量O2与O3的原子个数比为 .
(4) 3.01*1023个白磷分子(P4)中含有的原子数为 .
(2) 2NA 个BaCl2中含有Ba2+个数约为 .
概念认识
1 mol
1 mol
6.02*1023
6.02*1023
=
个数
物质的量
质量
≠
概念认识
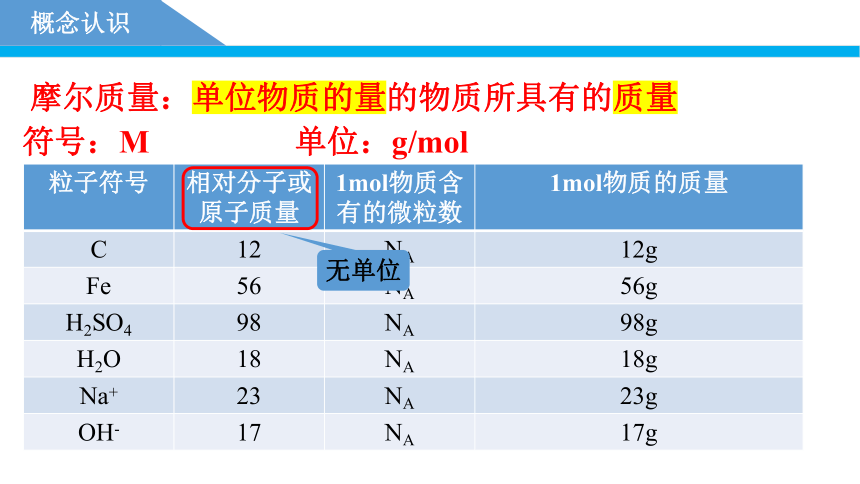
摩尔质量:单位物质的量的物质所具有的质量
符号:M 单位:g/mol
粒子符号 相对分子或原子质量 1mol物质含有的微粒数 1mol物质的质量
C 12 NA 12g
Fe 56 NA 56g
H2SO4 98 NA 98g
H2O 18 NA 18g
Na+ 23 NA 23g
OH- 17 NA 17g
无单位
练习
计算下列物质的质量
1 mol H2O2
0.1 mol CH3COOH
0.25 mol H2SO4
0.5NA H2O2
6.02*1022 CH3COOH
6.02*1023 H2SO4
计算下列物质的物质的量
9 g H2O 中的原子数
40 g NaOH 中的离子数
78 g Na2O2 中的离子数
计算下列物质的微粒个数
26.5g Na2CO3
105g HClO
练习
判断下列说法正误
(2)0.5 mol H2O的摩尔质量 9 g/mol
(1)1 mol H2O的摩尔质量是18
( )
( )
(3)1 mol H2SO4 的质量与H2SO4的摩尔质量相同
( )
(4)摩尔质量与该物质的相对分子质量或相对原子质量相等
( )
×
×
×
×
小结
微观
宏观
n
N
NA
—
m
M
—
=
=
物质的量
微粒个数
质量
练习
2.若1g水中含有n个氢原子,则阿伏伽德罗常数是
A. 18n mol-1
B. 9n mol-1
C. 2n mol-1
D. n/9 mol-1
3.若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是
A. M g
B. 1/M g
C. M/(6.02*1023) g
D. (6.02*1023)/M g
D
B
C
练习
6. 4℃时,如果20滴水恰好为1ml,1ml水约有1g,那么1滴水中所含的水分子数约为
A. 20NA
B. NA/360
C. 9NA/10
D. 360/NA
(2022·安徽合肥一中高一期末)一个氯原子的质量为a g,一个12C的质量是b g,用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 氯元素的相对原子质量为12a/b
B. 氯元素的摩尔质量为aNA g·mol-1
C. m g该氯原子的物质的量为m/(aNA) mol
D. n g该氯原子所含的电子数为17n/(aNA)
4. 等质量的 NO2 与N2O4,原子个数比为 .
5. 总质量为46g的 NO2 与N2O4的混合物,原子的总物质的量为 .
1:1
3mol
B
C
概念认识
1 mol
1 mol
6.02*1023
6.02*1023
=
个数
物质的量
质量
≠
体积
≠
概念认识
摩尔体积:单位物质的量的物质所具有的体积
符号:Vm 单位:L/mol
问1:某一状态下,Vm(H2)=25L/mol,则一个含有1gH2的气球的体积为?
问2:若对这个气球加热(气球材质耐热),气球会发生什么变化?这说明了什么?
任务一:物质摩尔体积的认识
深入思考
任务二:物质摩尔体积的影响因素
问1:影响物质摩尔体积的因素有哪些?
10-45m3
10-29m3
氢原子体积
铁原子体积
任务二:物质摩尔体积的影响因素
问1:影响物质摩尔体积的因素有哪些?
深入思考
温度升高
压强变大
任务二:物质摩尔体积的影响因素
问2:气体摩尔体积的影响因素?
微粒本身体积几乎不影响气体体积
气体体积仅受温度、压强影响
当温度、压强相同时,任何粒子数相同的气体拥有相等的体积
深入思考
氢气直径约0.289nm
氢气分子间距约3.3nm
概念强化
Vm (0℃,101kPa) = 22.4L/mol
标准状况
例题:计算1mol H2在标准状况下的体积
V=n*Vn(0℃,101kPa)
=1mol*22.4L/mol
=22.4L
当温度、压强相同时,任何粒子数相同的气体拥有相等的体积
0℃
101kPa
22.4L/mol
练习
计算标准状况下,下列气体体积
2 mol He
NA 个H2
16g O2
0.5 mol CO2
6.02*1022 N2
16g CH4
练习
判断下列说法的正误
(2)1mol某气体的体积一定为22.4L
(1)不同的气体,若体积不同,则它们所含的分子数一定不同
( )
( )
(3)标准状况下,1mol H2O 的体积是22.4L
( )
(4)只有标准状况下的气体摩尔体积是 22.4 L/mol,其他条件下一定不是该值
( )
×
×
×
×
知识提升
任务三:气体方程
pV=nRT
p,某气体的压强
V,某气体的体积(一般直接等于容器体积)
p,某气体的物质的量
T,某气体的温度
R,常数
例题:同温同压下,两个容器内分别有1mol H2与3mol N2,则这两个容器的体积之比为?
V=nRT/p
V1/V2=n1/n2=1/3
练习
计算
1.等温等体时,物质的量之比为2:1的A、B气体的压强之比 .
2.等温等压时,原子总数相等的H2、H2O气体的体积之比 .
3.等温等体时,质量相等的H2、N2气体的压强之比 .
2:1
3:2
14:1
B
小结
微观
宏观
n
N
NA
—
m
M
—
=
=
物质的量
微粒个数
质量
V
Vm
—
=
体积
综合提升
下列关于气体摩尔体积的说法中正确的是( )
A.标准状况下,1 mol H2O的体积是22.4 L
B.22 g CO2的物质的量是0.5 mol,其体积为11.2 L
C.只有标准状况下的气体摩尔体积是22.4 L·mol-1,其他条件下一定不是该值
D.标准状况下,1摩尔任何气体的体积都约是22.4 L
D
综合提升
(2022·武汉高一月考)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L 乙醇中含有0.1NA个分子
B.常温常压下,80 g氩气含有的原子数为2NA
C.1 mol Na2O2与足量H2O反应产生11.2 L的O2
D.1 mol Cl2与足量的铁粉反应转移的电子数目是3NA
B
综合提升
(2022·沈阳高一期末)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,40 g SO3所占的体积为11.2 L
B.1 mol OH-所含的电子数为10NA
C.标准状况下,28 g CO和N2的混合气体的体积为44.8 L
D.1 mol NaHSO4晶体中含H+数目为NA
B
综合提升
将质量均为m g的O2和X气体分别充入相同体积的密闭容器中,二者压强(p)与温度(T)的关系如图所示,则X气体可能是( )
A.H2 B.NH3 C.CO D.SO2
D
引入课程
初中生小明喝了一杯超级甜的甜水,为了和同桌炫耀自己优秀的化学成绩,他是这样描述这杯水有多甜的。
这杯水中糖的质量分数特别大,你懂什么是质量分数吗?
通过本节课的学习,掌握新的浓度概念,回击喜欢显摆的小明
引入课程
微观
宏观
n
N
NA
—
m
M
—
=
=
物质的量
微粒个数
质量
V
Vm
—
=
体积
浓度
概念认识
物质的量浓度:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度
符号:CB 单位:mol/L
问1:与质量分数相比,物质的量浓度概念有什么相同点,不同点?
任务一:物质的量浓度的认识
相同点:都是描述溶质与溶液的关系
不同点:溶质用物质的量描述,溶液用体积描述
练习
计算下列溶液中离子的浓度
2.36.5gHCl溶于水中形成200ml溶液,H+的浓度为 .
3. 23g 金属钠与水反应获得500ml溶液中OH-的浓度为 .
C
5 mol/L
2 mol/L
1.0.5mol/LFe2(SO4)3溶液中,Fe3+的浓度为 .
1 mol/L
练习
B
A
回忆
1 mol/L = 1*MB g/L = 1000*MB mg/L
1 m = 100 cm = 1000 mm = 106 um = 109 nm = 1012 pm
练习
C(Mg2+)=2*10-4 mol/L
C(SO42-)=2*10-4 mol/L
n=CV=0.35L*C=0.35*2*10-4=7*10-5 mol
综合提升
B
综合提升
B
36.5 g HCl溶解在1 L水中(水的密度近似为1 g·cm-3)所得溶液的密度为ρ g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )A.所得溶液的物质的量浓度为1 mol·L-1B.36.5 g HCl气体占有的体积为22.4 LC.c=ρ/(36.5+1 000)D.w=36.5c/1000ρ
综合提升
D
(2022·石家庄正定中学高一月考)某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25 ℃时,a g该晶体能够溶于b g水中形成V mL饱和溶液。下列关系中不正确的是( )A.该溶液的密度为ρ=1000(a+b)/V g·L-1B.该溶液的物质的量浓度为c=1000a/MV mol·L-1C.该溶液中溶剂与溶质的质量比为m(水)∶m(溶质)=(18na/M+b)∶(a-18na/M)D.该溶液中溶质的质量分数为w=(100aM-18n)/(a+b)%
综合提升
D
引入课程
微观反应
宏观分析
1mg水约有1019个水分子
精密仪器一般能称量最小1mg物品
引入课程
一袋米
一打鸡蛋
一箱牛奶
一坤年
一定数目的米
一定数目的鸡蛋
一定数目的牛奶
一定数目的时间
概念认识
物质的量:一定数目的粒子集合体
符号:n
单位:摩尔,简称摩,用mol表示
物质的量
1 mol H2O
1 kg O2
数值
数值
单位
描述对象
单位
描述对象
只能是微观粒子(分子、原子、离子、电子、质子)
概念认识
摩尔,来源于拉丁文moles,愿意为大量、堆积
练习
判断下列说法正误
(1)“物质的量”就是指物质的微粒个数
(2)摩尔是国际科学界建议采用的一种物理量
( )
( )
(3)2 mol 氢
( )
(4)2 mol Fe(OH)3胶体
( )
(5)1.5 mol Na+
( )
×
√
×
×
×
(6)1 mol H2中有2 mol H原子
( )
√
练习
1 mol H2O
H原子
O原子
质子
电子
物质的量
概念认识
阿伏伽德罗常数:1mol 任何粒子的粒子数
符号:NA
用 6.02*1023 mol-1 表示
近似值
问:1mol H2O 的分子数约为?
6.02 * 1023
NA
?
练习
计算下列物质中氧原子的个数
1 mol H2O2
0.1 mol CH3COOH
0.25 mol H2SO4
1.5 mol NaOH
2 mol NaHCO3
计算下列物质中氢原子的个数
1 mol H2O2
0.1 mol CH3COOH
0.25 mol H2SO4
1.5 mol NaOH
2 mol NaHCO3
练习
(1) 0.5 mol Na2SO4 中含有Na+个数约为 .
(3) 1 mol H2O 中含有原子个数约为 ,质子个数约为 .
(5) 1 mol Na与足量氯气反应转移的电子个数约为 .
(6) 等物质的量O2与O3的原子个数比为 .
(4) 3.01*1023个白磷分子(P4)中含有的原子数为 .
(2) 2NA 个BaCl2中含有Ba2+个数约为 .
概念认识
1 mol
1 mol
6.02*1023
6.02*1023
=
个数
物质的量
质量
≠
概念认识
摩尔质量:单位物质的量的物质所具有的质量
符号:M 单位:g/mol
粒子符号 相对分子或原子质量 1mol物质含有的微粒数 1mol物质的质量
C 12 NA 12g
Fe 56 NA 56g
H2SO4 98 NA 98g
H2O 18 NA 18g
Na+ 23 NA 23g
OH- 17 NA 17g
无单位
练习
计算下列物质的质量
1 mol H2O2
0.1 mol CH3COOH
0.25 mol H2SO4
0.5NA H2O2
6.02*1022 CH3COOH
6.02*1023 H2SO4
计算下列物质的物质的量
9 g H2O 中的原子数
40 g NaOH 中的离子数
78 g Na2O2 中的离子数
计算下列物质的微粒个数
26.5g Na2CO3
105g HClO
练习
判断下列说法正误
(2)0.5 mol H2O的摩尔质量 9 g/mol
(1)1 mol H2O的摩尔质量是18
( )
( )
(3)1 mol H2SO4 的质量与H2SO4的摩尔质量相同
( )
(4)摩尔质量与该物质的相对分子质量或相对原子质量相等
( )
×
×
×
×
小结
微观
宏观
n
N
NA
—
m
M
—
=
=
物质的量
微粒个数
质量
练习
2.若1g水中含有n个氢原子,则阿伏伽德罗常数是
A. 18n mol-1
B. 9n mol-1
C. 2n mol-1
D. n/9 mol-1
3.若某原子的摩尔质量是M g/mol,则一个该原子的真实质量是
A. M g
B. 1/M g
C. M/(6.02*1023) g
D. (6.02*1023)/M g
D
B
C
练习
6. 4℃时,如果20滴水恰好为1ml,1ml水约有1g,那么1滴水中所含的水分子数约为
A. 20NA
B. NA/360
C. 9NA/10
D. 360/NA
(2022·安徽合肥一中高一期末)一个氯原子的质量为a g,一个12C的质量是b g,用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 氯元素的相对原子质量为12a/b
B. 氯元素的摩尔质量为aNA g·mol-1
C. m g该氯原子的物质的量为m/(aNA) mol
D. n g该氯原子所含的电子数为17n/(aNA)
4. 等质量的 NO2 与N2O4,原子个数比为 .
5. 总质量为46g的 NO2 与N2O4的混合物,原子的总物质的量为 .
1:1
3mol
B
C
概念认识
1 mol
1 mol
6.02*1023
6.02*1023
=
个数
物质的量
质量
≠
体积
≠
概念认识
摩尔体积:单位物质的量的物质所具有的体积
符号:Vm 单位:L/mol
问1:某一状态下,Vm(H2)=25L/mol,则一个含有1gH2的气球的体积为?
问2:若对这个气球加热(气球材质耐热),气球会发生什么变化?这说明了什么?
任务一:物质摩尔体积的认识
深入思考
任务二:物质摩尔体积的影响因素
问1:影响物质摩尔体积的因素有哪些?
10-45m3
10-29m3
氢原子体积
铁原子体积
任务二:物质摩尔体积的影响因素
问1:影响物质摩尔体积的因素有哪些?
深入思考
温度升高
压强变大
任务二:物质摩尔体积的影响因素
问2:气体摩尔体积的影响因素?
微粒本身体积几乎不影响气体体积
气体体积仅受温度、压强影响
当温度、压强相同时,任何粒子数相同的气体拥有相等的体积
深入思考
氢气直径约0.289nm
氢气分子间距约3.3nm
概念强化
Vm (0℃,101kPa) = 22.4L/mol
标准状况
例题:计算1mol H2在标准状况下的体积
V=n*Vn(0℃,101kPa)
=1mol*22.4L/mol
=22.4L
当温度、压强相同时,任何粒子数相同的气体拥有相等的体积
0℃
101kPa
22.4L/mol
练习
计算标准状况下,下列气体体积
2 mol He
NA 个H2
16g O2
0.5 mol CO2
6.02*1022 N2
16g CH4
练习
判断下列说法的正误
(2)1mol某气体的体积一定为22.4L
(1)不同的气体,若体积不同,则它们所含的分子数一定不同
( )
( )
(3)标准状况下,1mol H2O 的体积是22.4L
( )
(4)只有标准状况下的气体摩尔体积是 22.4 L/mol,其他条件下一定不是该值
( )
×
×
×
×
知识提升
任务三:气体方程
pV=nRT
p,某气体的压强
V,某气体的体积(一般直接等于容器体积)
p,某气体的物质的量
T,某气体的温度
R,常数
例题:同温同压下,两个容器内分别有1mol H2与3mol N2,则这两个容器的体积之比为?
V=nRT/p
V1/V2=n1/n2=1/3
练习
计算
1.等温等体时,物质的量之比为2:1的A、B气体的压强之比 .
2.等温等压时,原子总数相等的H2、H2O气体的体积之比 .
3.等温等体时,质量相等的H2、N2气体的压强之比 .
2:1
3:2
14:1
B
小结
微观
宏观
n
N
NA
—
m
M
—
=
=
物质的量
微粒个数
质量
V
Vm
—
=
体积
综合提升
下列关于气体摩尔体积的说法中正确的是( )
A.标准状况下,1 mol H2O的体积是22.4 L
B.22 g CO2的物质的量是0.5 mol,其体积为11.2 L
C.只有标准状况下的气体摩尔体积是22.4 L·mol-1,其他条件下一定不是该值
D.标准状况下,1摩尔任何气体的体积都约是22.4 L
D
综合提升
(2022·武汉高一月考)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L 乙醇中含有0.1NA个分子
B.常温常压下,80 g氩气含有的原子数为2NA
C.1 mol Na2O2与足量H2O反应产生11.2 L的O2
D.1 mol Cl2与足量的铁粉反应转移的电子数目是3NA
B
综合提升
(2022·沈阳高一期末)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,40 g SO3所占的体积为11.2 L
B.1 mol OH-所含的电子数为10NA
C.标准状况下,28 g CO和N2的混合气体的体积为44.8 L
D.1 mol NaHSO4晶体中含H+数目为NA
B
综合提升
将质量均为m g的O2和X气体分别充入相同体积的密闭容器中,二者压强(p)与温度(T)的关系如图所示,则X气体可能是( )
A.H2 B.NH3 C.CO D.SO2
D
引入课程
初中生小明喝了一杯超级甜的甜水,为了和同桌炫耀自己优秀的化学成绩,他是这样描述这杯水有多甜的。
这杯水中糖的质量分数特别大,你懂什么是质量分数吗?
通过本节课的学习,掌握新的浓度概念,回击喜欢显摆的小明
引入课程
微观
宏观
n
N
NA
—
m
M
—
=
=
物质的量
微粒个数
质量
V
Vm
—
=
体积
浓度
概念认识
物质的量浓度:单位体积的溶液里所含溶质B的物质的量,也称为B的物质的量浓度
符号:CB 单位:mol/L
问1:与质量分数相比,物质的量浓度概念有什么相同点,不同点?
任务一:物质的量浓度的认识
相同点:都是描述溶质与溶液的关系
不同点:溶质用物质的量描述,溶液用体积描述
练习
计算下列溶液中离子的浓度
2.36.5gHCl溶于水中形成200ml溶液,H+的浓度为 .
3. 23g 金属钠与水反应获得500ml溶液中OH-的浓度为 .
C
5 mol/L
2 mol/L
1.0.5mol/LFe2(SO4)3溶液中,Fe3+的浓度为 .
1 mol/L
练习
B
A
回忆
1 mol/L = 1*MB g/L = 1000*MB mg/L
1 m = 100 cm = 1000 mm = 106 um = 109 nm = 1012 pm
练习
C(Mg2+)=2*10-4 mol/L
C(SO42-)=2*10-4 mol/L
n=CV=0.35L*C=0.35*2*10-4=7*10-5 mol
综合提升
B
综合提升
B
36.5 g HCl溶解在1 L水中(水的密度近似为1 g·cm-3)所得溶液的密度为ρ g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是( )A.所得溶液的物质的量浓度为1 mol·L-1B.36.5 g HCl气体占有的体积为22.4 LC.c=ρ/(36.5+1 000)D.w=36.5c/1000ρ
综合提升
D
(2022·石家庄正定中学高一月考)某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25 ℃时,a g该晶体能够溶于b g水中形成V mL饱和溶液。下列关系中不正确的是( )A.该溶液的密度为ρ=1000(a+b)/V g·L-1B.该溶液的物质的量浓度为c=1000a/MV mol·L-1C.该溶液中溶剂与溶质的质量比为m(水)∶m(溶质)=(18na/M+b)∶(a-18na/M)D.该溶液中溶质的质量分数为w=(100aM-18n)/(a+b)%
综合提升
D
