高一化学(人教2019版)必修第一册巩固练习:第一章 物质及其变化 测评(B) (含解析)
文档属性
| 名称 | 高一化学(人教2019版)必修第一册巩固练习:第一章 物质及其变化 测评(B) (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 186.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-26 20:46:36 | ||
图片预览



文档简介
第一章 物质及其变化 测评(B)
(时间:60分钟 满分:100分)
一、选择题(本题包括11个小题,每小题5分,共55分,每小题只有1个选项符合题意)
1.如图所示,符合图中阴影部分的物质是( )
A.NaHCO3 B.Cu2(OH)2CO3
C.NaCl D.Na2CO3
2.下列现象与氧化还原反应无关的是( )
A.铜制水龙头上出现铜锈[主要成分Cu2(OH)2CO3]
B.充有H2的气球遇明火发生爆炸
C.大理石雕像被酸雨腐蚀毁坏
D.银质首饰时间久了会变黑(表面覆盖Ag2S薄膜)
3.纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是( )
A.纳米铜是一种胶体
B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同
D.纳米铜无须密封保存
4.某溶液中含有K+、HC、S等离子,向溶液中加入适量的NaOH固体,溶液中离子的数目显著增加的是( )
A.HC B.K+
C.C D.S
5.化学概念在逻辑上存在如下关系:
下列说法正确的是( )
A.胶体与化合物属于包含关系
B.化合物与碱性氧化物属于包含关系
C.单质与电解质属于交叉关系
D.氧化还原反应与离子反应属于并列关系
6.下列化学反应中属于氧化还原反应但不属于置换反应的是( )
A.CuO+COCu+CO2
B.Fe+H2SO4FeSO4+H2↑
C.Cl2+2NaBr2NaCl+Br2
D.H2SO4+BaCl2BaSO4↓+2HCl
7.实验室需要配制只含选项中离子且各离子的个数均相等的溶液,能配制成功的是( )
A.Al3+、N、K+、S
B.Cu2+、Ba2+、S、C
C.OH-、Cl-、N、Na+
D.Mg2+、Na+、S、N
8.下列各项中根据离子方程式改写的化学方程式,其中不正确的是( )
A.Cu2++2OH-Cu(OH)2↓
CuSO4+Ba(OH)2Cu(OH)2↓+BaSO4↓
B.C+2H+CO2↑+H2O
Na2CO3+2HCl2NaCl+H2O+CO2↑
C.Ca2++CCaCO3↓
Ca(NO3)2+Na2CO3CaCO3↓+2NaNO3
D.Fe+Cu2+Fe2++Cu
Fe+CuSO4FeSO4+Cu
9.现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是( )
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
10.下列离子方程式书写不正确的是( )
A.碳酸钙中加入盐酸:CaCO3+2H+Ca2++H2O+CO2↑
B.氧化铜与硫酸反应:CuO+2H++SCuSO4↓+H2O
C.硫酸钠溶液中加入氢氧化钡溶液:Ba2++SBaSO4↓
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2CaCO3↓+H2O
11.用下列方法,各在一定条件下制取氧气:
①2KMnO4K2MnO4+MnO2+O2↑,
②2H2O22H2O+O2↑,
③2Na2O2+2H2O4NaOH+O2↑,
④2KClO32KCl+3O2↑。
若分别制取等质量的氧气,上述反应中转移电子数目之比为( )
A.2∶1∶1∶2 B.1∶1∶1∶1
C.1∶2∶2∶1 D.1∶2∶1∶2
二、非选择题(共4小题,共45分)
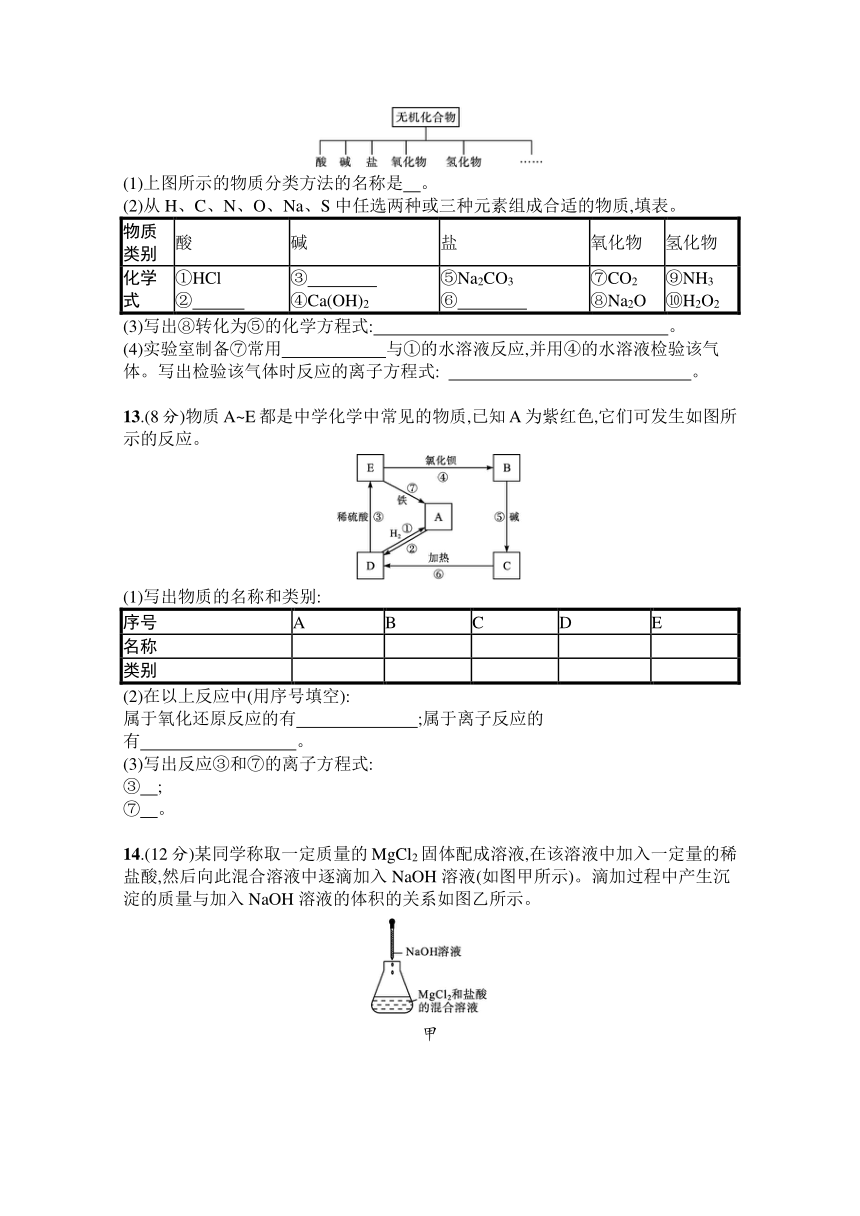
12.(8分)无机化合物可根据其组成和性质进行分类。
(1)上图所示的物质分类方法的名称是 。
(2)从H、C、N、O、Na、S中任选两种或三种元素组成合适的物质,填表。
物质 类别 酸 碱 盐 氧化物 氢化物
化学式 ①HCl ② ③ ④Ca(OH)2 ⑤Na2CO3 ⑥ ⑦CO2 ⑧Na2O ⑨NH3 ⑩H2O2
(3)写出⑧转化为⑤的化学方程式: 。
(4)实验室制备⑦常用 与①的水溶液反应,并用④的水溶液检验该气体。写出检验该气体时反应的离子方程式: 。
13.(8分)物质A~E都是中学化学中常见的物质,已知A为紫红色,它们可发生如图所示的反应。
(1)写出物质的名称和类别:
序号 A B C D E
名称
类别
(2)在以上反应中(用序号填空):
属于氧化还原反应的有 ;属于离子反应的有 。
(3)写出反应③和⑦的离子方程式:
③ ;
⑦ 。
14.(12分)某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
甲
乙
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有 。
A.天平 B.烧杯
C.漏斗 D.玻璃棒
(2)OA段反应的离子方程式为 。
(3)AB段反应的离子方程式为 。
(4)B点对应的溶液中的溶质为 ,向该溶液中滴加AgNO3溶液,观察到的现象是 ,反应的离子方程式为 。
15.(17分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生过程:H2O2O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是: 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目。
(4)H2O2常用作氧化剂、漂白剂和消毒剂。为了便于贮存、运输和使用,工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。接触下列物质不会使过碳酸钠失效的是 。
A.MnO2 B.Ca(OH)2
C.HCl D.NaCl
第一章 物质及其变化 测评(B)
(时间:60分钟 满分:100分)
一、选择题(本题包括11个小题,每小题5分,共55分,每小题只有1个选项符合题意)
1.如图所示,符合图中阴影部分的物质是( )
A.NaHCO3 B.Cu2(OH)2CO3
C.NaCl D.Na2CO3
答案:D
解析:NaHCO3和Cu2(OH)2CO3不是正盐;NaCl不是碳酸盐。
2.下列现象与氧化还原反应无关的是( )
A.铜制水龙头上出现铜锈[主要成分Cu2(OH)2CO3]
B.充有H2的气球遇明火发生爆炸
C.大理石雕像被酸雨腐蚀毁坏
D.银质首饰时间久了会变黑(表面覆盖Ag2S薄膜)
答案:C
解析:A项中铜被氧气氧化,B项中氢气被氧化,D项中银被氧化。C项发生复分解反应,没有元素化合价的变化。
3.纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是( )
A.纳米铜是一种胶体
B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同
D.纳米铜无须密封保存
答案:B
解析:纳米铜由铜元素组成,属于单质,与普通铜所含铜原子的种类相同,A、C两项错误;纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸,因此须密封保存,D项错误。
4.某溶液中含有K+、HC、S等离子,向溶液中加入适量的NaOH固体,溶液中离子的数目显著增加的是( )
A.HC B.K+
C.C D.S
答案:C
解析:OH-与HC反应生成C,C的数目会显著增加。
5.化学概念在逻辑上存在如下关系:
下列说法正确的是( )
A.胶体与化合物属于包含关系
B.化合物与碱性氧化物属于包含关系
C.单质与电解质属于交叉关系
D.氧化还原反应与离子反应属于并列关系
答案:B
解析:胶体是混合物,化合物属于纯净物,两者不属于包含关系,A项错误;电解质都是化合物,与单质不属于交叉关系,C项错误;氧化还原反应与离子反应属于交叉关系,D项错误。
6.下列化学反应中属于氧化还原反应但不属于置换反应的是( )
A.CuO+COCu+CO2
B.Fe+H2SO4FeSO4+H2↑
C.Cl2+2NaBr2NaCl+Br2
D.H2SO4+BaCl2BaSO4↓+2HCl
答案:A
解析:D项不是氧化还原反应;B项和C项既是氧化还原反应,又是置换反应;A项是氧化还原反应,但不是置换反应。
7.实验室需要配制只含选项中离子且各离子的个数均相等的溶液,能配制成功的是( )
A.Al3+、N、K+、S
B.Cu2+、Ba2+、S、C
C.OH-、Cl-、N、Na+
D.Mg2+、Na+、S、N
答案:D
解析:A项中电荷不守恒,B项中的离子不能大量共存,C项中N与OH-不能大量共存。
8.下列各项中根据离子方程式改写的化学方程式,其中不正确的是( )
A.Cu2++2OH-Cu(OH)2↓
CuSO4+Ba(OH)2Cu(OH)2↓+BaSO4↓
B.C+2H+CO2↑+H2O
Na2CO3+2HCl2NaCl+H2O+CO2↑
C.Ca2++CCaCO3↓
Ca(NO3)2+Na2CO3CaCO3↓+2NaNO3
D.Fe+Cu2+Fe2++Cu
Fe+CuSO4FeSO4+Cu
答案:A
解析:A项中的化学方程式中BaSO4不溶于水,书写离子方程式时不能拆分,要写化学式,A项错误。
9.现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是( )
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
答案:B
解析:根据所选用的试剂分别加入三种溶液中所发生的现象不同从而加以鉴别。H2SO4与NaOH反应无明显现象,H2SO4与Na2CO3反应生成无色气体,H2SO4与Ba(OH)2反应生成白色沉淀。
10.下列离子方程式书写不正确的是( )
A.碳酸钙中加入盐酸:CaCO3+2H+Ca2++H2O+CO2↑
B.氧化铜与硫酸反应:CuO+2H++SCuSO4↓+H2O
C.硫酸钠溶液中加入氢氧化钡溶液:Ba2++SBaSO4↓
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2CaCO3↓+H2O
答案:B
解析:CuSO4易溶于水,应该拆,正确的离子方程式为CuO+2H+Cu2++H2O。
11.用下列方法,各在一定条件下制取氧气:
①2KMnO4K2MnO4+MnO2+O2↑,
②2H2O22H2O+O2↑,
③2Na2O2+2H2O4NaOH+O2↑,
④2KClO32KCl+3O2↑。
若分别制取等质量的氧气,上述反应中转移电子数目之比为( )
A.2∶1∶1∶2 B.1∶1∶1∶1
C.1∶2∶2∶1 D.1∶2∶1∶2
答案:A
解析:从氧元素的化合价的变化入手分析。在①和④中,氧元素都是从-2价升高到0价,每生成1个O2分子失去4个电子;在②和③中,氧元素都是从-1价升高到0价,每生成1个O2分子失去2个电子。制取等质量的氧气,生成的O2分子数目相同,转移电子数目之比为4∶2∶2∶4,即2∶1∶1∶2。
二、非选择题(共4小题,共45分)
12.(8分)无机化合物可根据其组成和性质进行分类。
(1)上图所示的物质分类方法的名称是 。
(2)从H、C、N、O、Na、S中任选两种或三种元素组成合适的物质,填表。
物质 类别 酸 碱 盐 氧化物 氢化物
化学式 ①HCl ② ③ ④Ca(OH)2 ⑤Na2CO3 ⑥ ⑦CO2 ⑧Na2O ⑨NH3 ⑩H2O2
(3)写出⑧转化为⑤的化学方程式: 。
(4)实验室制备⑦常用 与①的水溶液反应,并用④的水溶液检验该气体。写出检验该气体时反应的离子方程式: 。
答案:(1)树状分类法
(2)②H2SO4(或HNO3等) ③NaOH(或NH3·H2O) ⑥Na2SO4(或NaNO3等)
(3)Na2O+CO2Na2CO3
(4)大理石(或石灰石) Ca2++2OH-+CO2CaCO3↓+H2O
解析:(1)常见的分类法有交叉分类法和树状分类法,由图可知此处为树状分类法。
(2)酸可以填写H2S、H2SO4、HNO3、H2CO3等中的一种,碱可以填写NaOH或NH3·H2O;盐可填写Na2SO4、NaNO3、Na2SO3等中的一种。
(3)Na2O是碱性氧化物,可与酸性氧化物CO2反应生成Na2CO3。
(4)实验室制备CO2常利用大理石或石灰石(CaCO3)与稀盐酸反应。
13.(8分)物质A~E都是中学化学中常见的物质,已知A为紫红色,它们可发生如图所示的反应。
(1)写出物质的名称和类别:
序号 A B C D E
名称
类别
(2)在以上反应中(用序号填空):
属于氧化还原反应的有 ;属于离子反应的有 。
(3)写出反应③和⑦的离子方程式:
③ ;
⑦ 。
答案:(1)
序号 A B C D E
名称 铜 氯化铜 氢氧化铜 氧化铜 硫酸铜
类别 单质 盐 碱 氧化物 盐
(2)①②⑦ ③④⑤⑦
(3)CuO+2H+Cu2++H2O Cu2++FeCu+Fe2+
14.(12分)某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
甲
乙
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有 。
A.天平 B.烧杯
C.漏斗 D.玻璃棒
(2)OA段反应的离子方程式为 。
(3)AB段反应的离子方程式为 。
(4)B点对应的溶液中的溶质为 ,向该溶液中滴加AgNO3溶液,观察到的现象是 ,反应的离子方程式为 。
答案:(1)BD (2)H++OH-H2O
(3)M+2OH-Mg(OH)2↓
(4)NaCl 有白色沉淀生成 Ag++Cl-AgCl↓
解析:乙图中OA段为OH-与H+反应,AB段为OH-与M反应,B点对应溶液为NaCl溶液,加入AgNO3溶液发生反应Ag++Cl-AgCl↓。
15.(17分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生过程:H2O2O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是: 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目。
(4)H2O2常用作氧化剂、漂白剂和消毒剂。为了便于贮存、运输和使用,工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。接触下列物质不会使过碳酸钠失效的是 。
A.MnO2 B.Ca(OH)2
C.HCl D.NaCl
答案:(1)H2O2
(2)H2CrO4 Cr(OH)3
(3)3O2↑+2H2O
(4)D
解析:H2O2O2,H2O2中氧元素化合价升高,H2O2是还原剂,则必有元素化合价降低,从所给物质可知,化合价降低的只有Cr元素,H2CrO4发生还原反应:H2CrO4Cr(OH)3。
(4)过碳酸钠晶体(2Na2CO3·3H2O2)既具有H2O2的化学性质(遇到MnO2时分解为O2和水),又具有碳酸钠的化学性质[与HCl反应放出气体;与Ca(OH)2反应生成沉淀],所以应根据Na2CO3和H2O2的性质分析作答。
(时间:60分钟 满分:100分)
一、选择题(本题包括11个小题,每小题5分,共55分,每小题只有1个选项符合题意)
1.如图所示,符合图中阴影部分的物质是( )
A.NaHCO3 B.Cu2(OH)2CO3
C.NaCl D.Na2CO3
2.下列现象与氧化还原反应无关的是( )
A.铜制水龙头上出现铜锈[主要成分Cu2(OH)2CO3]
B.充有H2的气球遇明火发生爆炸
C.大理石雕像被酸雨腐蚀毁坏
D.银质首饰时间久了会变黑(表面覆盖Ag2S薄膜)
3.纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是( )
A.纳米铜是一种胶体
B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同
D.纳米铜无须密封保存
4.某溶液中含有K+、HC、S等离子,向溶液中加入适量的NaOH固体,溶液中离子的数目显著增加的是( )
A.HC B.K+
C.C D.S
5.化学概念在逻辑上存在如下关系:
下列说法正确的是( )
A.胶体与化合物属于包含关系
B.化合物与碱性氧化物属于包含关系
C.单质与电解质属于交叉关系
D.氧化还原反应与离子反应属于并列关系
6.下列化学反应中属于氧化还原反应但不属于置换反应的是( )
A.CuO+COCu+CO2
B.Fe+H2SO4FeSO4+H2↑
C.Cl2+2NaBr2NaCl+Br2
D.H2SO4+BaCl2BaSO4↓+2HCl
7.实验室需要配制只含选项中离子且各离子的个数均相等的溶液,能配制成功的是( )
A.Al3+、N、K+、S
B.Cu2+、Ba2+、S、C
C.OH-、Cl-、N、Na+
D.Mg2+、Na+、S、N
8.下列各项中根据离子方程式改写的化学方程式,其中不正确的是( )
A.Cu2++2OH-Cu(OH)2↓
CuSO4+Ba(OH)2Cu(OH)2↓+BaSO4↓
B.C+2H+CO2↑+H2O
Na2CO3+2HCl2NaCl+H2O+CO2↑
C.Ca2++CCaCO3↓
Ca(NO3)2+Na2CO3CaCO3↓+2NaNO3
D.Fe+Cu2+Fe2++Cu
Fe+CuSO4FeSO4+Cu
9.现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是( )
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
10.下列离子方程式书写不正确的是( )
A.碳酸钙中加入盐酸:CaCO3+2H+Ca2++H2O+CO2↑
B.氧化铜与硫酸反应:CuO+2H++SCuSO4↓+H2O
C.硫酸钠溶液中加入氢氧化钡溶液:Ba2++SBaSO4↓
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2CaCO3↓+H2O
11.用下列方法,各在一定条件下制取氧气:
①2KMnO4K2MnO4+MnO2+O2↑,
②2H2O22H2O+O2↑,
③2Na2O2+2H2O4NaOH+O2↑,
④2KClO32KCl+3O2↑。
若分别制取等质量的氧气,上述反应中转移电子数目之比为( )
A.2∶1∶1∶2 B.1∶1∶1∶1
C.1∶2∶2∶1 D.1∶2∶1∶2
二、非选择题(共4小题,共45分)
12.(8分)无机化合物可根据其组成和性质进行分类。
(1)上图所示的物质分类方法的名称是 。
(2)从H、C、N、O、Na、S中任选两种或三种元素组成合适的物质,填表。
物质 类别 酸 碱 盐 氧化物 氢化物
化学式 ①HCl ② ③ ④Ca(OH)2 ⑤Na2CO3 ⑥ ⑦CO2 ⑧Na2O ⑨NH3 ⑩H2O2
(3)写出⑧转化为⑤的化学方程式: 。
(4)实验室制备⑦常用 与①的水溶液反应,并用④的水溶液检验该气体。写出检验该气体时反应的离子方程式: 。
13.(8分)物质A~E都是中学化学中常见的物质,已知A为紫红色,它们可发生如图所示的反应。
(1)写出物质的名称和类别:
序号 A B C D E
名称
类别
(2)在以上反应中(用序号填空):
属于氧化还原反应的有 ;属于离子反应的有 。
(3)写出反应③和⑦的离子方程式:
③ ;
⑦ 。
14.(12分)某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
甲
乙
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有 。
A.天平 B.烧杯
C.漏斗 D.玻璃棒
(2)OA段反应的离子方程式为 。
(3)AB段反应的离子方程式为 。
(4)B点对应的溶液中的溶质为 ,向该溶液中滴加AgNO3溶液,观察到的现象是 ,反应的离子方程式为 。
15.(17分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生过程:H2O2O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是: 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目。
(4)H2O2常用作氧化剂、漂白剂和消毒剂。为了便于贮存、运输和使用,工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。接触下列物质不会使过碳酸钠失效的是 。
A.MnO2 B.Ca(OH)2
C.HCl D.NaCl
第一章 物质及其变化 测评(B)
(时间:60分钟 满分:100分)
一、选择题(本题包括11个小题,每小题5分,共55分,每小题只有1个选项符合题意)
1.如图所示,符合图中阴影部分的物质是( )
A.NaHCO3 B.Cu2(OH)2CO3
C.NaCl D.Na2CO3
答案:D
解析:NaHCO3和Cu2(OH)2CO3不是正盐;NaCl不是碳酸盐。
2.下列现象与氧化还原反应无关的是( )
A.铜制水龙头上出现铜锈[主要成分Cu2(OH)2CO3]
B.充有H2的气球遇明火发生爆炸
C.大理石雕像被酸雨腐蚀毁坏
D.银质首饰时间久了会变黑(表面覆盖Ag2S薄膜)
答案:C
解析:A项中铜被氧气氧化,B项中氢气被氧化,D项中银被氧化。C项发生复分解反应,没有元素化合价的变化。
3.纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸。下列说法正确的是( )
A.纳米铜是一种胶体
B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同
D.纳米铜无须密封保存
答案:B
解析:纳米铜由铜元素组成,属于单质,与普通铜所含铜原子的种类相同,A、C两项错误;纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸,因此须密封保存,D项错误。
4.某溶液中含有K+、HC、S等离子,向溶液中加入适量的NaOH固体,溶液中离子的数目显著增加的是( )
A.HC B.K+
C.C D.S
答案:C
解析:OH-与HC反应生成C,C的数目会显著增加。
5.化学概念在逻辑上存在如下关系:
下列说法正确的是( )
A.胶体与化合物属于包含关系
B.化合物与碱性氧化物属于包含关系
C.单质与电解质属于交叉关系
D.氧化还原反应与离子反应属于并列关系
答案:B
解析:胶体是混合物,化合物属于纯净物,两者不属于包含关系,A项错误;电解质都是化合物,与单质不属于交叉关系,C项错误;氧化还原反应与离子反应属于交叉关系,D项错误。
6.下列化学反应中属于氧化还原反应但不属于置换反应的是( )
A.CuO+COCu+CO2
B.Fe+H2SO4FeSO4+H2↑
C.Cl2+2NaBr2NaCl+Br2
D.H2SO4+BaCl2BaSO4↓+2HCl
答案:A
解析:D项不是氧化还原反应;B项和C项既是氧化还原反应,又是置换反应;A项是氧化还原反应,但不是置换反应。
7.实验室需要配制只含选项中离子且各离子的个数均相等的溶液,能配制成功的是( )
A.Al3+、N、K+、S
B.Cu2+、Ba2+、S、C
C.OH-、Cl-、N、Na+
D.Mg2+、Na+、S、N
答案:D
解析:A项中电荷不守恒,B项中的离子不能大量共存,C项中N与OH-不能大量共存。
8.下列各项中根据离子方程式改写的化学方程式,其中不正确的是( )
A.Cu2++2OH-Cu(OH)2↓
CuSO4+Ba(OH)2Cu(OH)2↓+BaSO4↓
B.C+2H+CO2↑+H2O
Na2CO3+2HCl2NaCl+H2O+CO2↑
C.Ca2++CCaCO3↓
Ca(NO3)2+Na2CO3CaCO3↓+2NaNO3
D.Fe+Cu2+Fe2++Cu
Fe+CuSO4FeSO4+Cu
答案:A
解析:A项中的化学方程式中BaSO4不溶于水,书写离子方程式时不能拆分,要写化学式,A项错误。
9.现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是( )
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
答案:B
解析:根据所选用的试剂分别加入三种溶液中所发生的现象不同从而加以鉴别。H2SO4与NaOH反应无明显现象,H2SO4与Na2CO3反应生成无色气体,H2SO4与Ba(OH)2反应生成白色沉淀。
10.下列离子方程式书写不正确的是( )
A.碳酸钙中加入盐酸:CaCO3+2H+Ca2++H2O+CO2↑
B.氧化铜与硫酸反应:CuO+2H++SCuSO4↓+H2O
C.硫酸钠溶液中加入氢氧化钡溶液:Ba2++SBaSO4↓
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2CaCO3↓+H2O
答案:B
解析:CuSO4易溶于水,应该拆,正确的离子方程式为CuO+2H+Cu2++H2O。
11.用下列方法,各在一定条件下制取氧气:
①2KMnO4K2MnO4+MnO2+O2↑,
②2H2O22H2O+O2↑,
③2Na2O2+2H2O4NaOH+O2↑,
④2KClO32KCl+3O2↑。
若分别制取等质量的氧气,上述反应中转移电子数目之比为( )
A.2∶1∶1∶2 B.1∶1∶1∶1
C.1∶2∶2∶1 D.1∶2∶1∶2
答案:A
解析:从氧元素的化合价的变化入手分析。在①和④中,氧元素都是从-2价升高到0价,每生成1个O2分子失去4个电子;在②和③中,氧元素都是从-1价升高到0价,每生成1个O2分子失去2个电子。制取等质量的氧气,生成的O2分子数目相同,转移电子数目之比为4∶2∶2∶4,即2∶1∶1∶2。
二、非选择题(共4小题,共45分)
12.(8分)无机化合物可根据其组成和性质进行分类。
(1)上图所示的物质分类方法的名称是 。
(2)从H、C、N、O、Na、S中任选两种或三种元素组成合适的物质,填表。
物质 类别 酸 碱 盐 氧化物 氢化物
化学式 ①HCl ② ③ ④Ca(OH)2 ⑤Na2CO3 ⑥ ⑦CO2 ⑧Na2O ⑨NH3 ⑩H2O2
(3)写出⑧转化为⑤的化学方程式: 。
(4)实验室制备⑦常用 与①的水溶液反应,并用④的水溶液检验该气体。写出检验该气体时反应的离子方程式: 。
答案:(1)树状分类法
(2)②H2SO4(或HNO3等) ③NaOH(或NH3·H2O) ⑥Na2SO4(或NaNO3等)
(3)Na2O+CO2Na2CO3
(4)大理石(或石灰石) Ca2++2OH-+CO2CaCO3↓+H2O
解析:(1)常见的分类法有交叉分类法和树状分类法,由图可知此处为树状分类法。
(2)酸可以填写H2S、H2SO4、HNO3、H2CO3等中的一种,碱可以填写NaOH或NH3·H2O;盐可填写Na2SO4、NaNO3、Na2SO3等中的一种。
(3)Na2O是碱性氧化物,可与酸性氧化物CO2反应生成Na2CO3。
(4)实验室制备CO2常利用大理石或石灰石(CaCO3)与稀盐酸反应。
13.(8分)物质A~E都是中学化学中常见的物质,已知A为紫红色,它们可发生如图所示的反应。
(1)写出物质的名称和类别:
序号 A B C D E
名称
类别
(2)在以上反应中(用序号填空):
属于氧化还原反应的有 ;属于离子反应的有 。
(3)写出反应③和⑦的离子方程式:
③ ;
⑦ 。
答案:(1)
序号 A B C D E
名称 铜 氯化铜 氢氧化铜 氧化铜 硫酸铜
类别 单质 盐 碱 氧化物 盐
(2)①②⑦ ③④⑤⑦
(3)CuO+2H+Cu2++H2O Cu2++FeCu+Fe2+
14.(12分)某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
甲
乙
请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有 。
A.天平 B.烧杯
C.漏斗 D.玻璃棒
(2)OA段反应的离子方程式为 。
(3)AB段反应的离子方程式为 。
(4)B点对应的溶液中的溶质为 ,向该溶液中滴加AgNO3溶液,观察到的现象是 ,反应的离子方程式为 。
答案:(1)BD (2)H++OH-H2O
(3)M+2OH-Mg(OH)2↓
(4)NaCl 有白色沉淀生成 Ag++Cl-AgCl↓
解析:乙图中OA段为OH-与H+反应,AB段为OH-与M反应,B点对应溶液为NaCl溶液,加入AgNO3溶液发生反应Ag++Cl-AgCl↓。
15.(17分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生过程:H2O2O2。
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是: 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目。
(4)H2O2常用作氧化剂、漂白剂和消毒剂。为了便于贮存、运输和使用,工业上将过氧化氢转化为固态的过碳酸钠晶体(2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。接触下列物质不会使过碳酸钠失效的是 。
A.MnO2 B.Ca(OH)2
C.HCl D.NaCl
答案:(1)H2O2
(2)H2CrO4 Cr(OH)3
(3)3O2↑+2H2O
(4)D
解析:H2O2O2,H2O2中氧元素化合价升高,H2O2是还原剂,则必有元素化合价降低,从所给物质可知,化合价降低的只有Cr元素,H2CrO4发生还原反应:H2CrO4Cr(OH)3。
(4)过碳酸钠晶体(2Na2CO3·3H2O2)既具有H2O2的化学性质(遇到MnO2时分解为O2和水),又具有碳酸钠的化学性质[与HCl反应放出气体;与Ca(OH)2反应生成沉淀],所以应根据Na2CO3和H2O2的性质分析作答。
