高三化学高考备考一轮复习策略课件(共69张PPT)
文档属性
| 名称 | 高三化学高考备考一轮复习策略课件(共69张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-26 22:57:53 | ||
图片预览











文档简介
(共69张PPT)
明目标、夯基础、抓落实
化学学科质量分析
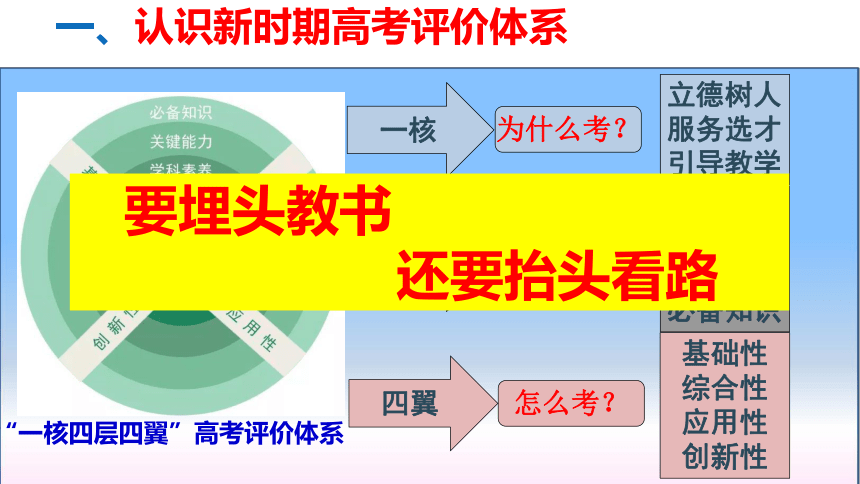
“一核四层四翼”高考评价体系
为什么考?
考什么?
怎么考?
一核
立德树人
服务选才
引导教学
核心价值
学科素养
关键能力
必备知识
四层
基础性
综合性
应用性
创新性
四翼
一、认识新时期高考评价体系
要埋头教书
还要抬头看路
完
善
优
化
三
轮
复
习
【安排好阶段复习】
二轮复习 (2022年1月下旬-2022年4月底)
连线织网、适度拓展,专题训练、提升能力
一轮复习 (2021年7月中旬-2022年1月下旬)
回归教材、适度整合,系统全面、夯实基础
三轮复习 (2022年4月底-2022年6月初)
模拟高考、实战演练,对照考纲、查漏补缺
形成答题技巧、时间分配、强化应试能力
三、注重能力、提升技能
【一轮备考策略】
一、明确思路、周密安排
二、细化目标、夯实基础
一轮复习:
花费时间最长,投入精力最多,
复习知识最广,高考贡献最大。
一轮有更大的调控空间,可以根据学生情况调整进度和复习模块,所有高考中可能出现的问题,都可以在一轮解决,一轮复习是提升能力、培养学科素养最关键的时期。
1.明确思路、周密安排
基础
一轮复习原则:
系统
全面
扎实
一轮复习目标:
夯实基础知识
完善知识体系
提升学科素养
走走站站,回头看看。
2.细化目标、夯实基础
依据考纲要求,仔细研究考题。
全面基础覆盖,扎实知识网络。
用好基础教材,切忌无限拔高。
3.注重能力、提升技能
训练知识迁移,构建思维模型。
培养学科素养,提升综合能力。
精简教材内容,整合教参资料。
完
善
优
化
三
轮
复
习
【安排好阶段复习】
二轮复习 (2022年1月下旬-2022年4月底)
连线织网、适度拓展,专题训练、提升能力
一轮复习 (2021年7月中旬-2022年1月下旬)
回归教材、适度整合,系统全面、夯实基础
三轮复习 (2022年4月底-2022年6月初)
模拟高考、实战演练,对照考纲、查漏补缺
形成答题技巧、时间分配、强化应试能力
【二轮复习策略】
1.组建知识网络、构建思维模型
2.弄清考题结构、强化模块训练
3.规范答题技巧、提高答题效率
二轮复习:
花费时间不长,投入精力不多,
能力提升最高,成绩提高最快。
1.组建知识网络、构建思维模型
Cu(OH)2NaMgAlFeCuAl3+Mg2+Na+Fe2+Fe3+Cu2+Na2O Na2O2MgOAl2O3Fe(OH)2Fe(OH)3NaOHMg(OH)2Al(OH)3FeO Fe2O3CuO五种元素四大类别五种元素一看类别二看价态三看通性计算实验物电元化四大理论CNSClH-40+2+4-30+1+2+3+4+5-20+4+6-10+1+3+5+7-10+1物理量性质变化物质分类实验操作十大核心nmVQ物化方离热元素规律分散系微粒晶体存取热分纯化学用语符号式子化学主干知识——原理是树干,物质是枝叶!
元素化合物知识体系——抓主线,明关系,会辨析
(1)钠线——5节点+5方程+5注意
(8)铁线——5节点+5方程+5注意
(9)铜线——5节点+5方程+5注意
(4)碳硅线—5节点+5方程+5注意
(7)氯线——6节点+6方程+6注意
(6)硫线——5节点+5方程+5注意
(5)氮线——5节点+5方程+5注意
(3)铝线——5节点+5方程+5注意
(9)串珠转化线
元素
化合物
基本
概念
基本
理论
有机化学必修
化学
实验
有机化学
基础[选修]
物质结构与性质
主干知识体系——七大专题衍生小专题
(1)碱金属
(2)镁铝铁
(3)碳族元素
(4)氮族元素
(5)氧族元素
(6)卤素
(7)化学计算
(8)物质的量及计算
(9)元素周期律及周期表
(10)电解质溶液
(11)反应速率与化学平衡
(12)热能与电能
(13)氧化还原与离子反应
(14)化学反应及其应用
(15)化学实验常用仪器及操作
(16)实验室制法
(17)物质的检验、分离、推断
(18)化学实验设计
(19)原子结构
(20)微粒间的作用
(21)分子结构
(22)晶体类型
(23)同分异构
(24)烃及其衍生物
(25)油酯、糖类、蛋白质
(26)有机合成材料
1.十大核心概念
2.四大核心常识
高分子材料
非金属材料
金属材料
高科技材料
传统/新型材料
日常生活
生态环境
安全防护
污染治理
3.十类物质用途
Na、Mg、Al、Fe、Cu
C、N、S、Cl、Br、I、
微量元素
4.胶体的用途
5.化学与文化
《本草衍义》《本草纲目拾遗》强水、五金、砒霜、酒醋茶
蒸馏、升华、干馏、萃取;
物理性质 + 用途 + 绿色化学
第一类:生活
(1)医用:75%酒精、84消毒液:杀菌消毒(新冠病毒)
(2)家庭:纯碱去油污、发酵粉NaHCO3、漂白粉、水性漆油性漆
(3)厨房:油脂、淀粉、纤维素、糖类、蛋白质变性、醋酸、
食用油、灼烧蚕丝羊毛、卤水点豆腐、泡沫灭火器
第二类:社会Society
(1)农业:草木灰与铵态氮肥、化肥、农药、波尔多液、
(2)工业:有机材料、无机材料、金属材料、稀土…
(3)军事:a炸药、b特种弹、c化学武器、d特种装备
a.黑火药、硝化甘油、TNT、硝酸铵、纤维素三硝酸酯
b.烟幕弹、燃烧弹、照明弹、催泪弹、信号弹
c.氯气、HCN、沙林、芥子气、光气、二元毒气弹
d.防毒面具、钛制装备、隐身飞机、人工降雨
(4) 医学:钡餐、人工脏器、医用高分子材料、人工角膜、
接触眼镜、人工骨齿、高分子药物
(5) 环境:PM2.5、绿色化学、煤石油天然气、酸雨、温室、雾霾;
第三类:科技Science and technology
(1)发明:侯氏制碱法Na2CO3、黑火药、造纸、
(2)制造:高分子化合物、新型材料(碳化硅、合成纤维、
合成橡胶、聚氨酯速滑服、碳包覆银纳米线、合成药物、
钛合金筛网轮)、 反渗透膜、人造纤维、
第四类:化学常识
(1)检验:Cl2、NH3、CO2、H2、O2
(2)俗名:烧碱、纯碱、
(2)用途:半导体硅、SiO2用途、光导纤维、合金、活性炭、
FeCl3腐蚀Cu线路板、水解用途、胶体用途
十类物质
用途
Na
Na2O2 NaHCO3 Na2CO3 NaOH
Mg
镁光灯、合金、海水提取镁
Al
储存浓酸、合金、焊接钢轨、铝矾土提取铝
Fe
Fe2+ Fe3+水解、净水、除锈、合金、腐蚀与防护
Cu
重金属盐、铜的腐蚀与回收、铜绿
C
天然气、水煤气、裂解气、温室效应、CO、CO2
N
大气污染、氮肥、炸药、保护气
S
大气污染、酸雨、大苏打、漂白、石硫合剂、火山、医疗
Cl、Br、I
Cl2 HClO HCl 漂白粉、海水提取Br、I
水溶液体系
水溶液5要点、胶体性质用途
《STES专题》——特殊用途要“熟”
三大污染固体污染白色污染、土壤污染、放射性污染液体污染重金属污染、有机肥、净水原理、酸雨气体污染O3空洞、光化学烟雾、温室效应、大气污染源三大能源石油主要成分、提取流程(4步骤)、产品应用煤主要成分、处理方法(干馏)、产品应用可燃气天然气、水煤气、裂解气三大营养油脂水解条件、Na2CO3去油脂、肥皂制备、甘油用途糖类水解条件、概念、性质、产物验证、光合作用蛋白质水解条件、主要性质、氨基酸、生理功能三大材料金属材料合金、金属的腐蚀与防护非金属材料三大传统材料(陶瓷、玻璃、水泥)、新型材料有机材料三大传统材料(塑料、橡胶、纤维)、新型材料《STES专题》——绿色化学的“四大核心”四大核心常识
十类物质
性质变化
组成
结构
Na
Na2O NaOH Na2O2 NaHCO3 Na2CO3
Mg
MgO Mg(OH)2 MgCl2
Al
Al2O3 Al(OH)3 AlCl3 NaAlO2
Fe
Fe2+ Fe3+ Fe(OH)2 Fe (OH)3
Cu
CuO Cu(OH)2 CuCl2
C
CO CO2 CH4、C2H4、C6H6 乙醇 乙酸 酯 糖类 蛋白质
N
NH3 NH4+ NO NO2 HNO3 NO3-
S
Cl
Cl2 HClO HCl Br2 I2
(H)
水溶液体系
溶液——5行为;胶体——胶体制备、胶体性质、胶体用途
S H2S SO2 SO3 H2SO4
四大原理
四大重点
两大工具
十
大
核
心
概
念
元素化合物
分类、性质、化学用语(1号/3式/4方程)、反应、用途
化学实验
仪器、药品、贮存、操作、安全、分离、提纯、检验(离子、气体)
化学计算
n、NA、M、Vm、C;转化率、产率、KKaKbKwKhKsp、pH、 H
物质结构
元素/律表
必:元素核素同位素、元素周期律、元素的性质、化学键离子键共价键、离子/共价化合物
选:三模型
(原子/共价键/晶体)等
速率平衡
化学反应速率、催化剂、化学平衡、勒夏特列原理
电解质溶液
电解质、电离平衡、pH及应用、盐类水解及应用、沉淀溶解平衡、离子反应及应用、胶体
两大反应
离子反应/氧化还原反应:相关概念、条件、类型、应用
两大能量
反应热、中和热、燃烧热、焓变、热化学方程式、盖斯定律、原电池电解池及应用
有机化学
分类、烃及衍生物结构、性质及应用、有机高分子材料(传统、新型)
材料
三类材料:金属材料、无机非金属材料(传统、新型)、有机高分子材料(传统、新型);
四大晶体:离子晶体、分子晶体、金属晶体、原子晶体;晶胞、特点、性质
化学实验核心性质验证结论探究制备物质综合实验基本操作四大类型验证一条性质验证一个结论验证一种原理制备一种物质制备一类物质实验应用仪器:洗涤、连接、气密性、检漏药品:取用、贮存、加入顺序、作用离子/气体:检验、鉴别、鉴定制备实验(无机物/有机物)制备胶体、配制溶液中和滴定、氧化还原滴定探究VC、CO2、Fe2+、Fe3+、NH3、NH4HCO3、SO2的性质探究水/乙醇中氢的活泼性;探究Cl、S、C非金属性强弱探究浓度对速率的影响、探究AgCl、AgI溶解度与Ksp大小(1)实验常识——仪器、药品、(2)安全常识——标志、事故、污染、处理;(3)基本性质实验——(无机物、有机物)混合物:分离、提纯十项操作基本实验安全常识
`
化学
实验
核心
性质验证
结论探究
制备物质
实验操作
验证一条性质
验证一个结论
验证一种原理
制备一种物质
制备一类物质
考查制备方法
检验离子/气体
鉴别鉴定
分离提纯
制备Fe(OH)3胶体
制备无水MgCl2
制取并纯化氢气
配制NaOH溶液
探究维生素C的还原性
探究浓度对速率的影响
探究“Fe、Fe2+、Fe3+”的性质
探究CO2具有氧化性
探究NH3、NH4HCO3的性质
探究水和乙醇中氢的活泼性
探究AgCl、AgI溶解度与Ksp大小
检验NH3的性质
除去Cu粉中混有的CuO
实验常识
实验安全
仪器药品
电化学
原电池
电解
概念
构成
原理
类型
概念
构成
原理
应用
把化学能转化为电能的装置。
两极、电解质溶液、闭合回路
电子离子移动、原电池反应
干电池、蓄电池、燃料电池等
把电能转化为化学能的装置。
电源、阴阳两极、电解质溶液
离子移动、放电顺序、氧化还原反应
电解食盐水、电解精炼铜、电镀等
新型电源
真实情境
化学能
电能
原电池
电解池
电解池工作原理——3333
3构造
3反应
3方向
3应用
稀硫酸
锌片
铜片
原电池工作原理——3333
3构造
3反应
3方向
3类型
以电化学为例构建模型
2能2池+四3考点!
辨析类型——原电池3类型 + 电解池2+4类型
稀硫酸
锌片
铜片
Zn - 2e- = Zn2+
2H+ + 2e- = H2
Zn + 2H+ = Zn2++H2
Zn - 2e- = Zn2+
2NH4+ + 2e- = 2NH3 +H2
Zn +2NH4+=Zn2++2NH3+H2
Pb - 2e- + SO42- = PbSO4
PbO2 +2e- +SO42-+4H+=PbSO4+2H2O
Pb + PbO2 + 2H2SO4 =PbSO4+2H2O
2H2 - 4e- = 4H+
O2 +4e- +4H+= 2H3 + 2H2O
2H2+O2 =2H2O
1.电解H2O
(1)H2SO4 HNO3
(2)NaOH
(3)Na2SO4 NaHSO4
2.电解溶质
(1)CuCl2
(2)FeCl3
3.放H2生碱
(1)NaCl
(2)NaBr
4.放O2生酸(1)CuSO4 (2)AgNO3
溶液
阳极
1.惰性电极
2.活性电极
高考改进类型——桥+膜+新
Zn - 2e- = Zn2+
Cu2+ + 2e- =Cu
Zn + Cu2+ = Zn2++Cu
盐桥的作用——使双液形成闭合回路
(1)导电,形成闭合回路;
(2)保持正负电荷守恒;
(3)避免电池的极化作用;
单(双)膜原电池——
阴离子交换膜:只允许阴离子和水分子通过;
阳离子交换膜:只允许阳离子和水分子通过;
质子H+交换膜:只允许H+通过;
交换膜的原理——选择性通过
(1)区域隔开,形成不同的区域;
(2)名称决定了允许通过的微粒;
高考改进类型——桥+膜+新
典型装置——观察新型装置图
2018-I-13.我国设计CO2+H2S协同转化装置
2018-I-27.(3)制备Na2S2O3三室膜电解图
2018-Ⅱ-12.可呼吸Na-CO2二次电池
2018-Ⅲ-27(3)电解法制备KClO3
典型装置——观察新型装置图
2020-I-12新型Zn CO2水介质电池
2020-I-27.电池装置进行实验验证
2020-II-12.电致变色器件图
2020-II-26(1)图(a)制取氯气
2019-Ⅰ.生物燃料电池原理研究室温下氨的合成
典型装置——观察新型装置图
2019-Ⅲ.强碱性电解质的3D Zn—NiOOH二次电池图
2019-III-(4)电解HCl回收Cl2,用碳基电极材料设计图
2019-II-27(4)制备二茂铁(Fe(C5H5)2图
2020-III-12碱性硼化钒(VB2)—空气电池
2020-山东-10微生物脱盐电池
2020-山东-13电解法制备双氧水图
2020-II-28(3)CH4和CO2耦合转化图
典型装置——观察新型装置图
2.弄清考题结构、强化模块训练
2021年全国甲卷理综化学试题双向细目表
题号 试题模块 学科核心素养 知识点 分值 预估难度 能力层次
7 化学与STSE 科学态度与社会责任 环境保护与绿色化学,废旧电池、含磷洗涤剂、天然气、食品添加剂 6 0.85 A
8 基本概念与原理 宏观辨识与微观探析 阿伏加德罗常数计算、重水、氧化还原反应、NO2性质、K2Cr2O7性质、化学键 6 0.60 B
9 化学实验基础 科学探究与创新意识 O2、H2S、NH3、NO2的实验室制法、NH4Cl的性质、浓硫酸的性质、稀硝酸的性质 6 0.70 B
10 有机化学实验(必修) 宏观辨识与微观探析 反应类型判断、同分异构体判断、分子式推算、官能团的性质;烯烃、烷烃、羧酸和醇的组成、结构和性质 6 0.65 B
11 物质结构与元素周期律 证据推理与模型认知 元素推断、元素周期表、元素周期律、化学键、元素原子半径比较、金属性和非金属性比较、氧化物的性质;铝、硫和氮及其化合物的性质 6 0.55 C
12 水溶液中的离子平衡 证据推理与模型认知变化观念与平衡思想 溶解平衡、溶度积曲线、对数坐标图像、溶度积计算、对数计算、图像变化分析 6 0.45 D
13 电化学基础 科学探究与创新意识证据推理与模型认知 新型电解装置分析、电极反应式、电子移动方向、离子移动方向、氧化还原反应、电子转移、羧酸与醛的结构 6 0.52 D
26 无机化学及化学工艺流程 宏观辨识与微观探析证据推理与模型认知变化观念与平衡思想 反应产物分析、试剂作用分析、陌生氧化还原反应化学方程式和离子方程式书写、氧化还原反应计算、循环利用物质判断等知识、铁氮碘元素化合物性质、化学实验 14 0.50 D
27 化学实验综合与探究 科学探究与创新意识宏观辨识与微观探析证据推理与模型认知 仪器选择、离子方程式书写、结晶步骤、胶体性质、Fe3+水解、分离提纯、氧化还原反应、实验评价、结晶水数目计算、误差分析 14 0.48 D
28 化学反应原理综合 证据推理与模型认知变化观念与平衡思想科学探究与创新意识 反应热计算、图像分析、平衡移动原理综合应用、分压及分压化学平衡常数计算、平衡常数与反应热的关系 15 0.45 D
35 物质结构与性质 宏观辨识与微观探析科学态度与社会责任证据推理与模型认知 核外电子排布、晶体类型判断、杂化轨道、化学键类型、化学键与氢键、分子结构与性质、晶胞离子配位数分析、晶胞密度计算、化合价计算 15 0.55 C
36 有机化学基础 宏观辨识与微观探析科学探究与创新意识证据推理与模型认知 有机化合物命名、言能团名称及性质、反应类型判断、有机物结构分析、信息迁移型有机化学方程式书写、同分异构体判断、有机合成路线设计 15 0.42 D
知识模块及题号 2021 2020 2019 2018
化学与STES 7 7 7
有机物结构与性质 10 8 9
元素周期表(律)+元素化合物 11 11 9 13
电化学(电解、原电池) 13 12 13 11
水溶液中离子平衡 12 / / 12
化学实验基础 9 10 12 10
NA(阿伏加德罗常数)题 8 9 11 8
反应机理
离子方程式正误判断 11
全国Ⅲ卷选择题题型
Ⅲ卷特点
全国卷综合实验题型
2021年27题 2020年26题 2019年27题 2018年26题
载体 胆矾制备及结晶水个数测定 氯气制备氯酸钾和次氯酸钠 咖啡因萃取实验 硫代硫酸钠纯度测定
答题量 9个空 10个空 9个空 9个空
涉及知识点 含1个计算仪器名称、化学方程式、环保、基本实操作、pH调控、胶体聚沉条件、结晶水计算、误差分析 (1)仪器名称、除杂试剂选择(2)加热方式、离子方程式(3)离子迁移(4)选择试剂(5)结晶实验操作(6)氧化性比较 (填空6个、3个简答、陌生度大,难度大)(1)研细目的、沸石作用(2)不用明火原因、索氏萃取优点(3)乙醇萃取剂的优点(4)生石灰作用(5)升华 (填空8个、1计算、无简答)(1)配制溶液步骤(2)①配制溶液步骤②滴定计算
结论 (常规实验)容易拿分 受疫情影响,难下降(新变化) 陌生实验(新变化) 文字型实验考查
突破综合实验题
几年来做答量都在7~10个空之间,通常有简答3~4个;且计算也有两个。每年 均有操作、现象、目的或原因;可能会有计算、设计实验、比较方案优点等。
考题类型从有机制备类(13,14) 性质探究(15物质分解探究、16化学反应 探究) 定量分析(17凯氏定氮法) 无机制备类(18醋酸亚铬的制备)→无机 制备类(19硫酸铁铵的制备含框图流程)。值高考过渡期,考题会相对较稳定, 连续三年均给出实验步骤的考查或呈现,框图流程的形式展示是实验步骤,探究式实验考查,都属于高阶思维的考查。21年属常规实验考查。
在复习备考中,强化实验必备知识(仪器、操作、制备、检验、探究、评价
、设计)的考查,注重信息处理能力及实验评价、实验探究与创新能力、实验设计能力的集中训练。
突破综合实验题
实验专题复习的主要内容
⑴化学实验基础知识:常用仪器的规格及用途、化学实验基本操作、化学实验室安全知识、物质的检验、分离与提纯。
⑵常见气体的实验室制法
①内容:H2、O2、Cl2、CO2、SO2、NH3、NO、NO2、C2H4
②要求:原理(一般方法、特殊方法)、装置(反应装置、净化装置、收集装置、尾气处理装置)、实验步骤、操作方法、收集方法、检验方法、净化方法、尾气吸收方法)
突破综合实验题
⑶常见物质的制备
①无机物制备
ⅰ硫酸亚铁的制备(原理、铁屑过量、趁热过滤、重结晶、产率计算等)
ⅱ氢氧化亚铁的制备(原理、硫酸亚铁和NaOH的配制、氢氧化亚铁得保护等)
ⅲ氢氧化铝制备(原理、沉淀、过滤、洗涤、干燥、称量、产率计算等。)
②有机物制备(溴苯、乙酸乙酯)
主要考点:反应原理(主副反应)、实验装置(回流、冷凝、三颈瓶、温度计、水浴加热等)、实验安全(防暴沸、防倒吸等)、分离提纯(萃取分液、蒸馏等)、产物检验、产率计算等。
突破综合实验题
⑷教材中的重要性质实验和定量实验
①钠、铁与水反应的实验(必修1)
②铜、碳与浓硫酸反应实验(必修1)
③氨的喷泉实验和催化氧化实验(必修1)
④影响化反应速率的因素探究实验(必修2、选修4)
⑤设计原电池实验(必修2 、选修4 )
⑥石蜡油的裂化实验(必修2)
⑦乙醇催化氧化和乙酸乙酯制备(必修2)
⑧海带中碘元素的检验和提取(必修2)
⑨证明醋酸、碳酸和硼酸的相对强弱(选修4)
⑩电解实验(选修4)
⑾两个定量实验:中和滴定(选修4)、中和热测定
全国卷工艺流程题
2021年26题(乙) 2020年26题(Ⅲ) 2021年26题(甲)
命题载体 炼铁高钛炉渣回收钛\镁\铝 废镍催化剂制备硫酸镍 含碘海水制备碘单质
答题量 8个空(填空5个、2个方程式、1个计算) 9个空(填空6个、2个方程式、1个计算) 8个空(填空4个、 计算1个、写方程3 个 )
涉及知识点 (1)焙烧化学方程式(2)滤液中离子判断(3)利用溶度积计算离子浓度(4)酸的选择\滤渣判断(5)离子方程式(6)母液溶质循环利用 (1)碱浸作用、方程式(2)溶液中离子判断(3)氧化剂选择、杂质离子分析(4)溶度积计算(5)离子方程式(6)循环利用的意义 (1)离子方程式\物质循环利用(2)氧化产物判断\碘回收率原因解释(3)复合反应的离子方程式(4)简单计算\试剂过量原因解释
难度 比20年稍易 - 比20年稍易
突破工艺流程题题型
利用“杂质线”“试剂线”“操作线”“产品线”四线法突破工艺的流程题,使工艺题的思路呈现有序性、完整性。
杂质线:基于四线法,多年全国卷工艺题为参考依据,可发现杂质线中常见杂质其出现次数为SiO2(14次);Al2O3(12次);FexOy(12次,FeS 1次 FeS2 1次 FeCO3 2次);MgO(6次);MnO2(4次);CaO(4次),高频出现的杂质应熟记其除杂方式。
由于地壳中元素含量最多的前几位为氧(O)、硅(Si)、铝(Al)、铁 (Fe)、钙(Ca)、钠(Na)、钾(K)、镁(Mg),考题中常见的杂质可见一斑。
常见的除杂方法有:沉淀法、金属置换、离子交换(pH有影响)、有机萃取法(pH有影响)等,其中沉淀法又有调pH[Fe(OH)3]、氟化(CaF2)、硫化(CuS)、氧化还原(Mn2+与KMnO4归中)等形式。积累杂质常见的去向:比如硅的走向有SiO2、H2SiO3、铝硅酸钠Na2Al2Si2O8↓等情况。
“四线法”突破工艺流程题
试剂线:基于四线法,多年全国卷工艺题为参考依据,可发现为了获取产品或除杂 常用的试剂统计如下
氧化剂:KMnO4、H2O2(多次)、空气(O2)(多次)、Cl2(次氯酸盐多次)、NH4NO3(多次、HNO3、
NaNO3)、NaNO3、Fe3+、MnO2(1次)、NaClO3(多次、KClO3)、ClO2(1次)
还原剂:SO2(+4、﹣2、+2等价态S)(1次)、I﹣、Fe2+、金属单质、H2O2、HCl(1次)、
NaClO2(1次)、金属单质(1次)
酸:HCl(多次)、H2O2(1次)、H2C2O4(多次)、H2SO4(多次)、SO2(多次)、HNO3(1次)、CO2(多次)
碱:NH3H2O(多次)、NaOH(多次、KOH)
盐:KCl(多次)、NH4NO3(多次)、(NH4)2CO3(多次)、NH4HCO3(多次)、NH4Cl(多次)、
(NH4)2SO3(1次)、(NH4)2SO4(1次)、(NH4)2C2O4(1次)、NaNO3(多次)、Na2CO3(1次,碱 熔)
调pH的试剂:酸、碱、盐、氧化物
“四线法”突破工艺流程题
突破工艺流程题题型
操作线:基于四线法,以多年全国卷工艺题为参考依据,可发现为了获取产品或除杂常用的常见操作为:
酸浸、碱浸、煅烧(灼烧、焙烧)、萃取分液、反萃取(稀释)、蒸发、蒸馏、结晶法、 重结晶法、洗涤(洗什么、用什么洗、为什么洗、是否洗干净了)、过滤、干燥、调pH、 调(控)温、离子交换、加入(足量)试剂、返回工序(循环利用)等
“四线法”突破工艺流程题
突破工艺流程题题型
2021年28题甲 2020年28题 2019年28题
情境 二氧化碳加氢制甲醇 二氧化碳催化加合成乙烯 地康制取氯气相关反应
答题数量 8个空(计算2个\填空4\原因分析) 7个空(填空5个、计算2个) 7个空(填空4个、计算3个)陌生度较大
涉及知 识点 (1) 盖斯定律\能量变化图及相关原因(2)压强平衡常数表达式\等压曲线推理及理由(3)转化率计算及对应具体条件的判断 (1) 计算推理计算反应比值\平衡移动方向(2)根据平衡移动判断曲线代表的物质\判断反应吸热或放热(3)给定的点计算压强平衡常数 (1)平衡常数比大小\平衡常计算\不利因素分析(2)盖斯定律计算(3)提高反应物转率的方法(4)电解池电极反应书写及及相关计算
全国卷反应原理题型
反应原理题常考考点
1.盖斯定律、△H
2.平衡常数
3.化学平衡及移动、转化率
4.化学反应速率与化学平衡图像分析
6.速率方程
7.活化能
5.化学反应速率及影响因素
突破反应原理题
1.注重化学观的构建:
速率观、平衡观、守恒观、微粒观、变量观。
3.熟练使用化学用语:化学方程式、离子方程式、热化学方程式、电离方程式、水解方程式、电极反应、平衡常数表达式、电子式、结构式等。
2.注重知识点建模:热化学方程式的书写模型,盖斯定律应用模型;速率与平衡、平衡状态的判断模型,三段式模型,平衡移动模型,Q与K比较;原电池和电解池的工作原理模型;水溶液中平衡常数计算模型,pH的计算模型,水溶液中的平衡移动模型等。
4.注重化学平衡教学中定量思想:提高定量分析问题的能力,掌握守恒法、定义表达式法等各种计算方法。
6.强化化学计算,计算要过心理关:
(1)掌握常见氧化还原反应的相关计算。
(2)能运用盖斯定律进行有关反应焓变的计算。
(3)化学速率计算,并能正确计算化学反应的转化率(α)。
(4)各种平衡常数计算。
5.加强“图像”分析:提高用图表获取信息和加工信息的能力,能够根据各种图表分析物质的变化过程和反应原理。
突破反应原理题
突破反应原理题
1.反应方向:能量、 H-T. S<0 ——方向问题、盖斯定律;
2.反应速率:影响因素、数据处理 ——快慢问题、速率方程;
3.反应限度:平衡建立、影响因素 ——条件控制、反应机理;
4.有关计算:平衡常数、转化率 ——数据处理、问题讨论;
1.载体:生产实际:污水、废气、实际环境;
2.技巧:图像、图表
3.关键:反应特点、容器特点、关键条件
4.能力:做这一类高考题,真正体现了“宏微观+平衡观”的
理科“高阶思维”价值!
突破反应原理题
第1模块:题头——元素化合物情境,找到关键的反应,抓住反应的特点!
例1.硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:
SO2(g)+O2(g) SO3(g)
例2.天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
C2H6(g) C2H4(g)+H2(g)
例3.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。
CO2(g)+4H2(g) C2H4(g)+2H2O(g)
第2模块:原理1——热化学:盖斯定律
原理2——动力学:速率、平衡、转化率、平衡常数、影响因素、条件选择
原理3——电化学:电解池
突破反应原理题
主干知识
1速率公式的剖析与应用 v(B)=Δc(B)/Δt
注意:(1)浓度适于气体和溶液;
(2)平均反应速率,取正值;
(3)同一反应、不同物质表示速率,数值可能不同,但意义相同;
(4)反应速率之比等于其化学计量数之比;
2.外界条件对反应速率影响
(1)纯液体、固体浓度视为常数,但固体颗粒大小影响反应速率;
(2)压强对无气体参加的化学反应的速率无影响;
(3)升温,不论吸热、放热、正反应、逆反应,速率都增大;
(4)温度选择还需考虑催化剂的活性温度范围;
(5)气体反应,要考虑T、P是否造成浓度改变,在判断速率变化;
3.常见失误
(1)不注意容器的体积;
(2)漏写单位或单位写错;
(3)忽略有效数字。
突破反应原理题
反应速率
4因素
2公式
浓度:适于气体、溶液,浓快稀慢;
压强:增压→积缩→浓增→速率增;
温度:升温→速率增,吸热/放热,速率都增大;
催化剂:增大反应速率,正逆同增;
2解释
碰撞理论:活化分子、有效碰撞
速率方程:速率常数
4误区
(1)速率计算,注意单位;
(2)固体、纯液体不改变速率;固变小速率快;
(3)辨析压强,引起浓度变化,速率变化;
(4)温度升高,正、逆速率都增大,但程度不同;
物质结构题题型
2019年 2018年 2017年
情境 磷酸亚铁电池 锌是人体必需的微量元素 钴\锰氧化物催化剂催化二氧化碳和氢气合成甲醇
是什么 对角线规则 电子自旋状态 杂化类型、共价键类型 锌的核外电子排布 空间构型、杂化类型 钴、锰核外电子排布、未成对电子数
杂化类型
共价键类型
为什么 苯胺与甲苯沸点高低比较及原因 氢、氮、氧、磷比较电负性 锌、铜第一电离能比较及原因 锌的卤化物的溶解性不同的原因 钴、锰第一电离能比较
四种分子晶体沸点高低比较及原因
是多少 双聚氯化铁结构及配位数 有限长片段离子化学式的确定 六方最密堆积、密度计算 由晶胞参数计算离子半径
物质结构题常考考点
2020年全国Ⅲ卷 2021年全国甲卷
素材 氨硼烷 金属元素铬(Cr)
是什么 对角线规则 氨硼烷中配位键、配位原子 硼原子杂化类型 态Cr原子核外电子排布及特点、电负性比较;[Cr(NH3)3(H2O)2Cl]2+ 配原子和配位数;PH3中P的杂化类型;晶胞顶角位置的原子
为什么 氢、硼、氮半径比较 氢、硼、氮电负性比较 乙烷、氨硼烷熔点比较及原因(双氢键) NH3的沸点比PH3的高的原因;H2O 的键角小于NH3的原因
是多少 氨硼烷密度计算 原子空间占有率
突破物质结构题
“是什么”—考查理解与辨析能力,是基础知识的迁移,核外电子排布
晶体类型、化学键类型
杂化方式(包括空间构型、大π键、分子的极性)
“为什么”——考查分析与推测能力,对应应用性
《物质结构与性质》
结构 性质
微观探析 宏观辨识
“是多少”——数学建模,考查归纳与论证能力
均摊法 配位数
坐标参数 晶体密度
实例 简单立方 体心立方 面心立方最密堆积 金刚石
示意图
配位数 6 8 12 4
特点 (晶胞参数为a\原子径为r) 棱相切 在棱长为2r的立方体中有一个内接球 8顶点、6面心有原子,在4个小立方体的体心有原子。最近距离为体对角线的1/4
空间利用率
单质晶体中,配位数是指与一个微粒等距紧邻的同种微粒的数目
突破物质结构题
突破物质结构题
化合物晶体中,配位数是指与一个微粒等距紧邻的另一种微粒的数目
实例 氯化钠 氟化钙 石英
示意图
配位数 6 钙离子为8 氟离子为4 硅原子为4
氧原子为2
晶体计算总结
三相切(晶胞参数为a,原子半径为r)
简单立方
面对角线相切 (三球 )
体对角线相切 (五球 )
晶体计算总结
棱相切(两球a=2r)
面心立方
金刚石立方,虚拟5球,只有1个球在对角线四等分点上
体对角线相切 (三球 )
体心立方
物质结构常见考点
1、电子排布式,电子排布图
2、电离能,电负性
3、σ键和π键、极性键,非极性键,氢键,配位键
4、极性分子和非极性分子
5、等电子体
6、常见空间构型的杂化类型
7、键能,键长,键角的判断
8、晶体类型的判断
9、熔沸点高低比较
10、关于晶胞的计算
11、晶体坐标
12、空隙的填充和计算
全国有机综合题题型
2021年甲 2020年 2019年 2018年36题
情境 大豆素合成大豆素异黄酮及其衍生物 苯基环丁烯酮合成合成系列有机化合物 Heck反应合成氧化白藜芦醇 有机物在Cr-Ni催化条件下发生偶联反应
答题数量 7个空(名1个、计算1个、官能团1个、反应类型1个、同分异构1、合成路线1个) 8个空(名1个、写结构简式3个、官能团1个、反应条件1个、手性碳1个、同分异构1) 9个空
8个空(填空5个、方程1个、写结构简式2个)
涉及知识点 (1)有机物名称(2)计算(3)官能团名称(4)方程式(5)反应类型(6)同分异构体(7)合成路线 (1)有机物名称(2)结构简式(3)反应条件、结构简式(4)官能团名称、手性碳(5)同分异构体(6)取代基对有机产率的影响规律 (1)有机物名称(2)官能团(3)反应类型、分子式反应方程式(4)不同条件对有机物产率的影响(5)同分异构体结构简式(6)合成路线
(1)有机物名称(2)反应方程式(3)有机反应类型2空(4)结构简式(5)官能团(6)结构简式(7)同分异构体
突破有机综合题考点
从考点类型看,每年都有判断反应类型、同分异构体书写(种类或结构简式书 写);写反应方程式或物质(原料、产物或中间产物)结构简式,轮流考查设计合成线路。
从框图路线角度可发现,卷I考题:16—不推断,17—全推断,18—不推断、19—间断式推断,20—推断(无合成路线考查)。21甲乙卷均是半推理形式,甲卷有合成路线。
从合成路线设计的步数发现,总步骤在3~4步间,其中学过的步骤控制在1~2步间,即控制未学反应要有2步左右。15-全陌生反应共3步,16-前陌生(2步)后已学 共3步,17-前后已学(各1步),中间未学共4步,18-与17形式一样共4步。
有机呈现路线与合成路线设计问的关系,15-含环状物合成(设计合 成路线主打链状化合物),16-含环状物合成(设计合成路线涉及成环), 17-含环状物合成(设计合成路线也涉及成环),18-含环状物合成(设计 合成路线主打链状化合物)。
同分异构体:14-含苯环19种(氮原子,氢 谱考2甲基),15-考链状3种(三键),16-含苯环12种(羧基,氢谱考苯环对位),17-含苯环(2个甲基,羧基,三键),18-考链状(2个甲基,2个酯基), 19-考环状(非苯环-六元碳环),20-吡啶环,吡啶环是芳香类化合物。
突破有机综合题考点
在教学过程中强化有机合成路线设计(总步骤在3~4步间,其中学过的步骤控制在1~2步间,即控制未学反应要有2步左右)的训练,该题较好的考查了学生的提取信息和加工信息能力和创新能力,今后高考仍会延续,同时对有机试题进行“部分推断”VS“间断式推断” VS“不推断”的全面训练。对成环和不成环进行强化训练,强化有机物命名。
有机综合常见考点
1、有机物的命名
2、官能团的判断
3、有机反应类型判断
4、分子式、结构式、结构简式、同分异构体书写
5、有机物相互转化、化学方程式的书写
6、有机合成线路
3.规范答题技巧、提高答题效率
1.了解高考阅卷要求
要了解高考阅卷评分方法和把握程度,指导学生有效得分。要经常的向学生强调高考的目的就是有效的得分,注意区别高一、高二的学习与高考复习。如钻研问题在总复习时要适可而止,特别是在考场上。
2.强化答题训练,提高应试能力
审题
审题的重要性怎样讲都不过分,看的清才能做得对,三审而后三思,三思而后作答。
3.答题规划
(1)顺序:先易后难(先吃肉,后啃骨头)
(2)综合科:平均每分钟做2分的题。一道6分的选择题值得用3分钟去做。
(3)不要与难题较劲:学会放弃,善于放弃
4.格式与表述
不能只重耕耘,不重视收获。
(1)学会说明:简洁明了,好的说明引领我们的思路
(2)写式子时一定要本着:方程独立、列解分离、由抽象到具体,由模糊到清晰,鸡蛋不能放在一个篮子里。
5.几个重要的原则
(1)提高正确率 (2)书写工整(3)分步做答
(4)做对会做的题,写清做对的题(理综问题)
6.培养正确的答题心态:心态是考高分的制胜法宝
(1)自信、从容
我难人亦难,我不畏难;人易我也易,我不大意。
(2)乐观、满足
关注点在我会做的题,老想着我又做了一道题;而非我不会做的题,不要老想我还有多少题没做。
完
善
优
化
三
轮
复
习
【安排好阶段复习】
二轮复习 (2022年1月下旬-2022年4月底)
连线织网、适度拓展,专题训练、提升能力
一轮复习 (2021年7月中旬-2022年1月下旬)
回归教材、适度整合,系统全面、夯实基础
三轮复习 (2022年4月底-2022年6月初)
模拟高考、实战演练,对照考纲、查漏补缺
形成答题技巧、时间分配、强化应试能力
三轮复习策略
复习方针:是冲刺,贯彻“仿真、内化、迁移、调整”的原则,以模拟训练为主,在提升解决实际问题能力的同时,强化学生规范化应试的状态、能力和技巧。
复习目标:力争100%少丢分。
复习措施:三轮复习回扣课本,多做模拟题,三轮看士气,立足一个“考”字。
以模拟高考时间训练为主线
加大训练,每周两考
考后讲评,先导研讨
评后补偿,查缺补漏
1、题目以重组为主,兼顾较好套题。编制题目要精
挑细选,一是对前面学生暴露问题的强化补漏,二
要抓住各地最新的备考方向。
2、时间和形式均按高考。
考前三轮复习实施措施
最后一套模拟卷,也叫押题卷,信心卷。
临考的前两三天也应该让学生有一个练手的机会,体验到自己的复习成功,所以简单而典型的最后一套模拟卷也是非常必要的。
明目标、夯基础、抓落实
化学学科质量分析
“一核四层四翼”高考评价体系
为什么考?
考什么?
怎么考?
一核
立德树人
服务选才
引导教学
核心价值
学科素养
关键能力
必备知识
四层
基础性
综合性
应用性
创新性
四翼
一、认识新时期高考评价体系
要埋头教书
还要抬头看路
完
善
优
化
三
轮
复
习
【安排好阶段复习】
二轮复习 (2022年1月下旬-2022年4月底)
连线织网、适度拓展,专题训练、提升能力
一轮复习 (2021年7月中旬-2022年1月下旬)
回归教材、适度整合,系统全面、夯实基础
三轮复习 (2022年4月底-2022年6月初)
模拟高考、实战演练,对照考纲、查漏补缺
形成答题技巧、时间分配、强化应试能力
三、注重能力、提升技能
【一轮备考策略】
一、明确思路、周密安排
二、细化目标、夯实基础
一轮复习:
花费时间最长,投入精力最多,
复习知识最广,高考贡献最大。
一轮有更大的调控空间,可以根据学生情况调整进度和复习模块,所有高考中可能出现的问题,都可以在一轮解决,一轮复习是提升能力、培养学科素养最关键的时期。
1.明确思路、周密安排
基础
一轮复习原则:
系统
全面
扎实
一轮复习目标:
夯实基础知识
完善知识体系
提升学科素养
走走站站,回头看看。
2.细化目标、夯实基础
依据考纲要求,仔细研究考题。
全面基础覆盖,扎实知识网络。
用好基础教材,切忌无限拔高。
3.注重能力、提升技能
训练知识迁移,构建思维模型。
培养学科素养,提升综合能力。
精简教材内容,整合教参资料。
完
善
优
化
三
轮
复
习
【安排好阶段复习】
二轮复习 (2022年1月下旬-2022年4月底)
连线织网、适度拓展,专题训练、提升能力
一轮复习 (2021年7月中旬-2022年1月下旬)
回归教材、适度整合,系统全面、夯实基础
三轮复习 (2022年4月底-2022年6月初)
模拟高考、实战演练,对照考纲、查漏补缺
形成答题技巧、时间分配、强化应试能力
【二轮复习策略】
1.组建知识网络、构建思维模型
2.弄清考题结构、强化模块训练
3.规范答题技巧、提高答题效率
二轮复习:
花费时间不长,投入精力不多,
能力提升最高,成绩提高最快。
1.组建知识网络、构建思维模型
Cu(OH)2NaMgAlFeCuAl3+Mg2+Na+Fe2+Fe3+Cu2+Na2O Na2O2MgOAl2O3Fe(OH)2Fe(OH)3NaOHMg(OH)2Al(OH)3FeO Fe2O3CuO五种元素四大类别五种元素一看类别二看价态三看通性计算实验物电元化四大理论CNSClH-40+2+4-30+1+2+3+4+5-20+4+6-10+1+3+5+7-10+1物理量性质变化物质分类实验操作十大核心nmVQ物化方离热元素规律分散系微粒晶体存取热分纯化学用语符号式子化学主干知识——原理是树干,物质是枝叶!
元素化合物知识体系——抓主线,明关系,会辨析
(1)钠线——5节点+5方程+5注意
(8)铁线——5节点+5方程+5注意
(9)铜线——5节点+5方程+5注意
(4)碳硅线—5节点+5方程+5注意
(7)氯线——6节点+6方程+6注意
(6)硫线——5节点+5方程+5注意
(5)氮线——5节点+5方程+5注意
(3)铝线——5节点+5方程+5注意
(9)串珠转化线
元素
化合物
基本
概念
基本
理论
有机化学必修
化学
实验
有机化学
基础[选修]
物质结构与性质
主干知识体系——七大专题衍生小专题
(1)碱金属
(2)镁铝铁
(3)碳族元素
(4)氮族元素
(5)氧族元素
(6)卤素
(7)化学计算
(8)物质的量及计算
(9)元素周期律及周期表
(10)电解质溶液
(11)反应速率与化学平衡
(12)热能与电能
(13)氧化还原与离子反应
(14)化学反应及其应用
(15)化学实验常用仪器及操作
(16)实验室制法
(17)物质的检验、分离、推断
(18)化学实验设计
(19)原子结构
(20)微粒间的作用
(21)分子结构
(22)晶体类型
(23)同分异构
(24)烃及其衍生物
(25)油酯、糖类、蛋白质
(26)有机合成材料
1.十大核心概念
2.四大核心常识
高分子材料
非金属材料
金属材料
高科技材料
传统/新型材料
日常生活
生态环境
安全防护
污染治理
3.十类物质用途
Na、Mg、Al、Fe、Cu
C、N、S、Cl、Br、I、
微量元素
4.胶体的用途
5.化学与文化
《本草衍义》《本草纲目拾遗》强水、五金、砒霜、酒醋茶
蒸馏、升华、干馏、萃取;
物理性质 + 用途 + 绿色化学
第一类:生活
(1)医用:75%酒精、84消毒液:杀菌消毒(新冠病毒)
(2)家庭:纯碱去油污、发酵粉NaHCO3、漂白粉、水性漆油性漆
(3)厨房:油脂、淀粉、纤维素、糖类、蛋白质变性、醋酸、
食用油、灼烧蚕丝羊毛、卤水点豆腐、泡沫灭火器
第二类:社会Society
(1)农业:草木灰与铵态氮肥、化肥、农药、波尔多液、
(2)工业:有机材料、无机材料、金属材料、稀土…
(3)军事:a炸药、b特种弹、c化学武器、d特种装备
a.黑火药、硝化甘油、TNT、硝酸铵、纤维素三硝酸酯
b.烟幕弹、燃烧弹、照明弹、催泪弹、信号弹
c.氯气、HCN、沙林、芥子气、光气、二元毒气弹
d.防毒面具、钛制装备、隐身飞机、人工降雨
(4) 医学:钡餐、人工脏器、医用高分子材料、人工角膜、
接触眼镜、人工骨齿、高分子药物
(5) 环境:PM2.5、绿色化学、煤石油天然气、酸雨、温室、雾霾;
第三类:科技Science and technology
(1)发明:侯氏制碱法Na2CO3、黑火药、造纸、
(2)制造:高分子化合物、新型材料(碳化硅、合成纤维、
合成橡胶、聚氨酯速滑服、碳包覆银纳米线、合成药物、
钛合金筛网轮)、 反渗透膜、人造纤维、
第四类:化学常识
(1)检验:Cl2、NH3、CO2、H2、O2
(2)俗名:烧碱、纯碱、
(2)用途:半导体硅、SiO2用途、光导纤维、合金、活性炭、
FeCl3腐蚀Cu线路板、水解用途、胶体用途
十类物质
用途
Na
Na2O2 NaHCO3 Na2CO3 NaOH
Mg
镁光灯、合金、海水提取镁
Al
储存浓酸、合金、焊接钢轨、铝矾土提取铝
Fe
Fe2+ Fe3+水解、净水、除锈、合金、腐蚀与防护
Cu
重金属盐、铜的腐蚀与回收、铜绿
C
天然气、水煤气、裂解气、温室效应、CO、CO2
N
大气污染、氮肥、炸药、保护气
S
大气污染、酸雨、大苏打、漂白、石硫合剂、火山、医疗
Cl、Br、I
Cl2 HClO HCl 漂白粉、海水提取Br、I
水溶液体系
水溶液5要点、胶体性质用途
《STES专题》——特殊用途要“熟”
三大污染固体污染白色污染、土壤污染、放射性污染液体污染重金属污染、有机肥、净水原理、酸雨气体污染O3空洞、光化学烟雾、温室效应、大气污染源三大能源石油主要成分、提取流程(4步骤)、产品应用煤主要成分、处理方法(干馏)、产品应用可燃气天然气、水煤气、裂解气三大营养油脂水解条件、Na2CO3去油脂、肥皂制备、甘油用途糖类水解条件、概念、性质、产物验证、光合作用蛋白质水解条件、主要性质、氨基酸、生理功能三大材料金属材料合金、金属的腐蚀与防护非金属材料三大传统材料(陶瓷、玻璃、水泥)、新型材料有机材料三大传统材料(塑料、橡胶、纤维)、新型材料《STES专题》——绿色化学的“四大核心”四大核心常识
十类物质
性质变化
组成
结构
Na
Na2O NaOH Na2O2 NaHCO3 Na2CO3
Mg
MgO Mg(OH)2 MgCl2
Al
Al2O3 Al(OH)3 AlCl3 NaAlO2
Fe
Fe2+ Fe3+ Fe(OH)2 Fe (OH)3
Cu
CuO Cu(OH)2 CuCl2
C
CO CO2 CH4、C2H4、C6H6 乙醇 乙酸 酯 糖类 蛋白质
N
NH3 NH4+ NO NO2 HNO3 NO3-
S
Cl
Cl2 HClO HCl Br2 I2
(H)
水溶液体系
溶液——5行为;胶体——胶体制备、胶体性质、胶体用途
S H2S SO2 SO3 H2SO4
四大原理
四大重点
两大工具
十
大
核
心
概
念
元素化合物
分类、性质、化学用语(1号/3式/4方程)、反应、用途
化学实验
仪器、药品、贮存、操作、安全、分离、提纯、检验(离子、气体)
化学计算
n、NA、M、Vm、C;转化率、产率、KKaKbKwKhKsp、pH、 H
物质结构
元素/律表
必:元素核素同位素、元素周期律、元素的性质、化学键离子键共价键、离子/共价化合物
选:三模型
(原子/共价键/晶体)等
速率平衡
化学反应速率、催化剂、化学平衡、勒夏特列原理
电解质溶液
电解质、电离平衡、pH及应用、盐类水解及应用、沉淀溶解平衡、离子反应及应用、胶体
两大反应
离子反应/氧化还原反应:相关概念、条件、类型、应用
两大能量
反应热、中和热、燃烧热、焓变、热化学方程式、盖斯定律、原电池电解池及应用
有机化学
分类、烃及衍生物结构、性质及应用、有机高分子材料(传统、新型)
材料
三类材料:金属材料、无机非金属材料(传统、新型)、有机高分子材料(传统、新型);
四大晶体:离子晶体、分子晶体、金属晶体、原子晶体;晶胞、特点、性质
化学实验核心性质验证结论探究制备物质综合实验基本操作四大类型验证一条性质验证一个结论验证一种原理制备一种物质制备一类物质实验应用仪器:洗涤、连接、气密性、检漏药品:取用、贮存、加入顺序、作用离子/气体:检验、鉴别、鉴定制备实验(无机物/有机物)制备胶体、配制溶液中和滴定、氧化还原滴定探究VC、CO2、Fe2+、Fe3+、NH3、NH4HCO3、SO2的性质探究水/乙醇中氢的活泼性;探究Cl、S、C非金属性强弱探究浓度对速率的影响、探究AgCl、AgI溶解度与Ksp大小(1)实验常识——仪器、药品、(2)安全常识——标志、事故、污染、处理;(3)基本性质实验——(无机物、有机物)混合物:分离、提纯十项操作基本实验安全常识
`
化学
实验
核心
性质验证
结论探究
制备物质
实验操作
验证一条性质
验证一个结论
验证一种原理
制备一种物质
制备一类物质
考查制备方法
检验离子/气体
鉴别鉴定
分离提纯
制备Fe(OH)3胶体
制备无水MgCl2
制取并纯化氢气
配制NaOH溶液
探究维生素C的还原性
探究浓度对速率的影响
探究“Fe、Fe2+、Fe3+”的性质
探究CO2具有氧化性
探究NH3、NH4HCO3的性质
探究水和乙醇中氢的活泼性
探究AgCl、AgI溶解度与Ksp大小
检验NH3的性质
除去Cu粉中混有的CuO
实验常识
实验安全
仪器药品
电化学
原电池
电解
概念
构成
原理
类型
概念
构成
原理
应用
把化学能转化为电能的装置。
两极、电解质溶液、闭合回路
电子离子移动、原电池反应
干电池、蓄电池、燃料电池等
把电能转化为化学能的装置。
电源、阴阳两极、电解质溶液
离子移动、放电顺序、氧化还原反应
电解食盐水、电解精炼铜、电镀等
新型电源
真实情境
化学能
电能
原电池
电解池
电解池工作原理——3333
3构造
3反应
3方向
3应用
稀硫酸
锌片
铜片
原电池工作原理——3333
3构造
3反应
3方向
3类型
以电化学为例构建模型
2能2池+四3考点!
辨析类型——原电池3类型 + 电解池2+4类型
稀硫酸
锌片
铜片
Zn - 2e- = Zn2+
2H+ + 2e- = H2
Zn + 2H+ = Zn2++H2
Zn - 2e- = Zn2+
2NH4+ + 2e- = 2NH3 +H2
Zn +2NH4+=Zn2++2NH3+H2
Pb - 2e- + SO42- = PbSO4
PbO2 +2e- +SO42-+4H+=PbSO4+2H2O
Pb + PbO2 + 2H2SO4 =PbSO4+2H2O
2H2 - 4e- = 4H+
O2 +4e- +4H+= 2H3 + 2H2O
2H2+O2 =2H2O
1.电解H2O
(1)H2SO4 HNO3
(2)NaOH
(3)Na2SO4 NaHSO4
2.电解溶质
(1)CuCl2
(2)FeCl3
3.放H2生碱
(1)NaCl
(2)NaBr
4.放O2生酸(1)CuSO4 (2)AgNO3
溶液
阳极
1.惰性电极
2.活性电极
高考改进类型——桥+膜+新
Zn - 2e- = Zn2+
Cu2+ + 2e- =Cu
Zn + Cu2+ = Zn2++Cu
盐桥的作用——使双液形成闭合回路
(1)导电,形成闭合回路;
(2)保持正负电荷守恒;
(3)避免电池的极化作用;
单(双)膜原电池——
阴离子交换膜:只允许阴离子和水分子通过;
阳离子交换膜:只允许阳离子和水分子通过;
质子H+交换膜:只允许H+通过;
交换膜的原理——选择性通过
(1)区域隔开,形成不同的区域;
(2)名称决定了允许通过的微粒;
高考改进类型——桥+膜+新
典型装置——观察新型装置图
2018-I-13.我国设计CO2+H2S协同转化装置
2018-I-27.(3)制备Na2S2O3三室膜电解图
2018-Ⅱ-12.可呼吸Na-CO2二次电池
2018-Ⅲ-27(3)电解法制备KClO3
典型装置——观察新型装置图
2020-I-12新型Zn CO2水介质电池
2020-I-27.电池装置进行实验验证
2020-II-12.电致变色器件图
2020-II-26(1)图(a)制取氯气
2019-Ⅰ.生物燃料电池原理研究室温下氨的合成
典型装置——观察新型装置图
2019-Ⅲ.强碱性电解质的3D Zn—NiOOH二次电池图
2019-III-(4)电解HCl回收Cl2,用碳基电极材料设计图
2019-II-27(4)制备二茂铁(Fe(C5H5)2图
2020-III-12碱性硼化钒(VB2)—空气电池
2020-山东-10微生物脱盐电池
2020-山东-13电解法制备双氧水图
2020-II-28(3)CH4和CO2耦合转化图
典型装置——观察新型装置图
2.弄清考题结构、强化模块训练
2021年全国甲卷理综化学试题双向细目表
题号 试题模块 学科核心素养 知识点 分值 预估难度 能力层次
7 化学与STSE 科学态度与社会责任 环境保护与绿色化学,废旧电池、含磷洗涤剂、天然气、食品添加剂 6 0.85 A
8 基本概念与原理 宏观辨识与微观探析 阿伏加德罗常数计算、重水、氧化还原反应、NO2性质、K2Cr2O7性质、化学键 6 0.60 B
9 化学实验基础 科学探究与创新意识 O2、H2S、NH3、NO2的实验室制法、NH4Cl的性质、浓硫酸的性质、稀硝酸的性质 6 0.70 B
10 有机化学实验(必修) 宏观辨识与微观探析 反应类型判断、同分异构体判断、分子式推算、官能团的性质;烯烃、烷烃、羧酸和醇的组成、结构和性质 6 0.65 B
11 物质结构与元素周期律 证据推理与模型认知 元素推断、元素周期表、元素周期律、化学键、元素原子半径比较、金属性和非金属性比较、氧化物的性质;铝、硫和氮及其化合物的性质 6 0.55 C
12 水溶液中的离子平衡 证据推理与模型认知变化观念与平衡思想 溶解平衡、溶度积曲线、对数坐标图像、溶度积计算、对数计算、图像变化分析 6 0.45 D
13 电化学基础 科学探究与创新意识证据推理与模型认知 新型电解装置分析、电极反应式、电子移动方向、离子移动方向、氧化还原反应、电子转移、羧酸与醛的结构 6 0.52 D
26 无机化学及化学工艺流程 宏观辨识与微观探析证据推理与模型认知变化观念与平衡思想 反应产物分析、试剂作用分析、陌生氧化还原反应化学方程式和离子方程式书写、氧化还原反应计算、循环利用物质判断等知识、铁氮碘元素化合物性质、化学实验 14 0.50 D
27 化学实验综合与探究 科学探究与创新意识宏观辨识与微观探析证据推理与模型认知 仪器选择、离子方程式书写、结晶步骤、胶体性质、Fe3+水解、分离提纯、氧化还原反应、实验评价、结晶水数目计算、误差分析 14 0.48 D
28 化学反应原理综合 证据推理与模型认知变化观念与平衡思想科学探究与创新意识 反应热计算、图像分析、平衡移动原理综合应用、分压及分压化学平衡常数计算、平衡常数与反应热的关系 15 0.45 D
35 物质结构与性质 宏观辨识与微观探析科学态度与社会责任证据推理与模型认知 核外电子排布、晶体类型判断、杂化轨道、化学键类型、化学键与氢键、分子结构与性质、晶胞离子配位数分析、晶胞密度计算、化合价计算 15 0.55 C
36 有机化学基础 宏观辨识与微观探析科学探究与创新意识证据推理与模型认知 有机化合物命名、言能团名称及性质、反应类型判断、有机物结构分析、信息迁移型有机化学方程式书写、同分异构体判断、有机合成路线设计 15 0.42 D
知识模块及题号 2021 2020 2019 2018
化学与STES 7 7 7
有机物结构与性质 10 8 9
元素周期表(律)+元素化合物 11 11 9 13
电化学(电解、原电池) 13 12 13 11
水溶液中离子平衡 12 / / 12
化学实验基础 9 10 12 10
NA(阿伏加德罗常数)题 8 9 11 8
反应机理
离子方程式正误判断 11
全国Ⅲ卷选择题题型
Ⅲ卷特点
全国卷综合实验题型
2021年27题 2020年26题 2019年27题 2018年26题
载体 胆矾制备及结晶水个数测定 氯气制备氯酸钾和次氯酸钠 咖啡因萃取实验 硫代硫酸钠纯度测定
答题量 9个空 10个空 9个空 9个空
涉及知识点 含1个计算仪器名称、化学方程式、环保、基本实操作、pH调控、胶体聚沉条件、结晶水计算、误差分析 (1)仪器名称、除杂试剂选择(2)加热方式、离子方程式(3)离子迁移(4)选择试剂(5)结晶实验操作(6)氧化性比较 (填空6个、3个简答、陌生度大,难度大)(1)研细目的、沸石作用(2)不用明火原因、索氏萃取优点(3)乙醇萃取剂的优点(4)生石灰作用(5)升华 (填空8个、1计算、无简答)(1)配制溶液步骤(2)①配制溶液步骤②滴定计算
结论 (常规实验)容易拿分 受疫情影响,难下降(新变化) 陌生实验(新变化) 文字型实验考查
突破综合实验题
几年来做答量都在7~10个空之间,通常有简答3~4个;且计算也有两个。每年 均有操作、现象、目的或原因;可能会有计算、设计实验、比较方案优点等。
考题类型从有机制备类(13,14) 性质探究(15物质分解探究、16化学反应 探究) 定量分析(17凯氏定氮法) 无机制备类(18醋酸亚铬的制备)→无机 制备类(19硫酸铁铵的制备含框图流程)。值高考过渡期,考题会相对较稳定, 连续三年均给出实验步骤的考查或呈现,框图流程的形式展示是实验步骤,探究式实验考查,都属于高阶思维的考查。21年属常规实验考查。
在复习备考中,强化实验必备知识(仪器、操作、制备、检验、探究、评价
、设计)的考查,注重信息处理能力及实验评价、实验探究与创新能力、实验设计能力的集中训练。
突破综合实验题
实验专题复习的主要内容
⑴化学实验基础知识:常用仪器的规格及用途、化学实验基本操作、化学实验室安全知识、物质的检验、分离与提纯。
⑵常见气体的实验室制法
①内容:H2、O2、Cl2、CO2、SO2、NH3、NO、NO2、C2H4
②要求:原理(一般方法、特殊方法)、装置(反应装置、净化装置、收集装置、尾气处理装置)、实验步骤、操作方法、收集方法、检验方法、净化方法、尾气吸收方法)
突破综合实验题
⑶常见物质的制备
①无机物制备
ⅰ硫酸亚铁的制备(原理、铁屑过量、趁热过滤、重结晶、产率计算等)
ⅱ氢氧化亚铁的制备(原理、硫酸亚铁和NaOH的配制、氢氧化亚铁得保护等)
ⅲ氢氧化铝制备(原理、沉淀、过滤、洗涤、干燥、称量、产率计算等。)
②有机物制备(溴苯、乙酸乙酯)
主要考点:反应原理(主副反应)、实验装置(回流、冷凝、三颈瓶、温度计、水浴加热等)、实验安全(防暴沸、防倒吸等)、分离提纯(萃取分液、蒸馏等)、产物检验、产率计算等。
突破综合实验题
⑷教材中的重要性质实验和定量实验
①钠、铁与水反应的实验(必修1)
②铜、碳与浓硫酸反应实验(必修1)
③氨的喷泉实验和催化氧化实验(必修1)
④影响化反应速率的因素探究实验(必修2、选修4)
⑤设计原电池实验(必修2 、选修4 )
⑥石蜡油的裂化实验(必修2)
⑦乙醇催化氧化和乙酸乙酯制备(必修2)
⑧海带中碘元素的检验和提取(必修2)
⑨证明醋酸、碳酸和硼酸的相对强弱(选修4)
⑩电解实验(选修4)
⑾两个定量实验:中和滴定(选修4)、中和热测定
全国卷工艺流程题
2021年26题(乙) 2020年26题(Ⅲ) 2021年26题(甲)
命题载体 炼铁高钛炉渣回收钛\镁\铝 废镍催化剂制备硫酸镍 含碘海水制备碘单质
答题量 8个空(填空5个、2个方程式、1个计算) 9个空(填空6个、2个方程式、1个计算) 8个空(填空4个、 计算1个、写方程3 个 )
涉及知识点 (1)焙烧化学方程式(2)滤液中离子判断(3)利用溶度积计算离子浓度(4)酸的选择\滤渣判断(5)离子方程式(6)母液溶质循环利用 (1)碱浸作用、方程式(2)溶液中离子判断(3)氧化剂选择、杂质离子分析(4)溶度积计算(5)离子方程式(6)循环利用的意义 (1)离子方程式\物质循环利用(2)氧化产物判断\碘回收率原因解释(3)复合反应的离子方程式(4)简单计算\试剂过量原因解释
难度 比20年稍易 - 比20年稍易
突破工艺流程题题型
利用“杂质线”“试剂线”“操作线”“产品线”四线法突破工艺的流程题,使工艺题的思路呈现有序性、完整性。
杂质线:基于四线法,多年全国卷工艺题为参考依据,可发现杂质线中常见杂质其出现次数为SiO2(14次);Al2O3(12次);FexOy(12次,FeS 1次 FeS2 1次 FeCO3 2次);MgO(6次);MnO2(4次);CaO(4次),高频出现的杂质应熟记其除杂方式。
由于地壳中元素含量最多的前几位为氧(O)、硅(Si)、铝(Al)、铁 (Fe)、钙(Ca)、钠(Na)、钾(K)、镁(Mg),考题中常见的杂质可见一斑。
常见的除杂方法有:沉淀法、金属置换、离子交换(pH有影响)、有机萃取法(pH有影响)等,其中沉淀法又有调pH[Fe(OH)3]、氟化(CaF2)、硫化(CuS)、氧化还原(Mn2+与KMnO4归中)等形式。积累杂质常见的去向:比如硅的走向有SiO2、H2SiO3、铝硅酸钠Na2Al2Si2O8↓等情况。
“四线法”突破工艺流程题
试剂线:基于四线法,多年全国卷工艺题为参考依据,可发现为了获取产品或除杂 常用的试剂统计如下
氧化剂:KMnO4、H2O2(多次)、空气(O2)(多次)、Cl2(次氯酸盐多次)、NH4NO3(多次、HNO3、
NaNO3)、NaNO3、Fe3+、MnO2(1次)、NaClO3(多次、KClO3)、ClO2(1次)
还原剂:SO2(+4、﹣2、+2等价态S)(1次)、I﹣、Fe2+、金属单质、H2O2、HCl(1次)、
NaClO2(1次)、金属单质(1次)
酸:HCl(多次)、H2O2(1次)、H2C2O4(多次)、H2SO4(多次)、SO2(多次)、HNO3(1次)、CO2(多次)
碱:NH3H2O(多次)、NaOH(多次、KOH)
盐:KCl(多次)、NH4NO3(多次)、(NH4)2CO3(多次)、NH4HCO3(多次)、NH4Cl(多次)、
(NH4)2SO3(1次)、(NH4)2SO4(1次)、(NH4)2C2O4(1次)、NaNO3(多次)、Na2CO3(1次,碱 熔)
调pH的试剂:酸、碱、盐、氧化物
“四线法”突破工艺流程题
突破工艺流程题题型
操作线:基于四线法,以多年全国卷工艺题为参考依据,可发现为了获取产品或除杂常用的常见操作为:
酸浸、碱浸、煅烧(灼烧、焙烧)、萃取分液、反萃取(稀释)、蒸发、蒸馏、结晶法、 重结晶法、洗涤(洗什么、用什么洗、为什么洗、是否洗干净了)、过滤、干燥、调pH、 调(控)温、离子交换、加入(足量)试剂、返回工序(循环利用)等
“四线法”突破工艺流程题
突破工艺流程题题型
2021年28题甲 2020年28题 2019年28题
情境 二氧化碳加氢制甲醇 二氧化碳催化加合成乙烯 地康制取氯气相关反应
答题数量 8个空(计算2个\填空4\原因分析) 7个空(填空5个、计算2个) 7个空(填空4个、计算3个)陌生度较大
涉及知 识点 (1) 盖斯定律\能量变化图及相关原因(2)压强平衡常数表达式\等压曲线推理及理由(3)转化率计算及对应具体条件的判断 (1) 计算推理计算反应比值\平衡移动方向(2)根据平衡移动判断曲线代表的物质\判断反应吸热或放热(3)给定的点计算压强平衡常数 (1)平衡常数比大小\平衡常计算\不利因素分析(2)盖斯定律计算(3)提高反应物转率的方法(4)电解池电极反应书写及及相关计算
全国卷反应原理题型
反应原理题常考考点
1.盖斯定律、△H
2.平衡常数
3.化学平衡及移动、转化率
4.化学反应速率与化学平衡图像分析
6.速率方程
7.活化能
5.化学反应速率及影响因素
突破反应原理题
1.注重化学观的构建:
速率观、平衡观、守恒观、微粒观、变量观。
3.熟练使用化学用语:化学方程式、离子方程式、热化学方程式、电离方程式、水解方程式、电极反应、平衡常数表达式、电子式、结构式等。
2.注重知识点建模:热化学方程式的书写模型,盖斯定律应用模型;速率与平衡、平衡状态的判断模型,三段式模型,平衡移动模型,Q与K比较;原电池和电解池的工作原理模型;水溶液中平衡常数计算模型,pH的计算模型,水溶液中的平衡移动模型等。
4.注重化学平衡教学中定量思想:提高定量分析问题的能力,掌握守恒法、定义表达式法等各种计算方法。
6.强化化学计算,计算要过心理关:
(1)掌握常见氧化还原反应的相关计算。
(2)能运用盖斯定律进行有关反应焓变的计算。
(3)化学速率计算,并能正确计算化学反应的转化率(α)。
(4)各种平衡常数计算。
5.加强“图像”分析:提高用图表获取信息和加工信息的能力,能够根据各种图表分析物质的变化过程和反应原理。
突破反应原理题
突破反应原理题
1.反应方向:能量、 H-T. S<0 ——方向问题、盖斯定律;
2.反应速率:影响因素、数据处理 ——快慢问题、速率方程;
3.反应限度:平衡建立、影响因素 ——条件控制、反应机理;
4.有关计算:平衡常数、转化率 ——数据处理、问题讨论;
1.载体:生产实际:污水、废气、实际环境;
2.技巧:图像、图表
3.关键:反应特点、容器特点、关键条件
4.能力:做这一类高考题,真正体现了“宏微观+平衡观”的
理科“高阶思维”价值!
突破反应原理题
第1模块:题头——元素化合物情境,找到关键的反应,抓住反应的特点!
例1.硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:
SO2(g)+O2(g) SO3(g)
例2.天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
C2H6(g) C2H4(g)+H2(g)
例3.二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。
CO2(g)+4H2(g) C2H4(g)+2H2O(g)
第2模块:原理1——热化学:盖斯定律
原理2——动力学:速率、平衡、转化率、平衡常数、影响因素、条件选择
原理3——电化学:电解池
突破反应原理题
主干知识
1速率公式的剖析与应用 v(B)=Δc(B)/Δt
注意:(1)浓度适于气体和溶液;
(2)平均反应速率,取正值;
(3)同一反应、不同物质表示速率,数值可能不同,但意义相同;
(4)反应速率之比等于其化学计量数之比;
2.外界条件对反应速率影响
(1)纯液体、固体浓度视为常数,但固体颗粒大小影响反应速率;
(2)压强对无气体参加的化学反应的速率无影响;
(3)升温,不论吸热、放热、正反应、逆反应,速率都增大;
(4)温度选择还需考虑催化剂的活性温度范围;
(5)气体反应,要考虑T、P是否造成浓度改变,在判断速率变化;
3.常见失误
(1)不注意容器的体积;
(2)漏写单位或单位写错;
(3)忽略有效数字。
突破反应原理题
反应速率
4因素
2公式
浓度:适于气体、溶液,浓快稀慢;
压强:增压→积缩→浓增→速率增;
温度:升温→速率增,吸热/放热,速率都增大;
催化剂:增大反应速率,正逆同增;
2解释
碰撞理论:活化分子、有效碰撞
速率方程:速率常数
4误区
(1)速率计算,注意单位;
(2)固体、纯液体不改变速率;固变小速率快;
(3)辨析压强,引起浓度变化,速率变化;
(4)温度升高,正、逆速率都增大,但程度不同;
物质结构题题型
2019年 2018年 2017年
情境 磷酸亚铁电池 锌是人体必需的微量元素 钴\锰氧化物催化剂催化二氧化碳和氢气合成甲醇
是什么 对角线规则 电子自旋状态 杂化类型、共价键类型 锌的核外电子排布 空间构型、杂化类型 钴、锰核外电子排布、未成对电子数
杂化类型
共价键类型
为什么 苯胺与甲苯沸点高低比较及原因 氢、氮、氧、磷比较电负性 锌、铜第一电离能比较及原因 锌的卤化物的溶解性不同的原因 钴、锰第一电离能比较
四种分子晶体沸点高低比较及原因
是多少 双聚氯化铁结构及配位数 有限长片段离子化学式的确定 六方最密堆积、密度计算 由晶胞参数计算离子半径
物质结构题常考考点
2020年全国Ⅲ卷 2021年全国甲卷
素材 氨硼烷 金属元素铬(Cr)
是什么 对角线规则 氨硼烷中配位键、配位原子 硼原子杂化类型 态Cr原子核外电子排布及特点、电负性比较;[Cr(NH3)3(H2O)2Cl]2+ 配原子和配位数;PH3中P的杂化类型;晶胞顶角位置的原子
为什么 氢、硼、氮半径比较 氢、硼、氮电负性比较 乙烷、氨硼烷熔点比较及原因(双氢键) NH3的沸点比PH3的高的原因;H2O 的键角小于NH3的原因
是多少 氨硼烷密度计算 原子空间占有率
突破物质结构题
“是什么”—考查理解与辨析能力,是基础知识的迁移,核外电子排布
晶体类型、化学键类型
杂化方式(包括空间构型、大π键、分子的极性)
“为什么”——考查分析与推测能力,对应应用性
《物质结构与性质》
结构 性质
微观探析 宏观辨识
“是多少”——数学建模,考查归纳与论证能力
均摊法 配位数
坐标参数 晶体密度
实例 简单立方 体心立方 面心立方最密堆积 金刚石
示意图
配位数 6 8 12 4
特点 (晶胞参数为a\原子径为r) 棱相切 在棱长为2r的立方体中有一个内接球 8顶点、6面心有原子,在4个小立方体的体心有原子。最近距离为体对角线的1/4
空间利用率
单质晶体中,配位数是指与一个微粒等距紧邻的同种微粒的数目
突破物质结构题
突破物质结构题
化合物晶体中,配位数是指与一个微粒等距紧邻的另一种微粒的数目
实例 氯化钠 氟化钙 石英
示意图
配位数 6 钙离子为8 氟离子为4 硅原子为4
氧原子为2
晶体计算总结
三相切(晶胞参数为a,原子半径为r)
简单立方
面对角线相切 (三球 )
体对角线相切 (五球 )
晶体计算总结
棱相切(两球a=2r)
面心立方
金刚石立方,虚拟5球,只有1个球在对角线四等分点上
体对角线相切 (三球 )
体心立方
物质结构常见考点
1、电子排布式,电子排布图
2、电离能,电负性
3、σ键和π键、极性键,非极性键,氢键,配位键
4、极性分子和非极性分子
5、等电子体
6、常见空间构型的杂化类型
7、键能,键长,键角的判断
8、晶体类型的判断
9、熔沸点高低比较
10、关于晶胞的计算
11、晶体坐标
12、空隙的填充和计算
全国有机综合题题型
2021年甲 2020年 2019年 2018年36题
情境 大豆素合成大豆素异黄酮及其衍生物 苯基环丁烯酮合成合成系列有机化合物 Heck反应合成氧化白藜芦醇 有机物在Cr-Ni催化条件下发生偶联反应
答题数量 7个空(名1个、计算1个、官能团1个、反应类型1个、同分异构1、合成路线1个) 8个空(名1个、写结构简式3个、官能团1个、反应条件1个、手性碳1个、同分异构1) 9个空
8个空(填空5个、方程1个、写结构简式2个)
涉及知识点 (1)有机物名称(2)计算(3)官能团名称(4)方程式(5)反应类型(6)同分异构体(7)合成路线 (1)有机物名称(2)结构简式(3)反应条件、结构简式(4)官能团名称、手性碳(5)同分异构体(6)取代基对有机产率的影响规律 (1)有机物名称(2)官能团(3)反应类型、分子式反应方程式(4)不同条件对有机物产率的影响(5)同分异构体结构简式(6)合成路线
(1)有机物名称(2)反应方程式(3)有机反应类型2空(4)结构简式(5)官能团(6)结构简式(7)同分异构体
突破有机综合题考点
从考点类型看,每年都有判断反应类型、同分异构体书写(种类或结构简式书 写);写反应方程式或物质(原料、产物或中间产物)结构简式,轮流考查设计合成线路。
从框图路线角度可发现,卷I考题:16—不推断,17—全推断,18—不推断、19—间断式推断,20—推断(无合成路线考查)。21甲乙卷均是半推理形式,甲卷有合成路线。
从合成路线设计的步数发现,总步骤在3~4步间,其中学过的步骤控制在1~2步间,即控制未学反应要有2步左右。15-全陌生反应共3步,16-前陌生(2步)后已学 共3步,17-前后已学(各1步),中间未学共4步,18-与17形式一样共4步。
有机呈现路线与合成路线设计问的关系,15-含环状物合成(设计合 成路线主打链状化合物),16-含环状物合成(设计合成路线涉及成环), 17-含环状物合成(设计合成路线也涉及成环),18-含环状物合成(设计 合成路线主打链状化合物)。
同分异构体:14-含苯环19种(氮原子,氢 谱考2甲基),15-考链状3种(三键),16-含苯环12种(羧基,氢谱考苯环对位),17-含苯环(2个甲基,羧基,三键),18-考链状(2个甲基,2个酯基), 19-考环状(非苯环-六元碳环),20-吡啶环,吡啶环是芳香类化合物。
突破有机综合题考点
在教学过程中强化有机合成路线设计(总步骤在3~4步间,其中学过的步骤控制在1~2步间,即控制未学反应要有2步左右)的训练,该题较好的考查了学生的提取信息和加工信息能力和创新能力,今后高考仍会延续,同时对有机试题进行“部分推断”VS“间断式推断” VS“不推断”的全面训练。对成环和不成环进行强化训练,强化有机物命名。
有机综合常见考点
1、有机物的命名
2、官能团的判断
3、有机反应类型判断
4、分子式、结构式、结构简式、同分异构体书写
5、有机物相互转化、化学方程式的书写
6、有机合成线路
3.规范答题技巧、提高答题效率
1.了解高考阅卷要求
要了解高考阅卷评分方法和把握程度,指导学生有效得分。要经常的向学生强调高考的目的就是有效的得分,注意区别高一、高二的学习与高考复习。如钻研问题在总复习时要适可而止,特别是在考场上。
2.强化答题训练,提高应试能力
审题
审题的重要性怎样讲都不过分,看的清才能做得对,三审而后三思,三思而后作答。
3.答题规划
(1)顺序:先易后难(先吃肉,后啃骨头)
(2)综合科:平均每分钟做2分的题。一道6分的选择题值得用3分钟去做。
(3)不要与难题较劲:学会放弃,善于放弃
4.格式与表述
不能只重耕耘,不重视收获。
(1)学会说明:简洁明了,好的说明引领我们的思路
(2)写式子时一定要本着:方程独立、列解分离、由抽象到具体,由模糊到清晰,鸡蛋不能放在一个篮子里。
5.几个重要的原则
(1)提高正确率 (2)书写工整(3)分步做答
(4)做对会做的题,写清做对的题(理综问题)
6.培养正确的答题心态:心态是考高分的制胜法宝
(1)自信、从容
我难人亦难,我不畏难;人易我也易,我不大意。
(2)乐观、满足
关注点在我会做的题,老想着我又做了一道题;而非我不会做的题,不要老想我还有多少题没做。
完
善
优
化
三
轮
复
习
【安排好阶段复习】
二轮复习 (2022年1月下旬-2022年4月底)
连线织网、适度拓展,专题训练、提升能力
一轮复习 (2021年7月中旬-2022年1月下旬)
回归教材、适度整合,系统全面、夯实基础
三轮复习 (2022年4月底-2022年6月初)
模拟高考、实战演练,对照考纲、查漏补缺
形成答题技巧、时间分配、强化应试能力
三轮复习策略
复习方针:是冲刺,贯彻“仿真、内化、迁移、调整”的原则,以模拟训练为主,在提升解决实际问题能力的同时,强化学生规范化应试的状态、能力和技巧。
复习目标:力争100%少丢分。
复习措施:三轮复习回扣课本,多做模拟题,三轮看士气,立足一个“考”字。
以模拟高考时间训练为主线
加大训练,每周两考
考后讲评,先导研讨
评后补偿,查缺补漏
1、题目以重组为主,兼顾较好套题。编制题目要精
挑细选,一是对前面学生暴露问题的强化补漏,二
要抓住各地最新的备考方向。
2、时间和形式均按高考。
考前三轮复习实施措施
最后一套模拟卷,也叫押题卷,信心卷。
临考的前两三天也应该让学生有一个练手的机会,体验到自己的复习成功,所以简单而典型的最后一套模拟卷也是非常必要的。
同课章节目录
