化学人教版(2019)必修第一册3.1.1铁单质及氧化物 课件(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.1铁单质及氧化物 课件(共17张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 22.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-26 22:31:22 | ||
图片预览






文档简介
(共17张PPT)
组织建设
第一节 铁及其化合物
(第1课时 铁的单质及其氧化物)
第三章 铁 金属材料
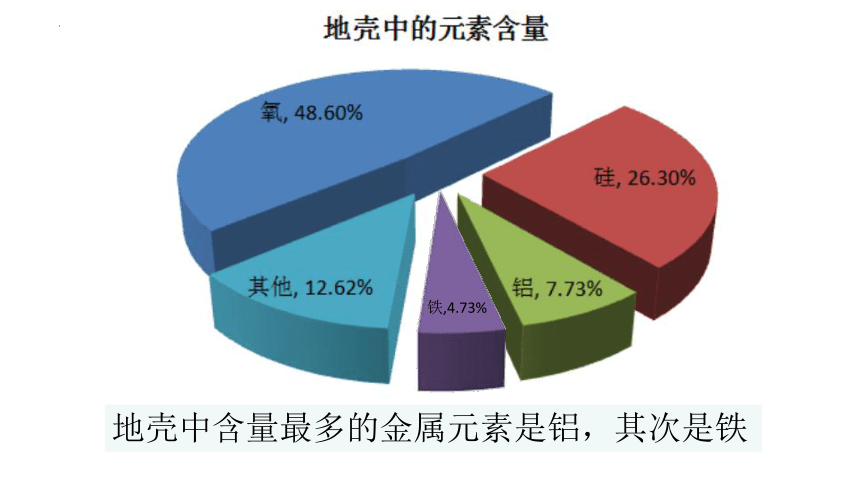
铁,4.73%
地壳中含量最多的金属元素是铝,其次是铁
一、铁元素的存在形态
陨铁
赤铁矿Fe2O3
磁铁矿Fe3O4
黄铁矿FeS2
菱铁矿FeCO3
甘肃张掖丹霞地貌
因富含Fe2O3而呈红色
怎样从铁矿物中获得铁单质?
Fe2O3 + 3CO 2Fe + 3CO2
高温
二、铁单质
1、物理性质
银白色金属光泽固体(铁粉为黑色粉末)
延展性、导热性、导电性、熔沸点高、能被磁体吸引
2. 化学性质
①与非金属的反应:
②与非氧化性酸的反应:
③与某些盐的反应:
3Fe+2O2 Fe3O4
点燃
Fe + Cu2+ Cu+Fe2+
Fe + 2H+ Fe2++H2↑
2Fe + 3Cl2 2FeCl3
Δ
Fe + S FeS
Δ
从生活常识我们可以知道,铁与冷水,甚至是沸腾的水都不反应,但是,在更高的温度下两者能不能反应呢?
Fe与水高温条件下能反应,生成H2和Fe(OH)x
活泼金属钠能与水发生反应,生成NaOH和H2
钢铁厂在生产中,将炽热的钢水或者铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水。
加热时产生水蒸气
灯罩:
集中火焰,提高温度
④与水蒸气的反应:
①听到“噗噗噗”爆鸣声
②固体仍为黑色
产物为H2
产物为Fe3O4
3Fe + 4H2O(g) Fe3O4 + 4H2
实验现象
实验结论
实验原理
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
H2O(g)
冷H2O
热H2O
金属活泼性越强与水反应越容易,实验现象也越剧烈
类别
化合价
单质
氧化物
盐
0
+2
+3
Fe3O4
Fe3+/Fe
+3
Fe2+/Fe
+2
强氧化剂
弱氧化剂
H2O/O2
铁单质的价类二维图
四氧化三铁
氧化亚铁
氧化铁
三、铁的重要化合物
1.铁的氧化物
氧化亚铁 FeO 三氧化二铁 Fe2O3 四氧化三铁
Fe3O4(FeO Fe2O3)
色态
俗称 ——
铁元素价态
溶解性
稳定性
黑色粉末
+2
难溶于水
红棕色粉末
铁红
+3
难溶于水
稳定
黑色晶体
磁性氧化铁
+2、+3
难溶于水
稳定
1、铁的氧化物
6FeO+O2=2Fe3O4
Δ
与HI反应
FeO+2H+=Fe2++H2O
Fe2O3+6H++2I-=2Fe2++I2+3H2O
Fe3O4+8H++2I-=3Fe2+ +I2 +4H2O
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3++3H2O
Fe3O4+8H+=2Fe3++ Fe2+ +4H2O
注意:① Fe3O4是纯净物,而非混合物;是一种复杂氧化物, 而非碱性氧化物。
②高温时,铁的氧化物均能被C、CO、Al等还原剂还原成铁。
Fe2O3+2Al 2Fe+Al2O3
高温
(铝热反应)
与盐酸反应
FeO+2HI=FeI2+H2O
Fe2O3+6HI=2FeI2+I2+3H2O
Fe3O4+8HI=3FeI2 +I2+4H2O
铁的氧化物的用途
高温
氧化铁常用于制造
红色油漆和涂料
氧化铁作外墙涂料
作为冶炼金属的原料
5.某化学兴趣小组利用如图装置(夹持装置已省略)进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是__________________________________,B中反应的化学方程式为__________________________________。 (2)D的作用是____________________________________。 (3)E中的现象是_____________________________________。 (4)A、B两个装置中应先点燃________处的酒精灯,点燃E处酒精灯之前应进行的操作是________________________________。
收集H2,并检验其纯度
产生水蒸气
3Fe+4H2O(g)=== Fe3O4+4H2
高温
吸收未反应的水蒸气
黑色固体变为红色,右端管壁有水珠生成
A
组织建设
第一节 铁及其化合物
(第1课时 铁的单质及其氧化物)
第三章 铁 金属材料
铁,4.73%
地壳中含量最多的金属元素是铝,其次是铁
一、铁元素的存在形态
陨铁
赤铁矿Fe2O3
磁铁矿Fe3O4
黄铁矿FeS2
菱铁矿FeCO3
甘肃张掖丹霞地貌
因富含Fe2O3而呈红色
怎样从铁矿物中获得铁单质?
Fe2O3 + 3CO 2Fe + 3CO2
高温
二、铁单质
1、物理性质
银白色金属光泽固体(铁粉为黑色粉末)
延展性、导热性、导电性、熔沸点高、能被磁体吸引
2. 化学性质
①与非金属的反应:
②与非氧化性酸的反应:
③与某些盐的反应:
3Fe+2O2 Fe3O4
点燃
Fe + Cu2+ Cu+Fe2+
Fe + 2H+ Fe2++H2↑
2Fe + 3Cl2 2FeCl3
Δ
Fe + S FeS
Δ
从生活常识我们可以知道,铁与冷水,甚至是沸腾的水都不反应,但是,在更高的温度下两者能不能反应呢?
Fe与水高温条件下能反应,生成H2和Fe(OH)x
活泼金属钠能与水发生反应,生成NaOH和H2
钢铁厂在生产中,将炽热的钢水或者铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水。
加热时产生水蒸气
灯罩:
集中火焰,提高温度
④与水蒸气的反应:
①听到“噗噗噗”爆鸣声
②固体仍为黑色
产物为H2
产物为Fe3O4
3Fe + 4H2O(g) Fe3O4 + 4H2
实验现象
实验结论
实验原理
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
H2O(g)
冷H2O
热H2O
金属活泼性越强与水反应越容易,实验现象也越剧烈
类别
化合价
单质
氧化物
盐
0
+2
+3
Fe3O4
Fe3+/Fe
+3
Fe2+/Fe
+2
强氧化剂
弱氧化剂
H2O/O2
铁单质的价类二维图
四氧化三铁
氧化亚铁
氧化铁
三、铁的重要化合物
1.铁的氧化物
氧化亚铁 FeO 三氧化二铁 Fe2O3 四氧化三铁
Fe3O4(FeO Fe2O3)
色态
俗称 ——
铁元素价态
溶解性
稳定性
黑色粉末
+2
难溶于水
红棕色粉末
铁红
+3
难溶于水
稳定
黑色晶体
磁性氧化铁
+2、+3
难溶于水
稳定
1、铁的氧化物
6FeO+O2=2Fe3O4
Δ
与HI反应
FeO+2H+=Fe2++H2O
Fe2O3+6H++2I-=2Fe2++I2+3H2O
Fe3O4+8H++2I-=3Fe2+ +I2 +4H2O
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3++3H2O
Fe3O4+8H+=2Fe3++ Fe2+ +4H2O
注意:① Fe3O4是纯净物,而非混合物;是一种复杂氧化物, 而非碱性氧化物。
②高温时,铁的氧化物均能被C、CO、Al等还原剂还原成铁。
Fe2O3+2Al 2Fe+Al2O3
高温
(铝热反应)
与盐酸反应
FeO+2HI=FeI2+H2O
Fe2O3+6HI=2FeI2+I2+3H2O
Fe3O4+8HI=3FeI2 +I2+4H2O
铁的氧化物的用途
高温
氧化铁常用于制造
红色油漆和涂料
氧化铁作外墙涂料
作为冶炼金属的原料
5.某化学兴趣小组利用如图装置(夹持装置已省略)进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
(1)A装置的作用是__________________________________,B中反应的化学方程式为__________________________________。 (2)D的作用是____________________________________。 (3)E中的现象是_____________________________________。 (4)A、B两个装置中应先点燃________处的酒精灯,点燃E处酒精灯之前应进行的操作是________________________________。
收集H2,并检验其纯度
产生水蒸气
3Fe+4H2O(g)=== Fe3O4+4H2
高温
吸收未反应的水蒸气
黑色固体变为红色,右端管壁有水珠生成
A
