第四章 物质结构 元素周期律 复习课件(共29张PPT)
文档属性
| 名称 | 第四章 物质结构 元素周期律 复习课件(共29张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 11:14:31 | ||
图片预览








文档简介
(共29张PPT)
物质结构元素周期律复习
高中化学
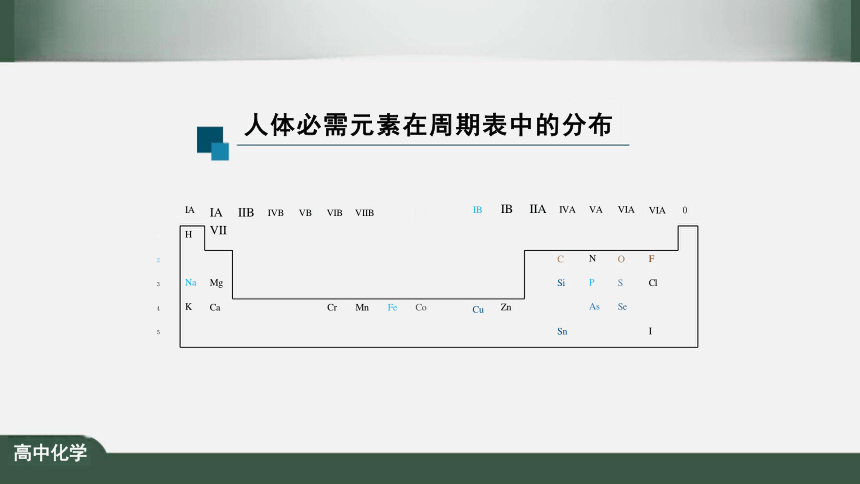
人体必需元素在周期表中的分布
Mg
Ca Cr Mn Fe Co
IA IIB IVB VB VIB VIIB VII
高中化学
VA
N
P
As
IB
Zn
IA
H
Na
K
IB
Cu
C
Si
Sn
F
Cl
I
O
S
Se
1
2
3
4
5
VIA 0
IVA
IIA
VIA
生活中的钙
高中化学
牛奶是人体钙元素重要的食物来源。
某种牛奶的营养成分表如右图所示。
营养成分表 项 目 每100g 能量 蛋白质 脂肪 碳水化合物 钠 钙
309 kJ
3.6 g
4.4 g
5.0g
65 mg
120 mg
生活中的钙
高中化学
【问题1】
查阅资料,了解牛奶中钙元素的主要
存在形式。
任务一探究牛奶中钙元素的存在形式
高中化学
【问题2】
查阅元素周期表,了解钙的有关信息,
画出钙的原子结构示意图。
任务一探究牛奶中钙元素的存在形式
高中化学
元 素 周 期 表 地于屈
008 4.005
2
Ⅱ A 原子序数 92 铀 f^6d*7s 238.0 长间位素的质量数 Ⅱ A IV A VA W A VI A 0.81 6 C 碳 2r2p 之 8 O 氧 2x 2p* 6.00 9F 氮 2*2 9.00 n Ne 20.18 k
2
Na Al 4 S 28.0 15 P 磷 sogr 16 S 硫 p 32.06 " 5.45 s Ar k 作 N
Ⅲ B V B VB VI B ⅡB 1B Ⅱ B 44.96 2 T A 47.8 3 04 52.00 25 Mn 54.94 F 55.85 C 58.93 58.69 Cu 65.35 30 Zr 锋 65.W Ga 69.72 z Ge 72.63 33 As 博 4.9 34 Se 78.97 35 Br 79.90 36 K 83.80
85.4 露 87.62 9Y 40 Zr 管 91.22 41 Nb W 9291 42 No 45 T 44 Ru R 029 7 Ag 48(d 帕 124 9 ln 14. 50 Si 误 18.7 51 S 21.8 52 T 醋 5% 5p 27.6 53 I 碘 5p 26.9 Xe y
55 Cs 能 32.9 56 Ba 1373 57-71 La-Lu 镧 系 2 Ht 帽 7R.5 73 Ta 9 74 W 1838 75 Re 1862 76 Os 902 77 Ir 922 78 P 95.1 Au 1970 80 Hg 2006 81 T 盛 82 Pb 2072 83 B 键 2006 84 P (2091 85 A Rr [222
钫 儒 [223]|【226] 婀 系 ld Rr laS Db 作 lu6 Sg 格 107 Rh t 108 Hs 性“ 10 Mt 世“ Iio Ds 11Rg 铊 112Cn 恃* 113 Nh 性 114 Fl 饭 15Me 116Lv 117 Ts 硼* 118 氨
38.9 铺 40. w 44 re [145 50.4 152. 673 158.9 162.5 67 H 1649 167.3 168.9 73 镥 1750
系 [2271」 2320 9Th 慧 想 93 NP 95 Am %Cm 97 Bk / 情 99 Es 00 Fm 101 Md 102 No 03 Lr
钙元素在周期表中的位置
20 Ca
钙
4s2
40.08
高中化学
品
【思路1】根据原子核外电子排布规律书写
【思路2】根据元素在周期表中的位置书写
原子序数=核电荷数
周期序数=电子层数
主族序数=最外层电子数
能量最低原理
2n 规则
限制条件
钙的原子结构示意图
高中化学
【问题3】
已知与钙同主族的镁能分别与O 、H O
反应。推测钙元素的性质。
任务一探究牛奶中钙元素的存在形式
高中化学
【思路1】根据原子结构预测
钙原子最外层电子数为2,少于4,在
化学反应中容易失去电子,钙元素具有金
属性。
单质具有还原性。
预测钙元素的性质
高中化学
周期 IA
IIA
3 Na
Mg
4 K
Ca
【思路2】根据元素在周期表中的位置预测
预测钙元素的性质
高中化学
位置 结构 ↓ 族 (IIA) 最外层电子数(2) 与Mg的相同
周期(4)
电子层数(4)
比Mg的多
性质 金属性: Ca>Mg
单质性质:易与O 、H O反应
高中化学
【思路2】根据元素在周期表中的位置预测
预测钙元素的性质
预测钙元素的性质
【思路2】根据元素在周期表中的位置预测
位置 族 (IIA) 周期(4)
↓
结构 最外层电子数(2) 电子层数(4)
比K的多 与K的相同
√
性质 金属性: K>Ca
单质活泼性:与K相比,稍难与O 、H O反应
高中化学
m
1 H
氧
1
无名路-
器 %
14.01
器
航 氮
33
品
z Hr 》 Ta
品
①最外层电子数依次增多
②原子半径逐渐减小
③金属性逐渐减弱,非金属性逐渐增强
系 C Pr 140.9 60 Nd 144.2 61 Pm |(145 62 Sm )104 63 Eu 152.0 64 Gd 1573 h51 然 158.9 66D) drw 162.5 67 Ho 16 68 Er 167.3 69 Tm 168.9 u Yh 能 1730
71 La
ar
1750
MV 238.0 【237] 4 Pu l244 繁, [252] a Fm [257] i0 Md [2581 102 No [2591
[262]
① 核 外 电 子 层 数 依 次 增 多
② 原 子 半 径 逐 渐 增 大
思
盛 盟
③ 金 属 性 逐 渐 增 强;
非金属逐渐减弱
高中化学
元 素 周 期 表
品
…;
第m
6C
碳
12M
二热国中的验百根变的
7 N 氰
2 2=
k
人造元素
38
HA
1
1.008
'
【问题4】
请结合元素的性质分析牛奶中钙元素
的存在形式。
任务一探究牛奶中钙元素的存在形式
高中化学
分析牛奶中钙元素的存在形式
Ca——CaO——Ca(OH) ——钙盐
碱性氧化物
活泼金属
碳酸钙
乳酸钙
磷酸钙
柠檬酸钙
高中化学
强碱
结构决定性质的化学观念
元素
位置
元素 性质
物质 应用
原子 结构
反映
决定
预测
解释
决定
反映
高中化学
硒与人类健康
密
肝称天款
明究使者
硒
硒与人类健康
高中化学
【问题1】
查阅元素周期表,分析硒元素的化合
价,指出硒元素可能的存在形式。
任务二补硒剂的发展
高中化学
元 素 周 期 表 原 子 序 数 -92 U- 铀 快于能药电学罚 相对原子质量,加括号的数 半衰期最 " 12 Mg i Si " 7 c 2290 Ⅲ”, V B MI B m B m I B Ⅱ B 09 0.97 19 K 2 Ca Se| z Ti 24 Cr 25 Mn 26 Fe 」27 Co|28 Ni|29 C Znl 32 Gee33 A 3 5 Br 品r|41Nb42 品e4Ru45 22 %s 网系 1 5 2 2047 2an2 209.0 (209) (z10) 2 He 氮 .003 10 Ne 20.18 18 Ar 氧 39.95 3% Kr 83.80 54 Xe 8 Rn (222)
电于层
钨
6
78
输
2
能
9
1
5
e
s2
S
121
st
0
9In5
Cd|
|
.
|
Pd
46
|
Rh
T
Mo|43
Y
8
Sr
62
h
4
126
3
76
T
8
b
2
48
9
Ag
07
7
1
4
品
|40 Z
7
8
8
3
7
R
85
恤
37
瓢
4 Se
焦
y Ga
低
23 V
然
z1
铝
候
IV B
Rr lns Dh lua Se lwr Eh laa Hs lw Mt ie Ds lui Rg ltCn lsNh lu lisMe uaLv ItTs180g
FrRa
物 [223][226] 馏 【278] [281] [281] [285 【286] [289] [289] |(293)|[293] 佩* [294
系 燕 40.5 0Nd 1 Pm 2Sm 6a Eu 然 64 Gd 钆 1573 65 T 然 1 9 66 Dy 102s 67 Ho 1649 68 Er 1623 a 69 Tm 钙 689 1730 错 1750 制 系 静A 2271 %Th 23210 1Pa n 231.0 92U stw 238.0 9%Np n [237] 9*Pu %Am srw 9%Cm srwrw 9 Bk "sr7 Cf 99 Es w 00 Fm 101 Md L28] 02 No 05 Lr sr
【思路1】根据元素在周期表中的位置推断
推断硒元素的化合价
-2
0
+4
+6
Cs56 Ba 2 Hf 73 Ta 74W|7s Re 76 Os7Ir 8Pt9Au *Hgsi T R Pb s Bi s A
39.10 400 44.9%4787 50.94520054.9455.85 短则 865.55 6538 69.72 72.63 74.92
高中化学
sf^6d'7e-
238.0 ·
元素名称。
案
HA
4 Be
7N
邕
222p 14.01
破
9.012
6C
碳 2r2p
[247]
6.941
ⅢA
1.008
10.81
IN A
2.01
一
'
元 素 周 期 表 于厘 ' 40s 2 Ⅱ A 原子序数 元素名称 人通元素 92 U- 铀 sfkd7 238.0 价电子排布,如括号的 过渡元素 Ⅲ A wA v^。 VA Ⅲ A Li 6.94 Be 9.01 5B 硼 2 2p 10.81 盖 7N 复 2p 14.0 16.00 19.00 in Ne " 2.9 “ 243 ” 26.98 “ 28.00 " 3097 “ 3206 " 3545 " Ⅲ B IV B V B VI B II B m。 I B Ⅱ B 9 K 甲 39.10 20 Ca 40.08 21 Se 轨 44.96 2z Ti 4787 23V 50.94 4Cr 5200 s Mn “好 ” 54.94 kFe “ 55.85 t Ca 5893 8Ni “” Cu 0Znl t Ga ” ” ln Ged a Asl 4p uSe 35 Br 感 Kr 18 4 R 伽 85.47 g, W BF 螺 | V 品 Z 2 h l = nTa luDn E leDh |wDd A | e l ca len e sh Ta I 1269 盘 0 55Cs 1329 56 Ba 锁 in5 ,57-71 调系 72Hf 输 178.5 7Tn 钽 1M09 74 W 部 75 Re 感 7608 品 77 Ir 感 78Pt 器 79 Au 盘 8 Hg 8ITI 82 Pb 8 Bi 8 Po 85 At 8 Rn ②置- "F" (223)|(2% B 家 0 - 1 0 3 Ac 104 Rf 105 Db to Sg 17 Bh 铠 ” 1sHs 强 ” ios Mt 钱 ” 11o Ds 铋* 1t Rg 砼* 12Cn 13 Nh 114FI ty 115Me ts 116Lv 117Ts o o lul 118Og dv2
锦 ” " 60 Nd|6 Pm6 2 Sm|3 Eu|64 Gd
409
然
144
黑
141,
g
最低负化合价-2
最高正化合价+6
【思路2】根据原子结构推断
推断硒元素的化合价
高中化学
镇””
”帖”
”
”
+6
SeO
H SeO
Na SeO
+4
SeO
H SeO
Na SeO
硒元素的可能存在形式
-2
H Se
Na Se
高中化学
Se
【问题2】
第一代补硒剂是用NaOH溶液溶解SeO
制得的。
结合化学方程式说明制备原理。
任务二补硒剂的发展
高中化学
Se是与S同主族的一种非金属元素,因
此SeO 属于酸性氧化物:
SeO +2NaOH =Na SeO +H O
无机补硒剂的制备
高中化学
【问题3】科学家常用77Se等同位素
示踪的方法研究植物吸收、转化、
富集硒的过程。77Se的原子核内有
多少个中子
有机硒的研究
中国工程院 刘更另院士
高中化学
有机硒的研究
质量数 (A)= 质子数 (Z)+ 中子数 (N)
中子数 (N)
=质量数 (A)- 质子数 (Z)
=77-34
=43
高中化学
有机补硒剂的结构
【问题4】硒代半胱氨酸是硒元素在富硒粮食
中的主要存在形式。指出其中Se所成化学键
的类型。
高中化学
有机补硒剂中的化学键
极性共价键
高中化学
宏观辨识与微观探析
元素
位置
元素 性质
物质 性质
物质 应用
原子 结构
高中化学
宏观
微观
物质结构元素周期律复习
高中化学
人体必需元素在周期表中的分布
Mg
Ca Cr Mn Fe Co
IA IIB IVB VB VIB VIIB VII
高中化学
VA
N
P
As
IB
Zn
IA
H
Na
K
IB
Cu
C
Si
Sn
F
Cl
I
O
S
Se
1
2
3
4
5
VIA 0
IVA
IIA
VIA
生活中的钙
高中化学
牛奶是人体钙元素重要的食物来源。
某种牛奶的营养成分表如右图所示。
营养成分表 项 目 每100g 能量 蛋白质 脂肪 碳水化合物 钠 钙
309 kJ
3.6 g
4.4 g
5.0g
65 mg
120 mg
生活中的钙
高中化学
【问题1】
查阅资料,了解牛奶中钙元素的主要
存在形式。
任务一探究牛奶中钙元素的存在形式
高中化学
【问题2】
查阅元素周期表,了解钙的有关信息,
画出钙的原子结构示意图。
任务一探究牛奶中钙元素的存在形式
高中化学
元 素 周 期 表 地于屈
008 4.005
2
Ⅱ A 原子序数 92 铀 f^6d*7s 238.0 长间位素的质量数 Ⅱ A IV A VA W A VI A 0.81 6 C 碳 2r2p 之 8 O 氧 2x 2p* 6.00 9F 氮 2*2 9.00 n Ne 20.18 k
2
Na Al 4 S 28.0 15 P 磷 sogr 16 S 硫 p 32.06 " 5.45 s Ar k 作 N
Ⅲ B V B VB VI B ⅡB 1B Ⅱ B 44.96 2 T A 47.8 3 04 52.00 25 Mn 54.94 F 55.85 C 58.93 58.69 Cu 65.35 30 Zr 锋 65.W Ga 69.72 z Ge 72.63 33 As 博 4.9 34 Se 78.97 35 Br 79.90 36 K 83.80
85.4 露 87.62 9Y 40 Zr 管 91.22 41 Nb W 9291 42 No 45 T 44 Ru R 029 7 Ag 48(d 帕 124 9 ln 14. 50 Si 误 18.7 51 S 21.8 52 T 醋 5% 5p 27.6 53 I 碘 5p 26.9 Xe y
55 Cs 能 32.9 56 Ba 1373 57-71 La-Lu 镧 系 2 Ht 帽 7R.5 73 Ta 9 74 W 1838 75 Re 1862 76 Os 902 77 Ir 922 78 P 95.1 Au 1970 80 Hg 2006 81 T 盛 82 Pb 2072 83 B 键 2006 84 P (2091 85 A Rr [222
钫 儒 [223]|【226] 婀 系 ld Rr laS Db 作 lu6 Sg 格 107 Rh t 108 Hs 性“ 10 Mt 世“ Iio Ds 11Rg 铊 112Cn 恃* 113 Nh 性 114 Fl 饭 15Me 116Lv 117 Ts 硼* 118 氨
38.9 铺 40. w 44 re [145 50.4 152. 673 158.9 162.5 67 H 1649 167.3 168.9 73 镥 1750
系 [2271」 2320 9Th 慧 想 93 NP 95 Am %Cm 97 Bk / 情 99 Es 00 Fm 101 Md 102 No 03 Lr
钙元素在周期表中的位置
20 Ca
钙
4s2
40.08
高中化学
品
【思路1】根据原子核外电子排布规律书写
【思路2】根据元素在周期表中的位置书写
原子序数=核电荷数
周期序数=电子层数
主族序数=最外层电子数
能量最低原理
2n 规则
限制条件
钙的原子结构示意图
高中化学
【问题3】
已知与钙同主族的镁能分别与O 、H O
反应。推测钙元素的性质。
任务一探究牛奶中钙元素的存在形式
高中化学
【思路1】根据原子结构预测
钙原子最外层电子数为2,少于4,在
化学反应中容易失去电子,钙元素具有金
属性。
单质具有还原性。
预测钙元素的性质
高中化学
周期 IA
IIA
3 Na
Mg
4 K
Ca
【思路2】根据元素在周期表中的位置预测
预测钙元素的性质
高中化学
位置 结构 ↓ 族 (IIA) 最外层电子数(2) 与Mg的相同
周期(4)
电子层数(4)
比Mg的多
性质 金属性: Ca>Mg
单质性质:易与O 、H O反应
高中化学
【思路2】根据元素在周期表中的位置预测
预测钙元素的性质
预测钙元素的性质
【思路2】根据元素在周期表中的位置预测
位置 族 (IIA) 周期(4)
↓
结构 最外层电子数(2) 电子层数(4)
比K的多 与K的相同
√
性质 金属性: K>Ca
单质活泼性:与K相比,稍难与O 、H O反应
高中化学
m
1 H
氧
1
无名路-
器 %
14.01
器
航 氮
33
品
z Hr 》 Ta
品
①最外层电子数依次增多
②原子半径逐渐减小
③金属性逐渐减弱,非金属性逐渐增强
系 C Pr 140.9 60 Nd 144.2 61 Pm |(145 62 Sm )104 63 Eu 152.0 64 Gd 1573 h51 然 158.9 66D) drw 162.5 67 Ho 16 68 Er 167.3 69 Tm 168.9 u Yh 能 1730
71 La
ar
1750
MV 238.0 【237] 4 Pu l244 繁, [252] a Fm [257] i0 Md [2581 102 No [2591
[262]
① 核 外 电 子 层 数 依 次 增 多
② 原 子 半 径 逐 渐 增 大
思
盛 盟
③ 金 属 性 逐 渐 增 强;
非金属逐渐减弱
高中化学
元 素 周 期 表
品
…;
第m
6C
碳
12M
二热国中的验百根变的
7 N 氰
2 2=
k
人造元素
38
HA
1
1.008
'
【问题4】
请结合元素的性质分析牛奶中钙元素
的存在形式。
任务一探究牛奶中钙元素的存在形式
高中化学
分析牛奶中钙元素的存在形式
Ca——CaO——Ca(OH) ——钙盐
碱性氧化物
活泼金属
碳酸钙
乳酸钙
磷酸钙
柠檬酸钙
高中化学
强碱
结构决定性质的化学观念
元素
位置
元素 性质
物质 应用
原子 结构
反映
决定
预测
解释
决定
反映
高中化学
硒与人类健康
密
肝称天款
明究使者
硒
硒与人类健康
高中化学
【问题1】
查阅元素周期表,分析硒元素的化合
价,指出硒元素可能的存在形式。
任务二补硒剂的发展
高中化学
元 素 周 期 表 原 子 序 数 -92 U- 铀 快于能药电学罚 相对原子质量,加括号的数 半衰期最 " 12 Mg i Si " 7 c 2290 Ⅲ”, V B MI B m B m I B Ⅱ B 09 0.97 19 K 2 Ca Se| z Ti 24 Cr 25 Mn 26 Fe 」27 Co|28 Ni|29 C Znl 32 Gee33 A 3 5 Br 品r|41Nb42 品e4Ru45 22 %s 网系 1 5 2 2047 2an2 209.0 (209) (z10) 2 He 氮 .003 10 Ne 20.18 18 Ar 氧 39.95 3% Kr 83.80 54 Xe 8 Rn (222)
电于层
钨
6
78
输
2
能
9
1
5
e
s2
S
121
st
0
9In5
Cd|
|
.
|
Pd
46
|
Rh
T
Mo|43
Y
8
Sr
62
h
4
126
3
76
T
8
b
2
48
9
Ag
07
7
1
4
品
|40 Z
7
8
8
3
7
R
85
恤
37
瓢
4 Se
焦
y Ga
低
23 V
然
z1
铝
候
IV B
Rr lns Dh lua Se lwr Eh laa Hs lw Mt ie Ds lui Rg ltCn lsNh lu lisMe uaLv ItTs180g
FrRa
物 [223][226] 馏 【278] [281] [281] [285 【286] [289] [289] |(293)|[293] 佩* [294
系 燕 40.5 0Nd 1 Pm 2Sm 6a Eu 然 64 Gd 钆 1573 65 T 然 1 9 66 Dy 102s 67 Ho 1649 68 Er 1623 a 69 Tm 钙 689 1730 错 1750 制 系 静A 2271 %Th 23210 1Pa n 231.0 92U stw 238.0 9%Np n [237] 9*Pu %Am srw 9%Cm srwrw 9 Bk "sr7 Cf 99 Es w 00 Fm 101 Md L28] 02 No 05 Lr sr
【思路1】根据元素在周期表中的位置推断
推断硒元素的化合价
-2
0
+4
+6
Cs56 Ba 2 Hf 73 Ta 74W|7s Re 76 Os7Ir 8Pt9Au *Hgsi T R Pb s Bi s A
39.10 400 44.9%4787 50.94520054.9455.85 短则 865.55 6538 69.72 72.63 74.92
高中化学
sf^6d'7e-
238.0 ·
元素名称。
案
HA
4 Be
7N
邕
222p 14.01
破
9.012
6C
碳 2r2p
[247]
6.941
ⅢA
1.008
10.81
IN A
2.01
一
'
元 素 周 期 表 于厘 ' 40s 2 Ⅱ A 原子序数 元素名称 人通元素 92 U- 铀 sfkd7 238.0 价电子排布,如括号的 过渡元素 Ⅲ A wA v^。 VA Ⅲ A Li 6.94 Be 9.01 5B 硼 2 2p 10.81 盖 7N 复 2p 14.0 16.00 19.00 in Ne " 2.9 “ 243 ” 26.98 “ 28.00 " 3097 “ 3206 " 3545 " Ⅲ B IV B V B VI B II B m。 I B Ⅱ B 9 K 甲 39.10 20 Ca 40.08 21 Se 轨 44.96 2z Ti 4787 23V 50.94 4Cr 5200 s Mn “好 ” 54.94 kFe “ 55.85 t Ca 5893 8Ni “” Cu 0Znl t Ga ” ” ln Ged a Asl 4p uSe 35 Br 感 Kr 18 4 R 伽 85.47 g, W BF 螺 | V 品 Z 2 h l = nTa luDn E leDh |wDd A | e l ca len e sh Ta I 1269 盘 0 55Cs 1329 56 Ba 锁 in5 ,57-71 调系 72Hf 输 178.5 7Tn 钽 1M09 74 W 部 75 Re 感 7608 品 77 Ir 感 78Pt 器 79 Au 盘 8 Hg 8ITI 82 Pb 8 Bi 8 Po 85 At 8 Rn ②置- "F" (223)|(2% B 家 0 - 1 0 3 Ac 104 Rf 105 Db to Sg 17 Bh 铠 ” 1sHs 强 ” ios Mt 钱 ” 11o Ds 铋* 1t Rg 砼* 12Cn 13 Nh 114FI ty 115Me ts 116Lv 117Ts o o lul 118Og dv2
锦 ” " 60 Nd|6 Pm6 2 Sm|3 Eu|64 Gd
409
然
144
黑
141,
g
最低负化合价-2
最高正化合价+6
【思路2】根据原子结构推断
推断硒元素的化合价
高中化学
镇””
”帖”
”
”
+6
SeO
H SeO
Na SeO
+4
SeO
H SeO
Na SeO
硒元素的可能存在形式
-2
H Se
Na Se
高中化学
Se
【问题2】
第一代补硒剂是用NaOH溶液溶解SeO
制得的。
结合化学方程式说明制备原理。
任务二补硒剂的发展
高中化学
Se是与S同主族的一种非金属元素,因
此SeO 属于酸性氧化物:
SeO +2NaOH =Na SeO +H O
无机补硒剂的制备
高中化学
【问题3】科学家常用77Se等同位素
示踪的方法研究植物吸收、转化、
富集硒的过程。77Se的原子核内有
多少个中子
有机硒的研究
中国工程院 刘更另院士
高中化学
有机硒的研究
质量数 (A)= 质子数 (Z)+ 中子数 (N)
中子数 (N)
=质量数 (A)- 质子数 (Z)
=77-34
=43
高中化学
有机补硒剂的结构
【问题4】硒代半胱氨酸是硒元素在富硒粮食
中的主要存在形式。指出其中Se所成化学键
的类型。
高中化学
有机补硒剂中的化学键
极性共价键
高中化学
宏观辨识与微观探析
元素
位置
元素 性质
物质 性质
物质 应用
原子 结构
高中化学
宏观
微观
