2.3人类对原子结构的认识同步练习(含解析)2023——2024学年上学期高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.3人类对原子结构的认识同步练习(含解析)2023——2024学年上学期高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 638.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-27 00:00:00 | ||
图片预览



文档简介
2.3人类对原子结构的认识同步练习
姓名()班级()学号()
一、单选题
1.有、两种元素,已知元素的核电荷数为,且与的电子排布完全相同,则元素的质子数为
A. B. C. D.
2.以下是某种元素的原子结构示意图,下列说法不正确的是
A.该原子易得两个电子而形成稳定结构 B.该原子的核电荷数为16
C.“+”表示该原子带正电 D.该原子的第二层电子数为8
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.22.4L HCl溶于水中,破坏共价键数为NA
B.中所含中子数为NA
C.溶液中含氧原子数目为0.04NA
D.通入足量水中充分反应转移电子数0.1NA
4.下列说法正确的是
A.决定元素种类的是原子核最外层电子数 B.质子数相同的原子一定属于同种元素
C.决定元素化学性质的是原子核内中子数 D.原子核内的中子数一定不为零
5.下图是元素周期表中某元素的相关信息,从图中不能获得的信息是
A.该元素是非金属元素 B.该元素的原子序数为7
C.该元素的相对原子质量是14.01 D.氮气的化学式为N2
6.化学学科的发展离不开历代科学家的共同努力,下列科学家提出的理论排列符合时间先后顺序的是
①阿伏加德罗提出了分子学说
②拉瓦锡提出了燃烧的氧化学说
③门捷列夫编制了第一张元素周期表
④波义耳提出元素的概念
⑤道尔顿提出原子学说
A.④②⑤①③ B.⑤①③②④
C.②④⑤①③ D.④①②⑤③
7.氚管是一种应用在深海夜光手表中的发光装置。其主要结构是在一个密闭玻璃管中充入氚气,由氚在β衰变时释放出的电子射中涂在玻璃管内部的荧光粉,发出荧光。下列说法错误的是
A.氚原子核内中子数为2
B.β衰变属于化学变化
C.H、D、T互为同位素
D.含有氚的废水具有放射性
8.下列有关的叙述正确的是
A.是铯的一种同素异形体
B.是一种新发现的元素
C.位于元素周期表中第六周期第ⅠA族
D.核内的中子数与核外电子数之差为82
9.用NA代表阿伏加德罗常数的值。下列说法正确的是
A.25℃,1.01×105Pa时,11.2LO2所含的原子数目为NA
B.78gNa2O2晶体所含阴阳离子的总数为3NA
C.0.5mol·L-1的FeCl3溶液中,含有Cl-个数为1.5NA
D.9g水D2O含有的中子数为5NA
10.下列说法正确的是
A.若离子中含有n个核外电子,则Y原子核内含有的中子数为
B.电子层由里到外依次为K层、L层、M层……,每层最多能容纳8个电子
C.若某元素原子核外最外层电子数小于或等于2,则该元素一定为金属元素
D.最外层电子数越少的金属元素对应的金属单质的金属活动性越强
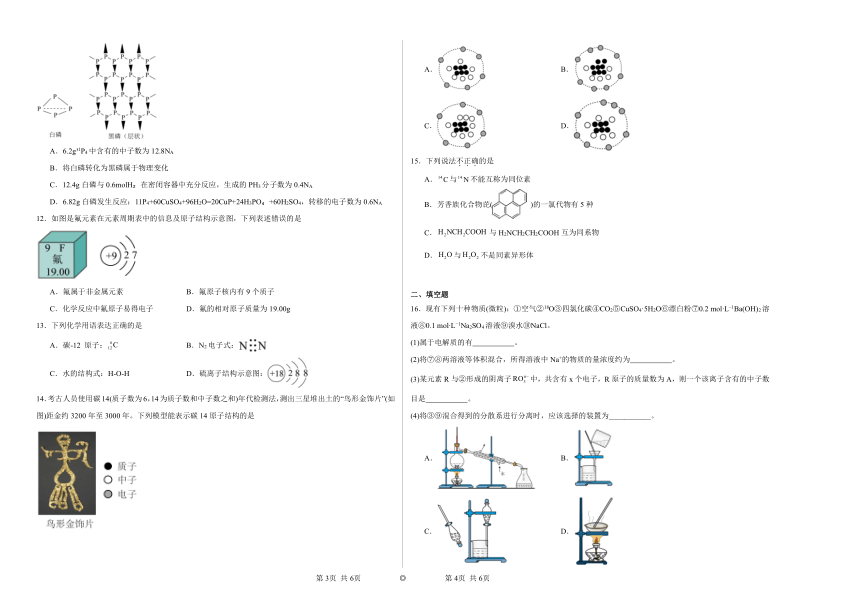
11.磷有多种同素异形体,其中白磷和黑磷的结构如图所示,设NA为阿伏加德罗常数的值。下列说法正确的是
A.6.2g 1P4中含有的中子数为12.8NA
B.将白磷转化为黑磷属于物理变化
C.12.4g白磷与0.6molH 在密闭容器中充分反应,生成的PH3分子数为0.4NA
D.6.82g白磷发生反应:11P4+60CuSO4+96H2O=20CuP+24H3PO +60H2SO4,转移的电子数为0.6NA
12.如图是氟元素在元素周期表中的信息及原子结构示意图,下列表述错误的是
A.氟属于非金属元素 B.氟原子核内有9个质子
C.化学反应中氟原子易得电子 D.氟的相对原子质量为19.00g
13.下列化学用语表达正确的是
A.碳-12 原子: B.N2电子式:
C.水的结构式:H-O-H D.硫离子结构示意图:
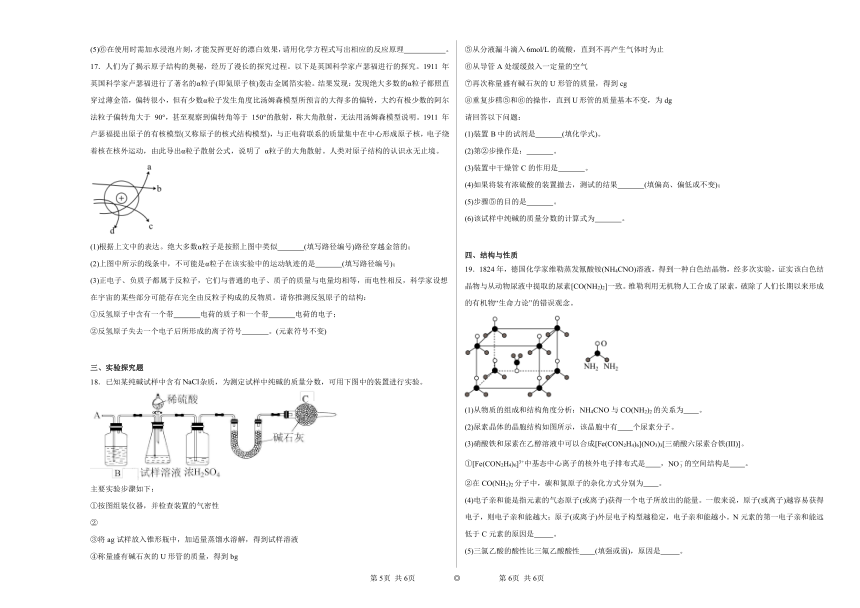
14.考古人员使用碳14(质子数为6,14为质子数和中子数之和)年代检测法,测出三星堆出土的“鸟形金饰片”(如图)距金约3200年至3000年。下列模型能表示碳14原子结构的是
A. B.
C. D.
15.下列说法不正确的是
A.与不能互称为同位素
B.芳香族化合物芘( )的一氯代物有5种
C.与H2NCH2CH2COOH互为同系物
D.与不是同素异形体
二、填空题
16.现有下列十种物质(微粒):①空气②18O③四氯化碳④CO2⑤CuSO4·5H2O⑥漂白粉⑦0.2 mol L 1Ba(OH)2溶液⑧0.1 mol L 1Na2SO4溶液⑨溴水⑩NaCl。
(1)属于电解质的有 。
(2)将⑦⑧两溶液等体积混合,所得溶液中Na+的物质的量浓度约为 。
(3)某元素R与②形成的阴离子中,共含有x个电子,R原子的质量数为A,则一个该离子含有的中子数目是 。
(4)将③⑨混合得到的分散系进行分离时,应该选择的装置为___________。
A. B.
C. D.
(5)⑥在使用时需加水浸泡片刻,才能发挥更好的漂白效果,请用化学方程式写出相应的反应原理 。
17.人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。1911 年英国科学家卢瑟福进行了著名的α粒子(即氦原子核)轰击金属箔实验。结果发现:发现绝大多数的α粒子都照直穿过薄金箔,偏转很小,但有少数α粒子发生角度比汤姆森模型所预言的大得多的偏转,大约有极少数的阿尔法粒子偏转角大于 90°,甚至观察到偏转角等于 150°的散射,称大角散射,无法用汤姆森模型说明。1911 年卢瑟福提出原子的有核模型(又称原子的核式结构模型),与正电荷联系的质量集中在中心形成原子核,电子绕着核在核外运动,由此导出α粒子散射公式,说明了 α粒子的大角散射。人类对原子结构的认识永无止境。
(1)根据上文中的表达。绝大多数α粒子是按照上图中类似 (填写路径编号)路径穿越金箔的;
(2)上图中所示的线条中,不可能是α粒子在该实验中的运动轨迹的是 (填写路径编号);
(3)正电子、负质子都属于反粒子,它们与普通的电子、质子的质量与电量均相等,而电性相反,科学家设想在宇宙的某些部分可能存在完全由反粒子构成的反物质。请你推测反氢原子的结构:
①反氢原子中含有一个带 电荷的质子和一个带 电荷的电子;
②反氢原子失去一个电子后所形成的离子符号 。(元素符号不变)
三、实验探究题
18.已知某纯碱试样中含有杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步 如下:
①按图组装仪器,并检查装置的气密性
②
③将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
④称量盛有碱石灰的U形管的质量,得到bg
⑤从分液漏斗滴入的硫酸,直到不再产生气体时为止
⑥从导管A处缓缓鼓入一定量的空气
⑦再次称量盛有碱石灰的U形管的质量,得到cg
⑧重复步穁⑤和⑥的操作,直到形管的质量基本不变,为dg
请回答以下问题:
(1)装置B中的试剂是 (填化学式)。
(2)第②步操作是: 。
(3)装置中干燥管C的作用是 。
(4)如果将装有浓硫酸的装置撤去,测试的结果 (填偏高、偏低或不变);
(5)步骤⑤的目的是 。
(6)该试样中纯碱的质量分数的计算式为 。
四、结构与性质
19.1824年,德国化学家维勒蒸发氰酸铵(NH4CNO)溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素[CO(NH2)2]一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
(1)从物质的组成和结构角度分析:NH4CNO与CO(NH2)2的关系为 。
(2)尿素晶体的晶胞结构如图所示,该晶胞中有 个尿素分子。
(3)硝酸铁和尿素在乙醇溶液中可以合成[Fe(CON2H4)6](NO3)3[三硝酸六尿素合铁(III)]。
①[Fe(CON2H4)6]3+中基态中心离子的核外电子排布式是 ,NO的空间结构是 。
②在CO(NH2)2分子中,碳和氮原子的杂化方式分别为 。
(4)电子亲和能是指元素的气态原子(或离子)获得一个电子所放出的能量。一般来说,原子(或离子)越容易获得电子,则电子亲和能越大;原子(或离子)外层电子构型越稳定,电子亲和能越小。N元素的第一电子亲和能远低于C元素的原因是 。
(5)三氯乙酸的酸性比三氟乙酸酸性 (填强或弱),原因是 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A元素原子的核电荷数为a,原子中核电荷数=核内质子数=核外电子数,则其核外电子数为a;A原子得到3个电子形成A3-,则A3-的核外电子数为a+3,B原子失去n个电子形成Bn+,设B的质子数为x,由于A3-与Bn+的电子层排布相同,则:a+3=x-n,解得x=a+n+3,所以元素B的质子数为a+n+3。
答案选D。
2.C
【详解】A.该原子最外层有6个电子,易得到2个电子而形成8电子稳定结构,A项正确;
B.由原子结构示意图可知,该原子的核电荷数为16,B项正确;
C.原子不带电,“+”表示该原子核内的质子带正电,C项错误;
D.由原子结构示意图可知,该原子的第二层电子数为8,D项正确;
故选C。
3.B
【详解】A.未指明温度与压强,22.4L HCl的物质的量不一定是1mol,溶于水中破坏共价键数不一定为NA,A不正确;
B.的物质的量为0.1mol,所含中子数为0.1mol×10NA= NA,B正确;
C.溶液中,Na2SO4含氧原子数目为0.04NA,溶液中的水也含有氧原子,则含氧原子数大于0.04NA,C不正确;
D.通入足量水中,与水反应生成HNO3和NO,存在下列关系:3NO2——2e-,则充分反应转移电子数=NA,D不正确;
故选B。
4.B
【详解】A.元素是指具有相同质子数的一类原子的总称,所以质子数决定元素的种类,A项错误;
B.元素是指具有相同质子数的一类原子的总称,所以质子数相同的原子一定属于同种元素,B项正确;
C.元素发生化学变化时主要是最外层电子数发生变化,所以元素的化学性质主要决定于原子核最外层电子数,C项错误;
D.氢原子的原子核内只有1个质子,没有中子,中子数为0,D项错误;
故选B。
5.D
【详解】A.氮元素是非金属元素,A正确;
B.氮元素的原子序数为7,B正确;
C.从图中可得到该元素的相对原子质量是14.01,C正确;
D.从图中不能得到氮气的化学式为N2,D错误;
故选D。
6.A
【详解】①1811年阿伏加德罗提出了分子学说
②1777年,法国科学家拉瓦锡发现了氧气并研究其在燃烧中的作用,提出了氧化学说;
③1869年门捷列夫编制了第一张元素周期表;
④1661年波义耳提出元素的概念;
⑤1803年道尔顿提出原子学说;
时间先后顺序的是④②⑤①③,故选A。
7.B
【详解】A.氚原子()核内质子数为1,中子数为2,故A正确;
B.β衰变是1个中子转化为1个质子和1个电子,原子核发生变化,属于物理变化,故B错误;
C.H、D、T的质子数相同、中子数不同,互为同位素,故C正确;
D.氚具有放射性,故D正确;
选B。
8.C
【详解】A.是铯的一种核素,A项错误;
B.是铯的一种核素,不是新发现的元素,B项错误;
C.为55号元素,位于素周期表中第六周期第ⅠA族,C项正确;
D.原子内,质子数=核外电子数,则核内的中子数与核外电子数之差为,D项错误;
故选:C。
9.B
【详解】A.25℃,1.01×105Pa时,气体摩尔体积大于22.4L/mol,11.2LO2的物质的量小于0.5mol,所含的原子数目小于NA,A错误;
B.1个Na2O2含有2个钠离子和1个过氧根离子,78gNa2O2为1mol,所含阴阳离子共3mol,离子总数为3NA,B正确;
C.没有明确溶液体积,不能计算0.5mol·L-1的FeCl3溶液中含有Cl-数目,C错误;
D.1分子D2O含有10个中子,9g水D2O为,含有的中子,数目为4.5NA,D错误;
故选B。
10.A
【详解】A.离子含有n个核外电子,则Y原子核内含有的质子数为,中子数=质量数-质子数,则中子数为,A正确;
B.K层最多能容纳2个电子,B错误;
C.氢元素原子核外最外层电子数为1,其为非金属元素,C错误;
D.金属活动性钙强于钠,但钙的最外层电子数比钠的多,D错误;
故选A。
11.D
【详解】A.6.2g 1P4物质的量,P原子物质的量,每个P原子中含中子数为16,则中子数为,即3.2NA,故A错误;
B.白磷和黑磷为不同物质,转化过程属于化学变化过程,故B错误;
C.12.4 g白磷物质的量,与0.6molH 在密闭容器中充分反应,该反应为可逆反应,生成PH3分子数小于0.4NA,故C错误;
D.6.82g白磷物质的量,反应:11P4+60CuSO4+96H2O=20CuP+24H3PO +60H2SO4中,11 mol P4发生反应转移的电子数为120NA,则0.055 mol P4参加反应时转移的电子数为0.6NA,故D正确;
答案选D
12.D
【详解】A.根据“氟”的偏旁可知,氟属于非金属元素,A正确;
B.由图可知,氟是9号元素,氟原子核内有9个质子,B正确;
C.氟原子的最外层电子数是7,化学反应中氟原子易获得1个电子形成稳定结构,C正确;
D.相对原子质量是指一个原子的实际质量与一个12C原子的质量的的比值,故氟的相对原子质量为19.00,D错误;
故选D。
13.C
【详解】A.C是6号元素,碳-12 原子:,故A错误;
B.N2电子式为:,故B错误;
C.水的结构式为:H-O-H,故C正确;
D.硫是16号元素,硫离子结构示意图为:,故D错误;
故选C。
14.C
【详解】1个碳14原子中含6个质子,含有的中子数=14-6=8,核外电子数等于质子数,则核外有6个电子,结合选项可知C符合;
故选:C。
15.B
【详解】A.和的质子数不相同,两者不是同位素,选项A正确;
B.芘分子存在2条对称轴( ),所以一氯化物有3种,选项B不正确;
C.与H2NCH2CH2COOH的官能种类与个数均相同,组成上相差1个,两者是同系物,选项C正确;
D.与不属于同种元素形成的单质,故不是同素异形体,选项D正确;
答案选B。
16.(1)⑤⑩
(2)0.1 mol L 1
(3)
(4)C
(5)
【详解】(1)电解质是指在水溶液或熔融状态下能导电的化合物,单质和混合物均不是电解质,则属于电解质的有⑤⑩;
(2)0.1 mol·L-1 Na2SO4溶液中Na+的物质的量浓度为0.2 mol·L-1,Ba(OH)2与Na2SO4反应生成BaSO4和NaOH,Na+的物质的量不变,将⑦⑧两溶液等体积混合,所得溶液中Na+的物质的量浓度约为原来的一半,即为0.1 mol·L-1;
(3)R原子的质量数为A,设R原子核内含中子的数目为N,则R的质子数为(A—N),由离子中共有x个核外电子可知(A—N)+24+n=x,解得N= A+n+24-x,则R原子核内含中子的数目A+n+24-x;
(4)将③⑨混合得到的分散系为溴水中萃取出溴后分液,进行分离时,应该选择的装置为C;
(5)漂白粉的有效成分为次氯酸钙,加水浸泡时与二氧化碳反应是次氯酸,漂白性增强,反应的化学方程式为:。
17.(1)b
(2)a
(3) 负 正 H-
【详解】(1)发现绝大多数的α粒子都照直穿过薄金箔,故绝大多数α粒子是按照上图中类似b路径穿越金箔的;
(2)α粒子(即氦原子核)带正电荷,原子核带正电荷,故会相互排斥而不是吸引,故不可能是α粒子在该实验中的运动轨迹的是a;
(3)①氢原子中含有一个带正电荷的质子和一个带负电荷的电子,则反氢原子中含有一个带负电荷的质子和一个带正电荷的电子;
②反氢原子失去一个电子后形成带负电荷的离子,H-。
18.(1)
(2)在装置B中加入氢氧化钠溶液,从导管A处缓缓鼓入一定量的空气
(3)防止空气中的二氧化碳和水分进入U形管,对结果产生误差
(4)偏高
(5)使碳酸根离子转化成二氧化碳,通过测定其质量,确定碳酸钠的质量最后得到纯碱的质量分数;
(6)
【分析】实验原理是通过准确测定和酸反应生成的二氧化碳气体的量,计算碳酸钠的量
【详解】(1)空气中含有二氧化碳,氢氧化钠溶液吸收二氧化碳,防止空气中的二氧化碳气体进入U形管中的碱石灰,答案: ;
(2)装置B的作用是吸收空气中的二氧化碳,应装药品氢氧化钠,且应该排净装置中的空气,答案:在装置B中加入氢氧化钠溶液,从导管A处缓缓鼓入一定量的空气;
(3)干燥管C的作用就是防止空气中的二氧化碳和水分进入U形管,对结果产生误差,答案:防止空气中的二氧化碳和水分进入U形管,对结果产生误差;
(4)如果将装有浓硫酸的装置撤去,会使U形管增重偏大吸收的物质是水和二氧化碳,使碳酸钠的质量偏大,最终结果偏高,答案:偏高;
(5)从分液漏斗滴入的硫酸 发生反应:,可以通过测定气体的量,确定碳酸钠的量,答案:使碳酸根离子转化成二氧化碳,通过测定其质量,确定碳酸钠的质量最后得到纯碱的质量分数;
(6)设样品中碳酸钠的质量为Xg,根据反应方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,可得反应关系式:Na2CO3~CO2,则有,解得,所以试样中纯碱的质量分数的计算式为,答案:。
19.(1)同分异构体
(2)2
(3) 1s22s22p63s23p63d5 平面三角形 sp2、sp3
(4)N的2p轨道处于半满状态,稳定性强。
(5) 弱 因为电负性F>Cl,F-C的极性就大于Cl-C,所以三氟乙酸中的羧基中羟基极性更强,更易电离出氢离子。
【解析】(1)
两者分子式相同,但结构不同,故两者的关系为同分异构体。
(2)
该晶胞中,尿素分子位于顶点和体心,故该晶胞中含有的尿素分子数为。
(3)
①其中心离子为铁离子,其核外电子排布式为1s 2s 2p 3s 3p 3d ,对于硝酸根离子,根据价层电子互斥理论,先计算孤电子对数为,所以硝酸根离子属于AB3型且无孤对电子,即是平面三角形。
②在尿素分子中,存在碳氧双键,故C原子的杂化方式为sp2杂化;N周围都是单键,故N原子的杂化方式为sp3杂化。
(4)
N的2p轨道处于半满状态,稳定性强,故N元素的第一电子亲和能远低于C元素。
(5)
三氯乙酸的酸性比三氟乙酸酸性弱,因为电负性F>Cl,F-C的极性就大于Cl-C,所以三氟乙酸中的羧基中羟基极性更强,更易电离出氢离子。
答案第1页,共2页
答案第1页,共2页
姓名()班级()学号()
一、单选题
1.有、两种元素,已知元素的核电荷数为,且与的电子排布完全相同,则元素的质子数为
A. B. C. D.
2.以下是某种元素的原子结构示意图,下列说法不正确的是
A.该原子易得两个电子而形成稳定结构 B.该原子的核电荷数为16
C.“+”表示该原子带正电 D.该原子的第二层电子数为8
3.设NA为阿伏加德罗常数的值,下列说法正确的是
A.22.4L HCl溶于水中,破坏共价键数为NA
B.中所含中子数为NA
C.溶液中含氧原子数目为0.04NA
D.通入足量水中充分反应转移电子数0.1NA
4.下列说法正确的是
A.决定元素种类的是原子核最外层电子数 B.质子数相同的原子一定属于同种元素
C.决定元素化学性质的是原子核内中子数 D.原子核内的中子数一定不为零
5.下图是元素周期表中某元素的相关信息,从图中不能获得的信息是
A.该元素是非金属元素 B.该元素的原子序数为7
C.该元素的相对原子质量是14.01 D.氮气的化学式为N2
6.化学学科的发展离不开历代科学家的共同努力,下列科学家提出的理论排列符合时间先后顺序的是
①阿伏加德罗提出了分子学说
②拉瓦锡提出了燃烧的氧化学说
③门捷列夫编制了第一张元素周期表
④波义耳提出元素的概念
⑤道尔顿提出原子学说
A.④②⑤①③ B.⑤①③②④
C.②④⑤①③ D.④①②⑤③
7.氚管是一种应用在深海夜光手表中的发光装置。其主要结构是在一个密闭玻璃管中充入氚气,由氚在β衰变时释放出的电子射中涂在玻璃管内部的荧光粉,发出荧光。下列说法错误的是
A.氚原子核内中子数为2
B.β衰变属于化学变化
C.H、D、T互为同位素
D.含有氚的废水具有放射性
8.下列有关的叙述正确的是
A.是铯的一种同素异形体
B.是一种新发现的元素
C.位于元素周期表中第六周期第ⅠA族
D.核内的中子数与核外电子数之差为82
9.用NA代表阿伏加德罗常数的值。下列说法正确的是
A.25℃,1.01×105Pa时,11.2LO2所含的原子数目为NA
B.78gNa2O2晶体所含阴阳离子的总数为3NA
C.0.5mol·L-1的FeCl3溶液中,含有Cl-个数为1.5NA
D.9g水D2O含有的中子数为5NA
10.下列说法正确的是
A.若离子中含有n个核外电子,则Y原子核内含有的中子数为
B.电子层由里到外依次为K层、L层、M层……,每层最多能容纳8个电子
C.若某元素原子核外最外层电子数小于或等于2,则该元素一定为金属元素
D.最外层电子数越少的金属元素对应的金属单质的金属活动性越强
11.磷有多种同素异形体,其中白磷和黑磷的结构如图所示,设NA为阿伏加德罗常数的值。下列说法正确的是
A.6.2g 1P4中含有的中子数为12.8NA
B.将白磷转化为黑磷属于物理变化
C.12.4g白磷与0.6molH 在密闭容器中充分反应,生成的PH3分子数为0.4NA
D.6.82g白磷发生反应:11P4+60CuSO4+96H2O=20CuP+24H3PO +60H2SO4,转移的电子数为0.6NA
12.如图是氟元素在元素周期表中的信息及原子结构示意图,下列表述错误的是
A.氟属于非金属元素 B.氟原子核内有9个质子
C.化学反应中氟原子易得电子 D.氟的相对原子质量为19.00g
13.下列化学用语表达正确的是
A.碳-12 原子: B.N2电子式:
C.水的结构式:H-O-H D.硫离子结构示意图:
14.考古人员使用碳14(质子数为6,14为质子数和中子数之和)年代检测法,测出三星堆出土的“鸟形金饰片”(如图)距金约3200年至3000年。下列模型能表示碳14原子结构的是
A. B.
C. D.
15.下列说法不正确的是
A.与不能互称为同位素
B.芳香族化合物芘( )的一氯代物有5种
C.与H2NCH2CH2COOH互为同系物
D.与不是同素异形体
二、填空题
16.现有下列十种物质(微粒):①空气②18O③四氯化碳④CO2⑤CuSO4·5H2O⑥漂白粉⑦0.2 mol L 1Ba(OH)2溶液⑧0.1 mol L 1Na2SO4溶液⑨溴水⑩NaCl。
(1)属于电解质的有 。
(2)将⑦⑧两溶液等体积混合,所得溶液中Na+的物质的量浓度约为 。
(3)某元素R与②形成的阴离子中,共含有x个电子,R原子的质量数为A,则一个该离子含有的中子数目是 。
(4)将③⑨混合得到的分散系进行分离时,应该选择的装置为___________。
A. B.
C. D.
(5)⑥在使用时需加水浸泡片刻,才能发挥更好的漂白效果,请用化学方程式写出相应的反应原理 。
17.人们为了揭示原子结构的奥秘,经历了漫长的探究过程。以下是英国科学家卢瑟福进行的探究。1911 年英国科学家卢瑟福进行了著名的α粒子(即氦原子核)轰击金属箔实验。结果发现:发现绝大多数的α粒子都照直穿过薄金箔,偏转很小,但有少数α粒子发生角度比汤姆森模型所预言的大得多的偏转,大约有极少数的阿尔法粒子偏转角大于 90°,甚至观察到偏转角等于 150°的散射,称大角散射,无法用汤姆森模型说明。1911 年卢瑟福提出原子的有核模型(又称原子的核式结构模型),与正电荷联系的质量集中在中心形成原子核,电子绕着核在核外运动,由此导出α粒子散射公式,说明了 α粒子的大角散射。人类对原子结构的认识永无止境。
(1)根据上文中的表达。绝大多数α粒子是按照上图中类似 (填写路径编号)路径穿越金箔的;
(2)上图中所示的线条中,不可能是α粒子在该实验中的运动轨迹的是 (填写路径编号);
(3)正电子、负质子都属于反粒子,它们与普通的电子、质子的质量与电量均相等,而电性相反,科学家设想在宇宙的某些部分可能存在完全由反粒子构成的反物质。请你推测反氢原子的结构:
①反氢原子中含有一个带 电荷的质子和一个带 电荷的电子;
②反氢原子失去一个电子后所形成的离子符号 。(元素符号不变)
三、实验探究题
18.已知某纯碱试样中含有杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
主要实验步 如下:
①按图组装仪器,并检查装置的气密性
②
③将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
④称量盛有碱石灰的U形管的质量,得到bg
⑤从分液漏斗滴入的硫酸,直到不再产生气体时为止
⑥从导管A处缓缓鼓入一定量的空气
⑦再次称量盛有碱石灰的U形管的质量,得到cg
⑧重复步穁⑤和⑥的操作,直到形管的质量基本不变,为dg
请回答以下问题:
(1)装置B中的试剂是 (填化学式)。
(2)第②步操作是: 。
(3)装置中干燥管C的作用是 。
(4)如果将装有浓硫酸的装置撤去,测试的结果 (填偏高、偏低或不变);
(5)步骤⑤的目的是 。
(6)该试样中纯碱的质量分数的计算式为 。
四、结构与性质
19.1824年,德国化学家维勒蒸发氰酸铵(NH4CNO)溶液,得到一种白色结晶物,经多次实验,证实该白色结晶物与从动物尿液中提取的尿素[CO(NH2)2]一致。维勒利用无机物人工合成了尿素,破除了人们长期以来形成的有机物“生命力论”的错误观念。
(1)从物质的组成和结构角度分析:NH4CNO与CO(NH2)2的关系为 。
(2)尿素晶体的晶胞结构如图所示,该晶胞中有 个尿素分子。
(3)硝酸铁和尿素在乙醇溶液中可以合成[Fe(CON2H4)6](NO3)3[三硝酸六尿素合铁(III)]。
①[Fe(CON2H4)6]3+中基态中心离子的核外电子排布式是 ,NO的空间结构是 。
②在CO(NH2)2分子中,碳和氮原子的杂化方式分别为 。
(4)电子亲和能是指元素的气态原子(或离子)获得一个电子所放出的能量。一般来说,原子(或离子)越容易获得电子,则电子亲和能越大;原子(或离子)外层电子构型越稳定,电子亲和能越小。N元素的第一电子亲和能远低于C元素的原因是 。
(5)三氯乙酸的酸性比三氟乙酸酸性 (填强或弱),原因是 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【详解】A元素原子的核电荷数为a,原子中核电荷数=核内质子数=核外电子数,则其核外电子数为a;A原子得到3个电子形成A3-,则A3-的核外电子数为a+3,B原子失去n个电子形成Bn+,设B的质子数为x,由于A3-与Bn+的电子层排布相同,则:a+3=x-n,解得x=a+n+3,所以元素B的质子数为a+n+3。
答案选D。
2.C
【详解】A.该原子最外层有6个电子,易得到2个电子而形成8电子稳定结构,A项正确;
B.由原子结构示意图可知,该原子的核电荷数为16,B项正确;
C.原子不带电,“+”表示该原子核内的质子带正电,C项错误;
D.由原子结构示意图可知,该原子的第二层电子数为8,D项正确;
故选C。
3.B
【详解】A.未指明温度与压强,22.4L HCl的物质的量不一定是1mol,溶于水中破坏共价键数不一定为NA,A不正确;
B.的物质的量为0.1mol,所含中子数为0.1mol×10NA= NA,B正确;
C.溶液中,Na2SO4含氧原子数目为0.04NA,溶液中的水也含有氧原子,则含氧原子数大于0.04NA,C不正确;
D.通入足量水中,与水反应生成HNO3和NO,存在下列关系:3NO2——2e-,则充分反应转移电子数=NA,D不正确;
故选B。
4.B
【详解】A.元素是指具有相同质子数的一类原子的总称,所以质子数决定元素的种类,A项错误;
B.元素是指具有相同质子数的一类原子的总称,所以质子数相同的原子一定属于同种元素,B项正确;
C.元素发生化学变化时主要是最外层电子数发生变化,所以元素的化学性质主要决定于原子核最外层电子数,C项错误;
D.氢原子的原子核内只有1个质子,没有中子,中子数为0,D项错误;
故选B。
5.D
【详解】A.氮元素是非金属元素,A正确;
B.氮元素的原子序数为7,B正确;
C.从图中可得到该元素的相对原子质量是14.01,C正确;
D.从图中不能得到氮气的化学式为N2,D错误;
故选D。
6.A
【详解】①1811年阿伏加德罗提出了分子学说
②1777年,法国科学家拉瓦锡发现了氧气并研究其在燃烧中的作用,提出了氧化学说;
③1869年门捷列夫编制了第一张元素周期表;
④1661年波义耳提出元素的概念;
⑤1803年道尔顿提出原子学说;
时间先后顺序的是④②⑤①③,故选A。
7.B
【详解】A.氚原子()核内质子数为1,中子数为2,故A正确;
B.β衰变是1个中子转化为1个质子和1个电子,原子核发生变化,属于物理变化,故B错误;
C.H、D、T的质子数相同、中子数不同,互为同位素,故C正确;
D.氚具有放射性,故D正确;
选B。
8.C
【详解】A.是铯的一种核素,A项错误;
B.是铯的一种核素,不是新发现的元素,B项错误;
C.为55号元素,位于素周期表中第六周期第ⅠA族,C项正确;
D.原子内,质子数=核外电子数,则核内的中子数与核外电子数之差为,D项错误;
故选:C。
9.B
【详解】A.25℃,1.01×105Pa时,气体摩尔体积大于22.4L/mol,11.2LO2的物质的量小于0.5mol,所含的原子数目小于NA,A错误;
B.1个Na2O2含有2个钠离子和1个过氧根离子,78gNa2O2为1mol,所含阴阳离子共3mol,离子总数为3NA,B正确;
C.没有明确溶液体积,不能计算0.5mol·L-1的FeCl3溶液中含有Cl-数目,C错误;
D.1分子D2O含有10个中子,9g水D2O为,含有的中子,数目为4.5NA,D错误;
故选B。
10.A
【详解】A.离子含有n个核外电子,则Y原子核内含有的质子数为,中子数=质量数-质子数,则中子数为,A正确;
B.K层最多能容纳2个电子,B错误;
C.氢元素原子核外最外层电子数为1,其为非金属元素,C错误;
D.金属活动性钙强于钠,但钙的最外层电子数比钠的多,D错误;
故选A。
11.D
【详解】A.6.2g 1P4物质的量,P原子物质的量,每个P原子中含中子数为16,则中子数为,即3.2NA,故A错误;
B.白磷和黑磷为不同物质,转化过程属于化学变化过程,故B错误;
C.12.4 g白磷物质的量,与0.6molH 在密闭容器中充分反应,该反应为可逆反应,生成PH3分子数小于0.4NA,故C错误;
D.6.82g白磷物质的量,反应:11P4+60CuSO4+96H2O=20CuP+24H3PO +60H2SO4中,11 mol P4发生反应转移的电子数为120NA,则0.055 mol P4参加反应时转移的电子数为0.6NA,故D正确;
答案选D
12.D
【详解】A.根据“氟”的偏旁可知,氟属于非金属元素,A正确;
B.由图可知,氟是9号元素,氟原子核内有9个质子,B正确;
C.氟原子的最外层电子数是7,化学反应中氟原子易获得1个电子形成稳定结构,C正确;
D.相对原子质量是指一个原子的实际质量与一个12C原子的质量的的比值,故氟的相对原子质量为19.00,D错误;
故选D。
13.C
【详解】A.C是6号元素,碳-12 原子:,故A错误;
B.N2电子式为:,故B错误;
C.水的结构式为:H-O-H,故C正确;
D.硫是16号元素,硫离子结构示意图为:,故D错误;
故选C。
14.C
【详解】1个碳14原子中含6个质子,含有的中子数=14-6=8,核外电子数等于质子数,则核外有6个电子,结合选项可知C符合;
故选:C。
15.B
【详解】A.和的质子数不相同,两者不是同位素,选项A正确;
B.芘分子存在2条对称轴( ),所以一氯化物有3种,选项B不正确;
C.与H2NCH2CH2COOH的官能种类与个数均相同,组成上相差1个,两者是同系物,选项C正确;
D.与不属于同种元素形成的单质,故不是同素异形体,选项D正确;
答案选B。
16.(1)⑤⑩
(2)0.1 mol L 1
(3)
(4)C
(5)
【详解】(1)电解质是指在水溶液或熔融状态下能导电的化合物,单质和混合物均不是电解质,则属于电解质的有⑤⑩;
(2)0.1 mol·L-1 Na2SO4溶液中Na+的物质的量浓度为0.2 mol·L-1,Ba(OH)2与Na2SO4反应生成BaSO4和NaOH,Na+的物质的量不变,将⑦⑧两溶液等体积混合,所得溶液中Na+的物质的量浓度约为原来的一半,即为0.1 mol·L-1;
(3)R原子的质量数为A,设R原子核内含中子的数目为N,则R的质子数为(A—N),由离子中共有x个核外电子可知(A—N)+24+n=x,解得N= A+n+24-x,则R原子核内含中子的数目A+n+24-x;
(4)将③⑨混合得到的分散系为溴水中萃取出溴后分液,进行分离时,应该选择的装置为C;
(5)漂白粉的有效成分为次氯酸钙,加水浸泡时与二氧化碳反应是次氯酸,漂白性增强,反应的化学方程式为:。
17.(1)b
(2)a
(3) 负 正 H-
【详解】(1)发现绝大多数的α粒子都照直穿过薄金箔,故绝大多数α粒子是按照上图中类似b路径穿越金箔的;
(2)α粒子(即氦原子核)带正电荷,原子核带正电荷,故会相互排斥而不是吸引,故不可能是α粒子在该实验中的运动轨迹的是a;
(3)①氢原子中含有一个带正电荷的质子和一个带负电荷的电子,则反氢原子中含有一个带负电荷的质子和一个带正电荷的电子;
②反氢原子失去一个电子后形成带负电荷的离子,H-。
18.(1)
(2)在装置B中加入氢氧化钠溶液,从导管A处缓缓鼓入一定量的空气
(3)防止空气中的二氧化碳和水分进入U形管,对结果产生误差
(4)偏高
(5)使碳酸根离子转化成二氧化碳,通过测定其质量,确定碳酸钠的质量最后得到纯碱的质量分数;
(6)
【分析】实验原理是通过准确测定和酸反应生成的二氧化碳气体的量,计算碳酸钠的量
【详解】(1)空气中含有二氧化碳,氢氧化钠溶液吸收二氧化碳,防止空气中的二氧化碳气体进入U形管中的碱石灰,答案: ;
(2)装置B的作用是吸收空气中的二氧化碳,应装药品氢氧化钠,且应该排净装置中的空气,答案:在装置B中加入氢氧化钠溶液,从导管A处缓缓鼓入一定量的空气;
(3)干燥管C的作用就是防止空气中的二氧化碳和水分进入U形管,对结果产生误差,答案:防止空气中的二氧化碳和水分进入U形管,对结果产生误差;
(4)如果将装有浓硫酸的装置撤去,会使U形管增重偏大吸收的物质是水和二氧化碳,使碳酸钠的质量偏大,最终结果偏高,答案:偏高;
(5)从分液漏斗滴入的硫酸 发生反应:,可以通过测定气体的量,确定碳酸钠的量,答案:使碳酸根离子转化成二氧化碳,通过测定其质量,确定碳酸钠的质量最后得到纯碱的质量分数;
(6)设样品中碳酸钠的质量为Xg,根据反应方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,可得反应关系式:Na2CO3~CO2,则有,解得,所以试样中纯碱的质量分数的计算式为,答案:。
19.(1)同分异构体
(2)2
(3) 1s22s22p63s23p63d5 平面三角形 sp2、sp3
(4)N的2p轨道处于半满状态,稳定性强。
(5) 弱 因为电负性F>Cl,F-C的极性就大于Cl-C,所以三氟乙酸中的羧基中羟基极性更强,更易电离出氢离子。
【解析】(1)
两者分子式相同,但结构不同,故两者的关系为同分异构体。
(2)
该晶胞中,尿素分子位于顶点和体心,故该晶胞中含有的尿素分子数为。
(3)
①其中心离子为铁离子,其核外电子排布式为1s 2s 2p 3s 3p 3d ,对于硝酸根离子,根据价层电子互斥理论,先计算孤电子对数为,所以硝酸根离子属于AB3型且无孤对电子,即是平面三角形。
②在尿素分子中,存在碳氧双键,故C原子的杂化方式为sp2杂化;N周围都是单键,故N原子的杂化方式为sp3杂化。
(4)
N的2p轨道处于半满状态,稳定性强,故N元素的第一电子亲和能远低于C元素。
(5)
三氯乙酸的酸性比三氟乙酸酸性弱,因为电负性F>Cl,F-C的极性就大于Cl-C,所以三氟乙酸中的羧基中羟基极性更强,更易电离出氢离子。
答案第1页,共2页
答案第1页,共2页
