4.2电解池第二课时课件(共24张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2电解池第二课时课件(共24张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-27 16:12:21 | ||
图片预览






文档简介
(共24张PPT)
第四章 化学反应与电能
第二节 电解池
第二课时 电解原理的应用
学习目标
1、理解并掌握电解电解饱和食盐水(氯碱工业)、电镀、电解精炼铜、电冶金的原理,会书写电极方程式和总方程式。
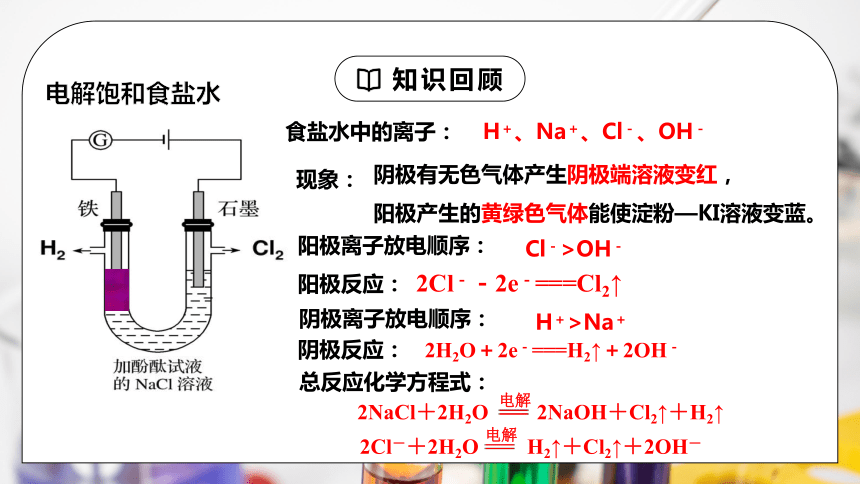
电解饱和食盐水
食盐水中的离子:
H+、Na+、Cl-、OH-
现象:
阴极有无色气体产生阴极端溶液变红,
阳极产生的黄绿色气体能使淀粉—KI溶液变蓝。
知识回顾
阳极反应:
2Cl--2e-===Cl2↑
Cl->OH-
阳极离子放电顺序:
阴极反应:
2H2O+2e-===H2↑+2OH-
H+>Na+
阴极离子放电顺序:
总反应化学方程式:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
电解
2Cl-+2H2O H2↑+Cl2↑+2OH-
电解
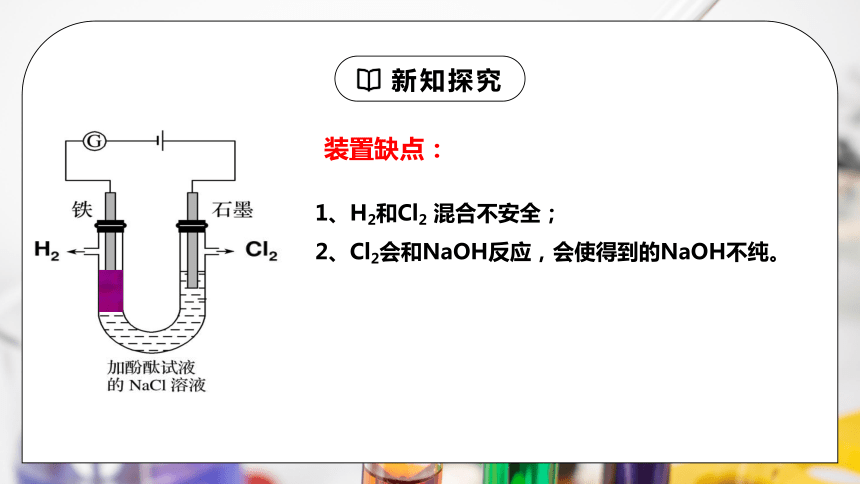
装置缺点:
1、H2和Cl2 混合不安全;
2、Cl2会和NaOH反应,会使得到的NaOH不纯。
新知探究
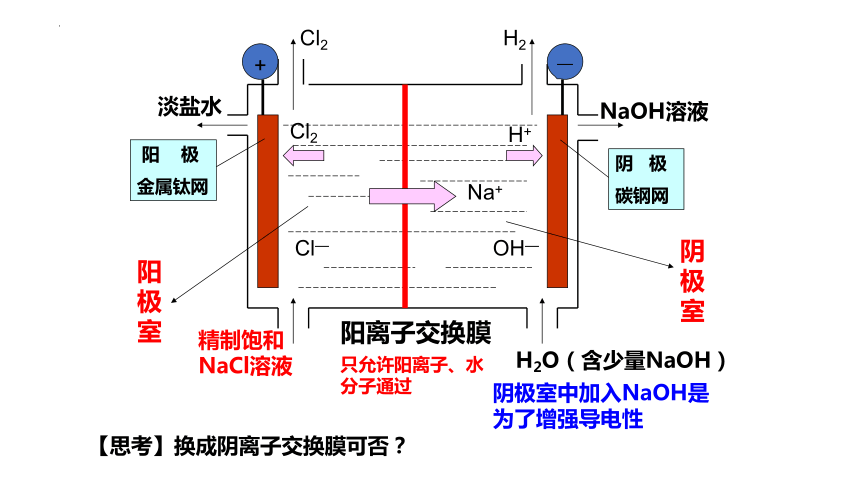
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢网
阳极:钛网
阳离子交换膜:
(2)离子交换膜的作用:
只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
a、防止氢气和氯气混合;
b、避免氯气和氢氧化钠反应生成 ,而影响氢氧化钠的产量。
二、电解原理的应用
1、电解饱和食盐水(氯碱工业——离子交换膜法制烧碱)
新知探究
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
金属钛网
阴 极
碳钢网
阳极室
阴极室
阴极室中加入NaOH是
为了增强导电性
只允许阳离子、水分子通过
【思考】换成阴离子交换膜可否?
粗盐的成份:
含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,会与碱性物质反应产生沉淀,损坏离子交换膜
精制食盐水
杂质的除去过程:
粗盐水
含少量Ca2+.Mg2+
精制盐水
知识回顾
【例1】目前电解法食盐水制烧碱通常采用离子交换膜法,阳(阴)离子交换膜不 允许阴(阳)离子通过。则下列叙述中错误的是( )
A.NaOH、H2均在Ⅰ区产生
B.图中a为阴离子交换膜
C.使用离子交换膜可以有效地隔离
NaOH和Cl2,阻止二者之间的反应
D.电解时往Ⅲ区的溶液中滴加几滴
甲基橙,溶液先变红后褪色
B
新知演练
⑴、概念:
2、电镀
电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
二、电解原理的应用
新知探究
目的:增强金属的抗腐蚀能力、耐磨性或改善金属制品的外观。
⑵、电镀池形成条件
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
①、镀件作阴极
②、镀层金属作阳极
③、含镀层金属阳离子的盐溶液作电解液
⑶、电镀的特点
电镀液的组成、浓度及酸碱性保持不变
2、电镀
二、电解原理的应用
新知探究
阳极:纯铜板
阴极:铁片
电镀液:硫酸铜溶液
铁片
铜片
硫酸铜溶液
电极方程式:
阳极:
阴极:
Cu-2e-= Cu2+
Cu2+ + 2e-= Cu
示例:铁片电镀铜
画出电镀池,书写电极方程式。
新知演练
【例2】在铜片上镀银时,下列叙述中错误的是( )
①将铜片接在电源的正极
②将银片接在电源的正极
③在铜片上发生的反应是Ag++e- = Ag
④在银片上发生的反应是4OH--4e-=O2↑+2H2O
⑤可用CuSO4溶液作电解质溶液
⑥可用AgNO3溶液作电解质溶液
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
C
新知演练
3、铜的电解精炼
⑴、粗铜所含的杂质
Zn、Fe、Ni、Ag、Au等
+
纯铜
粗铜
-
CuSO4溶液
⑵、粗铜的精炼对电解池的要求
①以粗铜为阳极
一般火法冶炼得到的粗铜中含有多种杂质(如锌
、铁、镍、银、金等),这种粗铜的导电性远不
能满足电气工业的要求,如果用以制电线,就会
大大降低电线的导电能力。因此必须利用电解的
方法精炼粗铜。
② 以纯铜为阴极
③ 以CuSO4溶液为电解液进行电解
二、电解原理的应用
新知探究
粗铜 含杂质(Zn Fe Ni Ag Au等)
阳极:
Zn-2e-= Zn2+
Zn
Fe
Ni
Cu
Ag Au
阴极:
阳极泥
思考:电解完后,CuSO4溶液的浓度有何变化?
阳极泥: 不活泼金属以单质的形式沉积在电解槽底,形成阳极泥,阳极泥中可以提取贵金属
(3)、电极反应
Fe -2e-= Fe2+
Ni -2e-= Ni2+
Cu-2e-= Cu2+
Cu2+ + 2e- = Cu
Zn2+ Fe2+ Ni2+ Cu2+
3、铜的电解精炼
二、电解原理的应用
新知探究
Cu2+的浓度有所下降。
【例3】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,
可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知氧化性:Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D
新知演练
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
将电能转变成化学能的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:电源正极相连
阴极:电源负极相连
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属;
阴极:纯金属
阳极:氧化反应
阴极:还原反应
课堂小结
电解是最强有力的氧化还原手段,所以电解法是冶炼金属的一种重要的方法。对于冶炼像Ca、Na、Mg、Al这样活泼的金属,电解法几乎是唯一可行的工业方法。
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
K、Ca、Na、Mg、Al 等活泼金属,很难用还原剂从它们的化合物中还原得到单质,因此必须通过电解熔融的化合物的方法得到。
原理: Mn+ + ne- = M
(1)制取金属钠
电解熔融状态的氯化钠。
通直流电后,
阳极:
2Cl - -2e- = Cl2↑
阴极:
2Na+ + 2e- = 2Na
总反应:
2NaCl(熔融) 2Na + Cl2 ↑
NaCl = Na+ + Cl -
Cl -
Na+
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
电解熔融氯化钠制钠
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
(2)制取金属镁
电解熔融状态的氯化镁。
通直流电后,
阳极:
2Cl - -2e- = Cl2↑
阴极:
Mg2+ + 2e- = Mg
总反应:
MgCl2(熔融) Mg + Cl2 ↑
MgCl2 = Mg2+ + 2Cl -
Cl -
Mg2+
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
(3)制取金属铝
电解熔融状态的氧化铝
阳极:
6O 2- -12e- = 3O2↑
阴极:
4Al 3+ + 12e- = 4Al
总反应:
2Al2O3(熔融) 4Al + 3O2 ↑
冰晶石
Al2O3= 2Al 3+ + 3O 2-
O 2-
Al 3+
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
阳极材料(碳)和熔融氧化铝需要定期补充
【思考】工业上为什么用电解熔融氧化铝的方法冶炼铝而不用AlCl3
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
因为氧化镁的熔点比氯化镁高很多,浪费了能量 ;
氯化铝是共价化合物,共价化合物为分子晶体,不能电解,而氧化铝是离子化合物,可电解。
与电源正极相连
阳极
阴极
与电源负极相连
发生氧化反应
阳离子移向
阴离子移向
发生还原反应
1、电源、电极、电极反应关系
2、电解原理的应用:氯碱工业、电镀、粗铜精炼、电冶金
课堂小结
课程结束
第四章 化学反应与电能
第二节 电解池
第二课时 电解原理的应用
学习目标
1、理解并掌握电解电解饱和食盐水(氯碱工业)、电镀、电解精炼铜、电冶金的原理,会书写电极方程式和总方程式。
电解饱和食盐水
食盐水中的离子:
H+、Na+、Cl-、OH-
现象:
阴极有无色气体产生阴极端溶液变红,
阳极产生的黄绿色气体能使淀粉—KI溶液变蓝。
知识回顾
阳极反应:
2Cl--2e-===Cl2↑
Cl->OH-
阳极离子放电顺序:
阴极反应:
2H2O+2e-===H2↑+2OH-
H+>Na+
阴极离子放电顺序:
总反应化学方程式:
2NaCl+2H2O 2NaOH+Cl2↑+H2↑
电解
2Cl-+2H2O H2↑+Cl2↑+2OH-
电解
装置缺点:
1、H2和Cl2 混合不安全;
2、Cl2会和NaOH反应,会使得到的NaOH不纯。
新知探究
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢网
阳极:钛网
阳离子交换膜:
(2)离子交换膜的作用:
只允许阳离子通过(Cl-、OH-离子和气体不能通过),把电解槽隔成阴极室和阳极室。
a、防止氢气和氯气混合;
b、避免氯气和氢氧化钠反应生成 ,而影响氢氧化钠的产量。
二、电解原理的应用
1、电解饱和食盐水(氯碱工业——离子交换膜法制烧碱)
新知探究
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
金属钛网
阴 极
碳钢网
阳极室
阴极室
阴极室中加入NaOH是
为了增强导电性
只允许阳离子、水分子通过
【思考】换成阴离子交换膜可否?
粗盐的成份:
含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,会与碱性物质反应产生沉淀,损坏离子交换膜
精制食盐水
杂质的除去过程:
粗盐水
含少量Ca2+.Mg2+
精制盐水
知识回顾
【例1】目前电解法食盐水制烧碱通常采用离子交换膜法,阳(阴)离子交换膜不 允许阴(阳)离子通过。则下列叙述中错误的是( )
A.NaOH、H2均在Ⅰ区产生
B.图中a为阴离子交换膜
C.使用离子交换膜可以有效地隔离
NaOH和Cl2,阻止二者之间的反应
D.电解时往Ⅲ区的溶液中滴加几滴
甲基橙,溶液先变红后褪色
B
新知演练
⑴、概念:
2、电镀
电镀是利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
二、电解原理的应用
新知探究
目的:增强金属的抗腐蚀能力、耐磨性或改善金属制品的外观。
⑵、电镀池形成条件
+
镀件
镀层金属
-
含镀层金属离子的盐溶液
①、镀件作阴极
②、镀层金属作阳极
③、含镀层金属阳离子的盐溶液作电解液
⑶、电镀的特点
电镀液的组成、浓度及酸碱性保持不变
2、电镀
二、电解原理的应用
新知探究
阳极:纯铜板
阴极:铁片
电镀液:硫酸铜溶液
铁片
铜片
硫酸铜溶液
电极方程式:
阳极:
阴极:
Cu-2e-= Cu2+
Cu2+ + 2e-= Cu
示例:铁片电镀铜
画出电镀池,书写电极方程式。
新知演练
【例2】在铜片上镀银时,下列叙述中错误的是( )
①将铜片接在电源的正极
②将银片接在电源的正极
③在铜片上发生的反应是Ag++e- = Ag
④在银片上发生的反应是4OH--4e-=O2↑+2H2O
⑤可用CuSO4溶液作电解质溶液
⑥可用AgNO3溶液作电解质溶液
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
C
新知演练
3、铜的电解精炼
⑴、粗铜所含的杂质
Zn、Fe、Ni、Ag、Au等
+
纯铜
粗铜
-
CuSO4溶液
⑵、粗铜的精炼对电解池的要求
①以粗铜为阳极
一般火法冶炼得到的粗铜中含有多种杂质(如锌
、铁、镍、银、金等),这种粗铜的导电性远不
能满足电气工业的要求,如果用以制电线,就会
大大降低电线的导电能力。因此必须利用电解的
方法精炼粗铜。
② 以纯铜为阴极
③ 以CuSO4溶液为电解液进行电解
二、电解原理的应用
新知探究
粗铜 含杂质(Zn Fe Ni Ag Au等)
阳极:
Zn-2e-= Zn2+
Zn
Fe
Ni
Cu
Ag Au
阴极:
阳极泥
思考:电解完后,CuSO4溶液的浓度有何变化?
阳极泥: 不活泼金属以单质的形式沉积在电解槽底,形成阳极泥,阳极泥中可以提取贵金属
(3)、电极反应
Fe -2e-= Fe2+
Ni -2e-= Ni2+
Cu-2e-= Cu2+
Cu2+ + 2e- = Cu
Zn2+ Fe2+ Ni2+ Cu2+
3、铜的电解精炼
二、电解原理的应用
新知探究
Cu2+的浓度有所下降。
【例3】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,
可用电解法制备高纯度的镍,下列叙述正确的是( )
(已知氧化性:Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式: Ni2+ + 2e— = Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
D
新知演练
电解池 电解精炼池 电镀池
定义
形成 条件
电极 名称
电极 反应
将电能转变成化学能的装置。
应用电解原理在某些金属表面镀上一层其它金属的装置。
①两电极接直流电源
②电极插人电解质溶液
③形成闭合回路
①镀层金属接电源正极待镀金属接电源负极
②电镀液须含有镀层金属的离子
阳极:电源正极相连
阴极:电源负极相连
阳极:镀层金属;
阴极:镀件
阳极:氧化反应
阴极:还原反应
阳极:氧化反应
阴极:还原反应
应用电解原理将不纯的金属提纯的装置。
①不纯金属接电源正极纯的金属接电源负极
②电解质溶液须待提纯金属的离子
阳极:不纯金属;
阴极:纯金属
阳极:氧化反应
阴极:还原反应
课堂小结
电解是最强有力的氧化还原手段,所以电解法是冶炼金属的一种重要的方法。对于冶炼像Ca、Na、Mg、Al这样活泼的金属,电解法几乎是唯一可行的工业方法。
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
K、Ca、Na、Mg、Al 等活泼金属,很难用还原剂从它们的化合物中还原得到单质,因此必须通过电解熔融的化合物的方法得到。
原理: Mn+ + ne- = M
(1)制取金属钠
电解熔融状态的氯化钠。
通直流电后,
阳极:
2Cl - -2e- = Cl2↑
阴极:
2Na+ + 2e- = 2Na
总反应:
2NaCl(熔融) 2Na + Cl2 ↑
NaCl = Na+ + Cl -
Cl -
Na+
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
电解熔融氯化钠制钠
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
(2)制取金属镁
电解熔融状态的氯化镁。
通直流电后,
阳极:
2Cl - -2e- = Cl2↑
阴极:
Mg2+ + 2e- = Mg
总反应:
MgCl2(熔融) Mg + Cl2 ↑
MgCl2 = Mg2+ + 2Cl -
Cl -
Mg2+
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
(3)制取金属铝
电解熔融状态的氧化铝
阳极:
6O 2- -12e- = 3O2↑
阴极:
4Al 3+ + 12e- = 4Al
总反应:
2Al2O3(熔融) 4Al + 3O2 ↑
冰晶石
Al2O3= 2Al 3+ + 3O 2-
O 2-
Al 3+
助熔剂:冰晶石(Na3AlF6 六氟合铝酸钠)
阳极材料(碳)和熔融氧化铝需要定期补充
【思考】工业上为什么用电解熔融氧化铝的方法冶炼铝而不用AlCl3
4、电冶金(冶炼活泼金属钠、镁、铝等)
二、电解原理的应用
新知探究
因为氧化镁的熔点比氯化镁高很多,浪费了能量 ;
氯化铝是共价化合物,共价化合物为分子晶体,不能电解,而氧化铝是离子化合物,可电解。
与电源正极相连
阳极
阴极
与电源负极相连
发生氧化反应
阳离子移向
阴离子移向
发生还原反应
1、电源、电极、电极反应关系
2、电解原理的应用:氯碱工业、电镀、粗铜精炼、电冶金
课堂小结
课程结束
