2024科粤版化学九年级下学期课时练--第1课时 常见的酸 酸的化学性质
文档属性
| 名称 | 2024科粤版化学九年级下学期课时练--第1课时 常见的酸 酸的化学性质 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-29 17:09:56 | ||
图片预览


文档简介
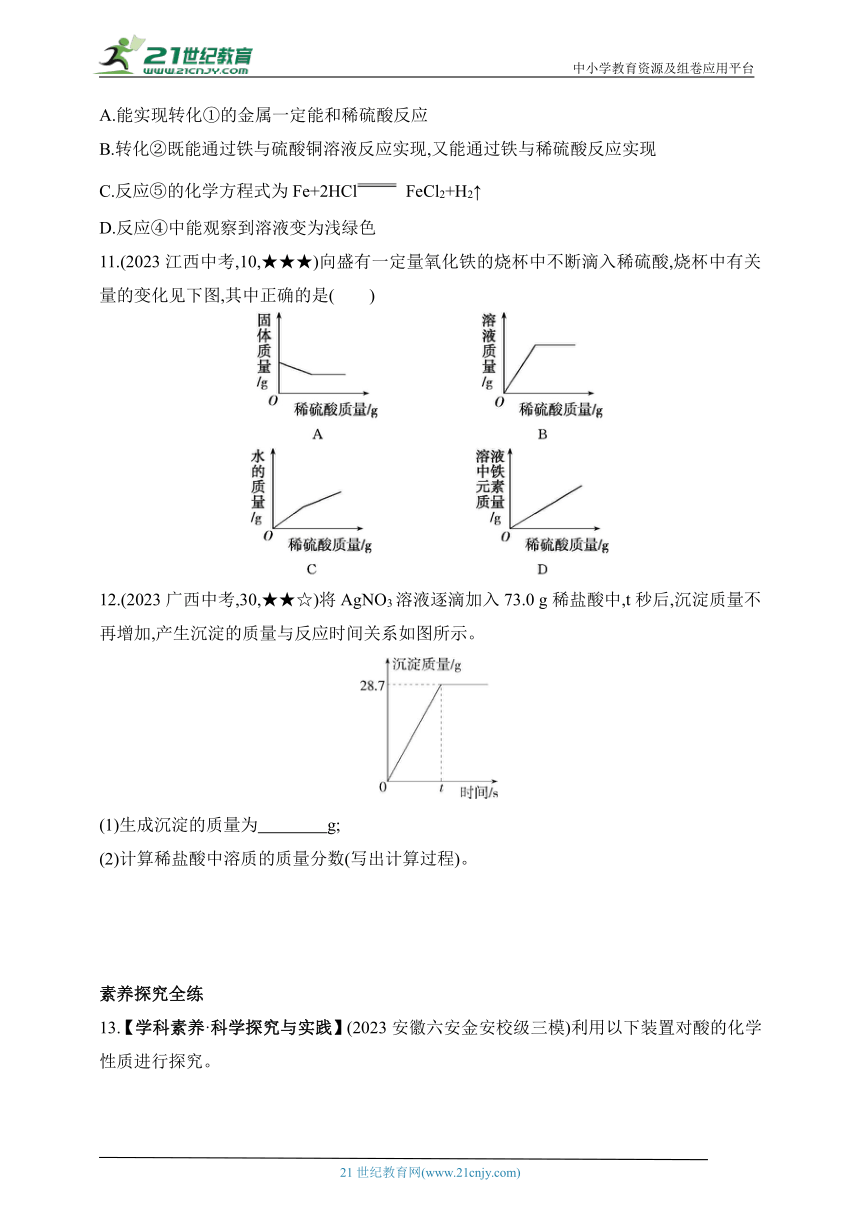
中小学教育资源及组卷应用平台
2024科粤版化学九年级下学期
第八章 常见的酸、碱、盐
8.2 常见的酸和碱
第1课时 常见的酸 酸的化学性质
基础过关全练
知识点1 常见的酸、浓酸的特性
1.(2023广西河池宜州二模)化学实验员在对实验室里的药品进行定期整理时,发现有两瓶浓盐酸和浓硫酸忘记塞上瓶塞了,则这两瓶试剂都发生的变化是( )
A.溶液的质量减小 B.瓶口会冒出白烟
C.溶质的质量分数减小 D.颜色发生改变
2.(2021广东广州越秀二模)HCl的水溶液俗称盐酸。下列关于HCl的说法正确的是( )
A.组成:HCl气体由H+、Cl-构成
B.性质:将HCl气体通入紫色石蕊溶液中,石蕊溶液变蓝
C.用途:浓盐酸常用作干燥剂
D.生产:工业上可用氯化钠来生产盐酸
知识点2 稀酸的化学性质
3.下列物质中,能与稀硫酸反应的是( )
A.NaCl B.CuO C.Cu D.CO2
4.(2023北京顺义一模)过量的氧化铁与稀硫酸反应后溶液的颜色为( )
A.黄色 B.蓝色 C.红色 D.浅绿色
5.下图表示化学反应中溶液的颜色变化。下列叙述错误的是( )
A.若X是稀硫酸,a可能是紫色石蕊溶液
B.若X是稀硫酸,b可能是氧化物
C.若X是稀盐酸,c不可能是单质
D.若X是稀盐酸,蓝色溶液一定是氯化铜溶液
6.【教材变式·P232实验】归纳是学习化学的重要方法,小红在复习盐酸的性质时,归纳出盐酸的部分化学性质,如图所示,连线表示相互反应。
(1)若想验证性质②,得到浅绿色溶液,选用的单质是 (填化学式)。
(2)性质③决定了盐酸可用于除铁锈,将表面生锈的铁钉投入少量稀盐酸中,观察到的现象是 ,发生反应的化学方程式为 。
(3)为了验证性质④,选用碳酸钙,反应的化学方程式为 。
能力提升全练
7.(2023湖南郴州中考,11,★☆☆)下列关于硫酸的说法错误的是( )
A.浓硫酸有强烈的腐蚀性
B.稀释浓硫酸时,应将水注入浓硫酸中,并用玻璃棒搅拌
C.稀硫酸可用来除铁锈
D.浓硫酸有吸水性,可作干燥剂
8.(2023山东滨州中考,12,★☆☆)下列有关实验现象的描述,正确的是( )
A.打开盛浓硫酸的试剂瓶,瓶口会形成白雾
B.铁与稀硫酸反应时有气泡产生,形成黄色溶液
C.将铜片放入稀硫酸中,铜片逐渐消失,形成蓝色溶液
D.用稀硫酸除铁锈时,铁锈逐渐溶解,形成黄色溶液
9.(2021广西南宁中考,15,★☆☆)下列有关硫酸的认识或做法,正确的是( )
A.组成:硫酸溶液中H+和S的数目相同
B.性质:能与CO2、SO2等非金属氧化物反应
C.用途:用于生产化肥、农药、火药、染料等
D.生产:含硫酸的工业废水,用CaCl2处理后直接排放
10.(2023宁夏银川兴庆一模改编,20,★★☆)请结合下图分析,下列说法不正确的是( )
A.能实现转化①的金属一定能和稀硫酸反应
B.转化②既能通过铁与硫酸铜溶液反应实现,又能通过铁与稀硫酸反应实现
C.反应⑤的化学方程式为Fe+2HCl FeCl2+H2↑
D.反应④中能观察到溶液变为浅绿色
11.(2023江西中考,10,★★★)向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,烧杯中有关量的变化见下图,其中正确的是( )
12.(2023广西中考,30,★★☆)将AgNO3溶液逐滴加入73.0 g稀盐酸中,t秒后,沉淀质量不再增加,产生沉淀的质量与反应时间关系如图所示。
(1)生成沉淀的质量为 g;
(2)计算稀盐酸中溶质的质量分数(写出计算过程)。
素养探究全练
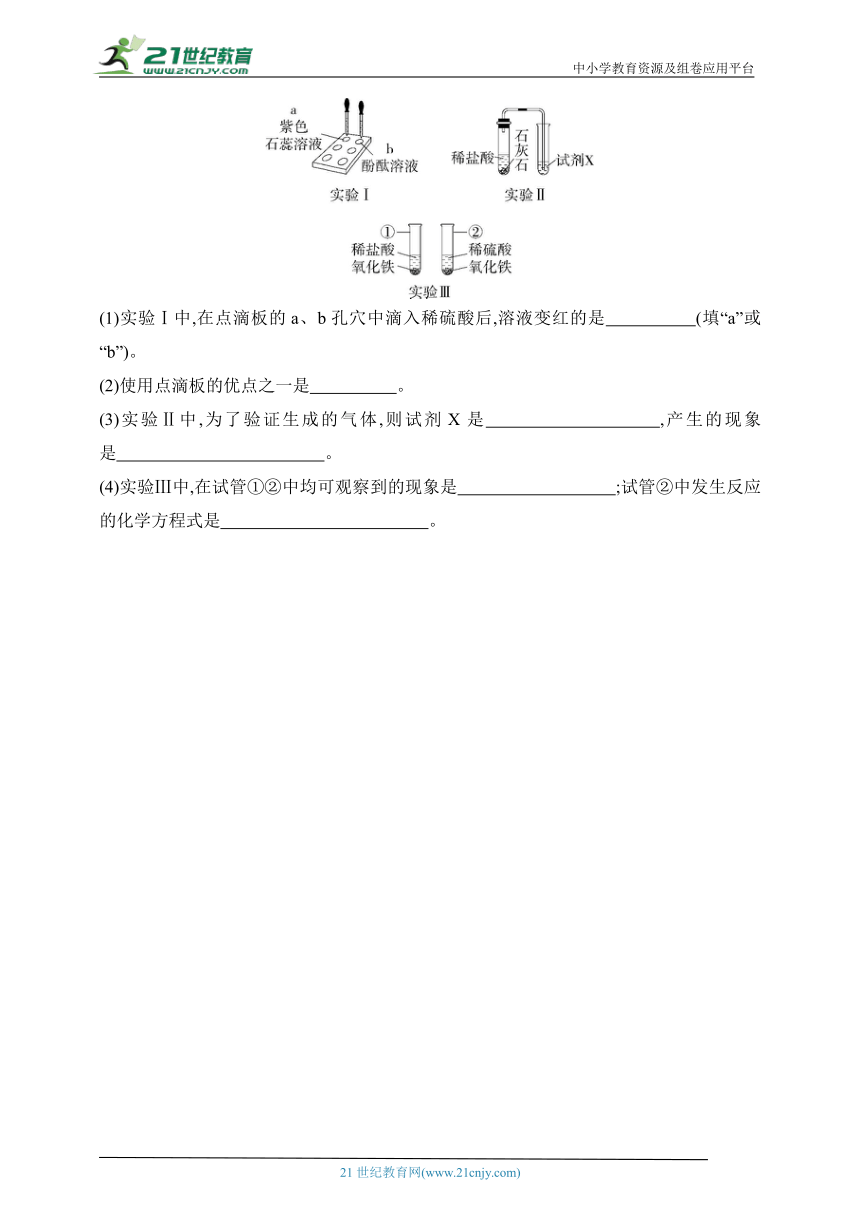
13.【学科素养·科学探究与实践】(2023安徽六安金安校级三模)利用以下装置对酸的化学性质进行探究。
(1)实验Ⅰ中,在点滴板的a、b孔穴中滴入稀硫酸后,溶液变红的是 (填“a”或“b”)。
(2)使用点滴板的优点之一是 。
(3)实验Ⅱ中,为了验证生成的气体,则试剂X是 ,产生的现象是 。
(4)实验Ⅲ中,在试管①②中均可观察到的现象是 ;试管②中发生反应的化学方程式是 。
答案全解全析
基础过关全练
1.C 浓盐酸具有挥发性,露置在空气中,瓶口会冒出白雾,溶质质量减小,溶剂质量不变,溶质质量分数减小;浓硫酸具有吸水性,露置在空气中,溶质质量不变,溶剂质量增大,溶质质量分数减小。
2.D 氯化氢气体是由氯化氢分子构成的,A错误;将HCl气体通入紫色石蕊溶液中,HCl气体溶于水形成盐酸,使石蕊溶液变红,B错误;浓盐酸不具有吸水性,不能用作干燥剂,C错误;工业上可用氯化钠来生产盐酸,D正确。
3.B 酸能和金属氧化物反应生成盐和水,氧化铜和稀硫酸反应生成硫酸铜和水。
4.A 氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁溶液显黄色。
5.C 紫色石蕊溶液遇酸性溶液变红,若X是稀硫酸,a可能是紫色石蕊溶液,A正确;若X是稀硫酸,氧化铁能与稀硫酸反应生成硫酸铁和水,硫酸铁溶液呈黄色,b可能是氧化物,B正确;铁能与稀盐酸反应生成氯化亚铁和氢气,氯化亚铁溶液呈浅绿色,若X是稀盐酸,c可能是单质,C错误;含铜离子的溶液显蓝色,若X是稀盐酸,蓝色溶液一定是氯化铜溶液,D正确。
6.(1)Fe (2)铁锈逐渐溶解,溶液变为黄色 Fe2O3+6HCl 2FeCl3+3H2O (3)CaCO3+2HCl CaCl2+H2O+CO2↑
解析 (1)铁与盐酸反应生成氯化亚铁和氢气,得到浅绿色溶液。(2)铁锈的主要成分氧化铁与盐酸反应生成氯化铁和水,会观察到铁锈逐渐溶解,溶液变为黄色。(3)盐酸与碳酸钙反应生成氯化钙、水和二氧化碳。
能力提升全练
7.B 稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,一定不能把水注入浓硫酸中。
8.D 打开盛浓硫酸的试剂瓶,瓶口上方无明显现象,A错误;铁与稀硫酸反应生成硫酸亚铁和氢气,有气泡产生,形成浅绿色溶液,B错误;将铜片放入稀硫酸中,无明显现象,C错误;用稀硫酸除铁锈时,铁锈的主要成分氧化铁能与硫酸反应生成硫酸铁和水,铁锈逐渐溶解,形成黄色溶液,D正确。
9.C 硫酸溶液中H+和S的数目之比是2∶1,A错误;硫酸不能与CO2、SO2等非金属氧化物反应,B错误;硫酸可用于生产化肥、农药、火药、染料等,C正确;硫酸不能与氯化钙反应,含硫酸的工业废水应用氢氧化钙处理达标后排放,D错误。
10.D 能实现转化①的金属的活动性比铁强,一定能和稀硫酸反应;铁和硫酸铜溶液反应能得到硫酸亚铁溶液和铜,铁和稀硫酸反应得到硫酸亚铁溶液和氢气;铁和稀盐酸反应生成氯化亚铁和氢气;稀盐酸和氧化铁反应生成氯化铁和水,得到的溶液呈黄色。
11.C 向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,氧化铁和稀硫酸反应生成硫酸铁和水,随着反应的进行,固体的质量逐渐减小,至氧化铁完全反应,固体的质量减小为0,A错误;向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,溶液的质量逐渐增大,至氧化铁完全反应,继续加入稀硫酸,溶液的质量继续增大,但第二个过程中溶液质量增大的幅度小于第一个过程,B错误;随着反应的进行,水的质量逐渐增大,至氧化铁完全反应,继续加入稀硫酸,水的质量始终在增大,由于氧化铁和稀硫酸反应有水生成,则第二个过程中水质量增大的幅度小于第一个过程,C正确;随着反应的进行,溶液中铁元素的质量逐渐增大,至氧化铁完全反应,不再发生改变,D错误。
12.(1)28.7
(2)解:设参加反应的HCl的质量为x。
AgNO3+HCl AgCl↓+HNO3
36.5 143.5
x 28.7 g
=
x=7.3 g
稀盐酸中溶质的质量分数为×100%=10%
答:稀盐酸中溶质的质量分数为10%。
解析 (1)由题图可知,生成的氯化银的质量为28.7 g;(2)根据氯化银的质量和对应的化学方程式求算出参加反应的HCl的质量,进而求算出稀盐酸中溶质的质量分数。
素养探究全练
13.(1)a (2)节约药品(合理即可) (3)澄清石灰水 澄清石灰水变浑浊 (4)固体逐渐溶解、溶液变成黄色 Fe2O3+3H2SO4 Fe2(SO4)3+3H2O
解析 (1)实验Ⅰ中,在点滴板的a、b孔穴中滴入酸溶液后,溶液变红的是a,因为紫色石蕊遇酸变红。(2)使用点滴板的优点是节约药品,现象明显。(3)实验Ⅱ中,石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,需验证的气体是二氧化碳,二氧化碳能与氢氧化钙反应生成碳酸钙白色沉淀和水,则试剂X可以是澄清石灰水。(4)氧化铁与稀盐酸反应生成氯化铁和水,氧化铁与稀硫酸反应生成硫酸铁和水,在试管①②中均可观察到固体逐渐溶解、溶液变成黄色。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024科粤版化学九年级下学期
第八章 常见的酸、碱、盐
8.2 常见的酸和碱
第1课时 常见的酸 酸的化学性质
基础过关全练
知识点1 常见的酸、浓酸的特性
1.(2023广西河池宜州二模)化学实验员在对实验室里的药品进行定期整理时,发现有两瓶浓盐酸和浓硫酸忘记塞上瓶塞了,则这两瓶试剂都发生的变化是( )
A.溶液的质量减小 B.瓶口会冒出白烟
C.溶质的质量分数减小 D.颜色发生改变
2.(2021广东广州越秀二模)HCl的水溶液俗称盐酸。下列关于HCl的说法正确的是( )
A.组成:HCl气体由H+、Cl-构成
B.性质:将HCl气体通入紫色石蕊溶液中,石蕊溶液变蓝
C.用途:浓盐酸常用作干燥剂
D.生产:工业上可用氯化钠来生产盐酸
知识点2 稀酸的化学性质
3.下列物质中,能与稀硫酸反应的是( )
A.NaCl B.CuO C.Cu D.CO2
4.(2023北京顺义一模)过量的氧化铁与稀硫酸反应后溶液的颜色为( )
A.黄色 B.蓝色 C.红色 D.浅绿色
5.下图表示化学反应中溶液的颜色变化。下列叙述错误的是( )
A.若X是稀硫酸,a可能是紫色石蕊溶液
B.若X是稀硫酸,b可能是氧化物
C.若X是稀盐酸,c不可能是单质
D.若X是稀盐酸,蓝色溶液一定是氯化铜溶液
6.【教材变式·P232实验】归纳是学习化学的重要方法,小红在复习盐酸的性质时,归纳出盐酸的部分化学性质,如图所示,连线表示相互反应。
(1)若想验证性质②,得到浅绿色溶液,选用的单质是 (填化学式)。
(2)性质③决定了盐酸可用于除铁锈,将表面生锈的铁钉投入少量稀盐酸中,观察到的现象是 ,发生反应的化学方程式为 。
(3)为了验证性质④,选用碳酸钙,反应的化学方程式为 。
能力提升全练
7.(2023湖南郴州中考,11,★☆☆)下列关于硫酸的说法错误的是( )
A.浓硫酸有强烈的腐蚀性
B.稀释浓硫酸时,应将水注入浓硫酸中,并用玻璃棒搅拌
C.稀硫酸可用来除铁锈
D.浓硫酸有吸水性,可作干燥剂
8.(2023山东滨州中考,12,★☆☆)下列有关实验现象的描述,正确的是( )
A.打开盛浓硫酸的试剂瓶,瓶口会形成白雾
B.铁与稀硫酸反应时有气泡产生,形成黄色溶液
C.将铜片放入稀硫酸中,铜片逐渐消失,形成蓝色溶液
D.用稀硫酸除铁锈时,铁锈逐渐溶解,形成黄色溶液
9.(2021广西南宁中考,15,★☆☆)下列有关硫酸的认识或做法,正确的是( )
A.组成:硫酸溶液中H+和S的数目相同
B.性质:能与CO2、SO2等非金属氧化物反应
C.用途:用于生产化肥、农药、火药、染料等
D.生产:含硫酸的工业废水,用CaCl2处理后直接排放
10.(2023宁夏银川兴庆一模改编,20,★★☆)请结合下图分析,下列说法不正确的是( )
A.能实现转化①的金属一定能和稀硫酸反应
B.转化②既能通过铁与硫酸铜溶液反应实现,又能通过铁与稀硫酸反应实现
C.反应⑤的化学方程式为Fe+2HCl FeCl2+H2↑
D.反应④中能观察到溶液变为浅绿色
11.(2023江西中考,10,★★★)向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,烧杯中有关量的变化见下图,其中正确的是( )
12.(2023广西中考,30,★★☆)将AgNO3溶液逐滴加入73.0 g稀盐酸中,t秒后,沉淀质量不再增加,产生沉淀的质量与反应时间关系如图所示。
(1)生成沉淀的质量为 g;
(2)计算稀盐酸中溶质的质量分数(写出计算过程)。
素养探究全练
13.【学科素养·科学探究与实践】(2023安徽六安金安校级三模)利用以下装置对酸的化学性质进行探究。
(1)实验Ⅰ中,在点滴板的a、b孔穴中滴入稀硫酸后,溶液变红的是 (填“a”或“b”)。
(2)使用点滴板的优点之一是 。
(3)实验Ⅱ中,为了验证生成的气体,则试剂X是 ,产生的现象是 。
(4)实验Ⅲ中,在试管①②中均可观察到的现象是 ;试管②中发生反应的化学方程式是 。
答案全解全析
基础过关全练
1.C 浓盐酸具有挥发性,露置在空气中,瓶口会冒出白雾,溶质质量减小,溶剂质量不变,溶质质量分数减小;浓硫酸具有吸水性,露置在空气中,溶质质量不变,溶剂质量增大,溶质质量分数减小。
2.D 氯化氢气体是由氯化氢分子构成的,A错误;将HCl气体通入紫色石蕊溶液中,HCl气体溶于水形成盐酸,使石蕊溶液变红,B错误;浓盐酸不具有吸水性,不能用作干燥剂,C错误;工业上可用氯化钠来生产盐酸,D正确。
3.B 酸能和金属氧化物反应生成盐和水,氧化铜和稀硫酸反应生成硫酸铜和水。
4.A 氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁溶液显黄色。
5.C 紫色石蕊溶液遇酸性溶液变红,若X是稀硫酸,a可能是紫色石蕊溶液,A正确;若X是稀硫酸,氧化铁能与稀硫酸反应生成硫酸铁和水,硫酸铁溶液呈黄色,b可能是氧化物,B正确;铁能与稀盐酸反应生成氯化亚铁和氢气,氯化亚铁溶液呈浅绿色,若X是稀盐酸,c可能是单质,C错误;含铜离子的溶液显蓝色,若X是稀盐酸,蓝色溶液一定是氯化铜溶液,D正确。
6.(1)Fe (2)铁锈逐渐溶解,溶液变为黄色 Fe2O3+6HCl 2FeCl3+3H2O (3)CaCO3+2HCl CaCl2+H2O+CO2↑
解析 (1)铁与盐酸反应生成氯化亚铁和氢气,得到浅绿色溶液。(2)铁锈的主要成分氧化铁与盐酸反应生成氯化铁和水,会观察到铁锈逐渐溶解,溶液变为黄色。(3)盐酸与碳酸钙反应生成氯化钙、水和二氧化碳。
能力提升全练
7.B 稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,一定不能把水注入浓硫酸中。
8.D 打开盛浓硫酸的试剂瓶,瓶口上方无明显现象,A错误;铁与稀硫酸反应生成硫酸亚铁和氢气,有气泡产生,形成浅绿色溶液,B错误;将铜片放入稀硫酸中,无明显现象,C错误;用稀硫酸除铁锈时,铁锈的主要成分氧化铁能与硫酸反应生成硫酸铁和水,铁锈逐渐溶解,形成黄色溶液,D正确。
9.C 硫酸溶液中H+和S的数目之比是2∶1,A错误;硫酸不能与CO2、SO2等非金属氧化物反应,B错误;硫酸可用于生产化肥、农药、火药、染料等,C正确;硫酸不能与氯化钙反应,含硫酸的工业废水应用氢氧化钙处理达标后排放,D错误。
10.D 能实现转化①的金属的活动性比铁强,一定能和稀硫酸反应;铁和硫酸铜溶液反应能得到硫酸亚铁溶液和铜,铁和稀硫酸反应得到硫酸亚铁溶液和氢气;铁和稀盐酸反应生成氯化亚铁和氢气;稀盐酸和氧化铁反应生成氯化铁和水,得到的溶液呈黄色。
11.C 向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,氧化铁和稀硫酸反应生成硫酸铁和水,随着反应的进行,固体的质量逐渐减小,至氧化铁完全反应,固体的质量减小为0,A错误;向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,溶液的质量逐渐增大,至氧化铁完全反应,继续加入稀硫酸,溶液的质量继续增大,但第二个过程中溶液质量增大的幅度小于第一个过程,B错误;随着反应的进行,水的质量逐渐增大,至氧化铁完全反应,继续加入稀硫酸,水的质量始终在增大,由于氧化铁和稀硫酸反应有水生成,则第二个过程中水质量增大的幅度小于第一个过程,C正确;随着反应的进行,溶液中铁元素的质量逐渐增大,至氧化铁完全反应,不再发生改变,D错误。
12.(1)28.7
(2)解:设参加反应的HCl的质量为x。
AgNO3+HCl AgCl↓+HNO3
36.5 143.5
x 28.7 g
=
x=7.3 g
稀盐酸中溶质的质量分数为×100%=10%
答:稀盐酸中溶质的质量分数为10%。
解析 (1)由题图可知,生成的氯化银的质量为28.7 g;(2)根据氯化银的质量和对应的化学方程式求算出参加反应的HCl的质量,进而求算出稀盐酸中溶质的质量分数。
素养探究全练
13.(1)a (2)节约药品(合理即可) (3)澄清石灰水 澄清石灰水变浑浊 (4)固体逐渐溶解、溶液变成黄色 Fe2O3+3H2SO4 Fe2(SO4)3+3H2O
解析 (1)实验Ⅰ中,在点滴板的a、b孔穴中滴入酸溶液后,溶液变红的是a,因为紫色石蕊遇酸变红。(2)使用点滴板的优点是节约药品,现象明显。(3)实验Ⅱ中,石灰石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,需验证的气体是二氧化碳,二氧化碳能与氢氧化钙反应生成碳酸钙白色沉淀和水,则试剂X可以是澄清石灰水。(4)氧化铁与稀盐酸反应生成氯化铁和水,氧化铁与稀硫酸反应生成硫酸铁和水,在试管①②中均可观察到固体逐渐溶解、溶液变成黄色。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
