6.2.2化学反应的限度 教案 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.2.2化学反应的限度 教案 2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 93.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-27 00:00:00 | ||
图片预览

文档简介
课题 化学反应的限度 教学设计
教科书 书 名:必修二教材 出版社:人民教育出版社 出版日期:2019年6月
教学目标
核心素养: 1.结合真实情境中的应用实例或通过实验探究,了解硝酸的主要性质,认识这些性质在生产中的应用和对生态环境的影响。 2.结合实例认识硝酸的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。 学习目标: 1. 结合实验探究,了解硝酸的主要性质——不稳定性和强氧化性,知道硝酸是重要的化工原料。
教学内容
教学重点: 硝酸的不稳定性和强氧化性。 教学难点: 硝酸的强氧化性。
教学过程
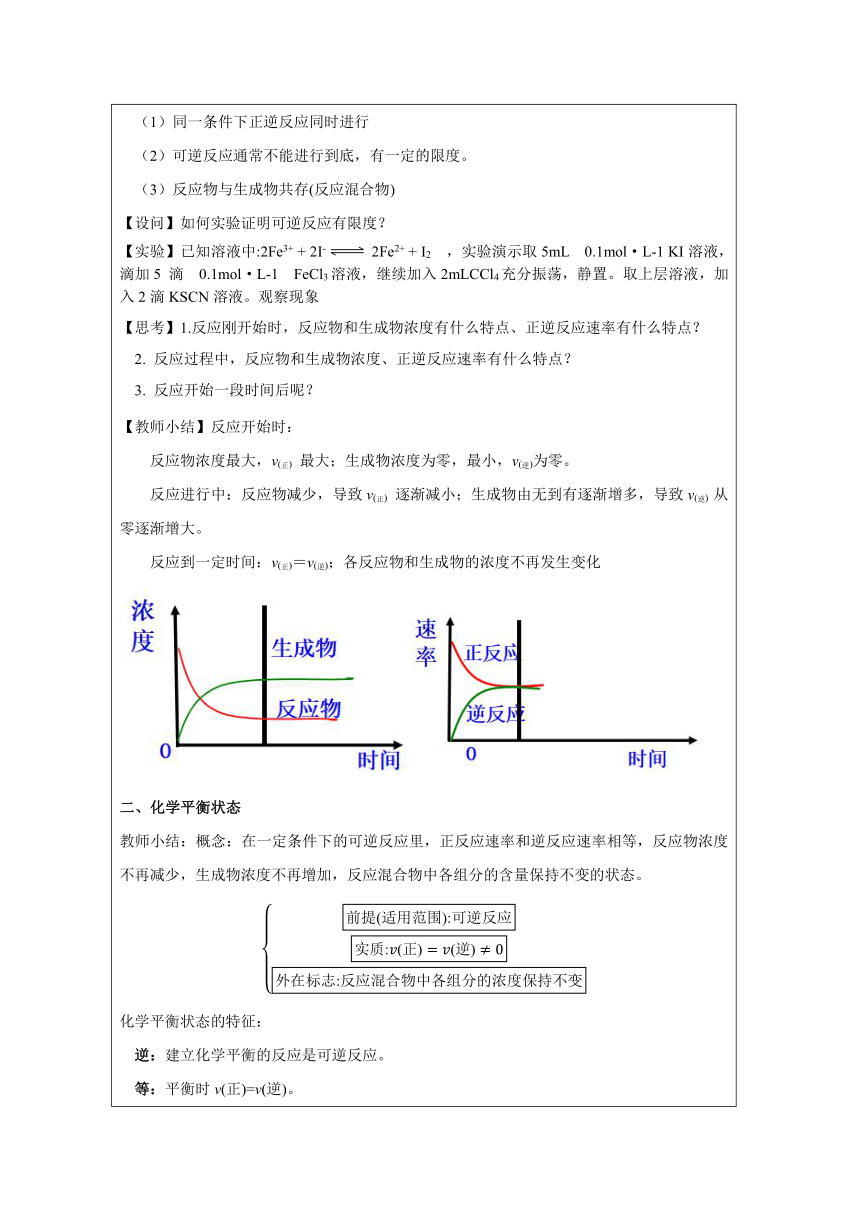
【学生活动】思考与交流:一个化学反应在实际进行时,反应物能否完全转变为生成物?阅读:P48 科学史话,从这一材料中,你得到什么启示? 炼铁高炉尾气之谜:炼制1t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。 【教师小结】:化学反应中有可逆反应,存在化学反应限度。 设计意图:加强学生能初步学会收集各种证据,对物质的性质及其变化提出可能的假设;基于证据进行分析 推理,证实或证伪假设;能解释证据与结论之间的关系,确定形成科学结论所需要的证据和 寻找证据的途径; 一、可逆反应 【教师小结】概念:在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。 典型的可逆反应有:2SO2+O2 2SO3 SO2 +H2OH2SO3 N2+3H22NH3 NH3 +H2O NH3 ·H2O 可逆反应的特点: 大部分化学反应都是可逆反应。完全反应是相对的,可逆反应是绝对的! (1)同一条件下正逆反应同时进行
(2)可逆反应通常不能进行到底,有一定的限度。
(3)反应物与生成物共存(反应混合物) 【设问】如何实验证明可逆反应有限度? 【实验】已知溶液中:2Fe3+ + 2I- 2Fe2+ + I2 ,实验演示取5mL 0.1mol·L-1 KI溶液,滴加5 滴 0.1mol·L-1 FeCl3溶液,继续加入2mLCCl4充分振荡,静置。取上层溶液,加入2滴KSCN溶液。观察现象 【思考】1.反应刚开始时,反应物和生成物浓度有什么特点、正逆反应速率有什么特点? 2. 反应过程中,反应物和生成物浓度、正逆反应速率有什么特点? 3. 反应开始一段时间后呢? 【教师小结】反应开始时: 反应物浓度最大,v(正) 最大;生成物浓度为零,最小,v(逆)为零。 反应进行中:反应物减少,导致v(正) 逐渐减小;生成物由无到有逐渐增多,导致v(逆) 从零逐渐增大。 反应到一定时间:v(正)=v(逆);各反应物和生成物的浓度不再发生变化 二、化学平衡状态 教师小结:概念:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物浓度不再减少,生成物浓度不再增加,反应混合物中各组分的含量保持不变的状态。 化学平衡状态的特征: 逆:建立化学平衡的反应是可逆反应。 等:平衡时v(正)=v(逆)。 动:化学平衡是一个动态平衡v(正)=v(逆)≠0。 定:达到平衡状态时,外界条件一定,反应速率一定,混合物中各组分的浓度一定,混合物中各组分的百分含量一定。 变:当外界条件改变时,平衡一般要发生改变。 同:不论从正反应开始还是从逆反应开始,在相同的反应条件下,能达到相同的平衡状态。 【教师提示】微观上判断:v(正)=v(逆),v(正)=v(逆)是指指定某物质(反应物或生成物)的消耗速率与生成速率相等。宏观上判断:各物质的浓度保持不变,各物质的百分含量不变。 设计意图:能认识化学现象与模型之间的联系,能运用多种模型来描述和解释化学现象,预测物质及其变化的可能结果;能依据物质及其变化的信息建构模型,建立解决复杂化 学问题的思维框架。 【设问】你觉得平衡状态特征中,哪些可以说明一个可逆反应达到了一定条件下的反应限度(化学平衡状态)? 三、化学平衡状态标志的判断 ⑴直接标志——“等” 同一物质:v消耗(A)=v生成(A);不同物质:v正(A):v逆(B)=a:b “一正一逆,符合比例” 【例1】一定条件下,对于可逆反应N2(g)+3H2(g) 2NH3(g),下列能表示反应达到化学平衡状态的是 (1)2v正(N2)=v逆(NH3) (2)单位时间内,有1mol N2消耗,同时有1mol N2生成 (3) 单位时间内,有3mol H2生成,同时有2mol NH3生成 (4) 单位时间内,有1mol N2消耗,同时有3mol H2生成 (5)1mol N三N 键断裂的同时有2mol N-H 键断裂 (2)间接标志——“定” 核心:一个量随反应一直变,后来保持不变。变量不变,即平衡 【例2】一定条件下,对于可逆反应N2(g)+3H2(g) 2NH3(g),下列能表示该反应达到化学平衡状态的是 (1)容器内氮气的物质的量不再改变 (2) (3)容器内颜色不再改变 (4)固定容器恒容条件下,容器内压强不再改变 (5)固定容器恒容条件下,容器内气体密度不再改变 【课堂小结】 【作业】完成课本49-50页 第4、5、6 题
备注:教学设计应至少含教学目标、教学内容、教学过程等三个部分,如有其它内容,可自行补充增加
教科书 书 名:必修二教材 出版社:人民教育出版社 出版日期:2019年6月
教学目标
核心素养: 1.结合真实情境中的应用实例或通过实验探究,了解硝酸的主要性质,认识这些性质在生产中的应用和对生态环境的影响。 2.结合实例认识硝酸的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在促进社会文明进步、自然资源综合利用和环境保护中的重要价值。 学习目标: 1. 结合实验探究,了解硝酸的主要性质——不稳定性和强氧化性,知道硝酸是重要的化工原料。
教学内容
教学重点: 硝酸的不稳定性和强氧化性。 教学难点: 硝酸的强氧化性。
教学过程
【学生活动】思考与交流:一个化学反应在实际进行时,反应物能否完全转变为生成物?阅读:P48 科学史话,从这一材料中,你得到什么启示? 炼铁高炉尾气之谜:炼制1t生铁所需要的焦炭的实际用量,远高于按照化学方程式计算所需用量,且从高炉炉顶出来的气体中含有没有利用的CO气体。 【教师小结】:化学反应中有可逆反应,存在化学反应限度。 设计意图:加强学生能初步学会收集各种证据,对物质的性质及其变化提出可能的假设;基于证据进行分析 推理,证实或证伪假设;能解释证据与结论之间的关系,确定形成科学结论所需要的证据和 寻找证据的途径; 一、可逆反应 【教师小结】概念:在同一条件下既能向正反应方向进行,又能向逆反应方向进行的反应。 典型的可逆反应有:2SO2+O2 2SO3 SO2 +H2OH2SO3 N2+3H22NH3 NH3 +H2O NH3 ·H2O 可逆反应的特点: 大部分化学反应都是可逆反应。完全反应是相对的,可逆反应是绝对的! (1)同一条件下正逆反应同时进行
(2)可逆反应通常不能进行到底,有一定的限度。
(3)反应物与生成物共存(反应混合物) 【设问】如何实验证明可逆反应有限度? 【实验】已知溶液中:2Fe3+ + 2I- 2Fe2+ + I2 ,实验演示取5mL 0.1mol·L-1 KI溶液,滴加5 滴 0.1mol·L-1 FeCl3溶液,继续加入2mLCCl4充分振荡,静置。取上层溶液,加入2滴KSCN溶液。观察现象 【思考】1.反应刚开始时,反应物和生成物浓度有什么特点、正逆反应速率有什么特点? 2. 反应过程中,反应物和生成物浓度、正逆反应速率有什么特点? 3. 反应开始一段时间后呢? 【教师小结】反应开始时: 反应物浓度最大,v(正) 最大;生成物浓度为零,最小,v(逆)为零。 反应进行中:反应物减少,导致v(正) 逐渐减小;生成物由无到有逐渐增多,导致v(逆) 从零逐渐增大。 反应到一定时间:v(正)=v(逆);各反应物和生成物的浓度不再发生变化 二、化学平衡状态 教师小结:概念:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物浓度不再减少,生成物浓度不再增加,反应混合物中各组分的含量保持不变的状态。 化学平衡状态的特征: 逆:建立化学平衡的反应是可逆反应。 等:平衡时v(正)=v(逆)。 动:化学平衡是一个动态平衡v(正)=v(逆)≠0。 定:达到平衡状态时,外界条件一定,反应速率一定,混合物中各组分的浓度一定,混合物中各组分的百分含量一定。 变:当外界条件改变时,平衡一般要发生改变。 同:不论从正反应开始还是从逆反应开始,在相同的反应条件下,能达到相同的平衡状态。 【教师提示】微观上判断:v(正)=v(逆),v(正)=v(逆)是指指定某物质(反应物或生成物)的消耗速率与生成速率相等。宏观上判断:各物质的浓度保持不变,各物质的百分含量不变。 设计意图:能认识化学现象与模型之间的联系,能运用多种模型来描述和解释化学现象,预测物质及其变化的可能结果;能依据物质及其变化的信息建构模型,建立解决复杂化 学问题的思维框架。 【设问】你觉得平衡状态特征中,哪些可以说明一个可逆反应达到了一定条件下的反应限度(化学平衡状态)? 三、化学平衡状态标志的判断 ⑴直接标志——“等” 同一物质:v消耗(A)=v生成(A);不同物质:v正(A):v逆(B)=a:b “一正一逆,符合比例” 【例1】一定条件下,对于可逆反应N2(g)+3H2(g) 2NH3(g),下列能表示反应达到化学平衡状态的是 (1)2v正(N2)=v逆(NH3) (2)单位时间内,有1mol N2消耗,同时有1mol N2生成 (3) 单位时间内,有3mol H2生成,同时有2mol NH3生成 (4) 单位时间内,有1mol N2消耗,同时有3mol H2生成 (5)1mol N三N 键断裂的同时有2mol N-H 键断裂 (2)间接标志——“定” 核心:一个量随反应一直变,后来保持不变。变量不变,即平衡 【例2】一定条件下,对于可逆反应N2(g)+3H2(g) 2NH3(g),下列能表示该反应达到化学平衡状态的是 (1)容器内氮气的物质的量不再改变 (2) (3)容器内颜色不再改变 (4)固定容器恒容条件下,容器内压强不再改变 (5)固定容器恒容条件下,容器内气体密度不再改变 【课堂小结】 【作业】完成课本49-50页 第4、5、6 题
备注:教学设计应至少含教学目标、教学内容、教学过程等三个部分,如有其它内容,可自行补充增加
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
