3.4 离子反应 同步练习题 (含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 3.4 离子反应 同步练习题 (含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 443.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-27 21:11:02 | ||
图片预览




文档简介
3.4 离子反应 同步练习题
一、选择题
1.下列各组有机物只用一种试剂无法鉴别的是
A.乙醇、苯、四氯化碳 B.苯、苯酚、己烯
C.苯、甲苯、环己烷 D.甲酸、乙醛、乙酸
2.下列各组离子在指定溶液中一定能大量共存的是
A.氨水溶液中:、、、
B.0.1KI溶液中:、、、
C.能使甲基橙变红的溶液中:、、、
D.0.1溶液中:、、、
3.下列浓度为的溶液中分别滴加少量稀硫酸后不能稳定存在的是
A. B. C. D.
4.下列方程式与所给事实不相符的是
A.CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s)
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe-3e-=Fe3+
C.向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜:CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O
D.用作潜水艇供氧剂:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2
5.下列反应方程式书写错误的是
A.制备
B.制备铁粉:
C.过氧化钠与反应:
D.碳酸氢钙溶液与少量NaOH反应:
6.下列离子方程式正确的是
A.的水解方程:
B.铜与稀硝酸反应:
C.向含的溶液中加入含的溶液:
D.溶液中吸收少量[已知::
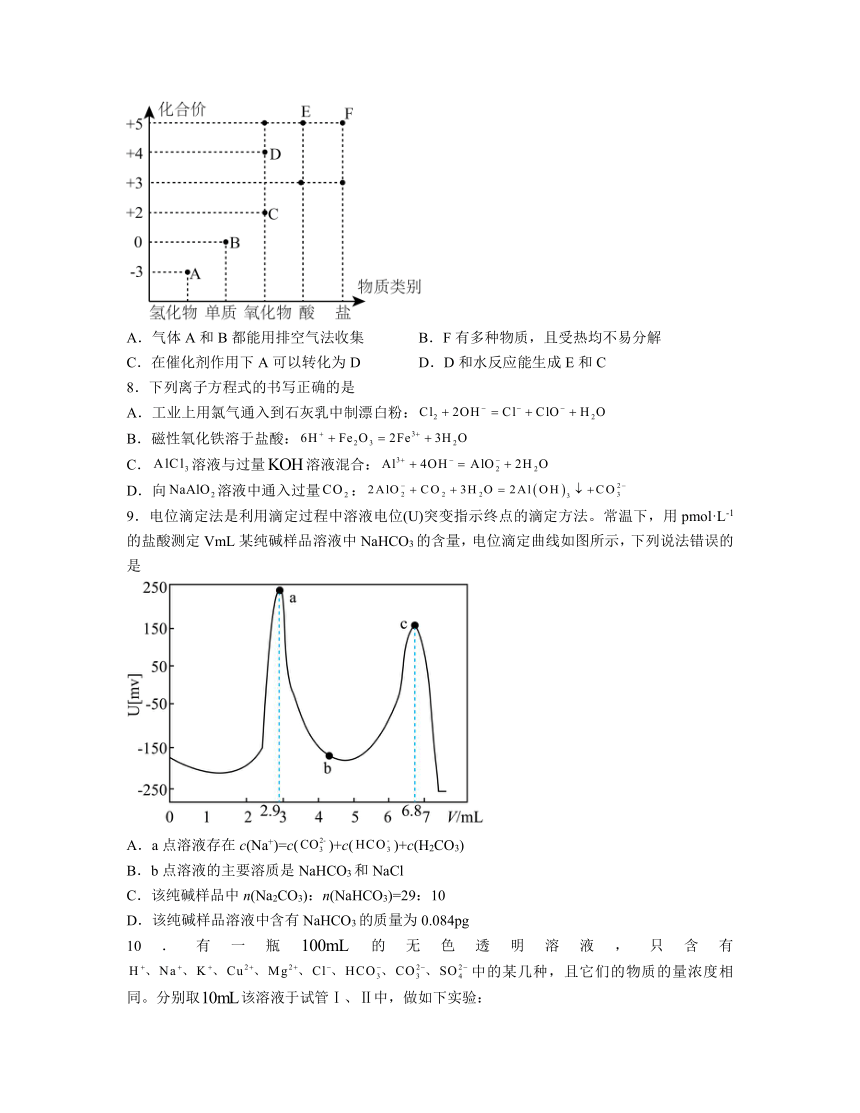
7.如图所示是某短周期元素的“价—类”二维图,其中E是强酸。下列说法正确的是
A.气体A和B都能用排空气法收集 B.F有多种物质,且受热均不易分解
C.在催化剂作用下A可以转化为D D.D和水反应能生成E和C
8.下列离子方程式的书写正确的是
A.工业上用氯气通入到石灰乳中制漂白粉:
B.磁性氧化铁溶于盐酸:
C.溶液与过量溶液混合:
D.向溶液中通入过量:
9.电位滴定法是利用滴定过程中溶液电位(U)突变指示终点的滴定方法。常温下,用pmol·L-1的盐酸测定VmL某纯碱样品溶液中NaHCO3的含量,电位滴定曲线如图所示,下列说法错误的是
A.a点溶液存在c(Na+)=c()+c()+c(H2CO3)
B.b点溶液的主要溶质是NaHCO3和NaCl
C.该纯碱样品中n(Na2CO3):n(NaHCO3)=29:10
D.该纯碱样品溶液中含有NaHCO3的质量为0.084pg
10.有一瓶的无色透明溶液,只含有中的某几种,且它们的物质的量浓度相同。分别取该溶液于试管Ⅰ、Ⅱ中,做如下实验:
①实验一:试管Ⅰ中,加入一小块去除表面氧化膜的金属,有气泡产生;
②实验二:试管Ⅱ中,加入足量的溶液,产生白色沉淀。
下列说法错误的是
A.原溶液中可能含有 B.原溶液中一定含有
C.产生的白色沉淀为 D.溶液中不可能含有和
二、填空题
11.有如下物质:①Na;②NaOH溶液;③固体;④;⑤酒精();⑥蒸馏水;⑦溶液;⑧晶体。
(1)以上物质中,属于电解质的是 (填序号,右同),属于非电解质的是 。
(2)将②与⑦进行混合,该过程中发生反应的离子方程式是 。
(3)向氢氧化钡溶液中加入物质③的溶液至恰好沉淀完全,其离子方程式为 。
(4)向100mL②溶液中通入一定量的④,然后向该溶液中逐滴加入2的盐酸,所加盐酸的体积与产生的体积(标准状况)关系如图所示:
回答下列问题:
①0A段发生反应的离子方程式为 。
②m= mL。
③原②溶液的物质的量浓度为 。
(5)将0.1mol⑤在足量氧气中充分燃烧,再将全部产物缓慢通过足量的固体,固体质量增加 g。
12.酸碱中和滴定指示剂的选择
(1)原理:由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
(2)酸碱指示剂法(只能测定溶液的pH范围)
指示剂 变色范围(颜色与pH的关系)
石蕊 <5.0 色 5.0~8.0紫色 >8.0 色
酚酞 <8.2 色 8.2~10.0浅红色 >10.0 色
甲基橙 <3.1 色 3.1~4.4橙色 >4.4 色
13.Ⅰ.某学生用的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
②量取20.00 mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是 (填编号),该步骤错误操作会导致测定结果 (填“偏大”“偏小”或“无影响”)。
(2)下列操作会导致上述所测盐酸溶液的浓度偏高的是_______(填正确答案标号)。
A.滴定达到终点时,俯视滴定管内液面读数
B.碱式滴定管尖嘴部分开始有气泡,滴定后消失
C.锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
Ⅱ.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体()进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体()中的x值。
通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性溶液进行滴定:
学习小组的同学设计了滴定的方法测定x值
①称取1.260g纯草酸晶体,将其制成100.00 mL水溶液为待测液
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀
③用浓度为的标准溶液进行滴定,达到终点记录消耗体积。
(3)滴定时,将酸性标准液装在如图中的 (填“甲”或“乙”)滴定管中。
(4)滴定时,左手操作滴定管,右手轻轻摇动锥形瓶,眼睛注视 。
(5)本实验滴定达到终点的标志是 。
(6)为了提高实验的准确性,学习小组共进行3次实验,记录数据如下表:
待测液/mL
25.00 0.00 9.95
25.00 1.05 11.10
25.00 0.50 13.50
通过上述数据,可知消耗的溶液体积为 mL,求得x= 。
讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性溶液因久置而导致浓度变小,则由此测得的x值会 。
14.室温下,取50mL H+浓度为0.20 mol/L的盐酸和硫酸的混合溶液,加入50mL Ba(OH)2溶液充分反应,得到沉淀0.233g,反应后溶液的pH值为12(假设反应后溶液的总体积为100mL)。请计算:
(1)原混合酸溶液中H+的物质的量为 mol。
(2)原混合酸溶液中HCl的物质的量浓度为 mol/L。
(3)加入的Ba(OH)2溶液的物质的量浓度为 mol/L。
15.离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在 (填编号)。
①单质②氧化物③电解质④盐⑤化合物
(2)将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:K+、Mg2+、Fe3+、Ba2+、、OH-、和Cl-,取该溶液进行如下实验:
Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许溶液滴入BaCl2溶液,无白色沉淀产生。
Ⅲ.另取少许溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。
Ⅳ.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是 ;肯定存在的离子是 。
②如溶液中各种离子的浓度相等,确定溶液中 (填“有”或“无”)K+,判断依据是 。
16.某学生用标准溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
A.用酸式滴定管取稀,注入锥形瓶中,加入酚酞
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏永洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去NaOH溶液15.00mL
(1)在G操作中如何确定终点 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”、“偏大”或“恰好合适”)
(3)配制100mL NaOH标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是 。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)。
(5)计算待测硫酸溶液的物质的量浓度 。
【参考答案】
一、选择题
1.C
解析:A.用水就能鉴别,乙醇溶于水,苯和四氯化碳不溶于水,但苯的密度比水小,四氯化碳的密度比水大,A不符合题意;
B.用溴水能进行鉴别,苯能使溴水层褪色,苯酚与溴水反应生成白色沉淀,己烯能使溴水褪色,B不符合题意;
C.无法用一种试剂将三种物质鉴别开,C符合题意;
D.用新制的氢氧化铜悬浊液进行鉴别,乙酸能使悬浊液变澄清,甲酸也能使之变澄清,但加热后出现红色沉淀,乙醛与之加热后出现红色沉淀,D不符合题意;
故选C。
2.B
解析:A.氨水溶液呈碱性,Cu2+和OH—反应生成Cu(OH)2沉淀而不能大量共存,故A错误;
B.这几种离子之间不反应且和KI不反应,所以能大量共存,故B正确;
C.使甲基橙变红色的溶液呈酸性,H+可以与反应生成S、SO2而不能大量共存,故C错误;
D.、Al3+相互促进发生双水解,所以不能大量共存,故D错误;
故选:B。
3.C
解析:A.和稀硫酸不反应,所以硫酸铁溶液中加入少量稀硫酸,硫酸铁能稳定存在,故A不选;
B.和稀硫酸不反应,所以硝酸铵溶液中加入少量稀硫酸,硝酸铵能稳定存在,故B不选;
C.为和稀硫酸反应生成微溶物,且、在酸性条件下生成,所以溶液加入稀硫酸后不能稳定存在,故C选;
D.和稀硫酸不反应,所以硫酸铜溶液中加入少量稀硫酸,硫酸铜能稳定存在,故D不选;
故选:C。
4.B
解析:A.由于Ksp(CuS)< Ksp(ZnS),所以CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS),离子方程式为:Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s),故A正确;
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe-2e-=Fe2+,故B错误;
C.向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜,反应方程式为:CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O,故C正确;
D.能吸收二氧化碳和水,并反应生成呼吸所需的氧气,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2,故D正确;
故答案选B。
5.B
解析:略
6.D
解析:A.硫氢化钠中硫氢根离子水解可逆,A错误;
B.铜和稀硝酸反应生成一氧化氮,B错误;
C.含的溶液中加入含的溶液反应生成1mol氢氧化铝和1.5mol硫酸钡和0.5mol硫酸铵,C错误;
D.根据电离平衡常数分析,碳酸钠溶液中吸收少量氯气,反应生成碳酸氢钠和氯化钠和次氯酸钠,D正确;
故选D。
7.D
【分析】由某短周期元素“价—类”二维图可知,该元素最高化合价为+5、最低化合价为-3,且其中E是强酸,则该元素为氮元素;
解析:A.气体B为氮气,密度接近空气密度,不能用排空气法收集,A错误;
B.F为硝酸盐,例如硝酸银等受热易分解,B错误;
C.AD分别为氨气、二氧化氮或四氧化二氮,在催化剂作用下氨气可以转化为一氧化氮,不直接生成二氧化氮,C错误;
D.D为二氧化氮或四氧化二氮,和水反应能生成硝酸和C一氧化氮,D正确;
故选D。
8.C
解析:A.工业上将Cl2通入石灰乳中制漂白粉:,故A错误;
B.磁性氧化铁为,溶于盐酸离子方程式为,故B错误;
C.溶液与过量溶液混合,生成偏铝酸钠,离子方程式为,故C正确;
D.向溶液中通入过量,离子方程式为,故D错误;
故答案选C
9.A
【分析】由图可知,a点为碳酸钠溶液与盐酸恰好反应生成碳酸氢钠和氯化钠,反应的方程式为Na2CO3+HCl=NaCl+NaHCO3,c点为碳酸氢钠溶液与盐酸恰好反应生成氯化钠、二氧化碳和水,反应的方程式为NaHCO3+HCl=NaCl+CO2↑+H2O。
解析:A.由分析可知,a点所得溶液为碳酸氢钠和氯化钠混合溶液,由物料守恒可知,溶液中c(Na+)>c()+c()+c(H2CO3),故A错误;
B.由分析可知,a点为碳酸钠溶液与盐酸恰好反应生成碳酸氢钠和氯化钠,则b点发生的反应为碳酸氢钠溶液部分与盐酸反应生成氯化钠、二氧化碳和水,反应所得溶液的溶质为碳酸氢钠和氯化钠,故B正确;
C.由图可知,a点碳酸钠溶液与盐酸恰好反应时,消耗盐酸的体积为2.9mL,则纯碱样品中碳酸钠的物质的量为pmol/L×2.9×10-3L=2.9p×10-3mol,c点为碳酸氢钠溶液与盐酸恰好反应消耗盐酸的体积为6.8mL,则样品中碳酸氢钠的物质的量为pmol/L×6.8×10-3L—2.9p×10-3mol=1.0p×10-3mol,样品中碳酸钠和碳酸氢钠的物质的量比为2.9p×10-3mol:1.0p×10-3mol=29:10,故C正确;
D.由图可知,a点碳酸钠溶液与盐酸恰好反应时,消耗盐酸的体积为2.9mL,则纯碱样品中碳酸钠的物质的量为pmol/L×2.9×10-3L=2.9p×10-3mol,c点为碳酸氢钠溶液与盐酸恰好反应消耗盐酸的体积为6.8mL,则样品中碳酸氢钠的物质的量为pmol/L×6.8×10-3L—2.9p×10-3mol=1.0p×10-3mol,样品中碳酸氢钠的质量为1.0p×10-3mol×84g/mol=0.084pg,故D正确;
故选A。
10.A
【分析】无色透明溶液,没有Cu2+,加入一小块去除表面氧化膜的金属Al,有气泡产生,溶液可以呈酸性也可以呈碱性,根据题意只能为酸性,一定有H+,则一定没有,加入足量的NaOH溶液,产生白色沉淀,一定有Mg2+,白色沉淀为,且各离子的物质的量浓度相同,根据溶液呈电中性,则溶液中一定还有,Na+、K+一定没有。
解析:A. Na+、K+一定没有,A错误;
B. 根据分析可知一定有,B正确;
C.根据分析可知白色沉淀为,C正确;
D.溶液呈酸性,一定没有,D正确;
故答案为:A。
二、填空题
11.(1) ③⑥⑧ ④⑤
(2)
(3)
(4) 、 896 0.9mol/L
(5)3.4
解析:(1)由电解质与非电解质概念可知,属于电解质的是③固体、⑥蒸馏水、⑧晶体;属于非电解质的是④、⑤酒精;
故答案为:③⑥⑧;④⑤。
(2)将NaOH溶液与进行混合,生成碳酸钠和水,该过程中发生的离子反应方程式是;
故答案为:。
(3)向氢氧化钡溶液中加入物质的溶液至恰好沉淀完全,硫酸氢钠完全反应,其离子方程式为:;
故答案为:。
(4)由图像可知,开始没有二氧化碳生成,是氢氧化钠与盐酸反应、碳酸钠与盐酸反应生成碳酸氢钠,0A段反应的离子方程式为:、;②结合图像可知,25~45mL发生碳酸氢钠与盐酸反应生成二氧化碳,此时消耗盐酸的物质的量为,依据方程式可知,此时产生二氧化碳的物质的量为0.04mol,则的体积(标准状况)为;③B点溶液为NaCl,根据元素守恒可知,;
故答案为:、;896;0.9mol/L。
(5)酒精完全燃烧的产物是和,,固体增加的质量相当于CO、的质量,根据元素守恒,固体增加的质量为;
故答案为:3.4。
12.红 蓝 无 红 红 黄
解析:石蕊遇pH<5.0的溶液显红色,pH:5.0~8.0时显紫色,pH>8.0显蓝色;
酚酞遇pH<8.2的溶液不变色,pH:8.2~10.0时显浅红色,pH>10.0显红色;
甲基橙遇pH<3.1的溶液显红色,pH:3.1~4.4时显橙色,pH>4.4时显黄色。
13.(1) ①; 偏大;
(2)BD
(3)甲;
(4)眼睛注视锥形瓶内颜色变化;
(5)滴加高锰酸钾溶液时,溶液将有无色变为紫色,且半分钟内不褪色,即达到滴定终点;
(6)10.00; 2; 偏大; 偏小;
解析:(1)根据碱式滴定管在装液前应用待装液进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入氢氧化钠溶液至“0”刻度线以上,碱式滴定管未用标准氢氧化钠溶液润洗就直接注入氢氧化钠溶液,标准液的浓度偏小,造成体积偏大,根据,偏大;
(2)A.滴定结束时,俯视计数,所用氢氧化钠溶液体积偏小,所测盐酸浓度偏小,A项错误;
B.滴定前有气泡,滴定结束无气泡,导致氢氧化钠溶液体积偏大,所以测得盐酸浓度偏大,B项正确;
C.锥形瓶蒸馏水洗净未干燥装入待测液无影响,C项错误;
D. 尖嘴处悬挂一滴溶液,造成消耗的标准体积偏大,会使测定结果偏高,D项正确;
答案选BD;
(3)因为高锰酸钾有强氧化性,会腐蚀橡胶管,故用酸式滴定管甲;
(4)滴定时,左手操作滴定管,右手轻轻摇动锥形瓶,眼睛注视锥形瓶内颜色变化;
(5)可利用高锰酸钾溶液自身的颜色作为指示剂判断滴定终点时,在滴加高锰酸钾溶液时,溶液将有无色变为紫色,且半分钟内不褪色,即达到滴定终点;
(6)三次实验中消耗标准液的体积分别是(mL)9.95,10.05,13.00,因此第三次实验误差大,舍去,消耗标准液的体积的平均值为10.00mL;根据方程式,可知,25mL待测液中含有草酸的物质的量是,100.00mL待测液中含有0.01mol草酸,0.01mol草酸的质量为0.9g,所以1.260g醇草酸晶体中水的物质的量为1.260g-0.9g=0.36g,其物质的量为0.02mol,则x=2;若滴定终点俯视滴定管读数,则所得消耗酸性高锰酸钾的体积偏小,由此草酸的物质的量偏小,则水的物质的量偏大,x偏大;若酸性高锰酸钾溶液因久置而导致浓度变小,则消耗其体积偏大,由此得到草酸的物质的量偏大,则水的物质的量偏小,x值偏小;
14.01 0.16 0.11
解析:(1)50mL H+浓度为0.2mol/L的盐酸和硫酸的混合溶液,根据公式可得,n(H+)=cV=0.2mol/L×0.05L=0.01mol;
(2)加入50mL Ba(OH)2溶液充分反应,得到沉淀0.233g,即生成0.001molBaSO4,则n()=0.001mol,硫酸电离出的n(H+)=0.002mol,由(1)可知,混酸中n(H+)=0.01mol,因此由HCl电离出的n(H+)=0.01mol-0.002mol=0.008mol,则n(HCl)=0.008mol,根据公式可得,c(HCl)=;
(3)加入50mL Ba(OH)2溶液充分反应,Ba(OH)2~2H+,原混合酸溶液中H+的物质的量为0.01mol,则参加反应的Ba(OH)2的物质的量为0.005mol;反应后溶液的pH值为12,则c(OH-)=0.01mol/L,n(OH-)=0.01mol/L×0.1L=0.001mol,即剩余Ba(OH)2的物质的量为0.001mol×=0.0005mol,因此反应前Ba(OH)2的物质的量为0.005mol+0.0005mol=0.0055mol,则加入的Ba(OH)2溶液的物质的量浓度为。
15.③⑤ Mg2+、Fe3+、、 Ba2+、OH-、Cl- 无 溶液中一定有Ba2+、Cl-、OH-,浓度相等时电荷守恒,所以无K+
解析:(1) 离子反应是由离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,则必须是电解质发生电离,故选③⑤;答案为:③⑤;
(2)①将两种化合物一起溶于水得到一种无色透明溶液,一定不含有颜色的Fe3+;
取少量溶液滴入紫色石蕊试液,溶液呈蓝色,说明溶液呈碱性,则存在OH-,与之反应的Mg2+一定没有,进一步说明没有Fe3+;
取少许溶液滴入BaCl2溶液,无白色沉淀产生,使用一定不含、;
另取少许溶液滴入AgNO3溶液,产生不溶于稀硝酸的白色沉淀,该沉淀只能是AgCl,说明有Cl-;
再取少许原溶液滴入H2SO4溶液,有白色沉淀产生,说明一定含有Ba2+,进一步说明不含,
综上所述,原溶液中肯定不存在的离子是Mg2+、Fe3+、、 ,肯定存在的离子是Ba2+、OH-、Cl-,不能确定是否含有K+,
故答案为:Mg2+、Fe3+、、;Ba2+、OH-、Cl-;
②溶液中一定有Ba2+、Cl-、OH-,离子浓度相等时,正负电荷数相等,所以无K+,
故答案为:无;溶液中一定有Ba2+、Cl-、OH-,浓度相等时电荷守恒,所以无K+。
【点睛】考查了电解质、非电解质的判断以及常见离子的检验方法,注意把握元素化合物的性质以及反应的现象,同一溶液中连续加试剂时,要注意现加试剂对后续检验的影响。
16.(1)无色变为浅红色(或粉红色)且半分钟不褪去
(2)偏大
(3)100mL容量瓶、胶头滴管
(4)偏小
(5)
解析:(1)终点时现象是当溶液无色变为浅红色(或粉红色)且半分钟不褪去;
故答案为:无色变为浅红色(或粉红色)且半分钟不褪去;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏大;
故答案为:偏大;
(3)需要使用的仪器有:药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管、100mL容量瓶,必须使用到的玻璃仪器是为:100 mL容量瓶、烧杯、玻璃棒、胶头滴管;
故答案为:100mL容量瓶、胶头滴管;
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小,所以测定的硫酸的浓度偏小;
故答案为:偏小;
(5)滴定时消耗的氢氧化钠的物质的量为,
根据反应:,则:,所以100mL硫酸中物质的量为,则待测硫酸溶液的物质的量浓度;
故答案为:。
一、选择题
1.下列各组有机物只用一种试剂无法鉴别的是
A.乙醇、苯、四氯化碳 B.苯、苯酚、己烯
C.苯、甲苯、环己烷 D.甲酸、乙醛、乙酸
2.下列各组离子在指定溶液中一定能大量共存的是
A.氨水溶液中:、、、
B.0.1KI溶液中:、、、
C.能使甲基橙变红的溶液中:、、、
D.0.1溶液中:、、、
3.下列浓度为的溶液中分别滴加少量稀硫酸后不能稳定存在的是
A. B. C. D.
4.下列方程式与所给事实不相符的是
A.CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS):Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s)
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe-3e-=Fe3+
C.向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜:CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O
D.用作潜水艇供氧剂:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2
5.下列反应方程式书写错误的是
A.制备
B.制备铁粉:
C.过氧化钠与反应:
D.碳酸氢钙溶液与少量NaOH反应:
6.下列离子方程式正确的是
A.的水解方程:
B.铜与稀硝酸反应:
C.向含的溶液中加入含的溶液:
D.溶液中吸收少量[已知::
7.如图所示是某短周期元素的“价—类”二维图,其中E是强酸。下列说法正确的是
A.气体A和B都能用排空气法收集 B.F有多种物质,且受热均不易分解
C.在催化剂作用下A可以转化为D D.D和水反应能生成E和C
8.下列离子方程式的书写正确的是
A.工业上用氯气通入到石灰乳中制漂白粉:
B.磁性氧化铁溶于盐酸:
C.溶液与过量溶液混合:
D.向溶液中通入过量:
9.电位滴定法是利用滴定过程中溶液电位(U)突变指示终点的滴定方法。常温下,用pmol·L-1的盐酸测定VmL某纯碱样品溶液中NaHCO3的含量,电位滴定曲线如图所示,下列说法错误的是
A.a点溶液存在c(Na+)=c()+c()+c(H2CO3)
B.b点溶液的主要溶质是NaHCO3和NaCl
C.该纯碱样品中n(Na2CO3):n(NaHCO3)=29:10
D.该纯碱样品溶液中含有NaHCO3的质量为0.084pg
10.有一瓶的无色透明溶液,只含有中的某几种,且它们的物质的量浓度相同。分别取该溶液于试管Ⅰ、Ⅱ中,做如下实验:
①实验一:试管Ⅰ中,加入一小块去除表面氧化膜的金属,有气泡产生;
②实验二:试管Ⅱ中,加入足量的溶液,产生白色沉淀。
下列说法错误的是
A.原溶液中可能含有 B.原溶液中一定含有
C.产生的白色沉淀为 D.溶液中不可能含有和
二、填空题
11.有如下物质:①Na;②NaOH溶液;③固体;④;⑤酒精();⑥蒸馏水;⑦溶液;⑧晶体。
(1)以上物质中,属于电解质的是 (填序号,右同),属于非电解质的是 。
(2)将②与⑦进行混合,该过程中发生反应的离子方程式是 。
(3)向氢氧化钡溶液中加入物质③的溶液至恰好沉淀完全,其离子方程式为 。
(4)向100mL②溶液中通入一定量的④,然后向该溶液中逐滴加入2的盐酸,所加盐酸的体积与产生的体积(标准状况)关系如图所示:
回答下列问题:
①0A段发生反应的离子方程式为 。
②m= mL。
③原②溶液的物质的量浓度为 。
(5)将0.1mol⑤在足量氧气中充分燃烧,再将全部产物缓慢通过足量的固体,固体质量增加 g。
12.酸碱中和滴定指示剂的选择
(1)原理:由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
(2)酸碱指示剂法(只能测定溶液的pH范围)
指示剂 变色范围(颜色与pH的关系)
石蕊 <5.0 色 5.0~8.0紫色 >8.0 色
酚酞 <8.2 色 8.2~10.0浅红色 >10.0 色
甲基橙 <3.1 色 3.1~4.4橙色 >4.4 色
13.Ⅰ.某学生用的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
②量取20.00 mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是 (填编号),该步骤错误操作会导致测定结果 (填“偏大”“偏小”或“无影响”)。
(2)下列操作会导致上述所测盐酸溶液的浓度偏高的是_______(填正确答案标号)。
A.滴定达到终点时,俯视滴定管内液面读数
B.碱式滴定管尖嘴部分开始有气泡,滴定后消失
C.锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
Ⅱ.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体()进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体()中的x值。
通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性溶液进行滴定:
学习小组的同学设计了滴定的方法测定x值
①称取1.260g纯草酸晶体,将其制成100.00 mL水溶液为待测液
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀
③用浓度为的标准溶液进行滴定,达到终点记录消耗体积。
(3)滴定时,将酸性标准液装在如图中的 (填“甲”或“乙”)滴定管中。
(4)滴定时,左手操作滴定管,右手轻轻摇动锥形瓶,眼睛注视 。
(5)本实验滴定达到终点的标志是 。
(6)为了提高实验的准确性,学习小组共进行3次实验,记录数据如下表:
待测液/mL
25.00 0.00 9.95
25.00 1.05 11.10
25.00 0.50 13.50
通过上述数据,可知消耗的溶液体积为 mL,求得x= 。
讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性溶液因久置而导致浓度变小,则由此测得的x值会 。
14.室温下,取50mL H+浓度为0.20 mol/L的盐酸和硫酸的混合溶液,加入50mL Ba(OH)2溶液充分反应,得到沉淀0.233g,反应后溶液的pH值为12(假设反应后溶液的总体积为100mL)。请计算:
(1)原混合酸溶液中H+的物质的量为 mol。
(2)原混合酸溶液中HCl的物质的量浓度为 mol/L。
(3)加入的Ba(OH)2溶液的物质的量浓度为 mol/L。
15.离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在 (填编号)。
①单质②氧化物③电解质④盐⑤化合物
(2)将两种化合物一起溶于水得到一种无色透明溶液,溶液中含有下列离子中的某些离子:K+、Mg2+、Fe3+、Ba2+、、OH-、和Cl-,取该溶液进行如下实验:
Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许溶液滴入BaCl2溶液,无白色沉淀产生。
Ⅲ.另取少许溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。
Ⅳ.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是 ;肯定存在的离子是 。
②如溶液中各种离子的浓度相等,确定溶液中 (填“有”或“无”)K+,判断依据是 。
16.某学生用标准溶液滴定未知浓度硫酸的实验操作如下(正确的操作顺序自行判断):
A.用酸式滴定管取稀,注入锥形瓶中,加入酚酞
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏永洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度,用去NaOH溶液15.00mL
(1)在G操作中如何确定终点 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果 (填“偏小”、“偏大”或“恰好合适”)
(3)配制100mL NaOH标准溶液,除了烧杯、玻璃棒,必须使用到的玻璃仪器是 。
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)。
(5)计算待测硫酸溶液的物质的量浓度 。
【参考答案】
一、选择题
1.C
解析:A.用水就能鉴别,乙醇溶于水,苯和四氯化碳不溶于水,但苯的密度比水小,四氯化碳的密度比水大,A不符合题意;
B.用溴水能进行鉴别,苯能使溴水层褪色,苯酚与溴水反应生成白色沉淀,己烯能使溴水褪色,B不符合题意;
C.无法用一种试剂将三种物质鉴别开,C符合题意;
D.用新制的氢氧化铜悬浊液进行鉴别,乙酸能使悬浊液变澄清,甲酸也能使之变澄清,但加热后出现红色沉淀,乙醛与之加热后出现红色沉淀,D不符合题意;
故选C。
2.B
解析:A.氨水溶液呈碱性,Cu2+和OH—反应生成Cu(OH)2沉淀而不能大量共存,故A错误;
B.这几种离子之间不反应且和KI不反应,所以能大量共存,故B正确;
C.使甲基橙变红色的溶液呈酸性,H+可以与反应生成S、SO2而不能大量共存,故C错误;
D.、Al3+相互促进发生双水解,所以不能大量共存,故D错误;
故选:B。
3.C
解析:A.和稀硫酸不反应,所以硫酸铁溶液中加入少量稀硫酸,硫酸铁能稳定存在,故A不选;
B.和稀硫酸不反应,所以硝酸铵溶液中加入少量稀硫酸,硝酸铵能稳定存在,故B不选;
C.为和稀硫酸反应生成微溶物,且、在酸性条件下生成,所以溶液加入稀硫酸后不能稳定存在,故C选;
D.和稀硫酸不反应,所以硫酸铜溶液中加入少量稀硫酸,硫酸铜能稳定存在,故D不选;
故选:C。
4.B
解析:A.由于Ksp(CuS)< Ksp(ZnS),所以CuSO4溶液与闪锌矿(ZnS)反应生成铜蓝(CuS),离子方程式为:Cu2+(aq)+ZnS(s)Zn2+(aq)+CuS(s),故A正确;
B.钢铁制品在潮湿空气中的电化学腐蚀:Fe-2e-=Fe2+,故B错误;
C.向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜,反应方程式为:CH3CHO+2Ag(NH3)2OHCH3COONH4+2Ag↓+3NH3+H2O,故C正确;
D.能吸收二氧化碳和水,并反应生成呼吸所需的氧气,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2,故D正确;
故答案选B。
5.B
解析:略
6.D
解析:A.硫氢化钠中硫氢根离子水解可逆,A错误;
B.铜和稀硝酸反应生成一氧化氮,B错误;
C.含的溶液中加入含的溶液反应生成1mol氢氧化铝和1.5mol硫酸钡和0.5mol硫酸铵,C错误;
D.根据电离平衡常数分析,碳酸钠溶液中吸收少量氯气,反应生成碳酸氢钠和氯化钠和次氯酸钠,D正确;
故选D。
7.D
【分析】由某短周期元素“价—类”二维图可知,该元素最高化合价为+5、最低化合价为-3,且其中E是强酸,则该元素为氮元素;
解析:A.气体B为氮气,密度接近空气密度,不能用排空气法收集,A错误;
B.F为硝酸盐,例如硝酸银等受热易分解,B错误;
C.AD分别为氨气、二氧化氮或四氧化二氮,在催化剂作用下氨气可以转化为一氧化氮,不直接生成二氧化氮,C错误;
D.D为二氧化氮或四氧化二氮,和水反应能生成硝酸和C一氧化氮,D正确;
故选D。
8.C
解析:A.工业上将Cl2通入石灰乳中制漂白粉:,故A错误;
B.磁性氧化铁为,溶于盐酸离子方程式为,故B错误;
C.溶液与过量溶液混合,生成偏铝酸钠,离子方程式为,故C正确;
D.向溶液中通入过量,离子方程式为,故D错误;
故答案选C
9.A
【分析】由图可知,a点为碳酸钠溶液与盐酸恰好反应生成碳酸氢钠和氯化钠,反应的方程式为Na2CO3+HCl=NaCl+NaHCO3,c点为碳酸氢钠溶液与盐酸恰好反应生成氯化钠、二氧化碳和水,反应的方程式为NaHCO3+HCl=NaCl+CO2↑+H2O。
解析:A.由分析可知,a点所得溶液为碳酸氢钠和氯化钠混合溶液,由物料守恒可知,溶液中c(Na+)>c()+c()+c(H2CO3),故A错误;
B.由分析可知,a点为碳酸钠溶液与盐酸恰好反应生成碳酸氢钠和氯化钠,则b点发生的反应为碳酸氢钠溶液部分与盐酸反应生成氯化钠、二氧化碳和水,反应所得溶液的溶质为碳酸氢钠和氯化钠,故B正确;
C.由图可知,a点碳酸钠溶液与盐酸恰好反应时,消耗盐酸的体积为2.9mL,则纯碱样品中碳酸钠的物质的量为pmol/L×2.9×10-3L=2.9p×10-3mol,c点为碳酸氢钠溶液与盐酸恰好反应消耗盐酸的体积为6.8mL,则样品中碳酸氢钠的物质的量为pmol/L×6.8×10-3L—2.9p×10-3mol=1.0p×10-3mol,样品中碳酸钠和碳酸氢钠的物质的量比为2.9p×10-3mol:1.0p×10-3mol=29:10,故C正确;
D.由图可知,a点碳酸钠溶液与盐酸恰好反应时,消耗盐酸的体积为2.9mL,则纯碱样品中碳酸钠的物质的量为pmol/L×2.9×10-3L=2.9p×10-3mol,c点为碳酸氢钠溶液与盐酸恰好反应消耗盐酸的体积为6.8mL,则样品中碳酸氢钠的物质的量为pmol/L×6.8×10-3L—2.9p×10-3mol=1.0p×10-3mol,样品中碳酸氢钠的质量为1.0p×10-3mol×84g/mol=0.084pg,故D正确;
故选A。
10.A
【分析】无色透明溶液,没有Cu2+,加入一小块去除表面氧化膜的金属Al,有气泡产生,溶液可以呈酸性也可以呈碱性,根据题意只能为酸性,一定有H+,则一定没有,加入足量的NaOH溶液,产生白色沉淀,一定有Mg2+,白色沉淀为,且各离子的物质的量浓度相同,根据溶液呈电中性,则溶液中一定还有,Na+、K+一定没有。
解析:A. Na+、K+一定没有,A错误;
B. 根据分析可知一定有,B正确;
C.根据分析可知白色沉淀为,C正确;
D.溶液呈酸性,一定没有,D正确;
故答案为:A。
二、填空题
11.(1) ③⑥⑧ ④⑤
(2)
(3)
(4) 、 896 0.9mol/L
(5)3.4
解析:(1)由电解质与非电解质概念可知,属于电解质的是③固体、⑥蒸馏水、⑧晶体;属于非电解质的是④、⑤酒精;
故答案为:③⑥⑧;④⑤。
(2)将NaOH溶液与进行混合,生成碳酸钠和水,该过程中发生的离子反应方程式是;
故答案为:。
(3)向氢氧化钡溶液中加入物质的溶液至恰好沉淀完全,硫酸氢钠完全反应,其离子方程式为:;
故答案为:。
(4)由图像可知,开始没有二氧化碳生成,是氢氧化钠与盐酸反应、碳酸钠与盐酸反应生成碳酸氢钠,0A段反应的离子方程式为:、;②结合图像可知,25~45mL发生碳酸氢钠与盐酸反应生成二氧化碳,此时消耗盐酸的物质的量为,依据方程式可知,此时产生二氧化碳的物质的量为0.04mol,则的体积(标准状况)为;③B点溶液为NaCl,根据元素守恒可知,;
故答案为:、;896;0.9mol/L。
(5)酒精完全燃烧的产物是和,,固体增加的质量相当于CO、的质量,根据元素守恒,固体增加的质量为;
故答案为:3.4。
12.红 蓝 无 红 红 黄
解析:石蕊遇pH<5.0的溶液显红色,pH:5.0~8.0时显紫色,pH>8.0显蓝色;
酚酞遇pH<8.2的溶液不变色,pH:8.2~10.0时显浅红色,pH>10.0显红色;
甲基橙遇pH<3.1的溶液显红色,pH:3.1~4.4时显橙色,pH>4.4时显黄色。
13.(1) ①; 偏大;
(2)BD
(3)甲;
(4)眼睛注视锥形瓶内颜色变化;
(5)滴加高锰酸钾溶液时,溶液将有无色变为紫色,且半分钟内不褪色,即达到滴定终点;
(6)10.00; 2; 偏大; 偏小;
解析:(1)根据碱式滴定管在装液前应用待装液进行润洗,用蒸馏水洗涤碱式滴定管,并立即注入氢氧化钠溶液至“0”刻度线以上,碱式滴定管未用标准氢氧化钠溶液润洗就直接注入氢氧化钠溶液,标准液的浓度偏小,造成体积偏大,根据,偏大;
(2)A.滴定结束时,俯视计数,所用氢氧化钠溶液体积偏小,所测盐酸浓度偏小,A项错误;
B.滴定前有气泡,滴定结束无气泡,导致氢氧化钠溶液体积偏大,所以测得盐酸浓度偏大,B项正确;
C.锥形瓶蒸馏水洗净未干燥装入待测液无影响,C项错误;
D. 尖嘴处悬挂一滴溶液,造成消耗的标准体积偏大,会使测定结果偏高,D项正确;
答案选BD;
(3)因为高锰酸钾有强氧化性,会腐蚀橡胶管,故用酸式滴定管甲;
(4)滴定时,左手操作滴定管,右手轻轻摇动锥形瓶,眼睛注视锥形瓶内颜色变化;
(5)可利用高锰酸钾溶液自身的颜色作为指示剂判断滴定终点时,在滴加高锰酸钾溶液时,溶液将有无色变为紫色,且半分钟内不褪色,即达到滴定终点;
(6)三次实验中消耗标准液的体积分别是(mL)9.95,10.05,13.00,因此第三次实验误差大,舍去,消耗标准液的体积的平均值为10.00mL;根据方程式,可知,25mL待测液中含有草酸的物质的量是,100.00mL待测液中含有0.01mol草酸,0.01mol草酸的质量为0.9g,所以1.260g醇草酸晶体中水的物质的量为1.260g-0.9g=0.36g,其物质的量为0.02mol,则x=2;若滴定终点俯视滴定管读数,则所得消耗酸性高锰酸钾的体积偏小,由此草酸的物质的量偏小,则水的物质的量偏大,x偏大;若酸性高锰酸钾溶液因久置而导致浓度变小,则消耗其体积偏大,由此得到草酸的物质的量偏大,则水的物质的量偏小,x值偏小;
14.01 0.16 0.11
解析:(1)50mL H+浓度为0.2mol/L的盐酸和硫酸的混合溶液,根据公式可得,n(H+)=cV=0.2mol/L×0.05L=0.01mol;
(2)加入50mL Ba(OH)2溶液充分反应,得到沉淀0.233g,即生成0.001molBaSO4,则n()=0.001mol,硫酸电离出的n(H+)=0.002mol,由(1)可知,混酸中n(H+)=0.01mol,因此由HCl电离出的n(H+)=0.01mol-0.002mol=0.008mol,则n(HCl)=0.008mol,根据公式可得,c(HCl)=;
(3)加入50mL Ba(OH)2溶液充分反应,Ba(OH)2~2H+,原混合酸溶液中H+的物质的量为0.01mol,则参加反应的Ba(OH)2的物质的量为0.005mol;反应后溶液的pH值为12,则c(OH-)=0.01mol/L,n(OH-)=0.01mol/L×0.1L=0.001mol,即剩余Ba(OH)2的物质的量为0.001mol×=0.0005mol,因此反应前Ba(OH)2的物质的量为0.005mol+0.0005mol=0.0055mol,则加入的Ba(OH)2溶液的物质的量浓度为。
15.③⑤ Mg2+、Fe3+、、 Ba2+、OH-、Cl- 无 溶液中一定有Ba2+、Cl-、OH-,浓度相等时电荷守恒,所以无K+
解析:(1) 离子反应是由离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,则必须是电解质发生电离,故选③⑤;答案为:③⑤;
(2)①将两种化合物一起溶于水得到一种无色透明溶液,一定不含有颜色的Fe3+;
取少量溶液滴入紫色石蕊试液,溶液呈蓝色,说明溶液呈碱性,则存在OH-,与之反应的Mg2+一定没有,进一步说明没有Fe3+;
取少许溶液滴入BaCl2溶液,无白色沉淀产生,使用一定不含、;
另取少许溶液滴入AgNO3溶液,产生不溶于稀硝酸的白色沉淀,该沉淀只能是AgCl,说明有Cl-;
再取少许原溶液滴入H2SO4溶液,有白色沉淀产生,说明一定含有Ba2+,进一步说明不含,
综上所述,原溶液中肯定不存在的离子是Mg2+、Fe3+、、 ,肯定存在的离子是Ba2+、OH-、Cl-,不能确定是否含有K+,
故答案为:Mg2+、Fe3+、、;Ba2+、OH-、Cl-;
②溶液中一定有Ba2+、Cl-、OH-,离子浓度相等时,正负电荷数相等,所以无K+,
故答案为:无;溶液中一定有Ba2+、Cl-、OH-,浓度相等时电荷守恒,所以无K+。
【点睛】考查了电解质、非电解质的判断以及常见离子的检验方法,注意把握元素化合物的性质以及反应的现象,同一溶液中连续加试剂时,要注意现加试剂对后续检验的影响。
16.(1)无色变为浅红色(或粉红色)且半分钟不褪去
(2)偏大
(3)100mL容量瓶、胶头滴管
(4)偏小
(5)
解析:(1)终点时现象是当溶液无色变为浅红色(或粉红色)且半分钟不褪去;
故答案为:无色变为浅红色(或粉红色)且半分钟不褪去;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏大;
故答案为:偏大;
(3)需要使用的仪器有:药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管、100mL容量瓶,必须使用到的玻璃仪器是为:100 mL容量瓶、烧杯、玻璃棒、胶头滴管;
故答案为:100mL容量瓶、胶头滴管;
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小,所以测定的硫酸的浓度偏小;
故答案为:偏小;
(5)滴定时消耗的氢氧化钠的物质的量为,
根据反应:,则:,所以100mL硫酸中物质的量为,则待测硫酸溶液的物质的量浓度;
故答案为:。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
