1.3氧化还原反应的应用 教学设计 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应的应用 教学设计 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-27 22:46:30 | ||
图片预览

文档简介
氧化还原反应的应用
教学目标
1、以氧化还原观分析双氧水的性质,能从元素价态角度预测物质的性质,初步形成“推理+验证”的认知方式。
2、通过设计实验,探究双氧水的氧化性、还原性,发展学生科学探究和创新意识。
3、建立以氧化还原反应为核心的科学思维模型,实验氧化还原反应概念功能化,形成基于物质核心元素化合价角度探究物质性质、实现物质转化的研究模型。
教学重难点
教学重点
从化合价角度认识物质的性质
教学难点
建立氧化还原反应研究模型
教学方法
小组实验法、讲授法、总结归纳法
教学过程
【导入新课】抗疫期间,双氧水发挥了非常重要的作用,适用于多个场景,如:医用消毒、家庭日常消毒、化学实验、表现喷洒消毒、意外受伤消毒、衣物漂白消毒等。
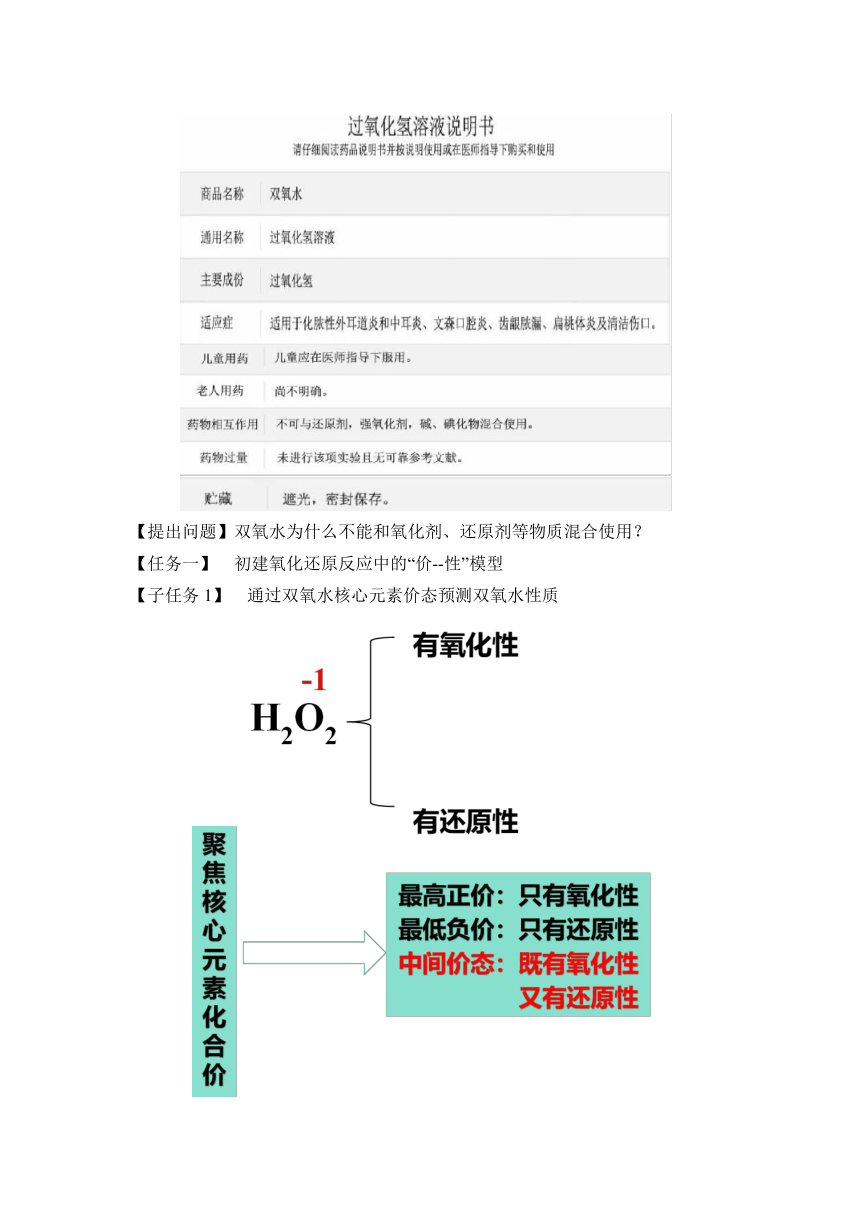
【提出问题】双氧水为什么不能和氧化剂、还原剂等物质混合使用?
【任务一】 初建氧化还原反应中的“价--性”模型
【子任务1】 通过双氧水核心元素价态预测双氧水性质
【任务二】完善氧化还原反应中的“价--性”模型
提供的试剂:
5% H2O2溶液、KI溶液、淀粉溶液、酸性KMnO4溶液
酸性KMnO4溶液具有氧化性,预测H2O2具有还原性
【查阅资料】
含锰元素的常见物质有:MnO4-、MnO42-、MnO2、Mn2+
【提出猜想】
预测高锰酸钾与H2O2反应的产物?
【设计并进行实验】
实验内容 取2滴酸性KMnO4溶液于小试管中,再逐滴滴加5%的H2O2溶液,边滴加边振荡并观察实验现象。
实验现象 溶液紫红色褪去并有气泡冒出
【得出结论】
H2O2具有还原性,可与氧化性物质反应
【交流研讨】
【问题1】书写酸性高锰酸钾与H2O2反应的离子方程式
2MnO4-+5H2O2+6H+ ==== 2Mn2++5O2↑+8H2O
【问题2】在标准状况下,产生22.4LO2时,反应中转移的电子数?
【问题3】在标准状况下,当反应转移5mol电子时,产生气体的体积为多少L
【子任务2】 探究双氧水的氧化性
提供的试剂:
5%H2O2溶液、酸性KMnO4溶液、淀粉溶液、KI溶液
【查阅资料】
I2:微溶于水,溶液显黄色,I2遇淀粉显蓝色
KI:可溶于水,溶液无色,KI遇淀粉不显色
【提出猜想】
预测KI溶液与H2O2反应生成什么产物?
KI溶液有还原性,预测H2O2具有氧化性
【设计并进行实验】
实验内容 取2滴KI溶液于小试管中,滴加4滴5%的H2O2溶液,再逐滴滴加淀粉溶液,边滴加边振荡并观察实验现象。
实验现象 加入淀粉后变蓝色
【得出结论】
H2O2具有氧化性,可与还原性物质反应
任务三 应用氧化还原反应中的“价--性”模型
【化学史话】氯气的意外发现
氯气的发现应归功于瑞典化学家舍勒。舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰)。当他使软锰矿(二氧化锰)与浓盐酸混合并加热时,产生了一种黄绿色的气体,这种气体的强烈的刺激性气味使舍勒感到极为难受。
舍勒发现氯气的方法至今还是实验室中制取氯气的主要方法之一。
实验室用二氧化锰与浓盐酸反应制取氯气
【反应原理】
【书写表达】将上述反应方程式改写成离子方程式
【全面剖析】
该反应的氧化剂为MnO2;还原剂为浓盐酸;
浓盐酸的作用:表现还原性,又表现酸性;
氧化剂和还原剂个数之比:1:2;
在标准状况下,产生22.4LCl2时,反应中转移2 mol e- 。
【交流研讨】
还能用什么物质来代替MnO2制取氯气?
【展示交流】
MnO2作该反应的氧化剂、寻找其他氧化剂代替MnO2,如KMnO4、KClO3等
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
上述反应转移的电子数分别是?
氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。例如,金属的冶炼、电镀、燃料的燃烧、绿色植物的光合作用等。希望同学们根据掌握的化学反应规律,将所学应用于实践,服务于社会发展。
【课后作业】
通过构建的氧化还原反应“价--性”模型,回答以下问题:
铁是人体必需微量元素中含量最多的一种。预测Fe、Fe2+和Fe3+可能具有的性质?并设计实验方案进行验证。
二价铁为铁元素在人体中主要存在形式,为什么吃富含维生素C的食物(如柑橘类水果、草莓、绿色蔬菜等)可以提高铁的吸收率?
教学目标
1、以氧化还原观分析双氧水的性质,能从元素价态角度预测物质的性质,初步形成“推理+验证”的认知方式。
2、通过设计实验,探究双氧水的氧化性、还原性,发展学生科学探究和创新意识。
3、建立以氧化还原反应为核心的科学思维模型,实验氧化还原反应概念功能化,形成基于物质核心元素化合价角度探究物质性质、实现物质转化的研究模型。
教学重难点
教学重点
从化合价角度认识物质的性质
教学难点
建立氧化还原反应研究模型
教学方法
小组实验法、讲授法、总结归纳法
教学过程
【导入新课】抗疫期间,双氧水发挥了非常重要的作用,适用于多个场景,如:医用消毒、家庭日常消毒、化学实验、表现喷洒消毒、意外受伤消毒、衣物漂白消毒等。
【提出问题】双氧水为什么不能和氧化剂、还原剂等物质混合使用?
【任务一】 初建氧化还原反应中的“价--性”模型
【子任务1】 通过双氧水核心元素价态预测双氧水性质
【任务二】完善氧化还原反应中的“价--性”模型
提供的试剂:
5% H2O2溶液、KI溶液、淀粉溶液、酸性KMnO4溶液
酸性KMnO4溶液具有氧化性,预测H2O2具有还原性
【查阅资料】
含锰元素的常见物质有:MnO4-、MnO42-、MnO2、Mn2+
【提出猜想】
预测高锰酸钾与H2O2反应的产物?
【设计并进行实验】
实验内容 取2滴酸性KMnO4溶液于小试管中,再逐滴滴加5%的H2O2溶液,边滴加边振荡并观察实验现象。
实验现象 溶液紫红色褪去并有气泡冒出
【得出结论】
H2O2具有还原性,可与氧化性物质反应
【交流研讨】
【问题1】书写酸性高锰酸钾与H2O2反应的离子方程式
2MnO4-+5H2O2+6H+ ==== 2Mn2++5O2↑+8H2O
【问题2】在标准状况下,产生22.4LO2时,反应中转移的电子数?
【问题3】在标准状况下,当反应转移5mol电子时,产生气体的体积为多少L
【子任务2】 探究双氧水的氧化性
提供的试剂:
5%H2O2溶液、酸性KMnO4溶液、淀粉溶液、KI溶液
【查阅资料】
I2:微溶于水,溶液显黄色,I2遇淀粉显蓝色
KI:可溶于水,溶液无色,KI遇淀粉不显色
【提出猜想】
预测KI溶液与H2O2反应生成什么产物?
KI溶液有还原性,预测H2O2具有氧化性
【设计并进行实验】
实验内容 取2滴KI溶液于小试管中,滴加4滴5%的H2O2溶液,再逐滴滴加淀粉溶液,边滴加边振荡并观察实验现象。
实验现象 加入淀粉后变蓝色
【得出结论】
H2O2具有氧化性,可与还原性物质反应
任务三 应用氧化还原反应中的“价--性”模型
【化学史话】氯气的意外发现
氯气的发现应归功于瑞典化学家舍勒。舍勒发现氯气是在1774年,当时他正在研究软锰矿(二氧化锰)。当他使软锰矿(二氧化锰)与浓盐酸混合并加热时,产生了一种黄绿色的气体,这种气体的强烈的刺激性气味使舍勒感到极为难受。
舍勒发现氯气的方法至今还是实验室中制取氯气的主要方法之一。
实验室用二氧化锰与浓盐酸反应制取氯气
【反应原理】
【书写表达】将上述反应方程式改写成离子方程式
【全面剖析】
该反应的氧化剂为MnO2;还原剂为浓盐酸;
浓盐酸的作用:表现还原性,又表现酸性;
氧化剂和还原剂个数之比:1:2;
在标准状况下,产生22.4LCl2时,反应中转移2 mol e- 。
【交流研讨】
还能用什么物质来代替MnO2制取氯气?
【展示交流】
MnO2作该反应的氧化剂、寻找其他氧化剂代替MnO2,如KMnO4、KClO3等
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
上述反应转移的电子数分别是?
氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。例如,金属的冶炼、电镀、燃料的燃烧、绿色植物的光合作用等。希望同学们根据掌握的化学反应规律,将所学应用于实践,服务于社会发展。
【课后作业】
通过构建的氧化还原反应“价--性”模型,回答以下问题:
铁是人体必需微量元素中含量最多的一种。预测Fe、Fe2+和Fe3+可能具有的性质?并设计实验方案进行验证。
二价铁为铁元素在人体中主要存在形式,为什么吃富含维生素C的食物(如柑橘类水果、草莓、绿色蔬菜等)可以提高铁的吸收率?
