第2章 化学反应的方向、限度与速率 (含答案)同步练习 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第2章 化学反应的方向、限度与速率 (含答案)同步练习 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 447.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 09:19:36 | ||
图片预览



文档简介
第2章化学反应的方向、限度与速率
1.已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:,有关该平衡的说法中正确的是
A.升高温度,平衡常数K变大
B.增大压强,W(g)物质的量分数变大
C.升温,若混合气体的平均相对分子质量变小,则正反应放热
D.增大X浓度,平衡向正反应方向移动
2.为阿伏加德罗常数的值,下列说法错误的是
A.常温下,11.2L氯气所含的原子数小于
B.1mol Fe与足量氯气完全反应转移的电子数约为
C.标准状况下,3.36L HF含有氢氟键的数目为0.15
D.标准状况下,11.2L NO与11.2L 混合后的分子数目可能为0.65
3.铁和足量的稀CH3COOH反应时,加入少量CuSO4固体,下列叙述正确的是
A.反应速率减慢,产生H2的量不变 B.反应速率加快,产生H2的量不变
C.反应速率不变,产生H2的量增加 D.反应速率加快,产生H2的量减少
4.某温度下,在一容积为1L的密闭容器中进行如下两个反应并达到平衡:
①
②
下列叙述错误的是
A.加入适量Z,平衡①和②均不移动
B.通入X(g),则N(g)的浓度增大
C.升高温度,题设条件无法判断R(g)浓度的增减
D.若将容器容积缩小至0.5L,平衡①正向移动,②不移动
5.下列实验方案设计、现象和结论都正确的是
实验目的 方案设计 现象和结论
A 探究反应物浓度对化学反应速率的影响 分别取溶液和溶液、5mL蒸馏水于两支试管中,然后同时加入溶液 前者出现浑浊的时间更短,说明增大浓度,可以加快反应速率
B 探究和测定中和反应的反应热 将50ml0.50mol/L氢氧化钠溶液,分批次倒入盛有50ml0.50mol/L盐酸的量热计内筒中 根据反应前后的温度变化和比热容等数值可计算中和反应的反应热
C 探究温度对化学反应速率的影响 将装有和混合气体的连通球分别浸泡在冰水和热水中 热水中气体颜色浅,冰水中颜色深
D 探究KI与反应的限度 取1mL0.1mol/LKI溶液于试管中,加入溶液,充分反应后滴入5滴15%KSCN溶液 若溶液变血红色,则KI与的反应有一定限度
A.A B.B C.C D.D
6.在某恒容密闭容器中进行反应:N2(g)+3H2(g)2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L,0.3 mol/L,0.2 mol/L。当反应达到平衡时,可能存在的数据是
A.N2为0.2 mol/L,H2为0.6 mol/L B.NH3为0.4 mol/L
C.N2、H2均为0.18 mol/L D.N2为0.15 mol/L
7.利用计算机技术测得在甲、乙两种催化剂作用下由正丁烷(g)制备1-丁烯(g)的反应历程如下,其中甲、乙催化剂表面的物种均用*号标注,过渡态均用TS表示,下列说法中错误的是
A.选用催化剂甲时的最高能垒(活化能)为1.95eV
B.选用催化剂乙时,相对能量从的过程为正丁烷的吸附过程
C.为吸热反应
D.若只从平均反应速率快慢角度考虑,生产中适宜选用催化剂乙
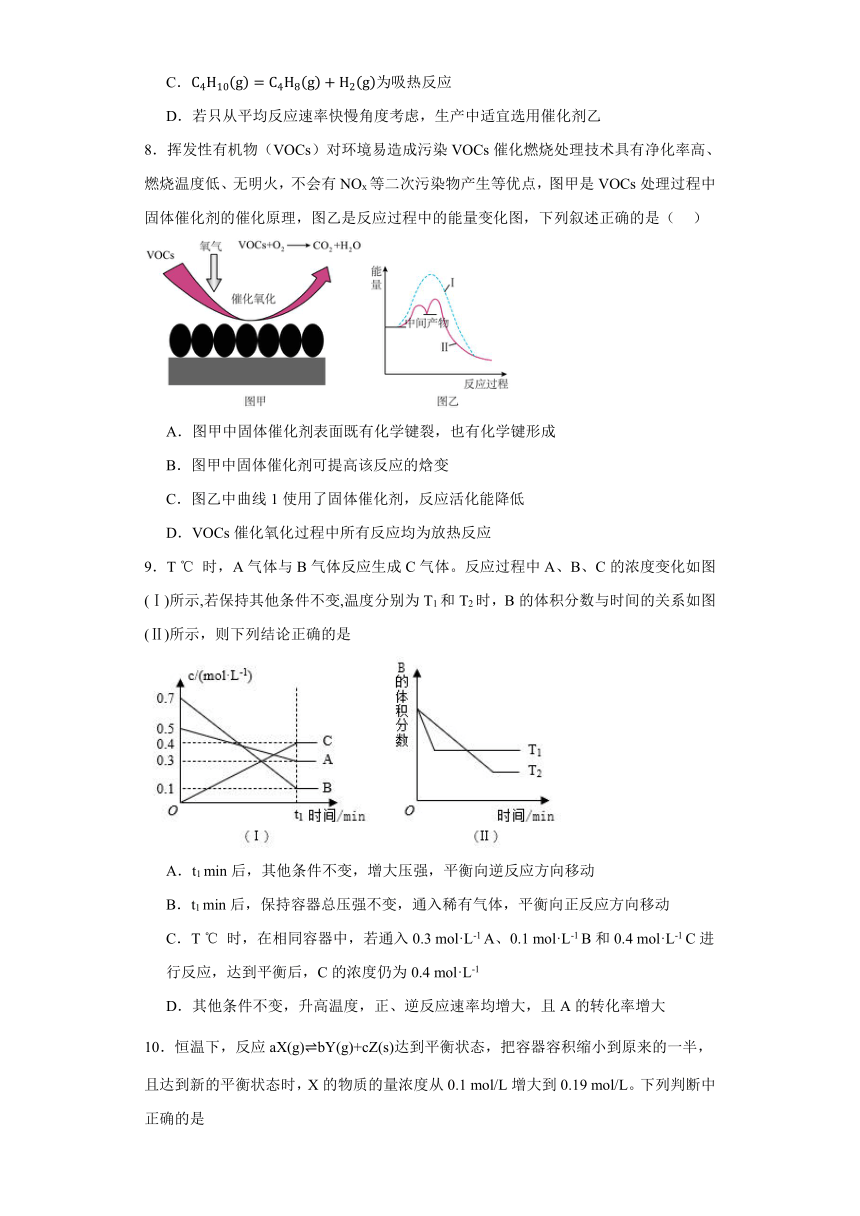
8.挥发性有机物(VOCs)对环境易造成污染VOCs催化燃烧处理技术具有净化率高、燃烧温度低、无明火,不会有NOx等二次污染物产生等优点,图甲是VOCs处理过程中固体催化剂的催化原理,图乙是反应过程中的能量变化图,下列叙述正确的是( )
A.图甲中固体催化剂表面既有化学键裂,也有化学键形成
B.图甲中固体催化剂可提高该反应的焓变
C.图乙中曲线1使用了固体催化剂,反应活化能降低
D.VOCs催化氧化过程中所有反应均为放热反应
9.T ℃ 时,A气体与B气体反应生成C气体。反应过程中A、B、C的浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.t1 min后,其他条件不变,增大压强,平衡向逆反应方向移动
B.t1 min后,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T ℃ 时,在相同容器中,若通入0.3 mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C进行反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
10.恒温下,反应aX(g)bY(g)+cZ(s)达到平衡状态,把容器容积缩小到原来的一半,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L。下列判断中正确的是
A.a>b B.a>b+c C.a=b+c D.a<b
11.下列事实中,不能用勒夏特列原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.实验室中常用排饱和食盐水的方式收集氯气
C.棕红色NO2加压后颜色先变深后变浅
D.对,平衡体系增大压强可使颜色变深
12.反应物和生成物均为气态的平衡体系,平衡常数表达式为 ,有关该平衡体系的说法正确的是
A.升高温度,该反应平衡常数K变大
B.增大压强,W的质量分数增大
C.该反应的化学方程式为
D.增大X气体的浓度平衡向正反应方向移动
13.某实验小组在一个恒压密闭容器中加入CH3OH和CO气体,发生反应CH3OH(g) + CO(g)CH3COOH(l)。已知在某温度下,达到平衡时,CH3OH(g)、CO(g)、CH3COOH(l)的物质的量分别为0.08mol、0.10mol、0.12mol,且容器的体积刚好为2L。往上述已达到平衡的恒压容器中,再在瞬间通入0.12mol CH3OH和0.06molCO混合气体,平衡的移动方向为
A.正向 B.逆向 C.不移动 D.无法确定
14.下列说法或表示方法中正确的是
A.101 kPa时,燃烧热为316.25 kJ/mol,则表示氨气燃烧热的热化学方程式为:
B.反应在常温下能自发进行,则该反应的
C.醋酸溶液和氢氧化钠溶液反应的热化学方程式为:
D.由于 ,则顺式1,3—丁二烯比较稳定
15.下列变化过程的焓变(△H)和熵变(△S)均大于零的是
A.H2O(g)→H2O(l) B.N2(g)+O2(g)=2NO(g)
C.2H2O2(l)=2H2O(l)+O2(g) D.Ag+(aq)+Cl-(aq)=AgCl(s)
16.已知可逆反应2NO(g)N2(g)+O2(g)。该反应的平衡常数表达式为 。若在某温度下达到平衡时C(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.1mol·L-1。该反应的平衡常数为 。保持温度不变,将容器体积缩小一半,则平衡常数 (填增大、减小或不变)。
17.反应N2(g)+3H2(g)2NH3(g)ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
回答问题:(1)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是 。
(2)由第一次平衡到第二次平衡,采取的措施是 。
18.25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应2NO(g)+Cl2(g)2NOCl(g) △H。已知:反应起始时和平衡时温度相同。
测得反应过程中压强(p)随时间(t)的变化关系如图1中曲线a所示,则△H (填“>”或“<”)0;若其他条件相同,仅改变某一条件时,测得压强(p)随时间(t)的变化关系如图1中曲线b所示,则改变的条件是 。图2是两位同学描绘的上述反应平衡常数的对数值(lgK)与温度的倒数()的变化关系图像,其中正确的曲线是 (填“甲”或“乙”)。
19.回答下列问题。
(1)结合钠与水的反应现象,从能量变化的角度看,钠与水的反应属于 反应。
(2)以硫酸铜为电解质溶液的银锌原电池中。银片上观察到的现象是 ;锌电极的反应式为 ,溶液中向 极移动。
(3)将一定量的A气体和B气体在2L的密闭容器中混合并在一定条件下发生反应; ,反应2min后测得C的浓度为0.6mol/L。
①用物质B表示的平均反应速率为 。
②其他条件不变时,再通入2molA气体,该反应的正反应速率将 (填“增大”“不变”或“减小”)。
20.工业上合成氨反应为:N2+3H22NH3,回答下列问题:
(1)反应过程中拆开的化学键是 ;
(2)反应放热,从价键角度分析,反应放热的原因是 ,下列图象正确的是 。
(3)在体积是2L的密闭容器中开始加入1molN2,3molH2,反应过程浓度中,物质的浓度与时间的关系如图所示。
①t1时生成NH3的物质的量是 ;用H2表示的化学反应速率υ(H2)= 。
②下列各项能表明反应达到化学平衡状态的是 。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH—H键同时形成6molN—H键
(4)下列措施中能提高合成氨反应化学反应速率的是 。
A.使用高效催化剂 B.恒温恒容再充入氢气 C.降低反应温度 D.扩大容器体积
参考答案:
1.C2.C3.D4.D5.A6.D7.A8.A9.C10.A11.D12.C13.C14.B15.B
16. 不变 0.25
17. αⅠ(H2)>αⅡ(H2)>αⅢ(H2) 减小氨气的浓度
18. < 加入催化剂 甲
19. 放热 生成紫红色的单质铜(合理即可) 负(或锌、Zn) 0.15 增大
20. N≡N键和H-H键 拆开反应物中的化学键吸收的能量小于形成化学键放出的能量 乙、丙 mol(或0.67mol) mol/(L·s) BC AB
1.已知:t℃下的某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:,有关该平衡的说法中正确的是
A.升高温度,平衡常数K变大
B.增大压强,W(g)物质的量分数变大
C.升温,若混合气体的平均相对分子质量变小,则正反应放热
D.增大X浓度,平衡向正反应方向移动
2.为阿伏加德罗常数的值,下列说法错误的是
A.常温下,11.2L氯气所含的原子数小于
B.1mol Fe与足量氯气完全反应转移的电子数约为
C.标准状况下,3.36L HF含有氢氟键的数目为0.15
D.标准状况下,11.2L NO与11.2L 混合后的分子数目可能为0.65
3.铁和足量的稀CH3COOH反应时,加入少量CuSO4固体,下列叙述正确的是
A.反应速率减慢,产生H2的量不变 B.反应速率加快,产生H2的量不变
C.反应速率不变,产生H2的量增加 D.反应速率加快,产生H2的量减少
4.某温度下,在一容积为1L的密闭容器中进行如下两个反应并达到平衡:
①
②
下列叙述错误的是
A.加入适量Z,平衡①和②均不移动
B.通入X(g),则N(g)的浓度增大
C.升高温度,题设条件无法判断R(g)浓度的增减
D.若将容器容积缩小至0.5L,平衡①正向移动,②不移动
5.下列实验方案设计、现象和结论都正确的是
实验目的 方案设计 现象和结论
A 探究反应物浓度对化学反应速率的影响 分别取溶液和溶液、5mL蒸馏水于两支试管中,然后同时加入溶液 前者出现浑浊的时间更短,说明增大浓度,可以加快反应速率
B 探究和测定中和反应的反应热 将50ml0.50mol/L氢氧化钠溶液,分批次倒入盛有50ml0.50mol/L盐酸的量热计内筒中 根据反应前后的温度变化和比热容等数值可计算中和反应的反应热
C 探究温度对化学反应速率的影响 将装有和混合气体的连通球分别浸泡在冰水和热水中 热水中气体颜色浅,冰水中颜色深
D 探究KI与反应的限度 取1mL0.1mol/LKI溶液于试管中,加入溶液,充分反应后滴入5滴15%KSCN溶液 若溶液变血红色,则KI与的反应有一定限度
A.A B.B C.C D.D
6.在某恒容密闭容器中进行反应:N2(g)+3H2(g)2NH3(g)。已知反应过程中某一时刻N2、H2、NH3的浓度分别为0.1 mol/L,0.3 mol/L,0.2 mol/L。当反应达到平衡时,可能存在的数据是
A.N2为0.2 mol/L,H2为0.6 mol/L B.NH3为0.4 mol/L
C.N2、H2均为0.18 mol/L D.N2为0.15 mol/L
7.利用计算机技术测得在甲、乙两种催化剂作用下由正丁烷(g)制备1-丁烯(g)的反应历程如下,其中甲、乙催化剂表面的物种均用*号标注,过渡态均用TS表示,下列说法中错误的是
A.选用催化剂甲时的最高能垒(活化能)为1.95eV
B.选用催化剂乙时,相对能量从的过程为正丁烷的吸附过程
C.为吸热反应
D.若只从平均反应速率快慢角度考虑,生产中适宜选用催化剂乙
8.挥发性有机物(VOCs)对环境易造成污染VOCs催化燃烧处理技术具有净化率高、燃烧温度低、无明火,不会有NOx等二次污染物产生等优点,图甲是VOCs处理过程中固体催化剂的催化原理,图乙是反应过程中的能量变化图,下列叙述正确的是( )
A.图甲中固体催化剂表面既有化学键裂,也有化学键形成
B.图甲中固体催化剂可提高该反应的焓变
C.图乙中曲线1使用了固体催化剂,反应活化能降低
D.VOCs催化氧化过程中所有反应均为放热反应
9.T ℃ 时,A气体与B气体反应生成C气体。反应过程中A、B、C的浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.t1 min后,其他条件不变,增大压强,平衡向逆反应方向移动
B.t1 min后,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T ℃ 时,在相同容器中,若通入0.3 mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C进行反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
10.恒温下,反应aX(g)bY(g)+cZ(s)达到平衡状态,把容器容积缩小到原来的一半,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L。下列判断中正确的是
A.a>b B.a>b+c C.a=b+c D.a<b
11.下列事实中,不能用勒夏特列原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.实验室中常用排饱和食盐水的方式收集氯气
C.棕红色NO2加压后颜色先变深后变浅
D.对,平衡体系增大压强可使颜色变深
12.反应物和生成物均为气态的平衡体系,平衡常数表达式为 ,有关该平衡体系的说法正确的是
A.升高温度,该反应平衡常数K变大
B.增大压强,W的质量分数增大
C.该反应的化学方程式为
D.增大X气体的浓度平衡向正反应方向移动
13.某实验小组在一个恒压密闭容器中加入CH3OH和CO气体,发生反应CH3OH(g) + CO(g)CH3COOH(l)。已知在某温度下,达到平衡时,CH3OH(g)、CO(g)、CH3COOH(l)的物质的量分别为0.08mol、0.10mol、0.12mol,且容器的体积刚好为2L。往上述已达到平衡的恒压容器中,再在瞬间通入0.12mol CH3OH和0.06molCO混合气体,平衡的移动方向为
A.正向 B.逆向 C.不移动 D.无法确定
14.下列说法或表示方法中正确的是
A.101 kPa时,燃烧热为316.25 kJ/mol,则表示氨气燃烧热的热化学方程式为:
B.反应在常温下能自发进行,则该反应的
C.醋酸溶液和氢氧化钠溶液反应的热化学方程式为:
D.由于 ,则顺式1,3—丁二烯比较稳定
15.下列变化过程的焓变(△H)和熵变(△S)均大于零的是
A.H2O(g)→H2O(l) B.N2(g)+O2(g)=2NO(g)
C.2H2O2(l)=2H2O(l)+O2(g) D.Ag+(aq)+Cl-(aq)=AgCl(s)
16.已知可逆反应2NO(g)N2(g)+O2(g)。该反应的平衡常数表达式为 。若在某温度下达到平衡时C(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.1mol·L-1。该反应的平衡常数为 。保持温度不变,将容器体积缩小一半,则平衡常数 (填增大、减小或不变)。
17.反应N2(g)+3H2(g)2NH3(g)ΔH<0在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
回答问题:(1)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是 。
(2)由第一次平衡到第二次平衡,采取的措施是 。
18.25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应2NO(g)+Cl2(g)2NOCl(g) △H。已知:反应起始时和平衡时温度相同。
测得反应过程中压强(p)随时间(t)的变化关系如图1中曲线a所示,则△H (填“>”或“<”)0;若其他条件相同,仅改变某一条件时,测得压强(p)随时间(t)的变化关系如图1中曲线b所示,则改变的条件是 。图2是两位同学描绘的上述反应平衡常数的对数值(lgK)与温度的倒数()的变化关系图像,其中正确的曲线是 (填“甲”或“乙”)。
19.回答下列问题。
(1)结合钠与水的反应现象,从能量变化的角度看,钠与水的反应属于 反应。
(2)以硫酸铜为电解质溶液的银锌原电池中。银片上观察到的现象是 ;锌电极的反应式为 ,溶液中向 极移动。
(3)将一定量的A气体和B气体在2L的密闭容器中混合并在一定条件下发生反应; ,反应2min后测得C的浓度为0.6mol/L。
①用物质B表示的平均反应速率为 。
②其他条件不变时,再通入2molA气体,该反应的正反应速率将 (填“增大”“不变”或“减小”)。
20.工业上合成氨反应为:N2+3H22NH3,回答下列问题:
(1)反应过程中拆开的化学键是 ;
(2)反应放热,从价键角度分析,反应放热的原因是 ,下列图象正确的是 。
(3)在体积是2L的密闭容器中开始加入1molN2,3molH2,反应过程浓度中,物质的浓度与时间的关系如图所示。
①t1时生成NH3的物质的量是 ;用H2表示的化学反应速率υ(H2)= 。
②下列各项能表明反应达到化学平衡状态的是 。
A.容器中气体的密度保持不变
B.容器中气体的压强不变
C.氨气的含量不变
D.拆开3molH—H键同时形成6molN—H键
(4)下列措施中能提高合成氨反应化学反应速率的是 。
A.使用高效催化剂 B.恒温恒容再充入氢气 C.降低反应温度 D.扩大容器体积
参考答案:
1.C2.C3.D4.D5.A6.D7.A8.A9.C10.A11.D12.C13.C14.B15.B
16. 不变 0.25
17. αⅠ(H2)>αⅡ(H2)>αⅢ(H2) 减小氨气的浓度
18. < 加入催化剂 甲
19. 放热 生成紫红色的单质铜(合理即可) 负(或锌、Zn) 0.15 增大
20. N≡N键和H-H键 拆开反应物中的化学键吸收的能量小于形成化学键放出的能量 乙、丙 mol(或0.67mol) mol/(L·s) BC AB
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
