1.1化学反应的热效应练习(含解析)2023——2024学年上学期高二化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.1化学反应的热效应练习(含解析)2023——2024学年上学期高二化学苏教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 10:00:13 | ||
图片预览




文档简介
1.1化学反应的热效应练习
姓名()班级()学号()
一、单选题
1.下列反应中生成物总能量高于反应物总能量的是
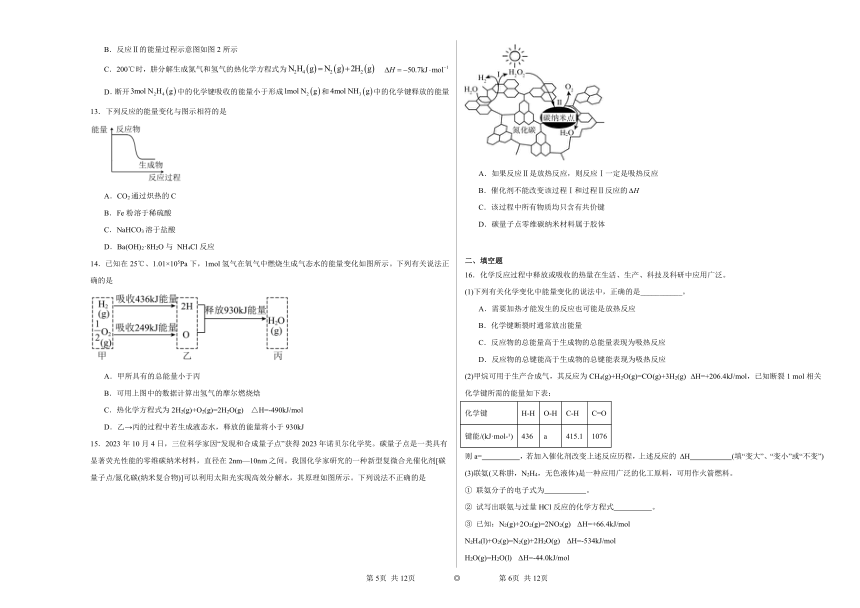
A.氧化钙溶于水 B.铁粉与硫粉共热
C.强酸强碱中和 D.氢氧化钡晶体与氯化铵晶体的反应
2.在一定条件下可发生如图所示的一系列反应。下列说法正确的是
A. B.
C. D.
3.硼单质及其化合物有重要的应用。硼晶体熔点为2076℃,可形成多种卤化物。可与反应生成。可与反应生成乙硼烷(标准燃烧热为),其分子中一个硼与周围的四个氢形成正四面体,结构式为,具有还原性。乙硼烷易水解生成与,是一种一元弱酸,可作吸水剂。乙硼烷可与反应生成氨硼烷(),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成,是一种常用的还原剂。下列化学反应表示正确的是
A.乙硼烷的制备:
B.乙硼烷的水解:
C.乙硼烷的燃烧:
D.乙硼烷酸性条件下还原乙酸:
4.工业中可用碘硫循环法处理气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是
已知:
A.反应物B是
B.反应①方程式为
C.等压条件下,反应①②③反应热之和小于直接分解的反应热
D.碘硫循环法总反应热化学方程式为
5.化学反应在有新物质生成的同时,一定伴随有能量的变化。下列说法正确的是
A.已知H2的燃烧热为285.8kJ/mol,则表示H2燃烧热的热化学方程式为H2(g)+O2(g)=H2O(l) △H=-285.8kJ/mol
B.已知H+(aq)+OH—(ag)=H2O(l) △H=—57.3kJ/mol,用含49.0gH2SO4的浓硫酸与足量稀NaOH溶液反应,放出57.3kJ热量
C.H2(g)与O2(g)充分反应生成等量的气态水比液态水放出的热量更多
D.已知I2(g)+H2(g) 2HI(g) △H=-11kJ/mol,现将1molI2(g)和1molH2(g)充入密闭容器中充分反应后,放出的热量为11kJ
6.下列说法或表示方法不正确的是
A.由 ,可知石墨比金刚石稳定
B.在稀溶液中: ,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
C.在101 kPa时,4 g H2完全燃烧生成液态水,放出571.6 kJ热量,氢气燃烧热的热化学方程式表示为:
D.已知 ,则1 mol S(s)完全反应,放出的热量小于20.1 kJ
7.2023年10月8日第19届亚运会在杭州圆满闭幕,本届亚运会秉持“绿色、智能、节俭、文明”的办会理念。下列说法正确的是
A.零碳甲醇作为本届亚运会的火炬燃料,甲醇燃烧属于吸热反应
B.吉祥物“江南忆”机器人所采用芯片的主要成分为硅单质
C.亚运会纪念章“琮琮”是由锌合金镀金制成的,锌合金镀金属于合成材料
D.场馆全部使用绿色能源,打造首届碳中和亚运会,碳中和就是不排放二氧化碳
8.几种物质间的转化焓变如图所示,下列说法不正确的是
A.ΔH3>ΔH4 B.ΔH1>ΔH6
C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0 D.H—H的键能为ΔH2
9.已知碘化氢分解吸热,分以下两步完成:2HI(g)→H2(g)+2I (g);2I (g)→I2(g),下列图像最符合上述反应历程的是
A. B.
C. D.
10.一定温度下,的氯化、溴化反应势能图及一段时间后产物的选择性如图,下列叙述正确的是
A.的氯化、溴化反应的均小于0
B.稳定性:
C.
D.和的键能差
11.某教师设计了如图所示的装置测定中和反应的反应热。磁力搅拌器通电后,搅拌磁子能高速转动。三次实验数据如下表所示,溶液密度均近似为1 g/mL,反应后生成的溶液比热容c约为4.18 J/(g·℃),且忽略量热计等的比热容,下列说法错误的是
盐酸与NaOH溶液反应时体系的温度变化情况
实验组号 反应前体系的温度T1/℃ 反应后体系的温度T2/℃ 温度差(T2-T1)/℃
1 20.8 24.1 3.3
2 20.8 24.2 3.4
3 20.9 24.3 3.4
A.隔一段时间需打开止水夹放出气体,防止容器内压强过大,但此操作会造成一定的热量损失
B.相同条件下,用醋酸溶液代替盐酸会使测得的△H偏大
C.该实验测得生成1 mol H2O时放出的热量约为56 kJ
D.用注射器分多次缓慢注入50 mL 0.55 mol/LNaOH溶液,以保证盐酸完全反应
12.肼在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。
已知200℃时:
反应Ⅰ:
反应Ⅱ:
下列说法不正确的是
A.图1所示过程①是放热反应、②是吸热反应。
B.反应Ⅱ的能量过程示意图如图2所示
C.200℃时,肼分解生成氮气和氢气的热化学方程式为
D.断开中的化学键吸收的能量小于形成和中的化学键释放的能量
13.下列反应的能量变化与图示相符的是
A.CO2通过炽热的C
B.Fe粉溶于稀硫酸
C.NaHCO3溶于盐酸
D.Ba(OH)2·8H2O与 NH4Cl反应
14.已知在25℃、1.01×105Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如图所示。下列有关说法正确的是
A.甲所具有的总能量小于丙
B.可用上图中的数据计算出氢气的摩尔燃烧焓
C.热化学方程式为2H2(g)+O2(g)=2H2O(g) △H=-490kJ/mol
D.乙→丙的过程中若生成液态水,释放的能量将小于930kJ
15.2023年10月4日,三位科学家因“发现和合成量子点”获得2023年诺贝尔化学奖。碳量子点是一类具有显著荧光性能的零维碳纳米材料,直径在2nm—10nm之间。我国化学家研究的一种新型复微合光催化剂[碳量子点/氮化碳(纳米复合物)]可以利用太阳光实现高效分解水,其原理如图所示。下列说法不正确的是
A.如果反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应
B.催化剂不能改变该过程Ⅰ和过程Ⅱ反应的
C.该过程中所有物质均只含有共价键
D.碳量子点零维碳纳米材料属于胶体
二、填空题
16.化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)下列有关化学变化中能量变化的说法中,正确的是___________。
A.需要加热才能发生的反应也可能是放热反应
B.化学键断裂时通常放出能量
C.反应物的总能量高于生成物的总能量表现为吸热反应
D.反应物的总键能高于生成物的总键能表现为吸热反应
(2)甲烷可用于生产合成气,其反应为CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4kJ/mol,已知断裂1 mol相关化学键所需的能量如下表:
化学键 H-H O-H C-H C=O
键能/(kJ·mol- ) 436 a 415.1 1076
则a= ,若加入催化剂改变上述反应历程,上述反应的 ΔH (填“变大”、“变小”或“不变”)
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
① 联氨分子的电子式为 。
② 试写出联氨与过量HCl反应的化学方程式 。
③ 已知:N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) ΔH= kJ/mol。
17.防治环境污染,改善生态环境已成为全球共识。回答下列问题:
(1)汽车尾气中NO生成过程中的能量变化如图所示。生成1 mol (填“吸收”或“放出”) kJ的热量。
(2)汽车尾气(含CO、和等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和进行净化处理,写出NO和CO反应转化为无害气体的化学方程式 。
(3)硝酸工业废气中有氮氧化物(),利用尿素消除污染的转化反应为:
ⅰ.,ⅱ.无污染气体。
尿素中C元素的化合价 ,反应ⅱ的化学方程式为 。
(4)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成和,其离子方程式为 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是 。
(5)加入过量次氯酸钠可使废水中完全转化为,而本身被还原为NaCl。
①检验废水中是否存在的方法是 。
②若处理废水产生了0.448 L (标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为 mL。
三、实验探究题
18.用图中装置测定中和反应热的测定步骤如下:
Ⅰ、测量反应物的温度。
①用量筒量取盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取溶液,用温度计测量并记录NaOH溶液的温度。
Ⅱ、测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度()。
Ⅲ、重复测定2次,数据记录见下表。
实验次数 反应物温度/℃ 反应前体系温度 反应后体系温度 温度差
盐酸 NaOH溶液 /℃ /℃ /℃
1 24.9 25.1 25.0 28.3 3.3
2 24.8 25.0 24.9 28.1 3.2
3 25.0 25.2 25.1 28.5 3.4
注:稀盐酸和稀碱密度近似为,混合液的比热容为:
完成以下问题:
(1)上述操作中将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是 。
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,测得反应热的绝对值 (填“偏大”“不变”或“偏小”,下同);反应后NaOH剩余,测得反应热的数值 。
(3)计算此反应的反应热的数值Q= KJ,写出中和热(生成)的热化学方程式(焓变数值精确到0.01) 。
(4)若实验中将的盐酸与未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持)。
则NaOH溶液的浓度为 。
四、原理综合题
19.研究大气中含硫化合物(主要是和)的转化具有重要意义。
(1)工业上采用高温热分解的方法制取,在膜反应器中分离,发生的反应为
已知:① ;②
则 (用含、的式子表示)。
(2)土壤中的微生物可将大气中的经两步反应氧化成,两步反应的能量变化示意图如下:
则 。1mol全部被氧化为的热化学方程式为 。
(3)将和空气的混合气体通入、、的混合溶液中反应回收S,其物质转化如图所示。
①该循环过程中的作用是 ,图示总反应的化学方程式为 。
②已知反应③生成1mol时放出akJ热量,则反应③中转移个电子时,放出 kJ热量。(用含a的式子表示)
五、无机推断题
20.A、B、C、D、E为原子序数依次增大的短周期主族元素,其中A原子的最外层电子数是电子层数的2倍,各元素在周期表中的相对位置如图所示:
A B C
D E
请回答下列问题:
(1)B在元素周期表中的位置为 。
(2)属于火车严禁携带的易燃易爆液体,已知的燃烧热为,写出表示燃烧热的热化学方程式: 。
(3)D、E的最高价氧化物对应水化物的酸性由强到弱的顺序为 (用化学式表示),结合元素周期律解释其原因: 。
(4)最新合成的分子结构完美对称(只含单键),具有极强的热稳定性和化学惰性,试画出的结构式: 。
21.有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01)的与原子序数的关系如图2所示。[已知:;]
根据上述信息进行判厮,并回答下列问题:
(1)h在元素周期表中的位置是 。
(2)比较f、g、h常见离子的半径大小: (用离子符号表示)。
(3)写出e、f的最高价氧化物对应水化物反应的离子方程式: 。
(4)下列可作为比较f和金属性强弱的依据是___________。
A.测两种元素单质的硬度和熔、沸点
B.比较最高价氧化物对应水化物的碱性强弱
C.比较单质与同浓度盐酸反应的剧烈程度
D.比较两种元素在化合物中化合价的高低
(5)据报道,最近意大利科学家获得了极具研究价值的,其分子结构与白磷分子的正四面体结构相似。已知断裂键吸收热量,生成键放出热量,则气体在一定条件下生成气体反应的热化学方程式为 。
(6)由上述元素中的y、z、e组成的某剧毒化合物不慎泄漏时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以较少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【分析】反应中生成物总能量高于反应物总能量的反应为吸热反应,以此解题。
【详解】A.氧化钙溶于水属于放热反应,选项A错误;
B.铁粉与硫粉共热的反应属于放热反应,选项B错误;
C.酸碱中和反应为放热反应,选项C错误;
D.氢氧化钡晶体与氯化铵晶体混合属于吸热反应,选项D正确;
故选D。
2.B
【详解】A.从转化过程可知,反应②+反应③=反应⑤,则ΔH3=ΔH5-ΔH2,A错误;
B.反应①生成气态水,反应⑤生成液态水,生成液态水放出的热量更多,即ΔH1>ΔH5,B正确;
C.根据转化过程可知,反应④=反应①-反应②-反应③,ΔH4=ΔH1-ΔH2-ΔH3,C错误;
D.反应④实质为液态水转化为气态水,液态水转化为气态水吸热,ΔH4>0,D错误;
故答案选B。
3.A
【详解】A.可与反应生成乙硼烷其方程式为:,故A正确;
B.硼酸是弱酸不能拆成,故B错误;
C.燃烧热中应该生成液态水不是气态水,故C错误;
D.酸性条件下不能生成大量的,故D错误;
故选A。
4.D
【分析】由图示知,反应①方程式为,反应②方程式为,反应③方程式为。
【详解】A.由分析知,A为I2,B为HI,A错误;
B.原子不守恒,正确的方程式应为,B错误;
C.根据盖斯定律,反应一步完成还是分多步完成,反应热不变,故等压条件下,反应①②③反应热之和等于直接分解的反应热,C错误;
D.可由方程式①+②+③得到,则,D正确;
故选D。
5.A
【详解】A.氢气的燃烧热为1mol氢气完全燃烧生成液态水放出的热量,则表示氢气燃烧热的热化学方程式为H2(g)+O2(g)=H2O(l) △H=—285.8kJ/mol,故A正确;
B.浓硫酸稀释时会放出热量,则含49.0g硫酸的浓硫酸与足量稀氢氧化钠溶液反应放出热量大于57.3kJ,故B错误;
C.气态水比液态水的能量高,则氢气与氧气充分反应生成等量的液态水比气态水放出的热量更多,故C错误;
D.氢气与碘蒸气生成碘化氢的反应为可逆反应,可逆反应不可能完全反应,所以1mol氢气与1mol碘蒸气充入密闭容器中充分反应后放出的热量小于11kJ,故D错误;
故选A。
6.C
【详解】A.由焓变可知石墨的能量低,则石墨比金刚石稳定,故A正确;
B.浓硫酸稀释放热,则含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ,故B正确;
C.燃烧热是1mol纯物质完全燃烧生成指定产物所放出的热量,4 g H2物质的量即2mol完全燃烧放出571.6 kJ热量,则H2(g)的燃烧热是285.8kJ mol-1,则 ,故C错误;
D.固态硫变为气体硫会吸收热量,改用固态硫,则1 mol S(s)完全反应放出的热量小于20.1 kJ,故D正确;
故选:C。
7.B
【详解】A.甲醇燃烧属于放热反应,A错误;
B.“江南忆”机器人所采用芯片的主要成分为硅单质,B正确;
C.锌合金镀金是金属材料,C错误;
D.“碳中和”指一段时间内直接或间接产生的二氧化碳或温室气体排放总量,通过植树造林、节能减排等形式,以抵消自身产生的二氧化碳的排放量,实现正负抵消,达到相对“零排放”,D错误;
答案选B。
8.D
【详解】A.氧气分子变为两个氧原子的过程需要断裂化学键,吸收能量所以ΔH3>0,氢原子和氧原子生成水分子得过程会有新化学键的形成,释放能量所以ΔH4<0,故ΔH3>ΔH4,A正确;
B.气态水分子能量高于液态水分子,所以液态水分子分解为氢气分子和氧气分子的过程吸热更多,故ΔH1>ΔH6,B正确;
C.ΔH2+ΔH3+ΔH4+ΔH5为反应的焓变,而ΔH1为其逆反应的焓变,数值相等,符号相反,所以ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0,C正确;
D.ΔH2在为2mol氢气断裂2molH—H所需要的能量,D错误;
答案选D。
9.A
【详解】根据题干描述,碘化氢分解的总反应是吸热的,而第二步是成键过程,一定是放热,故第一步必然吸热;
A.结合图像,第一步吸热,第二步放热,总反应吸热,符合上述分析,故A符合题意;
B.根据图像,总反应是放热反应,不符合上述分析,故B不符合题意;
C.根据图像,第二步吸热,不符合上述分析,故C不符合题意;
D.根据图像,第一步放热,第二步吸热,不符合上述分析,故D不符合题意。
答案选A。
10.C
【详解】A.由图可知溴化的,氯化的,A错误;
B.由于能量越低越稳定,由图可知,更稳定,B错误;
C.根据图像可知① ;② ;根据盖斯定律①-②得 ;③ ;④ ,根据盖斯定律③-④得 ,所以,C正确;
D.由图可知,① ,③ ,根据盖斯定律③-①得到 ,即 ,和的键能分别为、,则,D错误;
答案选C。
11.D
【详解】A.隔一段时间需打开止水夹放出气体,放出气体同时会有热量带出,因此会造成一定的热量损失,A正确;
B.相同条件下,用醋酸溶液代替盐酸,醋酸是弱酸部分电离,随着反应的进行会继续电离出氢离子,电离要吸热,最终放出热量值小,会使测得的△H偏大,B正确;
C.根据Q=cm△t=4.18 J/(g·℃)×100ml×1g/ml×°C=1396.12J=1.396kJ,△H=-==-56kJ·mol-1,生成1mol水放出的热量约为56 kJ,C正确;
D.用注射器注入50 mL 0.55 mol/LNaOH溶液要一次性迅速注入,以减少热量损失,D错误;
答案选D。
12.C
【详解】A.图1所示过程①发生的是反应Ⅰ,该过程焓变小于零,是放热反应,过程②是的分解,由反应Ⅰ-反应Ⅱ×3可得,焓变大于零,该过程是吸热反应,A正确;
B.反应Ⅱ是放热反应,生成物能量大于反应物能量,图2所示能量变化示意图正确,B正确;
C.根据盖斯定律,反应Ⅰ-2×反应Ⅱ得 ,C错误;
D.由于反应Ⅰ为放热反应,因此断开中的化学键吸收的能量小于形成和中的化学键释放的能量,D正确;
故答案选:C。
13.B
【分析】由图可知,反应物的总能量大于生成物的总能量,该反应为放热反应。
【详解】A.CO2通过炽热的C为吸热反应,与图示不符合,A错误;
B.Fe粉溶于稀硫酸为放热反应,与图示相符合,B正确;
C.NaHCO3溶于盐酸为吸热反应,与图示不相符合,C错误;
D.Ba(OH)2·8H2O与 NH4Cl反应为吸热反应,与图示不符合,D错误;
故选B。
14.C
【详解】A.由已知的能量变化图可知H2(g)+O2(g)=H2O(g) ΔH=反应物断键吸收的能量-生成物成键释放的能量=(436+249-930)kJ·mol-1=-245kJ·mol-1,即甲到丙属于放热反应,即甲具有的总能量大于丙,A错误;
B.氢气燃烧焓需要氢气的对应产物为液态水,但图中表示气态水的数据,故无法算出,B错误;
C.由已知的能量变化图可知H2(g)+O2(g)=H2O(g) ΔH=反应物断键吸收的能量-生成物成键释放的能量=(436+249-930)kJ·mol-1=-245kJ·mol-1,则热化学方程式2H2(g)+O2(g)=2H2O(g) ΔH=-245kJ·mol-1×2=-490kJ·mol-1,C正确;
D.乙→丙的过程中生成气态水时,释放930kJ的能量,若生成液态水,气态水转变为液态水会继续释放能量,则释放的能量将大于930kJ,D错误;
故选C。
15.D
【详解】A.分解水总反应为吸热反应,在此过程中,水的分解分两步,根据盖斯定律,若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应,A正确;
B.焓变的大小取决于反应物和生成物能量的大小,催化剂不影响焓变,B正确;
C.该过程中碳纳米点是碳单质,但碳原子之间存在共价键;氮化碳是化合物、存在共价键;H2O、H2O2、H2、O2等均只含共价键,所以图中物质构成中均只由共价键构成,C正确;
D.碳量子点是一类具有显著荧光性能的零维碳纳米材料只含碳原子,属于碳单质,与胶粒直径吻合,但是需要分散到分散剂才能形成胶体,D错误;
故选D。
16.(1)AD
(2) 465 不变
(3) N2H4+2HCl=N2H6Cl2 -1310.4
【详解】(1)A.需要加热才能发生的反应也可能是放热反应,比如燃烧,A正确;
B.化学键断裂时会吸收能量,B错误;
C.反应物的总能量高于生成物的总能量表现为放热反应,C错误;
D.反应物的总键能高于生成物的总键能表现为吸热反应,D正确;
故正确的选AD;
(2)根据反应CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4kJ/mol,ΔH等于反应物的总键能减去生成物的总键能,所以(4×415.1+2a) (1076+3×436) =+206.4,a=465 ;催化剂只改变反应速率,不改变化学反应的焓变,所以ΔH不变;
(3)①N2H4的电子式为: ;②联氨相当于二元弱碱,与过量HCl反应的化学方程式为:N2H4+2HCl=N2H6Cl2;③根据已知,
N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/mol 反应I
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol 反应II
H2O(g)=H2O(l) ΔH=-44.0kJ/mol 反应III
根据盖斯定律,将II×2 I+III×4可得目标方程式,所以其ΔH=(-534×2)-66.4+(-44)×4= 1310.4 kJ/mol。
17.(1) 吸收 90
(2)
(3) +4
(4) 溶液pH越小,HClO的浓度越大,氧化NO能力越强
(5) 取少量废水于试管中,加入氢氧化钠溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则证明废水中有 30
【详解】(1)根据分析,,则生成1molNO吸收90kJ的热量;
故答案为:吸收;90;
(2)含N的无害气体为N2,含C的无害气体为CO2,故;
故答案为:;
(3)CO(NH2)2中C为+4价,NO2中N由+4价降低到0价N2,CO(NH2)2中N由-3升高到0价,根据得失电子守恒,;
故答案为:+4;;
(4)①根据得失电子原理,HClO中Cl由+1价降低-1,得2个电子,NO由+2价升高到+5价,根据得失电子守恒,;
故答案为:;
②溶液pH越小,HClO的浓度越大,氧化NO能力越强,故NaClO溶液的初始pH越小,NO转化率越高;
故答案为:溶液pH越小,HClO的浓度越大,氧化NO能力越强;
(5)①取少量废水于试管中,加入氢氧化钠溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则证明废水中有铵根;
故答案为:取少量废水于试管中,加入氢氧化钠溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则证明废水中有铵根;
②ClO-中Cl的化合价由+1价降低-1价,得2个电子,2个铵根中N由-3价升高到0价N2,共失去6个电子,根据得失电子守恒,,则;
故答案为:30。
18.(1)减少热量散失,减小实验误差
(2) 偏小 不变
(3)
(4)
【详解】(1)将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是减少热量散失,减小实验误差;
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,则反应前溶液温度偏高,测得反应热的绝对值偏小;NaOH过量,反应后NaOH剩余,生成的水的量不变,测得反应热的数值不变;
(3)三次实验测得的温差平均值为3.3℃,反应放出的热量为,50mL 0.50盐酸与50mL 0.55NaOH溶液反应共生成0.025mol水,中和热值:,中和热(生成1mol )的热化学方程式;
(4)盐酸加入30mL时,温度最高,说明此时酸碱恰好完全中和,,解得;
19.(1)
(2) -442.39
(3) 催化作用
【详解】(1)已知:①;②,根据盖斯定律,①×2+②得为,其;
(2)根据第一步反应的能量图可知 ,则的焓变为;
根据第二步反应的能量图可知 ,将第一步反应和第二步反应相加得到
(3)整个循环过程中没有被消耗,是催化剂,起催化作用;反应③的方程式为: ,已知反应③生成1mol时放出akJ热量,根据反应方程式可知生成1mol转移2mol电子,所以转移个电子时,放出热量。
20.(1)第二周期ⅤA族
(2)
(3) S和位于同周期,电子层数相同,核电荷数:,原子半径:,非金属性:
(4)
【分析】A、B、C、D、E为原子序数依次增大的短周期主族元素,根据各元素在周期表中的相对位置可知,A、B、C在第二周期,D、E在第三周期,A原子的最外层电子数是电子层数的2倍,则A为C元素,B、C、D、E依次为N、F、S、Cl元素。
【详解】(1)根据分析,B为N元素,N元素在元素周期表中的位置为第二周期第ⅤA族;
(2)AD2为CS2,CS2完全燃烧的产物为CO2(g)、SO2(g),CS2的燃烧热=-1076.8kJ/mol,则表示CS2燃烧热的热化学方程式为CS2(l)+3O2(g)= CO2(g)+2SO2(g) =-1076.8kJ/mol;
(3)D、E都处于第三周期,同周期从左到右主族元素的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强,非金属性S<Cl,则D、E的最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>H2SO4;原因是:S和Cl位于同周期,电子层数相同,核电荷数:Cl>S,原子半径:Cl<S,非金属性:Cl>S;
(4)A8C8为C8F8,C原子最外层有4个电子,F原子最外层有7个电子,C8F8分子结构完美对称(只含单键),具有极强的热稳定性和化学惰性,则每个F原子形成1个F—C键、每个C原子形成1个C—F键和3个C—C键,C8F8的结构式为。
21.(1)第三周期第VIIA族
(2)
(3)
(4)BC
(5)
(6)
【分析】从图中的化合价、原子半径的大小及原子序数,可知x为H元素,y为C元素,d为O元素,f为Al元素,z、e、g、h的最高价氧化物对应水化物溶液浓度均为0.01mol/L,e的pH为12,为一元强碱,则e为Na元素,z、h的pH均为2,为一元强酸,则z为N元素、h为Cl元素;g的pH小于2,为二元强酸,则g为S元素;
【详解】(1)h为Cl元素,其在元素周期表中的位置是第三周期第VIIA族;
(2)离子电子层越多,离子半径越大,当电子层结构相同的离子,核电荷数越大半径越小,则离子半径:;
(3)e、f的最高价氧化物对应水化物分别为NaOH、Al(OH)3,其反应离子方程式为;
(4)A.单质的硬度和熔、沸点,属于物理性质,不能比较元素金属性强弱,A错误;
B.元素金属性越强,最高价氧化物对应水化物的碱性越强,则比较最高价氧化物对应水化物的碱性强弱能比较元素金属性强弱,B正确;
C.单质与同浓度盐酸反应越剧烈,说明金属性越强,则比较单质与同浓度盐酸反应的剧烈程度能比较元素金属性强弱,C正确;
D.化合物中金属元素化合价越高,说明金属原子失去电子越多,但金属性强弱与失去电子数目无关,与得失电子难易程度有关,则不能比较元素金属性强弱,D错误;
故选BC;
(5)根据原子守恒可知,一个N4分子生成2个N2分子,一个N4分子中含有6个N-N键,破坏1molN4分子中含有6molN-N键需要吸收167kJ/mol×6mol=1002kJ能量,生成2molNN键放出942 kJ/mol×2mol=1884kJ能量,所以该反应放出1884kJ-1002kJ=882kJ能量,则热化学方程式为;
(6)化合物NaCN不慎泄漏时,通常采用喷洒过氧化氢溶液的方式处理,以较少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,应生成NaHCO3、NH3,该反应的化学方程式为。
答案第1页,共2页
答案第1页,共2页
姓名()班级()学号()
一、单选题
1.下列反应中生成物总能量高于反应物总能量的是
A.氧化钙溶于水 B.铁粉与硫粉共热
C.强酸强碱中和 D.氢氧化钡晶体与氯化铵晶体的反应
2.在一定条件下可发生如图所示的一系列反应。下列说法正确的是
A. B.
C. D.
3.硼单质及其化合物有重要的应用。硼晶体熔点为2076℃,可形成多种卤化物。可与反应生成。可与反应生成乙硼烷(标准燃烧热为),其分子中一个硼与周围的四个氢形成正四面体,结构式为,具有还原性。乙硼烷易水解生成与,是一种一元弱酸,可作吸水剂。乙硼烷可与反应生成氨硼烷(),其在一定条件下可以脱氢,最终得到BN。乙硼烷也可与NaH反应生成,是一种常用的还原剂。下列化学反应表示正确的是
A.乙硼烷的制备:
B.乙硼烷的水解:
C.乙硼烷的燃烧:
D.乙硼烷酸性条件下还原乙酸:
4.工业中可用碘硫循环法处理气体(如下图所示),同时实现零碳排放制氢和硫。下列说法正确的是
已知:
A.反应物B是
B.反应①方程式为
C.等压条件下,反应①②③反应热之和小于直接分解的反应热
D.碘硫循环法总反应热化学方程式为
5.化学反应在有新物质生成的同时,一定伴随有能量的变化。下列说法正确的是
A.已知H2的燃烧热为285.8kJ/mol,则表示H2燃烧热的热化学方程式为H2(g)+O2(g)=H2O(l) △H=-285.8kJ/mol
B.已知H+(aq)+OH—(ag)=H2O(l) △H=—57.3kJ/mol,用含49.0gH2SO4的浓硫酸与足量稀NaOH溶液反应,放出57.3kJ热量
C.H2(g)与O2(g)充分反应生成等量的气态水比液态水放出的热量更多
D.已知I2(g)+H2(g) 2HI(g) △H=-11kJ/mol,现将1molI2(g)和1molH2(g)充入密闭容器中充分反应后,放出的热量为11kJ
6.下列说法或表示方法不正确的是
A.由 ,可知石墨比金刚石稳定
B.在稀溶液中: ,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
C.在101 kPa时,4 g H2完全燃烧生成液态水,放出571.6 kJ热量,氢气燃烧热的热化学方程式表示为:
D.已知 ,则1 mol S(s)完全反应,放出的热量小于20.1 kJ
7.2023年10月8日第19届亚运会在杭州圆满闭幕,本届亚运会秉持“绿色、智能、节俭、文明”的办会理念。下列说法正确的是
A.零碳甲醇作为本届亚运会的火炬燃料,甲醇燃烧属于吸热反应
B.吉祥物“江南忆”机器人所采用芯片的主要成分为硅单质
C.亚运会纪念章“琮琮”是由锌合金镀金制成的,锌合金镀金属于合成材料
D.场馆全部使用绿色能源,打造首届碳中和亚运会,碳中和就是不排放二氧化碳
8.几种物质间的转化焓变如图所示,下列说法不正确的是
A.ΔH3>ΔH4 B.ΔH1>ΔH6
C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0 D.H—H的键能为ΔH2
9.已知碘化氢分解吸热,分以下两步完成:2HI(g)→H2(g)+2I (g);2I (g)→I2(g),下列图像最符合上述反应历程的是
A. B.
C. D.
10.一定温度下,的氯化、溴化反应势能图及一段时间后产物的选择性如图,下列叙述正确的是
A.的氯化、溴化反应的均小于0
B.稳定性:
C.
D.和的键能差
11.某教师设计了如图所示的装置测定中和反应的反应热。磁力搅拌器通电后,搅拌磁子能高速转动。三次实验数据如下表所示,溶液密度均近似为1 g/mL,反应后生成的溶液比热容c约为4.18 J/(g·℃),且忽略量热计等的比热容,下列说法错误的是
盐酸与NaOH溶液反应时体系的温度变化情况
实验组号 反应前体系的温度T1/℃ 反应后体系的温度T2/℃ 温度差(T2-T1)/℃
1 20.8 24.1 3.3
2 20.8 24.2 3.4
3 20.9 24.3 3.4
A.隔一段时间需打开止水夹放出气体,防止容器内压强过大,但此操作会造成一定的热量损失
B.相同条件下,用醋酸溶液代替盐酸会使测得的△H偏大
C.该实验测得生成1 mol H2O时放出的热量约为56 kJ
D.用注射器分多次缓慢注入50 mL 0.55 mol/LNaOH溶液,以保证盐酸完全反应
12.肼在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。
已知200℃时:
反应Ⅰ:
反应Ⅱ:
下列说法不正确的是
A.图1所示过程①是放热反应、②是吸热反应。
B.反应Ⅱ的能量过程示意图如图2所示
C.200℃时,肼分解生成氮气和氢气的热化学方程式为
D.断开中的化学键吸收的能量小于形成和中的化学键释放的能量
13.下列反应的能量变化与图示相符的是
A.CO2通过炽热的C
B.Fe粉溶于稀硫酸
C.NaHCO3溶于盐酸
D.Ba(OH)2·8H2O与 NH4Cl反应
14.已知在25℃、1.01×105Pa下,1mol氢气在氧气中燃烧生成气态水的能量变化如图所示。下列有关说法正确的是
A.甲所具有的总能量小于丙
B.可用上图中的数据计算出氢气的摩尔燃烧焓
C.热化学方程式为2H2(g)+O2(g)=2H2O(g) △H=-490kJ/mol
D.乙→丙的过程中若生成液态水,释放的能量将小于930kJ
15.2023年10月4日,三位科学家因“发现和合成量子点”获得2023年诺贝尔化学奖。碳量子点是一类具有显著荧光性能的零维碳纳米材料,直径在2nm—10nm之间。我国化学家研究的一种新型复微合光催化剂[碳量子点/氮化碳(纳米复合物)]可以利用太阳光实现高效分解水,其原理如图所示。下列说法不正确的是
A.如果反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应
B.催化剂不能改变该过程Ⅰ和过程Ⅱ反应的
C.该过程中所有物质均只含有共价键
D.碳量子点零维碳纳米材料属于胶体
二、填空题
16.化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)下列有关化学变化中能量变化的说法中,正确的是___________。
A.需要加热才能发生的反应也可能是放热反应
B.化学键断裂时通常放出能量
C.反应物的总能量高于生成物的总能量表现为吸热反应
D.反应物的总键能高于生成物的总键能表现为吸热反应
(2)甲烷可用于生产合成气,其反应为CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4kJ/mol,已知断裂1 mol相关化学键所需的能量如下表:
化学键 H-H O-H C-H C=O
键能/(kJ·mol- ) 436 a 415.1 1076
则a= ,若加入催化剂改变上述反应历程,上述反应的 ΔH (填“变大”、“变小”或“不变”)
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。
① 联氨分子的电子式为 。
② 试写出联氨与过量HCl反应的化学方程式 。
③ 已知:N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol
H2O(g)=H2O(l) ΔH=-44.0kJ/mol
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) ΔH= kJ/mol。
17.防治环境污染,改善生态环境已成为全球共识。回答下列问题:
(1)汽车尾气中NO生成过程中的能量变化如图所示。生成1 mol (填“吸收”或“放出”) kJ的热量。
(2)汽车尾气(含CO、和等)是城市空气的污染源之一,三元催化可以将汽车尾气中的CO和进行净化处理,写出NO和CO反应转化为无害气体的化学方程式 。
(3)硝酸工业废气中有氮氧化物(),利用尿素消除污染的转化反应为:
ⅰ.,ⅱ.无污染气体。
尿素中C元素的化合价 ,反应ⅱ的化学方程式为 。
(4)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成和,其离子方程式为 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是 。
(5)加入过量次氯酸钠可使废水中完全转化为,而本身被还原为NaCl。
①检验废水中是否存在的方法是 。
②若处理废水产生了0.448 L (标准状况),则需消耗浓度为2 mol/L的次氯酸钠的体积为 mL。
三、实验探究题
18.用图中装置测定中和反应热的测定步骤如下:
Ⅰ、测量反应物的温度。
①用量筒量取盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取溶液,用温度计测量并记录NaOH溶液的温度。
Ⅱ、测量反应后体系的温度。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌;密切关注温度变化,将最高温度记为反应后体系的温度()。
Ⅲ、重复测定2次,数据记录见下表。
实验次数 反应物温度/℃ 反应前体系温度 反应后体系温度 温度差
盐酸 NaOH溶液 /℃ /℃ /℃
1 24.9 25.1 25.0 28.3 3.3
2 24.8 25.0 24.9 28.1 3.2
3 25.0 25.2 25.1 28.5 3.4
注:稀盐酸和稀碱密度近似为,混合液的比热容为:
完成以下问题:
(1)上述操作中将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是 。
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,测得反应热的绝对值 (填“偏大”“不变”或“偏小”,下同);反应后NaOH剩余,测得反应热的数值 。
(3)计算此反应的反应热的数值Q= KJ,写出中和热(生成)的热化学方程式(焓变数值精确到0.01) 。
(4)若实验中将的盐酸与未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持)。
则NaOH溶液的浓度为 。
四、原理综合题
19.研究大气中含硫化合物(主要是和)的转化具有重要意义。
(1)工业上采用高温热分解的方法制取,在膜反应器中分离,发生的反应为
已知:① ;②
则 (用含、的式子表示)。
(2)土壤中的微生物可将大气中的经两步反应氧化成,两步反应的能量变化示意图如下:
则 。1mol全部被氧化为的热化学方程式为 。
(3)将和空气的混合气体通入、、的混合溶液中反应回收S,其物质转化如图所示。
①该循环过程中的作用是 ,图示总反应的化学方程式为 。
②已知反应③生成1mol时放出akJ热量,则反应③中转移个电子时,放出 kJ热量。(用含a的式子表示)
五、无机推断题
20.A、B、C、D、E为原子序数依次增大的短周期主族元素,其中A原子的最外层电子数是电子层数的2倍,各元素在周期表中的相对位置如图所示:
A B C
D E
请回答下列问题:
(1)B在元素周期表中的位置为 。
(2)属于火车严禁携带的易燃易爆液体,已知的燃烧热为,写出表示燃烧热的热化学方程式: 。
(3)D、E的最高价氧化物对应水化物的酸性由强到弱的顺序为 (用化学式表示),结合元素周期律解释其原因: 。
(4)最新合成的分子结构完美对称(只含单键),具有极强的热稳定性和化学惰性,试画出的结构式: 。
21.有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01)的与原子序数的关系如图2所示。[已知:;]
根据上述信息进行判厮,并回答下列问题:
(1)h在元素周期表中的位置是 。
(2)比较f、g、h常见离子的半径大小: (用离子符号表示)。
(3)写出e、f的最高价氧化物对应水化物反应的离子方程式: 。
(4)下列可作为比较f和金属性强弱的依据是___________。
A.测两种元素单质的硬度和熔、沸点
B.比较最高价氧化物对应水化物的碱性强弱
C.比较单质与同浓度盐酸反应的剧烈程度
D.比较两种元素在化合物中化合价的高低
(5)据报道,最近意大利科学家获得了极具研究价值的,其分子结构与白磷分子的正四面体结构相似。已知断裂键吸收热量,生成键放出热量,则气体在一定条件下生成气体反应的热化学方程式为 。
(6)由上述元素中的y、z、e组成的某剧毒化合物不慎泄漏时,消防人员通常采用喷洒过氧化氢溶液的方式处理,以较少污染。反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.D
【分析】反应中生成物总能量高于反应物总能量的反应为吸热反应,以此解题。
【详解】A.氧化钙溶于水属于放热反应,选项A错误;
B.铁粉与硫粉共热的反应属于放热反应,选项B错误;
C.酸碱中和反应为放热反应,选项C错误;
D.氢氧化钡晶体与氯化铵晶体混合属于吸热反应,选项D正确;
故选D。
2.B
【详解】A.从转化过程可知,反应②+反应③=反应⑤,则ΔH3=ΔH5-ΔH2,A错误;
B.反应①生成气态水,反应⑤生成液态水,生成液态水放出的热量更多,即ΔH1>ΔH5,B正确;
C.根据转化过程可知,反应④=反应①-反应②-反应③,ΔH4=ΔH1-ΔH2-ΔH3,C错误;
D.反应④实质为液态水转化为气态水,液态水转化为气态水吸热,ΔH4>0,D错误;
故答案选B。
3.A
【详解】A.可与反应生成乙硼烷其方程式为:,故A正确;
B.硼酸是弱酸不能拆成,故B错误;
C.燃烧热中应该生成液态水不是气态水,故C错误;
D.酸性条件下不能生成大量的,故D错误;
故选A。
4.D
【分析】由图示知,反应①方程式为,反应②方程式为,反应③方程式为。
【详解】A.由分析知,A为I2,B为HI,A错误;
B.原子不守恒,正确的方程式应为,B错误;
C.根据盖斯定律,反应一步完成还是分多步完成,反应热不变,故等压条件下,反应①②③反应热之和等于直接分解的反应热,C错误;
D.可由方程式①+②+③得到,则,D正确;
故选D。
5.A
【详解】A.氢气的燃烧热为1mol氢气完全燃烧生成液态水放出的热量,则表示氢气燃烧热的热化学方程式为H2(g)+O2(g)=H2O(l) △H=—285.8kJ/mol,故A正确;
B.浓硫酸稀释时会放出热量,则含49.0g硫酸的浓硫酸与足量稀氢氧化钠溶液反应放出热量大于57.3kJ,故B错误;
C.气态水比液态水的能量高,则氢气与氧气充分反应生成等量的液态水比气态水放出的热量更多,故C错误;
D.氢气与碘蒸气生成碘化氢的反应为可逆反应,可逆反应不可能完全反应,所以1mol氢气与1mol碘蒸气充入密闭容器中充分反应后放出的热量小于11kJ,故D错误;
故选A。
6.C
【详解】A.由焓变可知石墨的能量低,则石墨比金刚石稳定,故A正确;
B.浓硫酸稀释放热,则含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ,故B正确;
C.燃烧热是1mol纯物质完全燃烧生成指定产物所放出的热量,4 g H2物质的量即2mol完全燃烧放出571.6 kJ热量,则H2(g)的燃烧热是285.8kJ mol-1,则 ,故C错误;
D.固态硫变为气体硫会吸收热量,改用固态硫,则1 mol S(s)完全反应放出的热量小于20.1 kJ,故D正确;
故选:C。
7.B
【详解】A.甲醇燃烧属于放热反应,A错误;
B.“江南忆”机器人所采用芯片的主要成分为硅单质,B正确;
C.锌合金镀金是金属材料,C错误;
D.“碳中和”指一段时间内直接或间接产生的二氧化碳或温室气体排放总量,通过植树造林、节能减排等形式,以抵消自身产生的二氧化碳的排放量,实现正负抵消,达到相对“零排放”,D错误;
答案选B。
8.D
【详解】A.氧气分子变为两个氧原子的过程需要断裂化学键,吸收能量所以ΔH3>0,氢原子和氧原子生成水分子得过程会有新化学键的形成,释放能量所以ΔH4<0,故ΔH3>ΔH4,A正确;
B.气态水分子能量高于液态水分子,所以液态水分子分解为氢气分子和氧气分子的过程吸热更多,故ΔH1>ΔH6,B正确;
C.ΔH2+ΔH3+ΔH4+ΔH5为反应的焓变,而ΔH1为其逆反应的焓变,数值相等,符号相反,所以ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=0,C正确;
D.ΔH2在为2mol氢气断裂2molH—H所需要的能量,D错误;
答案选D。
9.A
【详解】根据题干描述,碘化氢分解的总反应是吸热的,而第二步是成键过程,一定是放热,故第一步必然吸热;
A.结合图像,第一步吸热,第二步放热,总反应吸热,符合上述分析,故A符合题意;
B.根据图像,总反应是放热反应,不符合上述分析,故B不符合题意;
C.根据图像,第二步吸热,不符合上述分析,故C不符合题意;
D.根据图像,第一步放热,第二步吸热,不符合上述分析,故D不符合题意。
答案选A。
10.C
【详解】A.由图可知溴化的,氯化的,A错误;
B.由于能量越低越稳定,由图可知,更稳定,B错误;
C.根据图像可知① ;② ;根据盖斯定律①-②得 ;③ ;④ ,根据盖斯定律③-④得 ,所以,C正确;
D.由图可知,① ,③ ,根据盖斯定律③-①得到 ,即 ,和的键能分别为、,则,D错误;
答案选C。
11.D
【详解】A.隔一段时间需打开止水夹放出气体,放出气体同时会有热量带出,因此会造成一定的热量损失,A正确;
B.相同条件下,用醋酸溶液代替盐酸,醋酸是弱酸部分电离,随着反应的进行会继续电离出氢离子,电离要吸热,最终放出热量值小,会使测得的△H偏大,B正确;
C.根据Q=cm△t=4.18 J/(g·℃)×100ml×1g/ml×°C=1396.12J=1.396kJ,△H=-==-56kJ·mol-1,生成1mol水放出的热量约为56 kJ,C正确;
D.用注射器注入50 mL 0.55 mol/LNaOH溶液要一次性迅速注入,以减少热量损失,D错误;
答案选D。
12.C
【详解】A.图1所示过程①发生的是反应Ⅰ,该过程焓变小于零,是放热反应,过程②是的分解,由反应Ⅰ-反应Ⅱ×3可得,焓变大于零,该过程是吸热反应,A正确;
B.反应Ⅱ是放热反应,生成物能量大于反应物能量,图2所示能量变化示意图正确,B正确;
C.根据盖斯定律,反应Ⅰ-2×反应Ⅱ得 ,C错误;
D.由于反应Ⅰ为放热反应,因此断开中的化学键吸收的能量小于形成和中的化学键释放的能量,D正确;
故答案选:C。
13.B
【分析】由图可知,反应物的总能量大于生成物的总能量,该反应为放热反应。
【详解】A.CO2通过炽热的C为吸热反应,与图示不符合,A错误;
B.Fe粉溶于稀硫酸为放热反应,与图示相符合,B正确;
C.NaHCO3溶于盐酸为吸热反应,与图示不相符合,C错误;
D.Ba(OH)2·8H2O与 NH4Cl反应为吸热反应,与图示不符合,D错误;
故选B。
14.C
【详解】A.由已知的能量变化图可知H2(g)+O2(g)=H2O(g) ΔH=反应物断键吸收的能量-生成物成键释放的能量=(436+249-930)kJ·mol-1=-245kJ·mol-1,即甲到丙属于放热反应,即甲具有的总能量大于丙,A错误;
B.氢气燃烧焓需要氢气的对应产物为液态水,但图中表示气态水的数据,故无法算出,B错误;
C.由已知的能量变化图可知H2(g)+O2(g)=H2O(g) ΔH=反应物断键吸收的能量-生成物成键释放的能量=(436+249-930)kJ·mol-1=-245kJ·mol-1,则热化学方程式2H2(g)+O2(g)=2H2O(g) ΔH=-245kJ·mol-1×2=-490kJ·mol-1,C正确;
D.乙→丙的过程中生成气态水时,释放930kJ的能量,若生成液态水,气态水转变为液态水会继续释放能量,则释放的能量将大于930kJ,D错误;
故选C。
15.D
【详解】A.分解水总反应为吸热反应,在此过程中,水的分解分两步,根据盖斯定律,若反应Ⅱ是放热反应,则反应Ⅰ一定是吸热反应,A正确;
B.焓变的大小取决于反应物和生成物能量的大小,催化剂不影响焓变,B正确;
C.该过程中碳纳米点是碳单质,但碳原子之间存在共价键;氮化碳是化合物、存在共价键;H2O、H2O2、H2、O2等均只含共价键,所以图中物质构成中均只由共价键构成,C正确;
D.碳量子点是一类具有显著荧光性能的零维碳纳米材料只含碳原子,属于碳单质,与胶粒直径吻合,但是需要分散到分散剂才能形成胶体,D错误;
故选D。
16.(1)AD
(2) 465 不变
(3) N2H4+2HCl=N2H6Cl2 -1310.4
【详解】(1)A.需要加热才能发生的反应也可能是放热反应,比如燃烧,A正确;
B.化学键断裂时会吸收能量,B错误;
C.反应物的总能量高于生成物的总能量表现为放热反应,C错误;
D.反应物的总键能高于生成物的总键能表现为吸热反应,D正确;
故正确的选AD;
(2)根据反应CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.4kJ/mol,ΔH等于反应物的总键能减去生成物的总键能,所以(4×415.1+2a) (1076+3×436) =+206.4,a=465 ;催化剂只改变反应速率,不改变化学反应的焓变,所以ΔH不变;
(3)①N2H4的电子式为: ;②联氨相当于二元弱碱,与过量HCl反应的化学方程式为:N2H4+2HCl=N2H6Cl2;③根据已知,
N2(g)+2O2(g)=2NO2(g) ΔH=+66.4kJ/mol 反应I
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ/mol 反应II
H2O(g)=H2O(l) ΔH=-44.0kJ/mol 反应III
根据盖斯定律,将II×2 I+III×4可得目标方程式,所以其ΔH=(-534×2)-66.4+(-44)×4= 1310.4 kJ/mol。
17.(1) 吸收 90
(2)
(3) +4
(4) 溶液pH越小,HClO的浓度越大,氧化NO能力越强
(5) 取少量废水于试管中,加入氢氧化钠溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则证明废水中有 30
【详解】(1)根据分析,,则生成1molNO吸收90kJ的热量;
故答案为:吸收;90;
(2)含N的无害气体为N2,含C的无害气体为CO2,故;
故答案为:;
(3)CO(NH2)2中C为+4价,NO2中N由+4价降低到0价N2,CO(NH2)2中N由-3升高到0价,根据得失电子守恒,;
故答案为:+4;;
(4)①根据得失电子原理,HClO中Cl由+1价降低-1,得2个电子,NO由+2价升高到+5价,根据得失电子守恒,;
故答案为:;
②溶液pH越小,HClO的浓度越大,氧化NO能力越强,故NaClO溶液的初始pH越小,NO转化率越高;
故答案为:溶液pH越小,HClO的浓度越大,氧化NO能力越强;
(5)①取少量废水于试管中,加入氢氧化钠溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则证明废水中有铵根;
故答案为:取少量废水于试管中,加入氢氧化钠溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则证明废水中有铵根;
②ClO-中Cl的化合价由+1价降低-1价,得2个电子,2个铵根中N由-3价升高到0价N2,共失去6个电子,根据得失电子守恒,,则;
故答案为:30。
18.(1)减少热量散失,减小实验误差
(2) 偏小 不变
(3)
(4)
【详解】(1)将NaOH溶液迅速倒入量热计的内筒,并立即盖上杯盖的目的是减少热量散失,减小实验误差;
(2)测量过程中,测量盐酸后未清洗温度计即用来测量NaOH溶液温度,其他过程无误,则反应前溶液温度偏高,测得反应热的绝对值偏小;NaOH过量,反应后NaOH剩余,生成的水的量不变,测得反应热的数值不变;
(3)三次实验测得的温差平均值为3.3℃,反应放出的热量为,50mL 0.50盐酸与50mL 0.55NaOH溶液反应共生成0.025mol水,中和热值:,中和热(生成1mol )的热化学方程式;
(4)盐酸加入30mL时,温度最高,说明此时酸碱恰好完全中和,,解得;
19.(1)
(2) -442.39
(3) 催化作用
【详解】(1)已知:①;②,根据盖斯定律,①×2+②得为,其;
(2)根据第一步反应的能量图可知 ,则的焓变为;
根据第二步反应的能量图可知 ,将第一步反应和第二步反应相加得到
(3)整个循环过程中没有被消耗,是催化剂,起催化作用;反应③的方程式为: ,已知反应③生成1mol时放出akJ热量,根据反应方程式可知生成1mol转移2mol电子,所以转移个电子时,放出热量。
20.(1)第二周期ⅤA族
(2)
(3) S和位于同周期,电子层数相同,核电荷数:,原子半径:,非金属性:
(4)
【分析】A、B、C、D、E为原子序数依次增大的短周期主族元素,根据各元素在周期表中的相对位置可知,A、B、C在第二周期,D、E在第三周期,A原子的最外层电子数是电子层数的2倍,则A为C元素,B、C、D、E依次为N、F、S、Cl元素。
【详解】(1)根据分析,B为N元素,N元素在元素周期表中的位置为第二周期第ⅤA族;
(2)AD2为CS2,CS2完全燃烧的产物为CO2(g)、SO2(g),CS2的燃烧热=-1076.8kJ/mol,则表示CS2燃烧热的热化学方程式为CS2(l)+3O2(g)= CO2(g)+2SO2(g) =-1076.8kJ/mol;
(3)D、E都处于第三周期,同周期从左到右主族元素的非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强,非金属性S<Cl,则D、E的最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>H2SO4;原因是:S和Cl位于同周期,电子层数相同,核电荷数:Cl>S,原子半径:Cl<S,非金属性:Cl>S;
(4)A8C8为C8F8,C原子最外层有4个电子,F原子最外层有7个电子,C8F8分子结构完美对称(只含单键),具有极强的热稳定性和化学惰性,则每个F原子形成1个F—C键、每个C原子形成1个C—F键和3个C—C键,C8F8的结构式为。
21.(1)第三周期第VIIA族
(2)
(3)
(4)BC
(5)
(6)
【分析】从图中的化合价、原子半径的大小及原子序数,可知x为H元素,y为C元素,d为O元素,f为Al元素,z、e、g、h的最高价氧化物对应水化物溶液浓度均为0.01mol/L,e的pH为12,为一元强碱,则e为Na元素,z、h的pH均为2,为一元强酸,则z为N元素、h为Cl元素;g的pH小于2,为二元强酸,则g为S元素;
【详解】(1)h为Cl元素,其在元素周期表中的位置是第三周期第VIIA族;
(2)离子电子层越多,离子半径越大,当电子层结构相同的离子,核电荷数越大半径越小,则离子半径:;
(3)e、f的最高价氧化物对应水化物分别为NaOH、Al(OH)3,其反应离子方程式为;
(4)A.单质的硬度和熔、沸点,属于物理性质,不能比较元素金属性强弱,A错误;
B.元素金属性越强,最高价氧化物对应水化物的碱性越强,则比较最高价氧化物对应水化物的碱性强弱能比较元素金属性强弱,B正确;
C.单质与同浓度盐酸反应越剧烈,说明金属性越强,则比较单质与同浓度盐酸反应的剧烈程度能比较元素金属性强弱,C正确;
D.化合物中金属元素化合价越高,说明金属原子失去电子越多,但金属性强弱与失去电子数目无关,与得失电子难易程度有关,则不能比较元素金属性强弱,D错误;
故选BC;
(5)根据原子守恒可知,一个N4分子生成2个N2分子,一个N4分子中含有6个N-N键,破坏1molN4分子中含有6molN-N键需要吸收167kJ/mol×6mol=1002kJ能量,生成2molNN键放出942 kJ/mol×2mol=1884kJ能量,所以该反应放出1884kJ-1002kJ=882kJ能量,则热化学方程式为;
(6)化合物NaCN不慎泄漏时,通常采用喷洒过氧化氢溶液的方式处理,以较少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,应生成NaHCO3、NH3,该反应的化学方程式为。
答案第1页,共2页
答案第1页,共2页
