安徽省合肥市包河区2023-2024学年高一上学期期中考试化学试题(无答案)
文档属性
| 名称 | 安徽省合肥市包河区2023-2024学年高一上学期期中考试化学试题(无答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 11:16:00 | ||
图片预览


文档简介
合肥市包河区2023-2024学年高一上学期期中考试
化学
考生注意:
1.本试卷分选择题和非选择题两部分.满分100分,考试时间75分钟.
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚.
3.考生作答时,请将答案答在答题卡上.选择题每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效.
4.本卷命题范围:必修第一册第一章、第二章.
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5
一、选择题(本题共15小题,每小题3分,共45分.在每小题给出的四个选项中只有一项是符合题目要求的)
1.古典诗词凝聚了古人的智慧,是古人为我们留下的宝贵精神财富.下列诗词中涉及氧化还原反应的是( )
A.日照香炉生紫烟,遥看瀑布挂前川 B.梅须逊雪三分白,雪却输梅一段香
C.春蚕到死丝方尽,蜡炬成灰泪始干 D.千锤万凿出深山,烈火焚烧若等闲
2.一种以太阳能聚热驱动制备和的过程如图所示,是总反应的催化剂,下列说法正确的是( )
A.属于酸性氧化物 B.吸氮反应中氧化产物与还原产物的分子个数比为
C.和互为同素异形体 D.整个过程中铝元素化合价没有发生变化
3.下列对所学概念的认识,正确的是( )
A.由同一种元素组成的物质一定是纯净物
B.胶体区别于溶液的本质特征是分散质粒子直径大小
C.熔融状态下不能导电的化合物一定不是电解质
D.有单质参加的反应一定是氧化还原反应
4.咖啡含有咖啡因(化学式为).常温下,如果一杯体积为的咖啡中含有咖啡因,设为阿伏加德罗常数的值.下列说法正确的是( )
A.咖啡因的摩尔质量为 B.该咖啡中咖啡因的物质的量浓度为
C.所含咖啡因的分子数为 D.咖啡因中氢元素的质量分数最高
5.下列物质性质和用途都正确且二者有相关性的是( )
A.次氯酸可用作棉、麻和纸张的漂白剂,因为次氯酸具有强氧化性
B.可用作食用碱或工业用碱,主要是因为很稳定,不易分解
C.可用作呼吸面具的供氧剂,因为中含有氧分子
D.某些金属化合物可用于制作绚丽多彩的烟花,主要是因为这些金属化合物均易燃
6.对下列离子组在溶液中能否大量共存的判断和分析均正确的是( )
选项 离子组 判断和分析
A 、、、 不能大量共存,和会产生胶体
B 、、、 能大量共存,离子间不反应
C 、、、 不能大量共存,酸性条件下,会和发生氧化还原反应
D 、、、 能大量共存,离子间不反应
7.下列反应的离子方程式书写正确的是( )
A.将氯气溶于水制备次氯酸:
B.在过氧化钠上滴加蒸馏水:
C.向溶液中加入少量溶液:
D.向碳酸氢钠溶液中滴加稀硫酸:
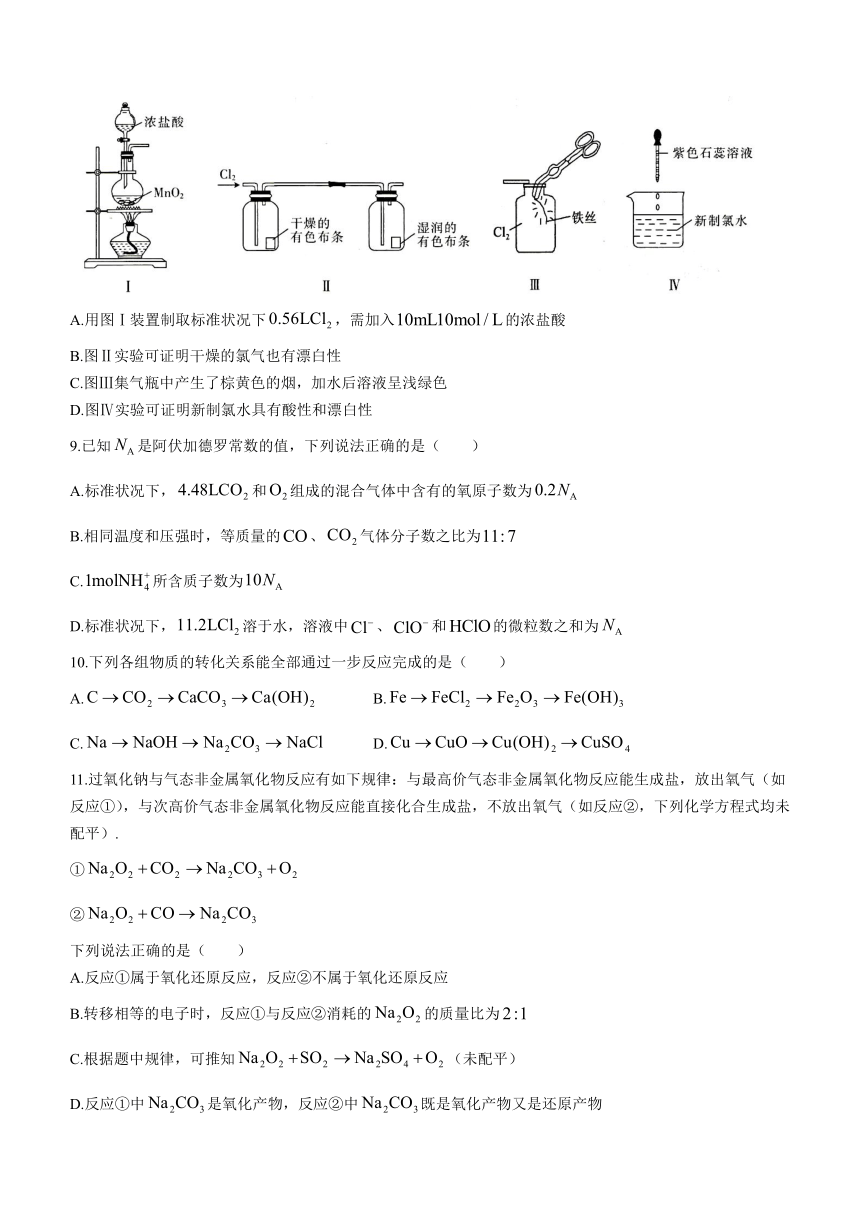
8.某同学用如下实验装置制备并检验的性质.下列说法正确的是( )
A.用图Ⅰ装置制取标准状况下,需加入的浓盐酸
B.图Ⅱ实验可证明干燥的氯气也有漂白性
C.图Ⅲ集气瓶中产生了棕黄色的烟,加水后溶液呈浅绿色
D.图Ⅳ实验可证明新制氯水具有酸性和漂白性
9.已知是阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,和组成的混合气体中含有的氧原子数为
B.相同温度和压强时,等质量的、气体分子数之比为
C.所含质子数为
D.标准状况下,溶于水,溶液中、和的微粒数之和为
10.下列各组物质的转化关系能全部通过一步反应完成的是( )
A. B.
C. D.
11.过氧化钠与气态非金属氧化物反应有如下规律:与最高价气态非金属氧化物反应能生成盐,放出氧气(如反应①),与次高价气态非金属氧化物反应能直接化合生成盐,不放出氧气(如反应②,下列化学方程式均未配平).
①
②
下列说法正确的是( )
A.反应①属于氧化还原反应,反应②不属于氧化还原反应
B.转移相等的电子时,反应①与反应②消耗的的质量比为
C.根据题中规律,可推知(未配平)
D.反应①中是氧化产物,反应②中既是氧化产物又是还原产物
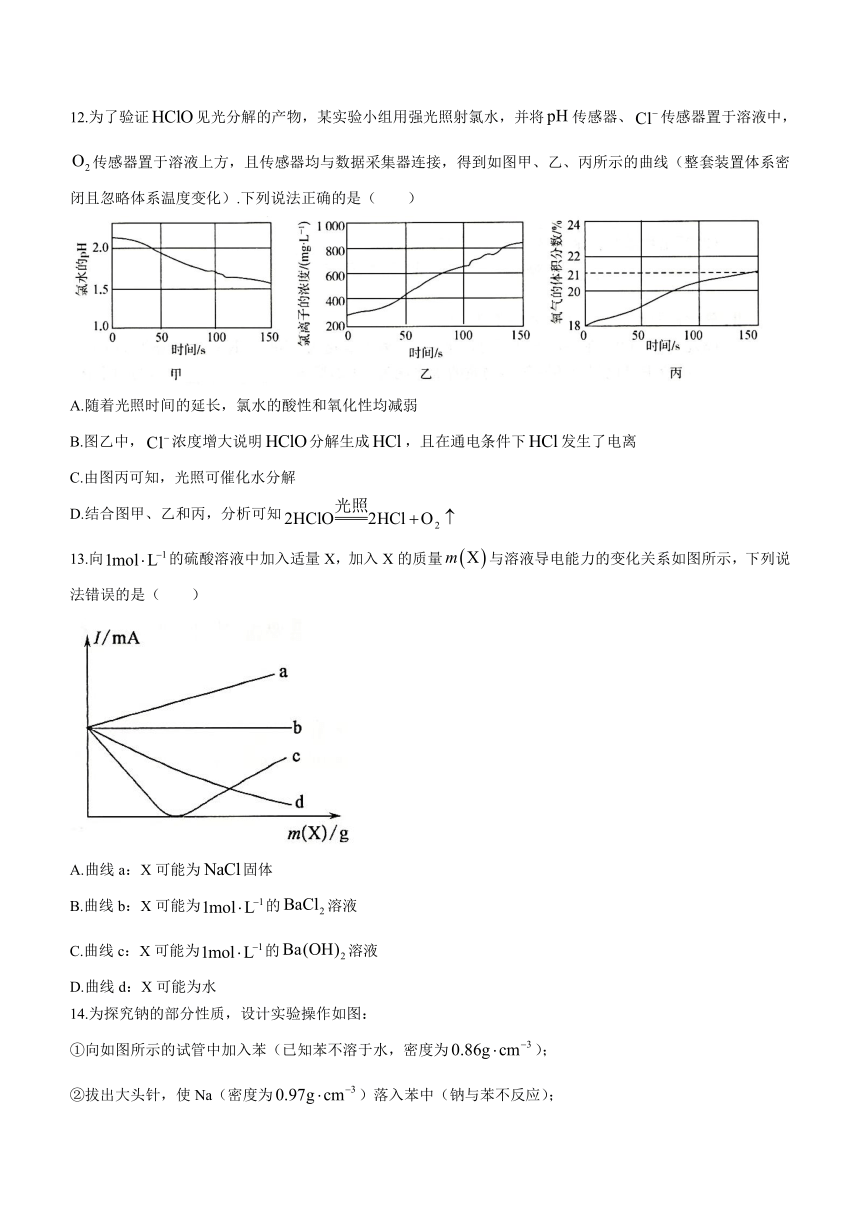
12.为了验证见光分解的产物,某实验小组用强光照射氯水,并将传感器、传感器置于溶液中,传感器置于溶液上方,且传感器均与数据采集器连接,得到如图甲、乙、丙所示的曲线(整套装置体系密闭且忽略体系温度变化).下列说法正确的是( )
A.随着光照时间的延长,氯水的酸性和氧化性均减弱
B.图乙中,浓度增大说明分解生成,且在通电条件下发生了电离
C.由图丙可知,光照可催化水分解
D.结合图甲、乙和丙,分析可知
13.向的硫酸溶液中加入适量X,加入X的质量与溶液导电能力的变化关系如图所示,下列说法错误的是( )
A.曲线a:X可能为固体
B.曲线b:X可能为的溶液
C.曲线c:X可能为的溶液
D.曲线d:X可能为水
14.为探究钠的部分性质,设计实验操作如图:
①向如图所示的试管中加入苯(已知苯不溶于水,密度为);
②拔出大头针,使Na(密度为)落入苯中(钠与苯不反应);
③从长颈漏斗中加入饱和澄清石灰水(密度约为).
对上述实验现象的说法错误的是( )
A.Na在石灰水与苯的界面处反应,并上下跳动
B.Na燃烧,最终消失
C.澄清石灰水变浑浊
D.苯层可观察到有气泡产生
15.向溶液中逐渐通入,其中、随通入物质的量的变化如图所示(已知:).下列说法正确的是( )
A.
B.由图可判断反应可以发生
C.当溶液中时,可能在之间
D.时,总的离子方程式为
二、非选择题(本题包括4小题,共55分)
16.(14分)
Ⅰ.分类法有助于人们发现和预测物质的性质,在化学学习中,科学的分类方法几乎是无可替代的.
(1)按要求对以下物质进行分类:①黄铜;②;③溶液;④熔融;⑤酒精;⑥氨气;⑦气体.上述物质中能导电的是___________(填序号,下同);属于电解质的是__________;属于非电解质的是__________________.
(2)写出物质②在水溶液中的电离方程式:____________________;干燥的不能导电的原因是__________________.
Ⅱ.氧化还原反应是一类重要的化学反应.
(3)已知在一定条件下可以把离子氧化为,被还原为,反应中氧化剂与还原剂的物质的量之比为,则_________,写出上述反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______________.若中含氧原子的个数为,则的相对原子质量为_________________.
17.(13分)农作物生产离不开肥料,其中对N、P、K三种元素的需求最大.下图为培养某植物需要配制的营养液.
某种植物营养液成分表 净含量:
(1)所用容量瓶在使用前应______________.
(2)配制溶液时,正确的操作顺序是C→_______→_________→___________→A→E(填字母).
操作A为定容,具体的操作方法是_________________________.
(3)在配制过程中,下列实验操作会使所配制溶液的浓度偏小的是_________(填字母).
A.配制溶液时,容量瓶用水洗净后未干燥
B.洗涤时,未冲洗玻璃棒
C.定容时仰视刻度线
D.定容后经摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)某同学在实验室中找到了、、、四种物质用于配制该营养液,所取上述各物质(按上述顺序)的物质的量之比为__________.若用实验室剩余的的溶液代替固体,则需要的溶液的体积为____________.
(5)若要检验所配制营养液中的,可进行的操作是_________________________.
18.(14分)联合制碱法(又称侯氏制碱法),因其提高了食盐的转化率,减少了对环境的污染,从而赢得了国际化工界的高度评价.联合制碱法的主要过程如图1所示:
图1
已知:沉淀池中的反应原理如下:
i.
ii.
(1)“侯氏制碱法”中的“碱”为_________(填化学式);写出煅烧炉中反应的化学方程式:____________.
(2)在饱和食盐水中先通入,再通入,这样操作的目的是______________.
(3)从“母液”中可得到的副产品为_____________,用途是_________________(任写一种).
(4)“循环Ⅱ”中参与循环的物质除水外还有_______________________________.
(5)常温下,在溶液中逐滴加入溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如图2所示.回答下列问题:
图2
①在同一溶液中,三种含碳微粒、、__________(填“能”或“不能”)大量共存.
②将和混合并配成溶液,向溶液中滴加稀盐酸.下列图像(图3)能正确表示加入盐酸的体积和生成的物质的量的关系的是__________(填字母).
图3
19.(14分)84消毒液是常用消毒剂,主要成分为,某化学小组在实验室制备84消毒液并探究其相关性质.回答下列问题:
(1)装置甲中盛放浓盐酸的仪器名称是___________,装置甲中反应的离子方程式为_______________.
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为_____________________________.
(3)装置丁制备的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取,理论上反应中转移电子数为______________.
(4)装置戊的作用是________________________.
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测.
猜测1:双氧水与消毒液发生反应产生氧气.猜测2:……
①猜测1中反应的化学方程式为______________________________;猜测2可能为____________________.
②为了验证猜想,某探究小组设计用如图装置进行实验.操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到________________________,则证明猜测1正确.
化学
考生注意:
1.本试卷分选择题和非选择题两部分.满分100分,考试时间75分钟.
2.答题前,考生务必用直径0.5毫米黑色墨水签字笔将密封线内项目填写清楚.
3.考生作答时,请将答案答在答题卡上.选择题每小题选出答案后,用2B 铅笔把答题卡上对应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效.
4.本卷命题范围:必修第一册第一章、第二章.
5.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5
一、选择题(本题共15小题,每小题3分,共45分.在每小题给出的四个选项中只有一项是符合题目要求的)
1.古典诗词凝聚了古人的智慧,是古人为我们留下的宝贵精神财富.下列诗词中涉及氧化还原反应的是( )
A.日照香炉生紫烟,遥看瀑布挂前川 B.梅须逊雪三分白,雪却输梅一段香
C.春蚕到死丝方尽,蜡炬成灰泪始干 D.千锤万凿出深山,烈火焚烧若等闲
2.一种以太阳能聚热驱动制备和的过程如图所示,是总反应的催化剂,下列说法正确的是( )
A.属于酸性氧化物 B.吸氮反应中氧化产物与还原产物的分子个数比为
C.和互为同素异形体 D.整个过程中铝元素化合价没有发生变化
3.下列对所学概念的认识,正确的是( )
A.由同一种元素组成的物质一定是纯净物
B.胶体区别于溶液的本质特征是分散质粒子直径大小
C.熔融状态下不能导电的化合物一定不是电解质
D.有单质参加的反应一定是氧化还原反应
4.咖啡含有咖啡因(化学式为).常温下,如果一杯体积为的咖啡中含有咖啡因,设为阿伏加德罗常数的值.下列说法正确的是( )
A.咖啡因的摩尔质量为 B.该咖啡中咖啡因的物质的量浓度为
C.所含咖啡因的分子数为 D.咖啡因中氢元素的质量分数最高
5.下列物质性质和用途都正确且二者有相关性的是( )
A.次氯酸可用作棉、麻和纸张的漂白剂,因为次氯酸具有强氧化性
B.可用作食用碱或工业用碱,主要是因为很稳定,不易分解
C.可用作呼吸面具的供氧剂,因为中含有氧分子
D.某些金属化合物可用于制作绚丽多彩的烟花,主要是因为这些金属化合物均易燃
6.对下列离子组在溶液中能否大量共存的判断和分析均正确的是( )
选项 离子组 判断和分析
A 、、、 不能大量共存,和会产生胶体
B 、、、 能大量共存,离子间不反应
C 、、、 不能大量共存,酸性条件下,会和发生氧化还原反应
D 、、、 能大量共存,离子间不反应
7.下列反应的离子方程式书写正确的是( )
A.将氯气溶于水制备次氯酸:
B.在过氧化钠上滴加蒸馏水:
C.向溶液中加入少量溶液:
D.向碳酸氢钠溶液中滴加稀硫酸:
8.某同学用如下实验装置制备并检验的性质.下列说法正确的是( )
A.用图Ⅰ装置制取标准状况下,需加入的浓盐酸
B.图Ⅱ实验可证明干燥的氯气也有漂白性
C.图Ⅲ集气瓶中产生了棕黄色的烟,加水后溶液呈浅绿色
D.图Ⅳ实验可证明新制氯水具有酸性和漂白性
9.已知是阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,和组成的混合气体中含有的氧原子数为
B.相同温度和压强时,等质量的、气体分子数之比为
C.所含质子数为
D.标准状况下,溶于水,溶液中、和的微粒数之和为
10.下列各组物质的转化关系能全部通过一步反应完成的是( )
A. B.
C. D.
11.过氧化钠与气态非金属氧化物反应有如下规律:与最高价气态非金属氧化物反应能生成盐,放出氧气(如反应①),与次高价气态非金属氧化物反应能直接化合生成盐,不放出氧气(如反应②,下列化学方程式均未配平).
①
②
下列说法正确的是( )
A.反应①属于氧化还原反应,反应②不属于氧化还原反应
B.转移相等的电子时,反应①与反应②消耗的的质量比为
C.根据题中规律,可推知(未配平)
D.反应①中是氧化产物,反应②中既是氧化产物又是还原产物
12.为了验证见光分解的产物,某实验小组用强光照射氯水,并将传感器、传感器置于溶液中,传感器置于溶液上方,且传感器均与数据采集器连接,得到如图甲、乙、丙所示的曲线(整套装置体系密闭且忽略体系温度变化).下列说法正确的是( )
A.随着光照时间的延长,氯水的酸性和氧化性均减弱
B.图乙中,浓度增大说明分解生成,且在通电条件下发生了电离
C.由图丙可知,光照可催化水分解
D.结合图甲、乙和丙,分析可知
13.向的硫酸溶液中加入适量X,加入X的质量与溶液导电能力的变化关系如图所示,下列说法错误的是( )
A.曲线a:X可能为固体
B.曲线b:X可能为的溶液
C.曲线c:X可能为的溶液
D.曲线d:X可能为水
14.为探究钠的部分性质,设计实验操作如图:
①向如图所示的试管中加入苯(已知苯不溶于水,密度为);
②拔出大头针,使Na(密度为)落入苯中(钠与苯不反应);
③从长颈漏斗中加入饱和澄清石灰水(密度约为).
对上述实验现象的说法错误的是( )
A.Na在石灰水与苯的界面处反应,并上下跳动
B.Na燃烧,最终消失
C.澄清石灰水变浑浊
D.苯层可观察到有气泡产生
15.向溶液中逐渐通入,其中、随通入物质的量的变化如图所示(已知:).下列说法正确的是( )
A.
B.由图可判断反应可以发生
C.当溶液中时,可能在之间
D.时,总的离子方程式为
二、非选择题(本题包括4小题,共55分)
16.(14分)
Ⅰ.分类法有助于人们发现和预测物质的性质,在化学学习中,科学的分类方法几乎是无可替代的.
(1)按要求对以下物质进行分类:①黄铜;②;③溶液;④熔融;⑤酒精;⑥氨气;⑦气体.上述物质中能导电的是___________(填序号,下同);属于电解质的是__________;属于非电解质的是__________________.
(2)写出物质②在水溶液中的电离方程式:____________________;干燥的不能导电的原因是__________________.
Ⅱ.氧化还原反应是一类重要的化学反应.
(3)已知在一定条件下可以把离子氧化为,被还原为,反应中氧化剂与还原剂的物质的量之比为,则_________,写出上述反应的离子方程式,并用单线桥法标出电子转移的方向和数目:_______________.若中含氧原子的个数为,则的相对原子质量为_________________.
17.(13分)农作物生产离不开肥料,其中对N、P、K三种元素的需求最大.下图为培养某植物需要配制的营养液.
某种植物营养液成分表 净含量:
(1)所用容量瓶在使用前应______________.
(2)配制溶液时,正确的操作顺序是C→_______→_________→___________→A→E(填字母).
操作A为定容,具体的操作方法是_________________________.
(3)在配制过程中,下列实验操作会使所配制溶液的浓度偏小的是_________(填字母).
A.配制溶液时,容量瓶用水洗净后未干燥
B.洗涤时,未冲洗玻璃棒
C.定容时仰视刻度线
D.定容后经摇匀、静置,发现液面下降,再加适量的蒸馏水
(4)某同学在实验室中找到了、、、四种物质用于配制该营养液,所取上述各物质(按上述顺序)的物质的量之比为__________.若用实验室剩余的的溶液代替固体,则需要的溶液的体积为____________.
(5)若要检验所配制营养液中的,可进行的操作是_________________________.
18.(14分)联合制碱法(又称侯氏制碱法),因其提高了食盐的转化率,减少了对环境的污染,从而赢得了国际化工界的高度评价.联合制碱法的主要过程如图1所示:
图1
已知:沉淀池中的反应原理如下:
i.
ii.
(1)“侯氏制碱法”中的“碱”为_________(填化学式);写出煅烧炉中反应的化学方程式:____________.
(2)在饱和食盐水中先通入,再通入,这样操作的目的是______________.
(3)从“母液”中可得到的副产品为_____________,用途是_________________(任写一种).
(4)“循环Ⅱ”中参与循环的物质除水外还有_______________________________.
(5)常温下,在溶液中逐滴加入溶液20mL,溶液中含碳元素的各种微粒的质量分数(纵轴)随溶液pH变化的部分情况如图2所示.回答下列问题:
图2
①在同一溶液中,三种含碳微粒、、__________(填“能”或“不能”)大量共存.
②将和混合并配成溶液,向溶液中滴加稀盐酸.下列图像(图3)能正确表示加入盐酸的体积和生成的物质的量的关系的是__________(填字母).
图3
19.(14分)84消毒液是常用消毒剂,主要成分为,某化学小组在实验室制备84消毒液并探究其相关性质.回答下列问题:
(1)装置甲中盛放浓盐酸的仪器名称是___________,装置甲中反应的离子方程式为_______________.
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为_____________________________.
(3)装置丁制备的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取,理论上反应中转移电子数为______________.
(4)装置戊的作用是________________________.
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测.
猜测1:双氧水与消毒液发生反应产生氧气.猜测2:……
①猜测1中反应的化学方程式为______________________________;猜测2可能为____________________.
②为了验证猜想,某探究小组设计用如图装置进行实验.操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到________________________,则证明猜测1正确.
同课章节目录
