3.2水的电离和溶液的PH(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2水的电离和溶液的PH(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 87.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 13:05:36 | ||
图片预览

文档简介
3.2水的电离和溶液的PH同步练习题
一、选择题
1.设NA为阿伏加德罗常数的值。下列说法正确的是
A.3molNO2溶于水转移的电子数为2NA
B.标准状况下,11.2 L SO3中含有的分子个数为0. 5 NA
C.1 L pH=13的氢氧化钠溶液中由水电离出的OH-的个数约为1 ×10-13 NA
D.17 g过氧化氢中含NA个共价键
2.常温下,下列说法正确的是
A.0.1 mol L 1醋酸溶液,加水稀释,溶液中减小
B.将金属Na加入水中,水的电离程度减小
C.的醋酸溶液中加入一定量的盐酸,醋酸电离平衡不移动
D.电离平衡向正向移动,弱电解质的电离度一定增大
3.下列溶液一定呈碱性的是
A.由水电离出的为的溶液
B.的溶液
C.使石蕊试液呈紫色的溶液
D.常温下,的氨水与的盐酸等体积混合后的溶液
4.K、Ka、Kw分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是
A.达平衡后,改变某一条件时K不变,的转化率可能增大、减小或不变
B.在500℃、20MPa条件下,在5L密闭容器中进行合成氨的反应,使用催化剂后K增大
C.室温下,说明的电离度一定比HCN的大
D.25℃时,pH均为4的盐酸和溶液中Kw不相等
5.某学生用中和滴定法测定某烧碱样品的纯度。先准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液,用待测烧碱溶液滴定0.200mol·L-1的盐酸标准液。下列操作会使烧碱样品纯度偏高的是
A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液
B.碱式滴定管用蒸馏水洗净后未润洗
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数
6.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1LpH=1的H2C2O4溶液中含有阳离子总数为0.2NA
B.12.0g二氧化硅晶体中含Si-O键的数目为0.4NA
C.常温下,1.6gO2与O3的混合气体中所含的原子数目为0.1NA
D.含0.4molHCl的浓盐酸与足量MnO2反应,转移电子数目为0.2NA
7.下列说法正确的是
A.当pH=7时,溶液一定呈中性
B.用pH试纸测出某溶液的pH值为3.2
C.0. 1 mol·L-1盐酸溶液中水电离出的c(H+)大于水电离出的c(OH-)
D.0. 1 mol·L-1盐酸溶液水电离出c(H+) 小于0. 1 mol·L-1醋酸溶液水电离出c(H+)
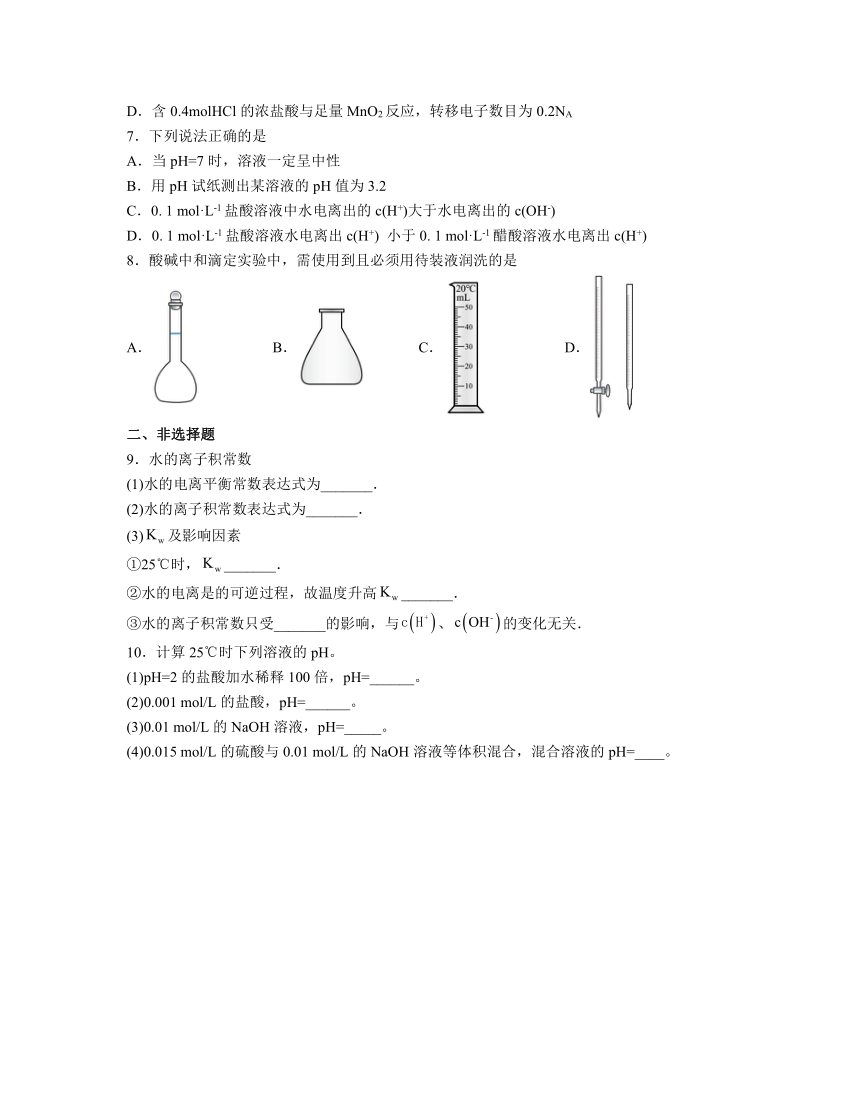
8.酸碱中和滴定实验中,需使用到且必须用待装液润洗的是
A. B. C. D.
二、非选择题
9.水的离子积常数
(1)水的电离平衡常数表达式为_______.
(2)水的离子积常数表达式为_______.
(3)及影响因素
①25℃时,_______.
②水的电离是的可逆过程,故温度升高_______.
③水的离子积常数只受_______的影响,与、的变化无关.
10.计算25℃时下列溶液的pH。
(1)pH=2的盐酸加水稀释100倍,pH=______。
(2)0.001 mol/L的盐酸,pH=______。
(3)0.01 mol/L的NaOH溶液,pH=_____。
(4)0.015 mol/L的硫酸与0.01 mol/L的NaOH溶液等体积混合,混合溶液的pH=____。
【参考答案】
一、选择题
1.A
解析:A.根据方程式3NO2+H2O=2HNO3+NO可知,3molNO2反应时转移的电子数为2NA,故A正确;
B.标准状况下, SO3不是气体,不能使用气体摩尔体积进行计算,故B错误;
C.未明确溶液的温度,不知道水的离子积,无法计算出由水电离出的OH-的数目,故C错误;
D.17g过氧化氢的物质的量为0.5mol,每个分子中含有3个共价键,故17g过氧化氢中含有1.5NA个共价键,故D错误;
故答案选A。
2.C
解析:A.0.1 mol L 1醋酸溶液,加水稀释,溶液中醋酸根浓度减小,则溶液中增大,故A错误;
B.将金属Na加入水中,钠与水电离出氢离子反应,消耗氢离子,平衡正向移动,因此水的电离程度增大,故B错误;
C.的醋酸溶液中加入一定量的盐酸,氢离子浓度不变,醋酸电离平衡不移动,故C正确;
D.电离平衡向正向移动,弱电解质的电离度不一定增大,比如向醋酸溶液中加冰醋酸,平衡正向移动,但电离程度减小,故D错误。
综上所述,答案为C。
3.D
解析:A. 溶液中水的电离被抑制,该溶液可能为酸溶液,故A错误;
B. 未指明温度,如100℃时的溶液呈中性,故B错误;
C. 石蕊试液呈紫色时,pH为5~8,此时溶液可能呈酸性、中性或碱性,故C错误;
D. ,等体积混合后氨水过量,溶液呈碱性,故D正确;
故选D。
4.A
【分析】化学平衡常数、电离常数和水的离子积常数等与温度有关,和浓度、压强、催化剂等无关。
解析:A.不改变温度的情况下,使用催化剂或改变压强或使用催化剂的同时改变压强,SO2 的转化率可能增大、减小或不变,但K不变,故A正确;
B.催化剂只能加快反应速率,不影响K,故B错误;
C.室温下 K(HCN)D.Kw只和温度有关,25℃时,pH均为4的盐酸和 NH4I 溶液中Kw相等,故D错误;
故选A。
5.D
解析:A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液,导致消耗的待测液体积偏大,会使烧碱样品纯度偏低,A错误;
B.碱式滴定管用蒸馏水洗净后未润洗,导致消耗的待测液体积偏大,会使烧碱样品纯度偏低, B错误;
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失,导致消耗的待测液体积偏大,会使烧碱样品纯度偏低, C错误;
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数,导致消耗的待测液体积偏小,会使烧碱样品纯度偏高, D正确;
故选D。
6.C
解析:A.1LpH=1的H2C2O4溶液中氢离子浓度为0.1mol/L,氢离子为0.1mol,含有阳离子总数为0.1NA,A错误;
B.12.0g二氧化硅晶体为0.2mol,1个硅原子形成4个硅氧键,则含Si-O键的数目为0.8NA,B错误;
C.常温下,1.6gO2与O3的混合气体中只含有氧原子,氧原子为1.6g÷16g/mol=0.1mol,则所含的原子数目为0.1NA,C正确;
D.随着反应的进行盐酸浓度减小,反应不再进行,故转移电子数目小于0.2NA,D错误;
故选C。
7.D
解析:A.任何温度下,溶液中的c(H+)= c(OH-),溶液呈中性,仅当温度为25℃时, pH=7的溶液一定呈中性,A错误;
B.pH试纸读数为整数,不能读出小数,故只能用pH试纸测出某溶液的pH值为接近3,B错误;
C.任何溶液中,水电离出的c(H+)等于水电离出的c(OH-),C错误;
D.0. 1 mol·L-1盐酸溶液中c(H+)大于0. 1 mol·L-1醋酸溶液c(H+),故前者对水的电离的抑制作用大于后者,故前者溶液中水电离出c(H+) 小于后者溶液中水电离出c(H+),D正确;
故答案为:D。
8.D
解析:A.容量瓶水洗后即可使用,若润洗导致配制溶液的浓度偏大,故A不符合题意;
B.锥形瓶水洗即可,若润洗,消耗标准液偏多,导致测定结果偏大,故B不符合题意;
C.量筒不需要润洗,故C不符合题意;
D.滴定管水洗后,需用待装液润洗,保证浓度不变,故D符合题意;
故答案选D。
二、非选择题
9. 吸热 增大
解析:略
10.3 12 2
解析:(1) pH=2的盐酸溶液中c(H+)=10-2mol/L,加水稀释100倍,溶液中c(H+)=10-4mol/L,pH=4;
故答案为:4。
(2) 0.001mol/L的盐酸,c(H+)=10-3mol/L,pH=3;
故答案为:3。
(3) 0.01mol/L的NaOH溶液,c(OH-)=10-2mol/L,根据Kw=c(OH-)×(H+)=10-14得溶液中c(H+)=10-12mol/L,pH=12;
故答案为:12。
(4) 0.015mol/L的硫酸与0.01 mol/L的NaOH溶液等体积混合,酸过量,溶液显酸性,设溶液的体积均为1L,所得混和溶液中c(H+)=(0.015mol/L×1L×2-0.01mol/L×1L)÷2L=10-2mol/L,pH=2;
故答案为:2
一、选择题
1.设NA为阿伏加德罗常数的值。下列说法正确的是
A.3molNO2溶于水转移的电子数为2NA
B.标准状况下,11.2 L SO3中含有的分子个数为0. 5 NA
C.1 L pH=13的氢氧化钠溶液中由水电离出的OH-的个数约为1 ×10-13 NA
D.17 g过氧化氢中含NA个共价键
2.常温下,下列说法正确的是
A.0.1 mol L 1醋酸溶液,加水稀释,溶液中减小
B.将金属Na加入水中,水的电离程度减小
C.的醋酸溶液中加入一定量的盐酸,醋酸电离平衡不移动
D.电离平衡向正向移动,弱电解质的电离度一定增大
3.下列溶液一定呈碱性的是
A.由水电离出的为的溶液
B.的溶液
C.使石蕊试液呈紫色的溶液
D.常温下,的氨水与的盐酸等体积混合后的溶液
4.K、Ka、Kw分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是
A.达平衡后,改变某一条件时K不变,的转化率可能增大、减小或不变
B.在500℃、20MPa条件下,在5L密闭容器中进行合成氨的反应,使用催化剂后K增大
C.室温下,说明的电离度一定比HCN的大
D.25℃时,pH均为4的盐酸和溶液中Kw不相等
5.某学生用中和滴定法测定某烧碱样品的纯度。先准确称量10.0g含有少量中性易溶杂质的样品,配成500mL待测溶液,用待测烧碱溶液滴定0.200mol·L-1的盐酸标准液。下列操作会使烧碱样品纯度偏高的是
A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液
B.碱式滴定管用蒸馏水洗净后未润洗
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数
6.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.1LpH=1的H2C2O4溶液中含有阳离子总数为0.2NA
B.12.0g二氧化硅晶体中含Si-O键的数目为0.4NA
C.常温下,1.6gO2与O3的混合气体中所含的原子数目为0.1NA
D.含0.4molHCl的浓盐酸与足量MnO2反应,转移电子数目为0.2NA
7.下列说法正确的是
A.当pH=7时,溶液一定呈中性
B.用pH试纸测出某溶液的pH值为3.2
C.0. 1 mol·L-1盐酸溶液中水电离出的c(H+)大于水电离出的c(OH-)
D.0. 1 mol·L-1盐酸溶液水电离出c(H+) 小于0. 1 mol·L-1醋酸溶液水电离出c(H+)
8.酸碱中和滴定实验中,需使用到且必须用待装液润洗的是
A. B. C. D.
二、非选择题
9.水的离子积常数
(1)水的电离平衡常数表达式为_______.
(2)水的离子积常数表达式为_______.
(3)及影响因素
①25℃时,_______.
②水的电离是的可逆过程,故温度升高_______.
③水的离子积常数只受_______的影响,与、的变化无关.
10.计算25℃时下列溶液的pH。
(1)pH=2的盐酸加水稀释100倍,pH=______。
(2)0.001 mol/L的盐酸,pH=______。
(3)0.01 mol/L的NaOH溶液,pH=_____。
(4)0.015 mol/L的硫酸与0.01 mol/L的NaOH溶液等体积混合,混合溶液的pH=____。
【参考答案】
一、选择题
1.A
解析:A.根据方程式3NO2+H2O=2HNO3+NO可知,3molNO2反应时转移的电子数为2NA,故A正确;
B.标准状况下, SO3不是气体,不能使用气体摩尔体积进行计算,故B错误;
C.未明确溶液的温度,不知道水的离子积,无法计算出由水电离出的OH-的数目,故C错误;
D.17g过氧化氢的物质的量为0.5mol,每个分子中含有3个共价键,故17g过氧化氢中含有1.5NA个共价键,故D错误;
故答案选A。
2.C
解析:A.0.1 mol L 1醋酸溶液,加水稀释,溶液中醋酸根浓度减小,则溶液中增大,故A错误;
B.将金属Na加入水中,钠与水电离出氢离子反应,消耗氢离子,平衡正向移动,因此水的电离程度增大,故B错误;
C.的醋酸溶液中加入一定量的盐酸,氢离子浓度不变,醋酸电离平衡不移动,故C正确;
D.电离平衡向正向移动,弱电解质的电离度不一定增大,比如向醋酸溶液中加冰醋酸,平衡正向移动,但电离程度减小,故D错误。
综上所述,答案为C。
3.D
解析:A. 溶液中水的电离被抑制,该溶液可能为酸溶液,故A错误;
B. 未指明温度,如100℃时的溶液呈中性,故B错误;
C. 石蕊试液呈紫色时,pH为5~8,此时溶液可能呈酸性、中性或碱性,故C错误;
D. ,等体积混合后氨水过量,溶液呈碱性,故D正确;
故选D。
4.A
【分析】化学平衡常数、电离常数和水的离子积常数等与温度有关,和浓度、压强、催化剂等无关。
解析:A.不改变温度的情况下,使用催化剂或改变压强或使用催化剂的同时改变压强,SO2 的转化率可能增大、减小或不变,但K不变,故A正确;
B.催化剂只能加快反应速率,不影响K,故B错误;
C.室温下 K(HCN)
故选A。
5.D
解析:A.锥形瓶用蒸馏水洗净后,先用盐酸标准液润洗再装标准液,导致消耗的待测液体积偏大,会使烧碱样品纯度偏低,A错误;
B.碱式滴定管用蒸馏水洗净后未润洗,导致消耗的待测液体积偏大,会使烧碱样品纯度偏低, B错误;
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失,导致消耗的待测液体积偏大,会使烧碱样品纯度偏低, C错误;
D.滴定前仰视碱式滴定管读数,滴定后俯视滴定管读数,导致消耗的待测液体积偏小,会使烧碱样品纯度偏高, D正确;
故选D。
6.C
解析:A.1LpH=1的H2C2O4溶液中氢离子浓度为0.1mol/L,氢离子为0.1mol,含有阳离子总数为0.1NA,A错误;
B.12.0g二氧化硅晶体为0.2mol,1个硅原子形成4个硅氧键,则含Si-O键的数目为0.8NA,B错误;
C.常温下,1.6gO2与O3的混合气体中只含有氧原子,氧原子为1.6g÷16g/mol=0.1mol,则所含的原子数目为0.1NA,C正确;
D.随着反应的进行盐酸浓度减小,反应不再进行,故转移电子数目小于0.2NA,D错误;
故选C。
7.D
解析:A.任何温度下,溶液中的c(H+)= c(OH-),溶液呈中性,仅当温度为25℃时, pH=7的溶液一定呈中性,A错误;
B.pH试纸读数为整数,不能读出小数,故只能用pH试纸测出某溶液的pH值为接近3,B错误;
C.任何溶液中,水电离出的c(H+)等于水电离出的c(OH-),C错误;
D.0. 1 mol·L-1盐酸溶液中c(H+)大于0. 1 mol·L-1醋酸溶液c(H+),故前者对水的电离的抑制作用大于后者,故前者溶液中水电离出c(H+) 小于后者溶液中水电离出c(H+),D正确;
故答案为:D。
8.D
解析:A.容量瓶水洗后即可使用,若润洗导致配制溶液的浓度偏大,故A不符合题意;
B.锥形瓶水洗即可,若润洗,消耗标准液偏多,导致测定结果偏大,故B不符合题意;
C.量筒不需要润洗,故C不符合题意;
D.滴定管水洗后,需用待装液润洗,保证浓度不变,故D符合题意;
故答案选D。
二、非选择题
9. 吸热 增大
解析:略
10.3 12 2
解析:(1) pH=2的盐酸溶液中c(H+)=10-2mol/L,加水稀释100倍,溶液中c(H+)=10-4mol/L,pH=4;
故答案为:4。
(2) 0.001mol/L的盐酸,c(H+)=10-3mol/L,pH=3;
故答案为:3。
(3) 0.01mol/L的NaOH溶液,c(OH-)=10-2mol/L,根据Kw=c(OH-)×(H+)=10-14得溶液中c(H+)=10-12mol/L,pH=12;
故答案为:12。
(4) 0.015mol/L的硫酸与0.01 mol/L的NaOH溶液等体积混合,酸过量,溶液显酸性,设溶液的体积均为1L,所得混和溶液中c(H+)=(0.015mol/L×1L×2-0.01mol/L×1L)÷2L=10-2mol/L,pH=2;
故答案为:2
