1.2.1 电解质的电离(课件)(共33张PPT)高一化学(人教版2019必修第一册)
文档属性
| 名称 | 1.2.1 电解质的电离(课件)(共33张PPT)高一化学(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 20.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 16:42:02 | ||
图片预览











文档简介
(共33张PPT)
必修第一册(人教版2019)
第一章 物质的分类及其变化
第二节 离子反应
第1课时 电解质的电离
目录
电离
02
电解质与非电解质
01
电离方程式的书写
03
习
学
目
标
1.通过实验、假设、推理等过程,认识电解质的导电实质,培养“宏观辨识与证据推理”的核心素养。
2.以探究的方式建构电离模型,能用电离方程式表示某些酸、碱、盐的电离过程,培养“微观探析与模型认知”的核心素养。
3.以电离的角度认识酸、碱、盐的本质,培养“宏观辨识与微观探析”的核心素养。
为什么湿手直接接触电源时容易发生触电事故?
只是因为有水吗?
NO.1
电解质
与
非电解质
观察固态氯化钠、熔融状态的氯化钠、氯化钠溶液的导电性实验,认识氯化钠在什么情况下能够导电。
研究氯化钠的导电性
活动﹒探究1
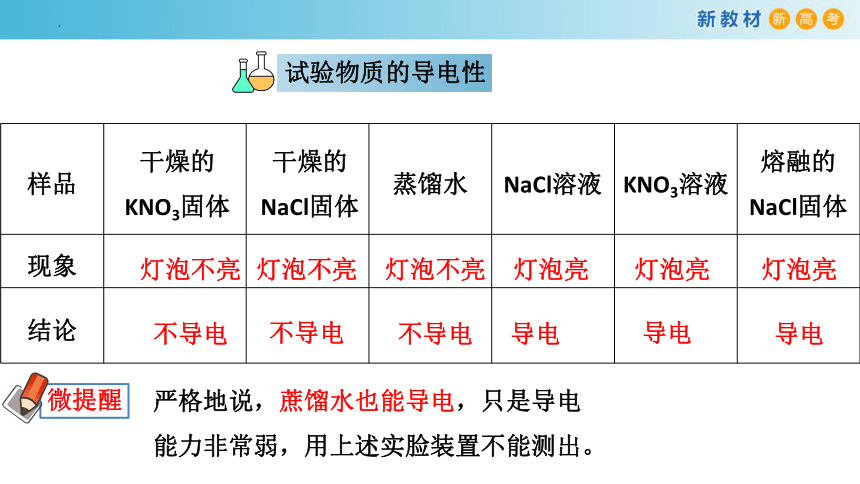
试验物质的导电性
试验物质的导电性
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
现象
结论
灯泡不亮
不导电
灯泡不亮
不导电
灯泡不亮
不导电
灯泡亮
导电
灯泡亮
导电
灯泡亮
导电
微提醒
严格地说,蔗馏水也能导电,只是导电能力非常弱,用上述实脸装置不能测出。
熔融状态的氯化钠导电的视频
1.电解质
在水溶液或熔融态下能够导电的化合物
物质类别
酸
eg:HCl、H2SO4、CH3COOH等
碱
eg:NaOH、Ba(OH)2、NH3 H2O等
大部分盐
eg:NaCl、BaSO4、CH3COONH4等
水
活泼金属氧化物
eg:Na2O、MgO、CaO等
活泼金属氢化物
eg:NaH、CaH2等
2.非电解质
在水溶液和熔融态下均不导电的化合物
物质类别
大部分非金属氧化物
eg:CO2、SO3、NO等
大部分有机物
eg:CH4、C2H5OH、C6H12O6等
部分非金属氢化物
eg:NH3、N2H4等
湿手直接接触电源时容易发生触电事故的原因
主要成分
NaCl或其他电解质
遇到水
电解质溶液
电解质溶液 能够导电
拓展
能导电的物质
酸、碱、盐的水溶液
熔融盐、熔融碱、熔融活泼金属氧化物
金属
石墨
半导体
为什么NaCI、KNO3等电解质,在干燥时不导电,而溶于水或熔化后却能导电呢?
导电
电流
:由带电荷的粒子按一定方向移动而形成的。
能导电的物质
必须具有能自由移动的、带电荷的粒子
电解质的水溶液(或熔化而成的液体)能够导电
在水溶液(或液体)中
有自由移动的、带电荷的粒子
练习1:下列物质中哪些能导电,哪些是电解质,哪些是非电解质?
Cu NaOH固体 H2SO4
石墨 CO2 NaCl溶液
CuSO4溶液 CH3COOH NH3
熔融NaCl H2O 盐酸
√
√
√
√
CO2
√
√
H2SO4
CH3COOH
H2O
NH3
熔融NaCl
NaOH固体
√
思考:固态氯化钠、熔融状态的氯化钠、氯化钠溶液,有的导电,有的不导电,原因是什么?(提示:导体导电原因是因为有自由移动的电荷或电子或离子)
金属能导电
金属内部有自由移
动的带负电的电子
定向迁移
熔融状态的NaCl、NaCl溶液能导电
NaCl溶液或熔融状态NaCl中也有自由移动的带电微粒
定向迁移
以氯化钠(NaCl)为例
+
-
Na+
带相反电荷的离子间的相互作用
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
-
+
+
-
-
Na+和Cl-按一定规则紧密地排列着
与电源正极相连的电极
与电源负极相连的电极
离子不能自由移动
干燥的NaCl固体不导电
以氯化钠(NaCl)为例
将NaCl固体加入水中
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
Na+
Cl-
H2O
以氯化钠(NaCl)为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
将NaCl固体加入水中
在水分子 的作用下
以氯化钠(NaCl)为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
将NaCl固体加入水中
在水分子 的作用下
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
-
+
Na+和Cl-脱离NaCl固体的表面
进入水中
形成能够自由移动的水合钠离子和水合氯离子
以氯化钠(NaCl)为例
将NaCl固体加入水中
在水分子 的作用下
Na+和Cl-脱离NaCl固体的表面
进入水中
形成能够自由移动的水合钠离子和水合氯离子
+
-
-
+
与电源正极相连的电极
与电源负极相连的电极
当在NaCI溶液 中插入电极并接通电源
带正电荷的水合钠离子向与电源负极相连的电极移动
带负电荷的水合氯离子向与电源正极相连的电极移动
NaCl溶液能够导电
以氯化钠(NaCl)为例
当NaCl固体受热熔化
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
离子的运动随温度升高而加快
克服了离子间 的相互作用
产生了能够自由移动的Na+和Cl-
-
+
-
+
-
+
与电源正极相连的电极
与电源负极相连的电极
NaCl在熔融状态能够导电
以氯化钠(NaCl)为例
干燥的NaCl固体不导电
NaCl 溶液 能够导电
NaCl 在熔融状态 能够导电
电解质
溶于水或受热融化时
形成自由移动粒子的过程
叫做电离
NO.2
电 离
1、定义:物质溶于水或受热熔化时,解离成能够自由移动的离子的过程称为电离。
注意:电离是物质本身的性质,无需通电。
一、电离
微提醒
电解质溶于水时是由于水分子的作用而电离
熔融状态下是由于热能破坏化学键而电离成自由移动的离子
都不是因为通电而电离
电离不需要通电
2、电离的表示方法——电离方程式
反思:电离的条件是什么?怎么表示?
电解质的电离
可以用电离方程式表示
-
+
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
为简便起见,用离子符号表示水合离子
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
微提醒
原子团不能拆开写
遵循质量守恒
和电荷守恒
练习2
写出下列物质在水溶液或熔融状态下的电离方程式
② H2SO4
① HCl
= H+ + Cl-
= 2H+ + SO42-
③ HNO3 =
H+ + NO3-
酸:
电离时生成的阳离子全部是氢离子(H+)的化合物
氢原子失去电子后,剩余1个质子构成的核,即氢离子。氢离子是“裸露”的质子,半径很小,易与水分子细合成水合氢离子,通常用H3O+表示。为了简便,也常把H3O+写作H+。
= 2Al3+ + 3O2-
④ NaOH
= Na+ + OH-
练习2
写出下列物质在水溶液或熔融状态下的电离方程式
⑦ NH4NO3
= NH4+ + NO3-
⑥ CuSO4
⑤ Ba(OH)2
⑧Al2O3 (熔融)
= Ba2+ + 2OH-
= Cu2+ + SO42-
碱:
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物
盐:
电离时生成的金属阳离子(或氨根离子)和酸根离子(或非金属离子)的化合物
2.电离方程式
微点拨
酸式盐的电离方程式
NaHSO4 =
Na+ + H+ + SO42-
NaHCO3 =
Na+ + HCO3-
NaHSO3 =
Na+ + HSO3-
电离时弱酸的酸式酸根不可拆
化合物
电解质
电离方程式
电离
酸、碱、盐、水、
金属氧化物
非电解质
不电离
强电解质
弱电解质
全部电离
部分电离
据电离程度
【课堂小结】
1.下列物质________________________________________能导电?
________________________________________是电解质?
______________________________________是非电解质?
(1)金属铜 (2)碳棒 (3)O2 (4)H2SO4 (5)液态HCl (6)CH3COOH
(7)葡萄糖 (8)固态NaCl (9)CaCO3固体 (10)CuSO4·5H2O
(11)熔融状态的KNO3 (12)KOH水溶液 (13)酒精水溶液
(14)盐酸 (15)CaO (16)CO2 (17)H2O (18)NH3
(1)、(2)、(11)、(12)、(14)、(17)
(4)、(5)、(6)、(8)、(9)、(10)、(11)、(15)
(7)、(16)、(18)
课堂检测
2.下面叙述正确的是________
A.NaCl溶液能导电,所以NaCl溶液是电解质
B.固态NaCl不导电,但NaCl是电解质
C.HCl水溶液能导电,所以HCl是电解质
D.SO3溶于水能导电,所以SO3是电解质
E.Cu能导电,所以是电解质
F.BaSO4的水溶液不能导电,所以BaSO4是非电解质
BC
3.下列电离方程式正确的是( )A.MgSO4=Mg+2+SO4-2
B.Ba(OH)2=Ba2++OH2-C.Al2(SO4)3=2Al3++3SO42-D.Ca(NO3)2=Ca2++NO3-
C
必修第一册(人教版2019)
第一章 物质的分类及其变化
第二节 离子反应
第1课时 电解质的电离
目录
电离
02
电解质与非电解质
01
电离方程式的书写
03
习
学
目
标
1.通过实验、假设、推理等过程,认识电解质的导电实质,培养“宏观辨识与证据推理”的核心素养。
2.以探究的方式建构电离模型,能用电离方程式表示某些酸、碱、盐的电离过程,培养“微观探析与模型认知”的核心素养。
3.以电离的角度认识酸、碱、盐的本质,培养“宏观辨识与微观探析”的核心素养。
为什么湿手直接接触电源时容易发生触电事故?
只是因为有水吗?
NO.1
电解质
与
非电解质
观察固态氯化钠、熔融状态的氯化钠、氯化钠溶液的导电性实验,认识氯化钠在什么情况下能够导电。
研究氯化钠的导电性
活动﹒探究1
试验物质的导电性
试验物质的导电性
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
现象
结论
灯泡不亮
不导电
灯泡不亮
不导电
灯泡不亮
不导电
灯泡亮
导电
灯泡亮
导电
灯泡亮
导电
微提醒
严格地说,蔗馏水也能导电,只是导电能力非常弱,用上述实脸装置不能测出。
熔融状态的氯化钠导电的视频
1.电解质
在水溶液或熔融态下能够导电的化合物
物质类别
酸
eg:HCl、H2SO4、CH3COOH等
碱
eg:NaOH、Ba(OH)2、NH3 H2O等
大部分盐
eg:NaCl、BaSO4、CH3COONH4等
水
活泼金属氧化物
eg:Na2O、MgO、CaO等
活泼金属氢化物
eg:NaH、CaH2等
2.非电解质
在水溶液和熔融态下均不导电的化合物
物质类别
大部分非金属氧化物
eg:CO2、SO3、NO等
大部分有机物
eg:CH4、C2H5OH、C6H12O6等
部分非金属氢化物
eg:NH3、N2H4等
湿手直接接触电源时容易发生触电事故的原因
主要成分
NaCl或其他电解质
遇到水
电解质溶液
电解质溶液 能够导电
拓展
能导电的物质
酸、碱、盐的水溶液
熔融盐、熔融碱、熔融活泼金属氧化物
金属
石墨
半导体
为什么NaCI、KNO3等电解质,在干燥时不导电,而溶于水或熔化后却能导电呢?
导电
电流
:由带电荷的粒子按一定方向移动而形成的。
能导电的物质
必须具有能自由移动的、带电荷的粒子
电解质的水溶液(或熔化而成的液体)能够导电
在水溶液(或液体)中
有自由移动的、带电荷的粒子
练习1:下列物质中哪些能导电,哪些是电解质,哪些是非电解质?
Cu NaOH固体 H2SO4
石墨 CO2 NaCl溶液
CuSO4溶液 CH3COOH NH3
熔融NaCl H2O 盐酸
√
√
√
√
CO2
√
√
H2SO4
CH3COOH
H2O
NH3
熔融NaCl
NaOH固体
√
思考:固态氯化钠、熔融状态的氯化钠、氯化钠溶液,有的导电,有的不导电,原因是什么?(提示:导体导电原因是因为有自由移动的电荷或电子或离子)
金属能导电
金属内部有自由移
动的带负电的电子
定向迁移
熔融状态的NaCl、NaCl溶液能导电
NaCl溶液或熔融状态NaCl中也有自由移动的带电微粒
定向迁移
以氯化钠(NaCl)为例
+
-
Na+
带相反电荷的离子间的相互作用
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
-
+
+
-
-
Na+和Cl-按一定规则紧密地排列着
与电源正极相连的电极
与电源负极相连的电极
离子不能自由移动
干燥的NaCl固体不导电
以氯化钠(NaCl)为例
将NaCl固体加入水中
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
Na+
Cl-
H2O
以氯化钠(NaCl)为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
将NaCl固体加入水中
在水分子 的作用下
以氯化钠(NaCl)为例
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
将NaCl固体加入水中
在水分子 的作用下
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
-
+
Na+和Cl-脱离NaCl固体的表面
进入水中
形成能够自由移动的水合钠离子和水合氯离子
以氯化钠(NaCl)为例
将NaCl固体加入水中
在水分子 的作用下
Na+和Cl-脱离NaCl固体的表面
进入水中
形成能够自由移动的水合钠离子和水合氯离子
+
-
-
+
与电源正极相连的电极
与电源负极相连的电极
当在NaCI溶液 中插入电极并接通电源
带正电荷的水合钠离子向与电源负极相连的电极移动
带负电荷的水合氯离子向与电源正极相连的电极移动
NaCl溶液能够导电
以氯化钠(NaCl)为例
当NaCl固体受热熔化
-
-
-
-
+
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
离子的运动随温度升高而加快
克服了离子间 的相互作用
产生了能够自由移动的Na+和Cl-
-
+
-
+
-
+
与电源正极相连的电极
与电源负极相连的电极
NaCl在熔融状态能够导电
以氯化钠(NaCl)为例
干燥的NaCl固体不导电
NaCl 溶液 能够导电
NaCl 在熔融状态 能够导电
电解质
溶于水或受热融化时
形成自由移动粒子的过程
叫做电离
NO.2
电 离
1、定义:物质溶于水或受热熔化时,解离成能够自由移动的离子的过程称为电离。
注意:电离是物质本身的性质,无需通电。
一、电离
微提醒
电解质溶于水时是由于水分子的作用而电离
熔融状态下是由于热能破坏化学键而电离成自由移动的离子
都不是因为通电而电离
电离不需要通电
2、电离的表示方法——电离方程式
反思:电离的条件是什么?怎么表示?
电解质的电离
可以用电离方程式表示
-
+
-
-
-
+
+
+
-
+
+
-
+
-
-
+
+
-
-
+
-
+
+
-
-
+
+
-
为简便起见,用离子符号表示水合离子
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
微提醒
原子团不能拆开写
遵循质量守恒
和电荷守恒
练习2
写出下列物质在水溶液或熔融状态下的电离方程式
② H2SO4
① HCl
= H+ + Cl-
= 2H+ + SO42-
③ HNO3 =
H+ + NO3-
酸:
电离时生成的阳离子全部是氢离子(H+)的化合物
氢原子失去电子后,剩余1个质子构成的核,即氢离子。氢离子是“裸露”的质子,半径很小,易与水分子细合成水合氢离子,通常用H3O+表示。为了简便,也常把H3O+写作H+。
= 2Al3+ + 3O2-
④ NaOH
= Na+ + OH-
练习2
写出下列物质在水溶液或熔融状态下的电离方程式
⑦ NH4NO3
= NH4+ + NO3-
⑥ CuSO4
⑤ Ba(OH)2
⑧Al2O3 (熔融)
= Ba2+ + 2OH-
= Cu2+ + SO42-
碱:
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物
盐:
电离时生成的金属阳离子(或氨根离子)和酸根离子(或非金属离子)的化合物
2.电离方程式
微点拨
酸式盐的电离方程式
NaHSO4 =
Na+ + H+ + SO42-
NaHCO3 =
Na+ + HCO3-
NaHSO3 =
Na+ + HSO3-
电离时弱酸的酸式酸根不可拆
化合物
电解质
电离方程式
电离
酸、碱、盐、水、
金属氧化物
非电解质
不电离
强电解质
弱电解质
全部电离
部分电离
据电离程度
【课堂小结】
1.下列物质________________________________________能导电?
________________________________________是电解质?
______________________________________是非电解质?
(1)金属铜 (2)碳棒 (3)O2 (4)H2SO4 (5)液态HCl (6)CH3COOH
(7)葡萄糖 (8)固态NaCl (9)CaCO3固体 (10)CuSO4·5H2O
(11)熔融状态的KNO3 (12)KOH水溶液 (13)酒精水溶液
(14)盐酸 (15)CaO (16)CO2 (17)H2O (18)NH3
(1)、(2)、(11)、(12)、(14)、(17)
(4)、(5)、(6)、(8)、(9)、(10)、(11)、(15)
(7)、(16)、(18)
课堂检测
2.下面叙述正确的是________
A.NaCl溶液能导电,所以NaCl溶液是电解质
B.固态NaCl不导电,但NaCl是电解质
C.HCl水溶液能导电,所以HCl是电解质
D.SO3溶于水能导电,所以SO3是电解质
E.Cu能导电,所以是电解质
F.BaSO4的水溶液不能导电,所以BaSO4是非电解质
BC
3.下列电离方程式正确的是( )A.MgSO4=Mg+2+SO4-2
B.Ba(OH)2=Ba2++OH2-C.Al2(SO4)3=2Al3++3SO42-D.Ca(NO3)2=Ca2++NO3-
C
