1.2.1电解质的电离 高一化学课件(共28张PPT)(人教版2019必修第一册)
文档属性
| 名称 | 1.2.1电解质的电离 高一化学课件(共28张PPT)(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 71.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 16:46:26 | ||
图片预览






文档简介
(共28张PPT)
2019人教版必修一
第二节 离子反应
第一章 物质及其变化
第一课时 电解质的电离
核心素养发展目标
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。
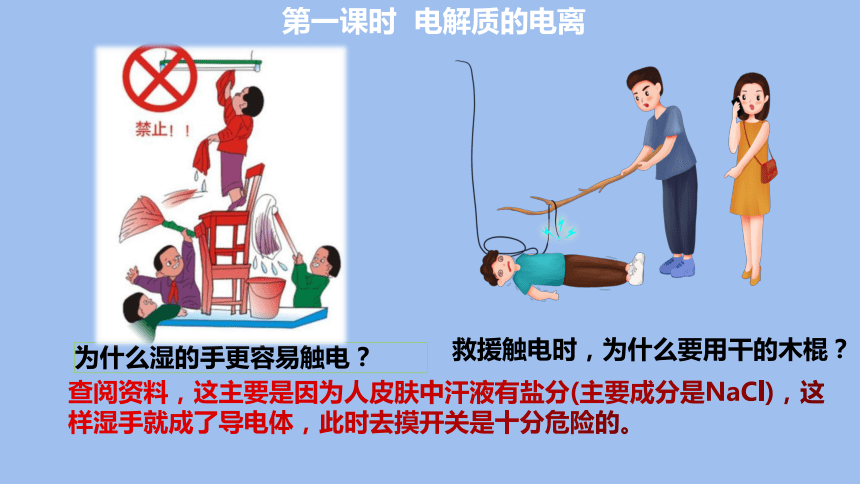
救援触电时,为什么要用干的木棍?
为什么湿的手更容易触电?
第一课时 电解质的电离
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时去摸开关是十分危险的。
哪些物质能导电?
NaCl溶液能导电
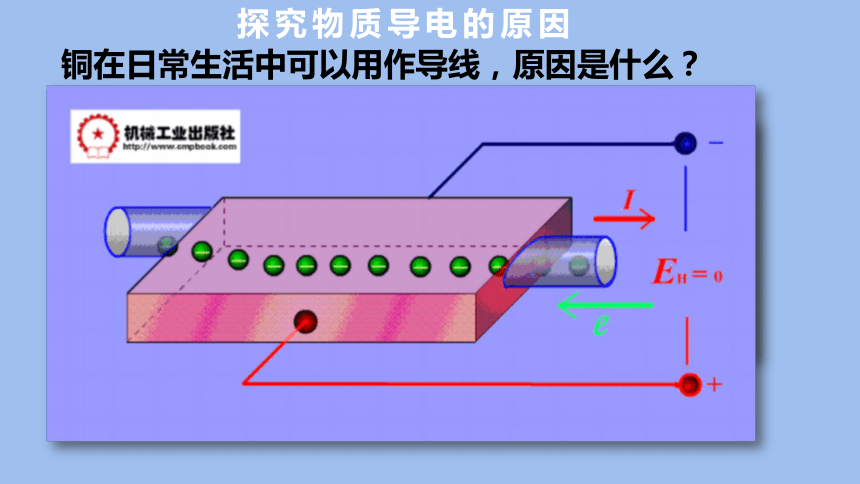
铜在日常生活中可以用作导线,原因是什么?
通常情况下金属内部电子的运动是不固定的,但在外加电场的作用下会定向移动形成电流。
探究物质导电的原因
课本P13:严格的说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
不能导电
不能导电
灯泡不亮
灯泡不亮
探究NaCl溶液能导电的原因
NaCl溶液
水
+
NaCl
猜想1:水能导电
猜想2:NaCl能导电
猜想3:水和NaCl共同作用能导电
实验序号 物质 实验现象 导电性
1 NaCl溶液 灯泡亮 能够导电
2 蒸馏水
3 NaCl固体
结论:水和NaCl共同作用能导电
氯化钠晶体
微观探究NaCl溶液能导电的原因
NaCl固体中Na+和Cl-按一定规则紧密地排列着,这些离子不能自由移动,因而干燥的NaCl固体不导电。
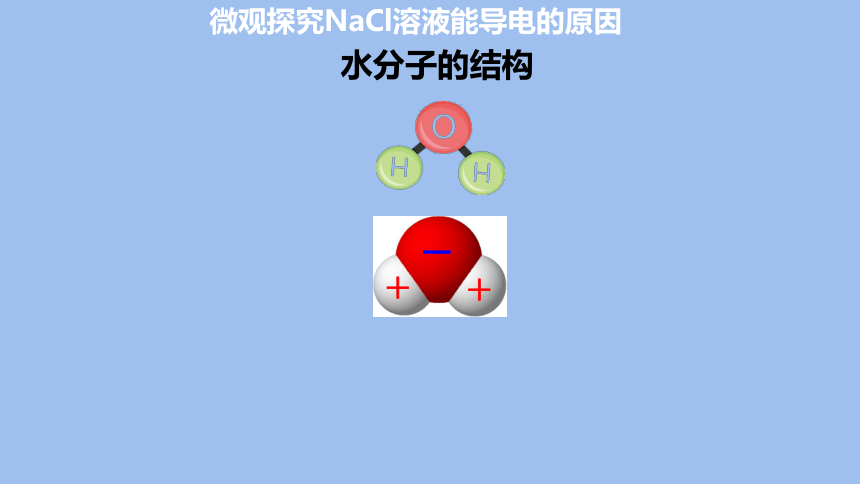
水分子的结构
-
+
+
微观探究NaCl溶液能导电的原因
微观探究NaCl溶液能导电的原因
将NaCl固体加入水中
水分子与NaCl固体作用
NaCl固体溶解并形成水合离子
微观探究NaCl溶液能导电的原因
NaCl晶体
熔融NaCl
加热熔融
要想使紧密排列的Na+和Cl-能够自由移动,还有什么方法能克服两种离子间的静电作用?
当NaCl固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的Na+和CI-
电离方程式
NaCl = Na+ + Cl-
化学式
阳离子
阴离子
离子符号(代表水合离子)
用化学用语表示NaCl的电离
电离:物质溶于水或受热熔化时,形成自由移动的离子的过程。
探究HCl、H2SO4、KOH、Ca(OH)2、蒸馏水、酒精的导电性。
从导电性角度,如何将化合物进行分类?
如: 酸、碱、盐、H2O、活泼金属氧化物等
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不能够导电的化合物。
电解质:
非电解质:
化合物
如:多数有机物、非金属氧化物(CO2、SO2等)、NH3等
两者满足其一
两者都满足
分类标准:水溶液或熔融状态能否导电
电解质与非电解质
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩ BaSO4 CO2 盐酸 水
电解质:
非电解质:
能导电:
②④⑧ ⑩
⑨
①⑤⑦ ⑧
注意:
(1)电解质或非电解质必须是化合物。单质及混合物既不是电解质,也不是非电解质。(如:金属单质、盐酸——电解质溶液)
电解质:首先是化合物,再考虑在溶液和熔融状态下能否有自由移动的离子
导电性关键看有无自由移动的离子或自由电子
电解质与非电解质
(2)电解质与非电解质的本质区别是看化合物自身在熔融状态下或在水溶液中能否发生电离,而溶液的导电只是一个表面现象。
CO2、SO2
SO3、NH3
自身不能电离出阴、阳离子
非电解质
加水
H2CO3、H2SO3
H2SO4、NH3·H2O
自身能电离出自由移动的阴、阳离子
电解质
电解质与非电解质
(4)溶液导电性与自由移动的离子浓度有关,离子浓度越大,导电能力越强。
(3)BaSO4、 AgCl虽然不溶于水但是熔融状态能导电,它们仍然是电解质
(5)有的电解质在水溶液中完全电离,有的电解质在水溶液中部分电离,因此等浓度的不同溶液中,电离出的离子浓度不同,导电能力也不同。
电解质与非电解质
强电解质:在水溶液中能完全电离的电解质。
弱电解质:在水溶液中部分电离的电解质。
拓展:强电解质和弱电解质
强酸:(六大强酸)HCl、HNO3、H2SO4、HClO4 、HBr、HI
强碱:(四大强碱)NaOH、KOH、Ca(OH)2、Ba(OH)2
大多数的盐:NaCl、AgCl、BaSO4……
金属氧化物也是强电解质,熔融状态下都能完全电离
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3、H3PO4
弱碱:所有难溶性碱、 NH3 H2O
极少数盐: (CH3COO)2Pb等
水是极弱的电解质
在下列给出的物质中,按要求填写下列空白
①HCl ②CuO ③CuSO4·5H2O ④Ca(OH)2 ⑤ H2O
⑥ Cu ⑦ Cl2 ⑧盐酸 ⑨ Na2CO3 ⑩ CH3COOH
在上述给出的物质中,其中属于强电解质的是_____________;
属于弱电解质的是_____________。
①②③④⑨
⑤⑩
注意:(1)电解质强弱与溶解度无关,如BaSO4是强电解质;
(2)溶液导电性强弱由取决于溶液中自由移动的离子浓度和所带的电荷(即自由移动的电荷浓度),与电解质强弱无关,BaSO4溶液导电能力弱于1mol·L-1的CH3COOH溶液。
拓展:强电解质和弱电解质
从电离的角度理解酸、碱、盐的分类,书写电离方程式
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
第三组:KCl、Na2CO3、CuSO4
书写步骤:
(1)阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、
OH-、NH4+、CO32-等不能拆。
(2)构成物质的原子或原子团的个数在书写成离子时为系数。
例:Al2 (SO4)3=2Al3+ +3SO42-
HCl = H+ + Cl-
H2SO4 =2H+ + SO42-
HNO3 = H+ + NO3-
酸:电离时生成的阳离子全部是H+的化合物。
NaOH = Na+ + OH-
KOH = K++ OH-
Ba(OH)2 = Ba2++ 2OH-
KCl = K+ + Cl-
Na2CO3 = 2Na+ + CO32-
CuSO4 = Cu2+ + SO42-
电离时生成的阴离子全部是OH-的化合物。
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
第三组:KCl、Na2CO3、CuSO4
从电离的角度理解酸、碱、盐的分类,书写电离方程式
第一步:
第二步:
H+ + HCO3-
H2CO3
难电离
HCO3-
H+ + CO32-
很难电离
A、一元弱酸难电离,使用可逆符号
H+ + CH3COO-
CH3COOH
B、多元弱酸分步电离,使用可逆符号(H2CO3):
C、一元难电离使用可逆符号:
NH3·H2O
NH4+ + OH-
D、多元弱碱的电离相当复杂,高中阶段只须一步写出;
Cu(OH)2
Cu2+ + 2OH-
弱电解质在水中只有部分电离
从电离的角度理解酸、碱、盐的分类,书写电离方程式
已知,水溶液中,强酸的酸式根能完全解离,而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。(1)NaHCO3 (2)NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+
写出NaHSO4熔融的电离方程式
NaHSO4 = Na+ +HSO4-
从电离的角度理解酸、碱、盐的分类,书写电离方程式
物质
混合物
纯净物
单质
化合物
电解质
酸
碱
盐
氧化物
溶于水或熔融时能导电
溶于水和熔融时,均不导电
非电解质
非金属氧化物:CO2 SO2
某些非金属氢化物:NH3
多数有机物:酒精 蔗糖
课堂小结
D
随堂演练
1.下列说法正确的是( )
A.铜、石墨均能导电,所以它们都是电解质
B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质
C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电解质
A
随堂演练
2.下列电离方程式不正确的是( )
A.NaHCO3在溶液中的电离方程式为NaHCO3=Na++H++CO32-
B.Ba(OH)2的电离方程式为Ba(OH)2=Ba2++2OH-
C.NaHSO4在熔融状态下的电离方程式为
NaHSO4(熔融)=Na++HSO4-
D.CH3COONH4电离方程式为CH3COONH4=NH4++CH3COO-
3.下列物质分类正确的组合是( )
选项 纯净物 混合物 电解质 非电解质
A 盐酸 空气 硫酸 干冰
B 蒸馏水 蔗糖溶液 氧化铝 二氧化硫
C 胆矾 氢氧化铁胶体 铁 碳酸钙
D 水银 澄清石灰水 氯化铜 碳酸钠
B
随堂演练
4、以下10种为中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH
⑦BaSO4 ⑧Cu(OH)2 ⑨Fe(OH)3 ⑩NH3·H2O
(1)属于电解质的是 .
(2)属于非电解质的是 .
(3)属于酸的是 .
(4)属于碱的是 .
(5)属于盐的是 .
②③⑤⑦⑧⑨⑩
④⑥
⑤
⑧⑨⑩
②③⑦
随堂演练
2019人教版必修一
第二节 离子反应
第一章 物质及其变化
第一课时 电解质的电离
核心素养发展目标
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。
救援触电时,为什么要用干的木棍?
为什么湿的手更容易触电?
第一课时 电解质的电离
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时去摸开关是十分危险的。
哪些物质能导电?
NaCl溶液能导电
铜在日常生活中可以用作导线,原因是什么?
通常情况下金属内部电子的运动是不固定的,但在外加电场的作用下会定向移动形成电流。
探究物质导电的原因
课本P13:严格的说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
不能导电
不能导电
灯泡不亮
灯泡不亮
探究NaCl溶液能导电的原因
NaCl溶液
水
+
NaCl
猜想1:水能导电
猜想2:NaCl能导电
猜想3:水和NaCl共同作用能导电
实验序号 物质 实验现象 导电性
1 NaCl溶液 灯泡亮 能够导电
2 蒸馏水
3 NaCl固体
结论:水和NaCl共同作用能导电
氯化钠晶体
微观探究NaCl溶液能导电的原因
NaCl固体中Na+和Cl-按一定规则紧密地排列着,这些离子不能自由移动,因而干燥的NaCl固体不导电。
水分子的结构
-
+
+
微观探究NaCl溶液能导电的原因
微观探究NaCl溶液能导电的原因
将NaCl固体加入水中
水分子与NaCl固体作用
NaCl固体溶解并形成水合离子
微观探究NaCl溶液能导电的原因
NaCl晶体
熔融NaCl
加热熔融
要想使紧密排列的Na+和Cl-能够自由移动,还有什么方法能克服两种离子间的静电作用?
当NaCl固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的Na+和CI-
电离方程式
NaCl = Na+ + Cl-
化学式
阳离子
阴离子
离子符号(代表水合离子)
用化学用语表示NaCl的电离
电离:物质溶于水或受热熔化时,形成自由移动的离子的过程。
探究HCl、H2SO4、KOH、Ca(OH)2、蒸馏水、酒精的导电性。
从导电性角度,如何将化合物进行分类?
如: 酸、碱、盐、H2O、活泼金属氧化物等
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不能够导电的化合物。
电解质:
非电解质:
化合物
如:多数有机物、非金属氧化物(CO2、SO2等)、NH3等
两者满足其一
两者都满足
分类标准:水溶液或熔融状态能否导电
电解质与非电解质
下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4 ⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩ BaSO4 CO2 盐酸 水
电解质:
非电解质:
能导电:
②④⑧ ⑩
⑨
①⑤⑦ ⑧
注意:
(1)电解质或非电解质必须是化合物。单质及混合物既不是电解质,也不是非电解质。(如:金属单质、盐酸——电解质溶液)
电解质:首先是化合物,再考虑在溶液和熔融状态下能否有自由移动的离子
导电性关键看有无自由移动的离子或自由电子
电解质与非电解质
(2)电解质与非电解质的本质区别是看化合物自身在熔融状态下或在水溶液中能否发生电离,而溶液的导电只是一个表面现象。
CO2、SO2
SO3、NH3
自身不能电离出阴、阳离子
非电解质
加水
H2CO3、H2SO3
H2SO4、NH3·H2O
自身能电离出自由移动的阴、阳离子
电解质
电解质与非电解质
(4)溶液导电性与自由移动的离子浓度有关,离子浓度越大,导电能力越强。
(3)BaSO4、 AgCl虽然不溶于水但是熔融状态能导电,它们仍然是电解质
(5)有的电解质在水溶液中完全电离,有的电解质在水溶液中部分电离,因此等浓度的不同溶液中,电离出的离子浓度不同,导电能力也不同。
电解质与非电解质
强电解质:在水溶液中能完全电离的电解质。
弱电解质:在水溶液中部分电离的电解质。
拓展:强电解质和弱电解质
强酸:(六大强酸)HCl、HNO3、H2SO4、HClO4 、HBr、HI
强碱:(四大强碱)NaOH、KOH、Ca(OH)2、Ba(OH)2
大多数的盐:NaCl、AgCl、BaSO4……
金属氧化物也是强电解质,熔融状态下都能完全电离
弱酸:CH3COOH、HF、HClO、H2S 、H2CO3、H2SO3、H3PO4
弱碱:所有难溶性碱、 NH3 H2O
极少数盐: (CH3COO)2Pb等
水是极弱的电解质
在下列给出的物质中,按要求填写下列空白
①HCl ②CuO ③CuSO4·5H2O ④Ca(OH)2 ⑤ H2O
⑥ Cu ⑦ Cl2 ⑧盐酸 ⑨ Na2CO3 ⑩ CH3COOH
在上述给出的物质中,其中属于强电解质的是_____________;
属于弱电解质的是_____________。
①②③④⑨
⑤⑩
注意:(1)电解质强弱与溶解度无关,如BaSO4是强电解质;
(2)溶液导电性强弱由取决于溶液中自由移动的离子浓度和所带的电荷(即自由移动的电荷浓度),与电解质强弱无关,BaSO4溶液导电能力弱于1mol·L-1的CH3COOH溶液。
拓展:强电解质和弱电解质
从电离的角度理解酸、碱、盐的分类,书写电离方程式
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
第三组:KCl、Na2CO3、CuSO4
书写步骤:
(1)阴阳离子部分拆开写,但原子团不能拆,例如NO3-、SO42-、
OH-、NH4+、CO32-等不能拆。
(2)构成物质的原子或原子团的个数在书写成离子时为系数。
例:Al2 (SO4)3=2Al3+ +3SO42-
HCl = H+ + Cl-
H2SO4 =2H+ + SO42-
HNO3 = H+ + NO3-
酸:电离时生成的阳离子全部是H+的化合物。
NaOH = Na+ + OH-
KOH = K++ OH-
Ba(OH)2 = Ba2++ 2OH-
KCl = K+ + Cl-
Na2CO3 = 2Na+ + CO32-
CuSO4 = Cu2+ + SO42-
电离时生成的阴离子全部是OH-的化合物。
第一组:HCl、H2SO4、HNO3
第二组:NaOH、KOH、Ba(OH)2
第三组:KCl、Na2CO3、CuSO4
从电离的角度理解酸、碱、盐的分类,书写电离方程式
第一步:
第二步:
H+ + HCO3-
H2CO3
难电离
HCO3-
H+ + CO32-
很难电离
A、一元弱酸难电离,使用可逆符号
H+ + CH3COO-
CH3COOH
B、多元弱酸分步电离,使用可逆符号(H2CO3):
C、一元难电离使用可逆符号:
NH3·H2O
NH4+ + OH-
D、多元弱碱的电离相当复杂,高中阶段只须一步写出;
Cu(OH)2
Cu2+ + 2OH-
弱电解质在水中只有部分电离
从电离的角度理解酸、碱、盐的分类,书写电离方程式
已知,水溶液中,强酸的酸式根能完全解离,而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。(1)NaHCO3 (2)NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+
写出NaHSO4熔融的电离方程式
NaHSO4 = Na+ +HSO4-
从电离的角度理解酸、碱、盐的分类,书写电离方程式
物质
混合物
纯净物
单质
化合物
电解质
酸
碱
盐
氧化物
溶于水或熔融时能导电
溶于水和熔融时,均不导电
非电解质
非金属氧化物:CO2 SO2
某些非金属氢化物:NH3
多数有机物:酒精 蔗糖
课堂小结
D
随堂演练
1.下列说法正确的是( )
A.铜、石墨均能导电,所以它们都是电解质
B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质
C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电解质
A
随堂演练
2.下列电离方程式不正确的是( )
A.NaHCO3在溶液中的电离方程式为NaHCO3=Na++H++CO32-
B.Ba(OH)2的电离方程式为Ba(OH)2=Ba2++2OH-
C.NaHSO4在熔融状态下的电离方程式为
NaHSO4(熔融)=Na++HSO4-
D.CH3COONH4电离方程式为CH3COONH4=NH4++CH3COO-
3.下列物质分类正确的组合是( )
选项 纯净物 混合物 电解质 非电解质
A 盐酸 空气 硫酸 干冰
B 蒸馏水 蔗糖溶液 氧化铝 二氧化硫
C 胆矾 氢氧化铁胶体 铁 碳酸钙
D 水银 澄清石灰水 氯化铜 碳酸钠
B
随堂演练
4、以下10种为中学化学常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4 ⑥C2H5OH
⑦BaSO4 ⑧Cu(OH)2 ⑨Fe(OH)3 ⑩NH3·H2O
(1)属于电解质的是 .
(2)属于非电解质的是 .
(3)属于酸的是 .
(4)属于碱的是 .
(5)属于盐的是 .
②③⑤⑦⑧⑨⑩
④⑥
⑤
⑧⑨⑩
②③⑦
随堂演练
