1.2.2离子反应 高一化学课件(人教版2019必修第一册)(共21张PPT)
文档属性
| 名称 | 1.2.2离子反应 高一化学课件(人教版2019必修第一册)(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 40.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 16:48:17 | ||
图片预览




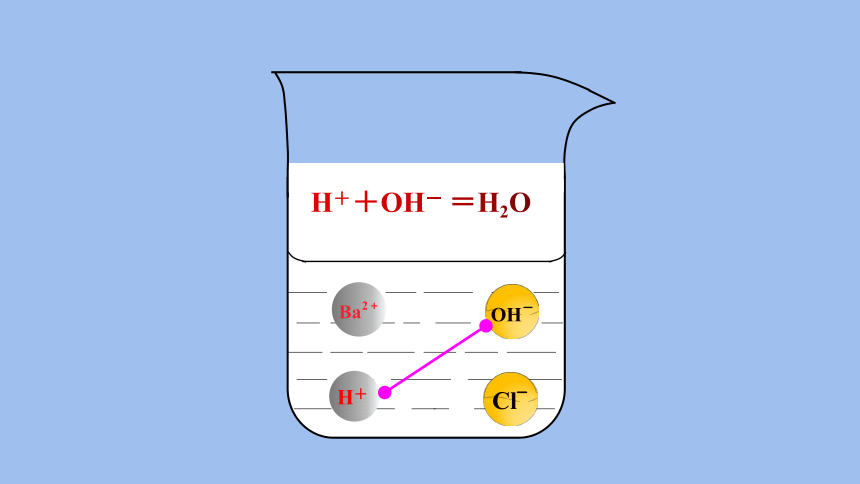
文档简介
(共21张PPT)
2019人教版必修一
第二节 离子反应
第一章 物质及其变化
第二课时 离子反应
核心素养发展目标
1.通过实验事实认识离子反应,并掌握离子反应发生的条件,增强化学核心素养中的变化观念意识。
2.能正确书写离子方程式及理解其意义。
画出你理解的微观过程图
反应前
反应后
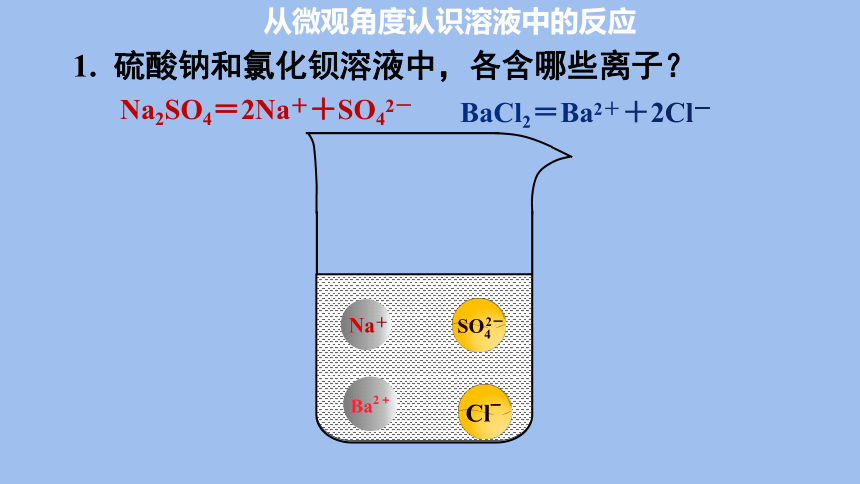
从微观角度认识溶液中的反应
以硫酸钠与氯化钡溶液反应为例,请你分析反应前后溶液中的微粒行为。即猜想混合后哪些微粒间发生了反应。
Na2SO4=2Na++SO42-
BaCl2=Ba2++2Cl-
1. 硫酸钠和氯化钡溶液中,各含哪些离子?
Na+
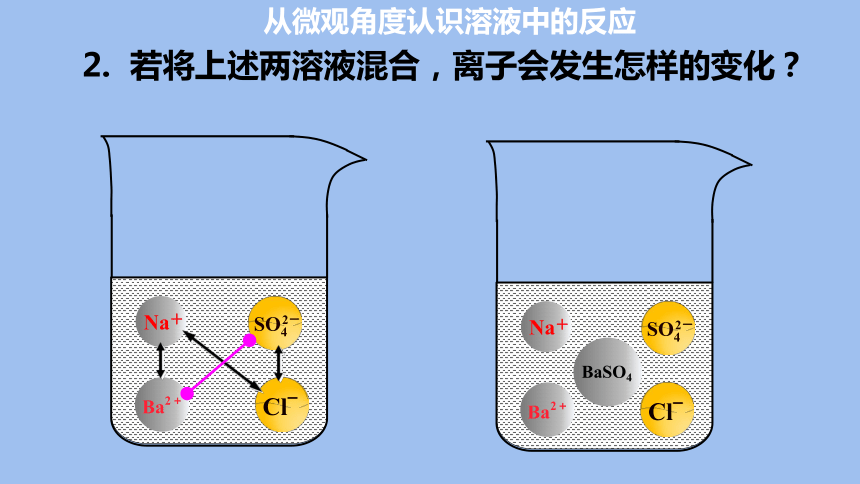
从微观角度认识溶液中的反应
Na+
2. 若将上述两溶液混合,离子会发生怎样的变化?
Na+
BaSO4
从微观角度认识溶液中的反应
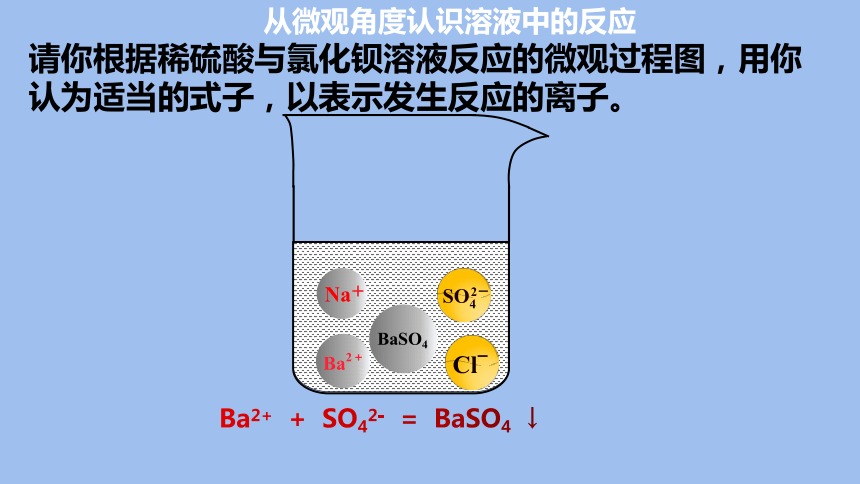
请你根据稀硫酸与氯化钡溶液反应的微观过程图,用你认为适当的式子,以表示发生反应的离子。
Na+
BaSO4
从微观角度认识溶液中的反应
Ba2+ + SO42- = BaSO4 ↓
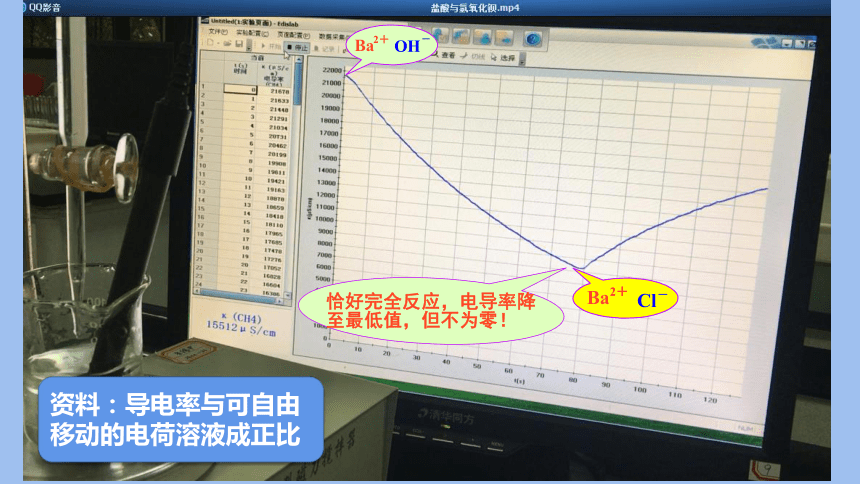
如何判断:稀盐酸与氢氧化钡溶液发生反应?
氢氧化钡溶液
酚酞试液
电导率传感器
磁力搅拌器
资料:导电率与可自由移动的电荷溶液成正比
H+
H++OH- =H2O
从微观角度认识溶液中的反应
Na2SO4溶液和BaCl2溶液反应的实质
Ba2+ + SO42- = BaSO4 ↓
离子反应:有离子参加的反应叫离子反应
离子反应实质:溶液中某种或某些离子会因反应明显减少。
离子方程式:用实际参加反应的离子表示反应的式子
稀盐酸与氢氧化钡溶液反应的实质
H++OH- =H2O
强酸、强碱、可溶性盐
离子方程式的书写步骤
1.写书写化学方程式
2.拆 将易溶于水且易电离的物质拆写成离子形式
3.删 删去方程式两边不参加反应的离子,并将方程式化成最简
4.查 检查离子方程式两边各元素的原子个数和电荷总数是否相等
2AgNO3 + CuCl2 = 2AgCl↓+ Cu(NO3)2
2Ag++2NO3-+Cu2++2Cl- = 2AgCl↓+Cu2++2NO3-
2Ag++2NO3-+Cu2++2Cl- = 2AgCl↓+Cu2++2NO3-
2Ag+ + 2Cl- =2AgCl↓
Ag+ + Cl- = AgCl↓
探究NaOH与CuSO4溶液反应的实质
2NaOH +CuSO4=Na2SO4 + Cu(OH)2↓
2Na++2OH-+Cu2++SO42-=2Na++SO4 2-+Cu(OH)2↓
2OH-+Cu2+=Cu(OH)2↓
探究NaOH与稀盐酸反应的实质
NaOH +HCl = NaCl+ H2O
Na++OH-+H++Cl-=Na++Cl-+H2O
H++OH-=H2O
1.将Na2CO3溶液与稀硫酸混合
2.将KCl溶液与NaOH溶液混合
3.将KOH溶液与稀盐酸混合
4.将NaOH溶液与稀硝酸混合
5.将稀硫酸与NaOH溶液混合
下列各组溶液混合后能否发生反应?能反应的,写出离子方程式。
×
离子反应发生的条件
2H+ +CO32- = H2O + CO2↑
H+ + OH-= H2O
H+ + OH-= H2O
H+ + OH-= H2O
表示同一类型的离子反应
离子反应发生的条件
生成沉淀、气体或水
酸、碱、盐
复分解反应
分析Zn与稀硫酸反应的实质
Zn + H2SO4 ZnSO4 + H2↑
Zn + 2H+ = Zn2+ + H2↑
离子反应发生的条件
2H+
SO42-
Zn2+
SO42-
置换反应(氧化还原反应)
1.H2SO4溶液与Ba(OH)2溶液反应的离子方程式:
___________________________________________________;
NaHSO4溶液与KOH溶液反应的离子方程式:
____________________________。
根据以上的离子方程式完成下列判断:
(1)酸碱中和反应的离子方程式都是H++OH-=H2O( )
(2)H++OH-=H2O仅表示酸碱中和反应( )
H++OH-===H2O
×
×
随堂演练
2.书写下列反应的离子方程式
(1)氧化镁溶于稀盐酸。
(2)用碳酸钙与稀盐酸反应制备二氧化碳。
(3)铁与稀硫酸反应生成氢气。
(4)二氧化碳与澄清石灰水反应生成沉淀。
(5)氢氧化铜溶于稀硫酸。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Fe+2H+===Fe2++H2↑
Ca2++2OH-+CO2===CaCO3↓+H2O
Cu(OH)2+2H+===Cu2++2H2O
随堂演练
离子方程式的正误判断
(1)看是否符合客观事实。
例:铁和稀硫酸:2Fe+6H+=2Fe3++3H2↑( )
(2)看物质拆分是否正确。强酸、强碱和可溶性盐拆成离子形
式,弱酸、 弱碱、难溶盐、单质、氧化物、气体用化学式表示。
×
×
例:NaHCO3溶液中加入稀盐酸:
CO32-+2H+=CO2↑+H2O。( )
在溶液中的NaHSO4应拆写成Na+、H+和SO42- ,NaHCO3
应拆写成Na+和HCO3- 。
对微溶物处理,如Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。
(3)看是否符合质量守恒、电荷守恒。
离子方程式的正误判断
例:稀H2SO4和Ba(OH)2溶液反应:
H++SO42-+Ba2++OH-=BaSO4↓+H2O。( )
×
×
例:向FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-。( )
不符合电荷守恒。
(4)看量的影响,阴阳离子的配比是否正确。
正确:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
注意:离子方程式中的“拆”与“不拆”
(1)要将易溶于水且易电离的电解质写成离子的形式。
(2)单质、氧化物、沉淀、气体、难电离的物质(如水、弱酸、弱碱)等写成化学式。
(3)在溶液中的NaHSO4应拆写成Na+、H+和SO42- ,NaHCO3应拆写成Na+和HCO3- 。
(4)对微溶物,如Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。
返回
离子方程式的正误判断
2019人教版必修一
第二节 离子反应
第一章 物质及其变化
第二课时 离子反应
核心素养发展目标
1.通过实验事实认识离子反应,并掌握离子反应发生的条件,增强化学核心素养中的变化观念意识。
2.能正确书写离子方程式及理解其意义。
画出你理解的微观过程图
反应前
反应后
从微观角度认识溶液中的反应
以硫酸钠与氯化钡溶液反应为例,请你分析反应前后溶液中的微粒行为。即猜想混合后哪些微粒间发生了反应。
Na2SO4=2Na++SO42-
BaCl2=Ba2++2Cl-
1. 硫酸钠和氯化钡溶液中,各含哪些离子?
Na+
从微观角度认识溶液中的反应
Na+
2. 若将上述两溶液混合,离子会发生怎样的变化?
Na+
BaSO4
从微观角度认识溶液中的反应
请你根据稀硫酸与氯化钡溶液反应的微观过程图,用你认为适当的式子,以表示发生反应的离子。
Na+
BaSO4
从微观角度认识溶液中的反应
Ba2+ + SO42- = BaSO4 ↓
如何判断:稀盐酸与氢氧化钡溶液发生反应?
氢氧化钡溶液
酚酞试液
电导率传感器
磁力搅拌器
资料:导电率与可自由移动的电荷溶液成正比
H+
H++OH- =H2O
从微观角度认识溶液中的反应
Na2SO4溶液和BaCl2溶液反应的实质
Ba2+ + SO42- = BaSO4 ↓
离子反应:有离子参加的反应叫离子反应
离子反应实质:溶液中某种或某些离子会因反应明显减少。
离子方程式:用实际参加反应的离子表示反应的式子
稀盐酸与氢氧化钡溶液反应的实质
H++OH- =H2O
强酸、强碱、可溶性盐
离子方程式的书写步骤
1.写书写化学方程式
2.拆 将易溶于水且易电离的物质拆写成离子形式
3.删 删去方程式两边不参加反应的离子,并将方程式化成最简
4.查 检查离子方程式两边各元素的原子个数和电荷总数是否相等
2AgNO3 + CuCl2 = 2AgCl↓+ Cu(NO3)2
2Ag++2NO3-+Cu2++2Cl- = 2AgCl↓+Cu2++2NO3-
2Ag++2NO3-+Cu2++2Cl- = 2AgCl↓+Cu2++2NO3-
2Ag+ + 2Cl- =2AgCl↓
Ag+ + Cl- = AgCl↓
探究NaOH与CuSO4溶液反应的实质
2NaOH +CuSO4=Na2SO4 + Cu(OH)2↓
2Na++2OH-+Cu2++SO42-=2Na++SO4 2-+Cu(OH)2↓
2OH-+Cu2+=Cu(OH)2↓
探究NaOH与稀盐酸反应的实质
NaOH +HCl = NaCl+ H2O
Na++OH-+H++Cl-=Na++Cl-+H2O
H++OH-=H2O
1.将Na2CO3溶液与稀硫酸混合
2.将KCl溶液与NaOH溶液混合
3.将KOH溶液与稀盐酸混合
4.将NaOH溶液与稀硝酸混合
5.将稀硫酸与NaOH溶液混合
下列各组溶液混合后能否发生反应?能反应的,写出离子方程式。
×
离子反应发生的条件
2H+ +CO32- = H2O + CO2↑
H+ + OH-= H2O
H+ + OH-= H2O
H+ + OH-= H2O
表示同一类型的离子反应
离子反应发生的条件
生成沉淀、气体或水
酸、碱、盐
复分解反应
分析Zn与稀硫酸反应的实质
Zn + H2SO4 ZnSO4 + H2↑
Zn + 2H+ = Zn2+ + H2↑
离子反应发生的条件
2H+
SO42-
Zn2+
SO42-
置换反应(氧化还原反应)
1.H2SO4溶液与Ba(OH)2溶液反应的离子方程式:
___________________________________________________;
NaHSO4溶液与KOH溶液反应的离子方程式:
____________________________。
根据以上的离子方程式完成下列判断:
(1)酸碱中和反应的离子方程式都是H++OH-=H2O( )
(2)H++OH-=H2O仅表示酸碱中和反应( )
H++OH-===H2O
×
×
随堂演练
2.书写下列反应的离子方程式
(1)氧化镁溶于稀盐酸。
(2)用碳酸钙与稀盐酸反应制备二氧化碳。
(3)铁与稀硫酸反应生成氢气。
(4)二氧化碳与澄清石灰水反应生成沉淀。
(5)氢氧化铜溶于稀硫酸。
MgO+2H+===Mg2++H2O
CaCO3+2H+===Ca2++CO2↑+H2O
Fe+2H+===Fe2++H2↑
Ca2++2OH-+CO2===CaCO3↓+H2O
Cu(OH)2+2H+===Cu2++2H2O
随堂演练
离子方程式的正误判断
(1)看是否符合客观事实。
例:铁和稀硫酸:2Fe+6H+=2Fe3++3H2↑( )
(2)看物质拆分是否正确。强酸、强碱和可溶性盐拆成离子形
式,弱酸、 弱碱、难溶盐、单质、氧化物、气体用化学式表示。
×
×
例:NaHCO3溶液中加入稀盐酸:
CO32-+2H+=CO2↑+H2O。( )
在溶液中的NaHSO4应拆写成Na+、H+和SO42- ,NaHCO3
应拆写成Na+和HCO3- 。
对微溶物处理,如Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。
(3)看是否符合质量守恒、电荷守恒。
离子方程式的正误判断
例:稀H2SO4和Ba(OH)2溶液反应:
H++SO42-+Ba2++OH-=BaSO4↓+H2O。( )
×
×
例:向FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-。( )
不符合电荷守恒。
(4)看量的影响,阴阳离子的配比是否正确。
正确:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
注意:离子方程式中的“拆”与“不拆”
(1)要将易溶于水且易电离的电解质写成离子的形式。
(2)单质、氧化物、沉淀、气体、难电离的物质(如水、弱酸、弱碱)等写成化学式。
(3)在溶液中的NaHSO4应拆写成Na+、H+和SO42- ,NaHCO3应拆写成Na+和HCO3- 。
(4)对微溶物,如Ca(OH)2,如果是反应物且为澄清石灰水,应拆成Ca2+和OH-的形式,如果是生成物或是石灰乳等,则保留化学式Ca(OH)2。
返回
离子方程式的正误判断
