1.2.3 离子反应的应用-高一化学课件(人教版2019必修第一册)(共25张PPT)
文档属性
| 名称 | 1.2.3 离子反应的应用-高一化学课件(人教版2019必修第一册)(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 16:48:59 | ||
图片预览








文档简介
(共25张PPT)
第二节 离子反应
第三课时 离子反应的应用
课程标准要求与核心素养发展目标
1.通过认识理解离子反应方程式,掌握离子方程式正误的判断方法;
2.能进行离子共存的判断及简单的离子推断。
1.掌握离子方程式的正误判断,初步掌握离子大量共存的判断方法,促进形成证据推理与模型认知的化学核心素养;
2. 初步掌握简单的离子检验方法进而进行离子推断。
课程标准要求
核心素养发展目标
本节重、难点
本节重点
本节难点
离子方程式正误判断及离子共存
离子的检验与推断
课前回顾
温故知新,发现问题
回顾离子方程式中可拆写的物质及离子反应发生的条件,并思考如何判断一个离子方程式是否正确
请回顾并写出CuSO4与Ba(OH)2电离反应的离子方程式
Cu2++ SO42- +Ba2++2OH- == BaSO4 ↓ +Cu(OH)2 ↓
一、离子方程式的正误判断
离子方程式正误判断的方法——“五看”
看是否符合反应的客观事实
1
2
看反应是否符合拆写原则
如:向稀盐酸溶液中加铁,2Fe+6H+===2Fe3++3H2↑ ( )
如:碳酸钡和稀硝酸反应,CO32-+2H+ == H2O + CO2↑ ( )
注意:
微溶物在生成物中当成沉淀,不拆写;
若为反应物且为澄清溶液则拆成离子。
×
×
随堂检测
判断正误:
(1) 向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓ ( )
(2) 氯气溶于水:Cl2+H2O 2H++Cl-+ClO- ( )
(3) NaHCO3溶液中加入稀盐酸:
CO32-+2H+=CO2↑+H2O ( )
(4) 硫酸铝溶液中加入过量氨水:
Al3++3OH-=Al(OH)3↓ ( )
(5) Na2O2固体与水反应:
2O22-+2H2O=4OH-+O2↑ ( )
(6) Mg(OH)2和稀盐酸反应:OH-+H+=H2O ( )
×
×
×
×
×
×
一、离子方程式的正误判断
离子方程式正误判断的方法——“五看”
看是否漏写离子反应
3
如:CuSO4与Ba(OH)2溶液混合,Ba2++SO42-=BaSO4↓ ( )
看是否符合原子守恒和电荷守恒
4
如:铝与稀盐酸反应,Al+3H+ = Al3++H2↑ ( )
FeCl2溶液与Cl2反应,Fe2++Cl2=Fe3++2Cl- ( )
看阴、阳离子配比是否正确
5
如:稀H2SO4和Ba(OH)2溶液反应,H++SO42- +OH- +Ba2+===BaSO4↓+H2O ( )
×
×
×
×
随堂检测
2. 能正确表示下列化学反应的离子方程式是( )
A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B.澄清的石灰水与稀盐酸反应:
Ca(OH)2+2H+===Ca2++2H2O
C.铁片插入硝酸银溶液中:Fe+Ag+===Fe2++Ag
D.氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
D
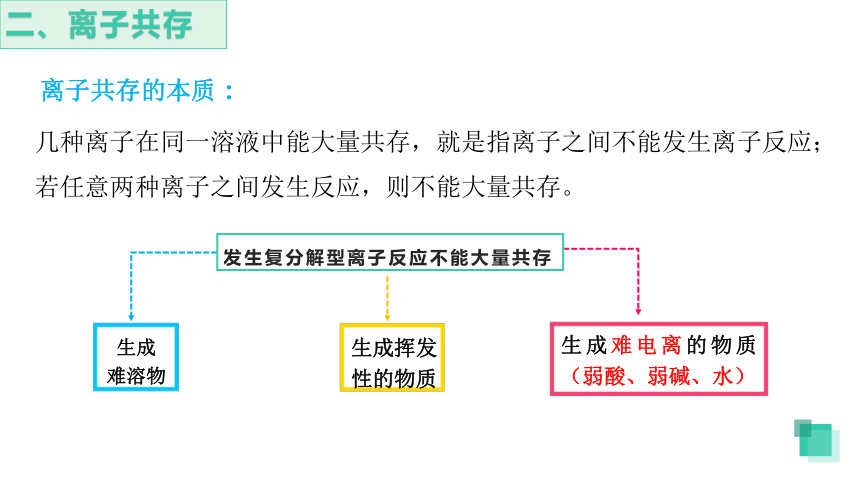
二、离子共存
离子共存的本质:
几种离子在同一溶液中能大量共存,就是指离子之间不能发生离子反应;若任意两种离子之间发生反应,则不能大量共存。
生成
难溶物
生成挥发性的物质
生成难电离的物质(弱酸、弱碱、水)
发生复分解型离子反应不能大量共存
二、离子共存
判断离子能否大量共存的“三个要点”:
透明不代表无色
一色、二性、三反应
一色——溶液的颜色:在“无色”溶液中,不能存在有色离子
1
几种常见离子的颜色
离子 Cu2+ Fe3+ Fe2+ MnO4- Cr2O72- CrO42- Cr3+
溶液颜色 蓝色 棕黄色 浅绿色 紫红色 橙红色 黄色 绿色
二、离子共存
判断离子能否大量共存的“三个要点”:
二性——溶液的酸碱性
2
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
在强酸性溶液中(隐含有H+)不能共存的离子有:
① 氢氧根离子:OH-
② 弱酸根离子:
CO32-、S2-、SO32-、ClO-、F-、CH3COO-、PO43- 等
③ 弱酸的酸式酸根离子:
HCO3-、HS-、HSO3-、HPO42-、H2PO4- 等
二、离子共存
碱性溶液;
常温下,pH>7的溶液;
使紫色石蕊溶液变蓝色(或红色石蕊试纸变蓝)的溶液;
使pH试纸变蓝的溶液;
使甲基橙呈黄色的溶液;
酚酞变红的溶液;
c(H+)<c(OH-)的溶液。
“碱性”溶液的不同描述:
二、离子共存
二性——溶液的酸碱性
2
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
在强碱性溶液中(隐含有OH-)不能共存的离子有:
① 氢离子:H+
② 弱碱阳离子:
NH4+、Mg2+、Al3+、Cu2+、Fe2+、Fe3+等
③ 弱酸酸式酸根离子:
HCO3-、HS-、HSO3-、HPO42-、H2PO4- 等
二、离子共存
酸性溶液;
常温下,pH<7的溶液;
使紫色石蕊溶液变红色(或蓝色石蕊试纸变红)的溶液;
使pH试纸变红的溶液;
使甲基橙呈红色的溶液;
加镁粉放氢气的溶液;
c(H+)>c(OH-)的溶液。
“酸性”溶液的不同描述:
二、离子共存
判断离子能否大量共存的“三个要点”:
三反应——离子间发生离子反应的不能共存
3
氧化还原反应型离子反应不能大量共存
双水解型离子反应不能大量共存
复分解型离子反应不能大量共存
络合反应型离子反应不能大量共存
随堂检测
3. 常温下,下列各组离子可以大量共存的是( )
A.Cu2 + 、Mg2 + 、OH-、Cl- B.H + 、Na + 、CO32-、NO3-
C.Na + 、K + 、SO42-、Cu2+ D.Ba2+ 、H+ 、Fe2+ 、SO42-
C
4. 下列各组离子在给定条件下能大量共存的是( )
A.在强酸性溶液中:NH4+、K + 、CO32-、Cl-
B.有SO42-存在的溶液中:Na+ 、Mg2+ 、Ba2 + 、Br-
C.使酚酞溶液变红的溶液中:Na+ 、Cl-、 SO42- 、Fe3 +
D.无色透明的水溶液中:K+ 、Ba2+ 、Cl-、 NO3-
D
三、常见离子的检验与推断
根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
离子推断的“四原则”:
——通常指反应生成或引入的离子对后续实验的干扰
肯定性原则
互斥性原则
电中性原则
进出性原则
——根据实验现象推出肯定存在或肯定不存在的离子
——在肯定某些离子存在的同时,结合离子共存规
律,否定一些离子的存在
——溶液中阴、阳离子共存,且正、负电荷总数相等
随堂检测
5.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解
根据上述实验事实,回答下列问题(均填写化学式) :
原固体混合物中一定含有的物质是____________,一定不含有的物质是 ,可能含有的物质是________。
Na2SO4、CuSO4、CaCl2
Na2CO3
NaCl
课堂小结
离子方程式正误的判断
离子反应的应用
离子共存
常见离子的检验与推断
1.在无色透明的强酸性溶液中,下列各组离子能大量共存的是( )
A.Cu2+、K+、Cl-、 NO3- B.Ag+、Na+、 NO3- 、Cl-
C.Mg2+、Na+、 SO42- 、Cl- D.Na+、K+、Cl-、CO32-
C
2.甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下,其中记录结果合理的是( )
甲:K2SO4、BaCl2、NaCl 乙:NaCl、Ba(OH)2、K2CO3
丙:HCl、K2CO3、NaCl 丁:K2SO4、Na2CO3、KCl
A.甲 B.乙 C.丙 D.丁
D
3. 下列化学反应的离子方程式正确的是( )
A.向碳酸镁中滴加稀盐酸: CO32- +2H+===CO2↑+H2O
B.碳酸钡与硫酸溶液反应:Ba2++ SO42- ===BaSO4↓
C.氢氧化铜加入稀盐酸中:Cu(OH)2+2H+===Cu2++2H2O
D.醋酸溶液与氢氧化钠溶液反应:H++OH-===H2O
C
4. 下列离子方程式的书写正确的是( )
A.稀醋酸与NaOH溶液的反应:H++OH-===H2O
B.铜粉与稀硝酸的反应:Cu+2H+===Cu2++H2↑
C.氯气与碘化钾溶液的反应:Cl2+I-===Cl-+I2
D.氧化铁与稀硫酸反应:Fe2O3+6H+===2Fe3++3H2O
D
5.某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、 SO42- 、 NO3- 、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是( )
A.Na+和NO3-来自同一工厂
B.Cl-和NO3-一定来自同一工厂
C.Ag+和Na+可能来自同一工厂
D. SO42-和OH-一定来自同一工厂
D
6. 某溶液的溶质可能由下列离子组成:Cl-、SO42-、 CO32- 、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生;
(3)将(1)中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。依据以上实验可以推断,原溶液中一定含有 ;一定没有 ;可能含有________。
SO42-、 CO32- 、Na+
H+、Ba2+
Cl-
Thanks
谢谢观看
第三课时 离子反应的应用
第二节 离子反应
第三课时 离子反应的应用
课程标准要求与核心素养发展目标
1.通过认识理解离子反应方程式,掌握离子方程式正误的判断方法;
2.能进行离子共存的判断及简单的离子推断。
1.掌握离子方程式的正误判断,初步掌握离子大量共存的判断方法,促进形成证据推理与模型认知的化学核心素养;
2. 初步掌握简单的离子检验方法进而进行离子推断。
课程标准要求
核心素养发展目标
本节重、难点
本节重点
本节难点
离子方程式正误判断及离子共存
离子的检验与推断
课前回顾
温故知新,发现问题
回顾离子方程式中可拆写的物质及离子反应发生的条件,并思考如何判断一个离子方程式是否正确
请回顾并写出CuSO4与Ba(OH)2电离反应的离子方程式
Cu2++ SO42- +Ba2++2OH- == BaSO4 ↓ +Cu(OH)2 ↓
一、离子方程式的正误判断
离子方程式正误判断的方法——“五看”
看是否符合反应的客观事实
1
2
看反应是否符合拆写原则
如:向稀盐酸溶液中加铁,2Fe+6H+===2Fe3++3H2↑ ( )
如:碳酸钡和稀硝酸反应,CO32-+2H+ == H2O + CO2↑ ( )
注意:
微溶物在生成物中当成沉淀,不拆写;
若为反应物且为澄清溶液则拆成离子。
×
×
随堂检测
判断正误:
(1) 向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓ ( )
(2) 氯气溶于水:Cl2+H2O 2H++Cl-+ClO- ( )
(3) NaHCO3溶液中加入稀盐酸:
CO32-+2H+=CO2↑+H2O ( )
(4) 硫酸铝溶液中加入过量氨水:
Al3++3OH-=Al(OH)3↓ ( )
(5) Na2O2固体与水反应:
2O22-+2H2O=4OH-+O2↑ ( )
(6) Mg(OH)2和稀盐酸反应:OH-+H+=H2O ( )
×
×
×
×
×
×
一、离子方程式的正误判断
离子方程式正误判断的方法——“五看”
看是否漏写离子反应
3
如:CuSO4与Ba(OH)2溶液混合,Ba2++SO42-=BaSO4↓ ( )
看是否符合原子守恒和电荷守恒
4
如:铝与稀盐酸反应,Al+3H+ = Al3++H2↑ ( )
FeCl2溶液与Cl2反应,Fe2++Cl2=Fe3++2Cl- ( )
看阴、阳离子配比是否正确
5
如:稀H2SO4和Ba(OH)2溶液反应,H++SO42- +OH- +Ba2+===BaSO4↓+H2O ( )
×
×
×
×
随堂检测
2. 能正确表示下列化学反应的离子方程式是( )
A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B.澄清的石灰水与稀盐酸反应:
Ca(OH)2+2H+===Ca2++2H2O
C.铁片插入硝酸银溶液中:Fe+Ag+===Fe2++Ag
D.氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
D
二、离子共存
离子共存的本质:
几种离子在同一溶液中能大量共存,就是指离子之间不能发生离子反应;若任意两种离子之间发生反应,则不能大量共存。
生成
难溶物
生成挥发性的物质
生成难电离的物质(弱酸、弱碱、水)
发生复分解型离子反应不能大量共存
二、离子共存
判断离子能否大量共存的“三个要点”:
透明不代表无色
一色、二性、三反应
一色——溶液的颜色:在“无色”溶液中,不能存在有色离子
1
几种常见离子的颜色
离子 Cu2+ Fe3+ Fe2+ MnO4- Cr2O72- CrO42- Cr3+
溶液颜色 蓝色 棕黄色 浅绿色 紫红色 橙红色 黄色 绿色
二、离子共存
判断离子能否大量共存的“三个要点”:
二性——溶液的酸碱性
2
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
在强酸性溶液中(隐含有H+)不能共存的离子有:
① 氢氧根离子:OH-
② 弱酸根离子:
CO32-、S2-、SO32-、ClO-、F-、CH3COO-、PO43- 等
③ 弱酸的酸式酸根离子:
HCO3-、HS-、HSO3-、HPO42-、H2PO4- 等
二、离子共存
碱性溶液;
常温下,pH>7的溶液;
使紫色石蕊溶液变蓝色(或红色石蕊试纸变蓝)的溶液;
使pH试纸变蓝的溶液;
使甲基橙呈黄色的溶液;
酚酞变红的溶液;
c(H+)<c(OH-)的溶液。
“碱性”溶液的不同描述:
二、离子共存
二性——溶液的酸碱性
2
10.下列反应属于放热反应的是
A.煅烧石灰石制生石灰 B.煤的气化制水煤气
在强碱性溶液中(隐含有OH-)不能共存的离子有:
① 氢离子:H+
② 弱碱阳离子:
NH4+、Mg2+、Al3+、Cu2+、Fe2+、Fe3+等
③ 弱酸酸式酸根离子:
HCO3-、HS-、HSO3-、HPO42-、H2PO4- 等
二、离子共存
酸性溶液;
常温下,pH<7的溶液;
使紫色石蕊溶液变红色(或蓝色石蕊试纸变红)的溶液;
使pH试纸变红的溶液;
使甲基橙呈红色的溶液;
加镁粉放氢气的溶液;
c(H+)>c(OH-)的溶液。
“酸性”溶液的不同描述:
二、离子共存
判断离子能否大量共存的“三个要点”:
三反应——离子间发生离子反应的不能共存
3
氧化还原反应型离子反应不能大量共存
双水解型离子反应不能大量共存
复分解型离子反应不能大量共存
络合反应型离子反应不能大量共存
随堂检测
3. 常温下,下列各组离子可以大量共存的是( )
A.Cu2 + 、Mg2 + 、OH-、Cl- B.H + 、Na + 、CO32-、NO3-
C.Na + 、K + 、SO42-、Cu2+ D.Ba2+ 、H+ 、Fe2+ 、SO42-
C
4. 下列各组离子在给定条件下能大量共存的是( )
A.在强酸性溶液中:NH4+、K + 、CO32-、Cl-
B.有SO42-存在的溶液中:Na+ 、Mg2+ 、Ba2 + 、Br-
C.使酚酞溶液变红的溶液中:Na+ 、Cl-、 SO42- 、Fe3 +
D.无色透明的水溶液中:K+ 、Ba2+ 、Cl-、 NO3-
D
三、常见离子的检验与推断
根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型:①生成沉淀;②生成气体;③显现特殊颜色。
离子推断的“四原则”:
——通常指反应生成或引入的离子对后续实验的干扰
肯定性原则
互斥性原则
电中性原则
进出性原则
——根据实验现象推出肯定存在或肯定不存在的离子
——在肯定某些离子存在的同时,结合离子共存规
律,否定一些离子的存在
——溶液中阴、阳离子共存,且正、负电荷总数相等
随堂检测
5.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解
根据上述实验事实,回答下列问题(均填写化学式) :
原固体混合物中一定含有的物质是____________,一定不含有的物质是 ,可能含有的物质是________。
Na2SO4、CuSO4、CaCl2
Na2CO3
NaCl
课堂小结
离子方程式正误的判断
离子反应的应用
离子共存
常见离子的检验与推断
1.在无色透明的强酸性溶液中,下列各组离子能大量共存的是( )
A.Cu2+、K+、Cl-、 NO3- B.Ag+、Na+、 NO3- 、Cl-
C.Mg2+、Na+、 SO42- 、Cl- D.Na+、K+、Cl-、CO32-
C
2.甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下,其中记录结果合理的是( )
甲:K2SO4、BaCl2、NaCl 乙:NaCl、Ba(OH)2、K2CO3
丙:HCl、K2CO3、NaCl 丁:K2SO4、Na2CO3、KCl
A.甲 B.乙 C.丙 D.丁
D
3. 下列化学反应的离子方程式正确的是( )
A.向碳酸镁中滴加稀盐酸: CO32- +2H+===CO2↑+H2O
B.碳酸钡与硫酸溶液反应:Ba2++ SO42- ===BaSO4↓
C.氢氧化铜加入稀盐酸中:Cu(OH)2+2H+===Cu2++2H2O
D.醋酸溶液与氢氧化钠溶液反应:H++OH-===H2O
C
4. 下列离子方程式的书写正确的是( )
A.稀醋酸与NaOH溶液的反应:H++OH-===H2O
B.铜粉与稀硝酸的反应:Cu+2H+===Cu2++H2↑
C.氯气与碘化钾溶液的反应:Cl2+I-===Cl-+I2
D.氧化铁与稀硫酸反应:Fe2O3+6H+===2Fe3++3H2O
D
5.某地甲、乙两厂排放的污水中各含有下列8种离子中的4种(两厂废水所含离子不同):Ag+、Ba2+、Fe2+、Na+、Cl-、 SO42- 、 NO3- 、OH-。若两厂单独排放污水都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便能变得无色澄清,溶质主要含硝酸钠,污染程度大大降低。根据所给信息有以下几种说法,你认为正确的是( )
A.Na+和NO3-来自同一工厂
B.Cl-和NO3-一定来自同一工厂
C.Ag+和Na+可能来自同一工厂
D. SO42-和OH-一定来自同一工厂
D
6. 某溶液的溶质可能由下列离子组成:Cl-、SO42-、 CO32- 、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生;
(3)将(1)中的沉淀加入稀盐酸中,沉淀部分消失,有气体产生。依据以上实验可以推断,原溶液中一定含有 ;一定没有 ;可能含有________。
SO42-、 CO32- 、Na+
H+、Ba2+
Cl-
Thanks
谢谢观看
第三课时 离子反应的应用
