1.3.1 氧化还原反应(1)高一化学课件(共37张PPT)(人教版2019必修第一册)
文档属性
| 名称 | 1.3.1 氧化还原反应(1)高一化学课件(共37张PPT)(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 16:52:48 | ||
图片预览











文档简介
(共37张PPT)
新
教
材
第一章 物质及其变化
第1课时 氧化还原反应的概念及判断
氧化还原反应
第三节
学习目标:
1、氧化还原反应的特征与本质
2、氧化还原反应的判断
3、认识氧化剂、还原剂、氧化性、还原性等基本概念。
4、了解常见的氧化剂、还原剂。
苹果为什么会变色?
钢铁为什么会生锈?
H2 + CuO === H2O + Cu
一. 从得失氧的角度认识氧化还原反应
氧化反应:
还原反应:
一种物质失去氧,同时另一种物质得到氧的反应
氧化还原反应:
物质失去氧原子的反应
物质得到氧原子的反应
得到氧,氧化反应
失去氧,发生还原反应
氧化反应和还原反应一定同时发生!
——表观认知
二.从化合价升降的角度认识氧化还原反应
——本质认知
2.化合物:元素正、负化合价代数和为0
元素化合价性质:
1.单质:元素化合价为“0”
3. 化合价范围:
-4、-3、-2、-1、0、+1、+2、+3、+4、+5、+6、+7
-4……0……+7
[知识回顾]
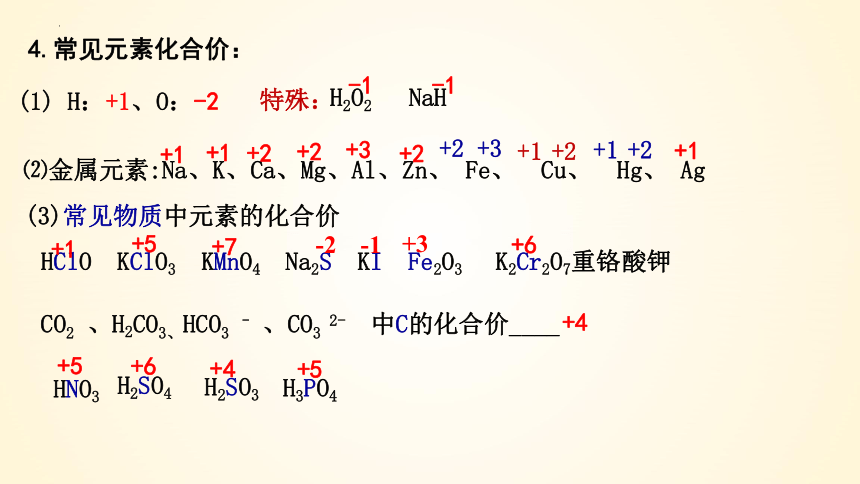
HClO KClO3 KMnO4 Na2S KI Fe2O3 K2Cr2O7重铬酸钾
⑵金属元素:Na、K、Ca、Mg、Al、Zn、 Fe、 Cu、 Hg、 Ag
(1) H:+1、O:-2
4.常见元素化合价:
特殊:
H2O2
-1
NaH
-1
+1
+1
+2
+2
+3
+2
+2 +3
+1 +2
+1 +2
+1
(3)常见物质中元素的化合价
+6
CO2 、H2CO3、HCO3 – 、CO3 2- 中C的化合价____
+4
HNO3
H3PO4
H2SO4
H2SO3
+5
+6
+4
+5
+1
+5
+7
-2
-1
+3
请分析下列3个氧化还原反应中各种元素的化合价在反应前后
【思考与交流】
2 CuO + C ==== 2 Cu + CO2↑
高温
CuO + H2 === Cu + H2O
+2
0
0
+4
+3 +2 0 +4
+2 0 0 +1
化合价升高,被氧化
化合价降低,被还原
化合价升高,被氧化
化合价降低,被还原
化合价升高,被氧化
化合价降低,被还原
“价升”,发生氧化反应
“价降”,发生还原反应
高温
Fe2O3 + CO ==== Fe + CO2
有无变化,讨论氧化还原反应与元素化合价的升降有什么关系?
二.从化合价升降的角度认识氧化还原反应
——本质认知
课本P21
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
想一想:氧化还原反应是否一定存在得失氧?请分析下面的反应。
Zn + 2HCl==== ZnCl2 + H2↑
0
+1
+2
0
化合价升高
化合价降低
,发生氧化反应
,发生还原反应
2Na + Cl2 ==== 2NaCl
0
+1
0
-1
化合价升高
化合价降低
,发生氧化反应
,发生还原反应
所以,并非只有得氧、失氧的反应才是氧化还原反应。
凡是有元素化合价升降的化学反应都是氧化还原反应
“升氧”
“降还”
二.从化合价升降的角度认识氧化还原反应
——本质认知
凡是有元素化合价升降的化学反应都是氧化还原反应
凡是没有元素化合价升降的反应,叫非氧化还原反应
课本P21
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
“升氧”
“降还”
二.从化合价升降的角度认识氧化还原反应
——本质认知
下列反应属于氧化还原反应的是
A、 C + H2O === H2+ CO
B、NH4NO3 === N2O ↑+ 2H2O
C、2NaHCO3 ==Na2CO3 + CO2↑+ H2O
D、3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
E、Cu2(OH)2CO3 ==2CuO + CO2↑+ H2O
F、 H2SO4 + Ba(OH)2== BaSO4 + 2H2O
H、Zn + 2HCl = ZnCl2 + H2 ↑
高温
△
△
△
A、B、D、H
√
√
√
√
0 +1 0 +2
-3 +5 +1
0 -1 +5
0 +1 +2 0
氧化还原反应的判断依据是:
(特 征)
是否有元素化合价的升降
凡是有元素化合价升降的化学反应都是氧化还原反应
凡是没有元素化合价升降的反应,叫非氧化还原反应
课本P21
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
“升氧”
“降还”
二.从化合价升降的角度认识氧化还原反应
——本质认知
再练习:
判断下列反应各属于四种基本反应类型中的哪一种?其中哪些属于氧化还原反应?
① H2O + CaO = Ca(OH)2↓
② C + O2 ==== CO2
点燃
2KClO3==== 2KCl + 3O2↑
MnO2
③
CaCO3 ==== CaO + CO2↑
高温
④
2KMnO4 == K2MnO4 + MnO2 + O2↑
△
⑤
Fe + CuSO4 = FeSO4 + Cu
⑥
Fe + 2HCl = FeCl2 + H2 ↑
⑦
CaCl2 + Na2CO3 == CaCO3↓+ 2NaCl
⑧
CaCO3+2HCl = CaCl2+ CO2↑+ H2O
⑨
化合反应
化合反应
分解反应
分解反应
分解反应
置换反应
置换反应
复分解反应
复分解反应
√
√
√
√
√
有单质参加的化合反应是氧化还原反应
有单质生成的分解反应是氧化还原反应
所有的置换反应一定是氧化还原反应
所有的复分解反应一定不是氧化还原反应
氧化还原反应和四大基本反应类型的关系:
置换反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
“脸 谱”
课本P22图1-14
判 断:
1.有单质参加或者有单质生成的反应一定是氧化还原反应
2.反应中,某元素由化合态变成游离态,该元素在反应中一定被还原。
2O3 == 3O2
单质态
可能被氧化,也可能被还原
“非0价”
“0价”
化合价升高
化合价降低
先分析钠与
氯气的反应吧!
问题:在氧化还原反应中,元素化合价发生改变的本质原因是什么?
2Na + Cl2 ==== 2NaCl
点燃
【想一想】
0
0
+1
-1
Na+
Cl-
1
分析: NaCl的形成过程
8
电子转移
2Na + Cl2 ==== 2NaCl
化合价升高
化合价降低
点燃
0
0
+1
-1
失去 e-
得到e-
——电子的得失
化合价变化的原因:
分析: NaCl的形成过程
电子得失的动画演示
得、降、还
失、升、氧
H Cl
+17
+1
+1
+17
H
Cl
HCl
化合价的升降原因
H2 + Cl2 === 2HCl
点燃
我想要1个e-变成2e-稳定结构
我也想要1个e-变成8e-稳定结构
?
0
0
+1
-1
共用电子对
+1
-1
H Cl
——共用电子对的偏移
【结论】:
本质上,元素化合价的升降是由于元素得失电子或电子对的偏移。
所以,氧化还原反应的本质是有电子的转移。
(包括电子的得失或共用电子对的偏移)
有电子转移的反应都是氧化还原反应。
三. 从电子转移的角度认识氧化还原反应
——本质认知
没有电子转移的反应都是非氧化还原反应。
元素被还原,发生还原反应
1.氧化还原反应的特征
【理顺关系】
:有元素化合价的升降
2.氧化还原反应的本质:
(判断依据)
(包括电子的得失或共用电子对的偏移)
有电子的转移
元素失电子/电子对偏离
化合价升高
元素被氧化,发生氧化反应
元素得电子/电子对偏向
化合价降低
失、升、氧
得、降、还
记住
1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl==CuCl2 +H2O
B.CaCO3+2HCl==2NaCl+CO2↑+H2O
C.2KMnO4===K2MnO4+MnO2+O2 ↑
D.Ca(OH)2+CO2==CaCO3↓ + H2O
C
△
2、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失
B
3. 磷单质在反应4P+3KOH+3H2O=3KH2PO2+PH3中的变化是 ( )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
C
0 +1 -3
4、下列变化属于氧化反应的是 ( )
A、Fe2O3 Fe
B、Zn ZnCl2
C、Na2CO3 CO2
D、Al Al2O3
→
→
→
→
BD
失、升、氧
1、氧化剂和还原剂
CuO + H2 === Cu + H2O
△
+2 0 0 +1
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
氧化剂
还原剂
反应物
还原产物
氧化产物
生成物
氧化剂:
还原剂:
四.氧化剂和还原剂
[课本P23]
还原剂
氧化剂
得到电子(或电子对偏向)的物质
(所含元素的化合价降低)
失去电子(或电子对偏离)的物质
(所含元素的化合价升高)
还是咱哥俩好啊!
基本规律:
还原剂 + 氧化剂 = 氧化产物 + 还原产物
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
得、降、还
氧化剂:
还原剂:
失、升、氧
被氧化,发生氧化反应,得到氧化产物
被还原,发生还原反应,得到还原产物
“还原剂被氧化,氧化剂被还原”
氧化性:
还原性:
物质失去电子的能力或性质。
物质得到电子的能力或性质。
还原剂具有还原性。
氧化剂具有氧化性。
具有还原性
具有氧化性
四.氧化剂和还原剂
电子
电子
氧化反应
化合价升高,失去电子
还原反应
得到电子,化合价降低
还原剂
氧化剂
①活泼的非金属单质如:Cl2、 O2等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:酸性KMnO4、MnO2、浓H2SO4、HNO3。
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C等。
③较低态的化合物:CO、SO2、H2S等。
常见的氧化剂有:
常见的还原剂有:
(氧化剂特点:价态较高)
(还原剂特点:价态较低)
下列反应中,哪些是氧化剂?哪些是还原剂?
〖做一做〗
氧化剂
还原剂
氧化剂
还原剂
既是氧化剂又是还原剂
哪是氧化产物?还原产物?
Cl2 + H2O = HCl + HClO
Zn + H2SO4 = ZnSO4 + H2↑
Cu + Cl2 = CuCl2
既是氧化产物,又是还原产物
氧化产物
还原产物
0
+2
失、升、氧
得、降、还
+1
0
0
0
+2
-1
0
-1
+1
[歧化反应]
氧化产物
还原产物
Fe + CuSO4 = FeSO4 + Cu
2HClO = 2HCl + O2 ↑
2H2S + SO2 = 3S + 2H2O
Cl2 + H2O = HCl + HClO
3Cu +8HNO3(稀)= 3Cu(NO3)2 + 2NO↑+ 4H2O
各种类型的氧化还原反应:
1.氧化剂,还原剂为不同种物质
2.氧化剂,还原剂为同种物质
4.部分氧化还原反应
3.同种元素既被氧化,又被还原
0
+2
+2
0
+1
-1
-2
0
-2
+4
0
[归中反应]
0
-1
+1
[歧化反应]
0
+2
+5
+2
[自身氧化还原反应]
8mol HNO3: 2mol作氧化剂, 6mol作酸性
判断正误:
1. 在氧化还原反应中,有一种物质被还原,
必然有另一种物质被氧化。
2. 在氧化还原反应中,参加反应的物质,不是氧化剂就是还原剂。
Cl2 + H2O = HCl + HClO
0
-1
+1
1.下列变化一定需要加入还原剂的是( )
A. Fe2O3 Fe B. C CO2
C. Na2CO3 CO2 D. KMnO4 MnO2
得、降、还
A
被还原的反应:
上述变化中发生氧化反应的的是( )
+3 0
0 +4
B
+7 +4
2.下列变化中,必须要加入氧化剂才能实现的是( )
A、KMnO4→O2 B、HCl→Cl2
C、HCl→H2 D、SO3→H2SO4
B
练习3.
④
①
Fe
FeCl2
需要加 剂?如:
氧化
HCl
、CuCl2
Fe3+
②
Fe
需要加 剂?
还原
③
HCl
H2
需要加 剂?如:
HCl
需要加 剂?
Cl2
HCl是 剂
氧化
还原
还原
Fe、Zn
4.已知G、Q、X、Y、Z均为含氯的化合物,我们不了解它们的化学式,但知道它们在一定条件下具有下列转化关系(未配平);
(1)G→Q+NaCl (2)Q+H2O→X+H2(电解)
(3)Y+NaOH→G+Q+H2O (4)Z+NaOH→Q+X+H2O
这五种化合物中氯元素的化合价由低到高的顺序是 。
GYQZX
新
教
材
第一章 物质及其变化
第1课时 氧化还原反应的概念及判断
氧化还原反应
第三节
学习目标:
1、氧化还原反应的特征与本质
2、氧化还原反应的判断
3、认识氧化剂、还原剂、氧化性、还原性等基本概念。
4、了解常见的氧化剂、还原剂。
苹果为什么会变色?
钢铁为什么会生锈?
H2 + CuO === H2O + Cu
一. 从得失氧的角度认识氧化还原反应
氧化反应:
还原反应:
一种物质失去氧,同时另一种物质得到氧的反应
氧化还原反应:
物质失去氧原子的反应
物质得到氧原子的反应
得到氧,氧化反应
失去氧,发生还原反应
氧化反应和还原反应一定同时发生!
——表观认知
二.从化合价升降的角度认识氧化还原反应
——本质认知
2.化合物:元素正、负化合价代数和为0
元素化合价性质:
1.单质:元素化合价为“0”
3. 化合价范围:
-4、-3、-2、-1、0、+1、+2、+3、+4、+5、+6、+7
-4……0……+7
[知识回顾]
HClO KClO3 KMnO4 Na2S KI Fe2O3 K2Cr2O7重铬酸钾
⑵金属元素:Na、K、Ca、Mg、Al、Zn、 Fe、 Cu、 Hg、 Ag
(1) H:+1、O:-2
4.常见元素化合价:
特殊:
H2O2
-1
NaH
-1
+1
+1
+2
+2
+3
+2
+2 +3
+1 +2
+1 +2
+1
(3)常见物质中元素的化合价
+6
CO2 、H2CO3、HCO3 – 、CO3 2- 中C的化合价____
+4
HNO3
H3PO4
H2SO4
H2SO3
+5
+6
+4
+5
+1
+5
+7
-2
-1
+3
请分析下列3个氧化还原反应中各种元素的化合价在反应前后
【思考与交流】
2 CuO + C ==== 2 Cu + CO2↑
高温
CuO + H2 === Cu + H2O
+2
0
0
+4
+3 +2 0 +4
+2 0 0 +1
化合价升高,被氧化
化合价降低,被还原
化合价升高,被氧化
化合价降低,被还原
化合价升高,被氧化
化合价降低,被还原
“价升”,发生氧化反应
“价降”,发生还原反应
高温
Fe2O3 + CO ==== Fe + CO2
有无变化,讨论氧化还原反应与元素化合价的升降有什么关系?
二.从化合价升降的角度认识氧化还原反应
——本质认知
课本P21
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
想一想:氧化还原反应是否一定存在得失氧?请分析下面的反应。
Zn + 2HCl==== ZnCl2 + H2↑
0
+1
+2
0
化合价升高
化合价降低
,发生氧化反应
,发生还原反应
2Na + Cl2 ==== 2NaCl
0
+1
0
-1
化合价升高
化合价降低
,发生氧化反应
,发生还原反应
所以,并非只有得氧、失氧的反应才是氧化还原反应。
凡是有元素化合价升降的化学反应都是氧化还原反应
“升氧”
“降还”
二.从化合价升降的角度认识氧化还原反应
——本质认知
凡是有元素化合价升降的化学反应都是氧化还原反应
凡是没有元素化合价升降的反应,叫非氧化还原反应
课本P21
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
“升氧”
“降还”
二.从化合价升降的角度认识氧化还原反应
——本质认知
下列反应属于氧化还原反应的是
A、 C + H2O === H2+ CO
B、NH4NO3 === N2O ↑+ 2H2O
C、2NaHCO3 ==Na2CO3 + CO2↑+ H2O
D、3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
E、Cu2(OH)2CO3 ==2CuO + CO2↑+ H2O
F、 H2SO4 + Ba(OH)2== BaSO4 + 2H2O
H、Zn + 2HCl = ZnCl2 + H2 ↑
高温
△
△
△
A、B、D、H
√
√
√
√
0 +1 0 +2
-3 +5 +1
0 -1 +5
0 +1 +2 0
氧化还原反应的判断依据是:
(特 征)
是否有元素化合价的升降
凡是有元素化合价升降的化学反应都是氧化还原反应
凡是没有元素化合价升降的反应,叫非氧化还原反应
课本P21
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
“升氧”
“降还”
二.从化合价升降的角度认识氧化还原反应
——本质认知
再练习:
判断下列反应各属于四种基本反应类型中的哪一种?其中哪些属于氧化还原反应?
① H2O + CaO = Ca(OH)2↓
② C + O2 ==== CO2
点燃
2KClO3==== 2KCl + 3O2↑
MnO2
③
CaCO3 ==== CaO + CO2↑
高温
④
2KMnO4 == K2MnO4 + MnO2 + O2↑
△
⑤
Fe + CuSO4 = FeSO4 + Cu
⑥
Fe + 2HCl = FeCl2 + H2 ↑
⑦
CaCl2 + Na2CO3 == CaCO3↓+ 2NaCl
⑧
CaCO3+2HCl = CaCl2+ CO2↑+ H2O
⑨
化合反应
化合反应
分解反应
分解反应
分解反应
置换反应
置换反应
复分解反应
复分解反应
√
√
√
√
√
有单质参加的化合反应是氧化还原反应
有单质生成的分解反应是氧化还原反应
所有的置换反应一定是氧化还原反应
所有的复分解反应一定不是氧化还原反应
氧化还原反应和四大基本反应类型的关系:
置换反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
“脸 谱”
课本P22图1-14
判 断:
1.有单质参加或者有单质生成的反应一定是氧化还原反应
2.反应中,某元素由化合态变成游离态,该元素在反应中一定被还原。
2O3 == 3O2
单质态
可能被氧化,也可能被还原
“非0价”
“0价”
化合价升高
化合价降低
先分析钠与
氯气的反应吧!
问题:在氧化还原反应中,元素化合价发生改变的本质原因是什么?
2Na + Cl2 ==== 2NaCl
点燃
【想一想】
0
0
+1
-1
Na+
Cl-
1
分析: NaCl的形成过程
8
电子转移
2Na + Cl2 ==== 2NaCl
化合价升高
化合价降低
点燃
0
0
+1
-1
失去 e-
得到e-
——电子的得失
化合价变化的原因:
分析: NaCl的形成过程
电子得失的动画演示
得、降、还
失、升、氧
H Cl
+17
+1
+1
+17
H
Cl
HCl
化合价的升降原因
H2 + Cl2 === 2HCl
点燃
我想要1个e-变成2e-稳定结构
我也想要1个e-变成8e-稳定结构
?
0
0
+1
-1
共用电子对
+1
-1
H Cl
——共用电子对的偏移
【结论】:
本质上,元素化合价的升降是由于元素得失电子或电子对的偏移。
所以,氧化还原反应的本质是有电子的转移。
(包括电子的得失或共用电子对的偏移)
有电子转移的反应都是氧化还原反应。
三. 从电子转移的角度认识氧化还原反应
——本质认知
没有电子转移的反应都是非氧化还原反应。
元素被还原,发生还原反应
1.氧化还原反应的特征
【理顺关系】
:有元素化合价的升降
2.氧化还原反应的本质:
(判断依据)
(包括电子的得失或共用电子对的偏移)
有电子的转移
元素失电子/电子对偏离
化合价升高
元素被氧化,发生氧化反应
元素得电子/电子对偏向
化合价降低
失、升、氧
得、降、还
记住
1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl==CuCl2 +H2O
B.CaCO3+2HCl==2NaCl+CO2↑+H2O
C.2KMnO4===K2MnO4+MnO2+O2 ↑
D.Ca(OH)2+CO2==CaCO3↓ + H2O
C
△
2、下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失
B
3. 磷单质在反应4P+3KOH+3H2O=3KH2PO2+PH3中的变化是 ( )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
C
0 +1 -3
4、下列变化属于氧化反应的是 ( )
A、Fe2O3 Fe
B、Zn ZnCl2
C、Na2CO3 CO2
D、Al Al2O3
→
→
→
→
BD
失、升、氧
1、氧化剂和还原剂
CuO + H2 === Cu + H2O
△
+2 0 0 +1
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
氧化剂
还原剂
反应物
还原产物
氧化产物
生成物
氧化剂:
还原剂:
四.氧化剂和还原剂
[课本P23]
还原剂
氧化剂
得到电子(或电子对偏向)的物质
(所含元素的化合价降低)
失去电子(或电子对偏离)的物质
(所含元素的化合价升高)
还是咱哥俩好啊!
基本规律:
还原剂 + 氧化剂 = 氧化产物 + 还原产物
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
得、降、还
氧化剂:
还原剂:
失、升、氧
被氧化,发生氧化反应,得到氧化产物
被还原,发生还原反应,得到还原产物
“还原剂被氧化,氧化剂被还原”
氧化性:
还原性:
物质失去电子的能力或性质。
物质得到电子的能力或性质。
还原剂具有还原性。
氧化剂具有氧化性。
具有还原性
具有氧化性
四.氧化剂和还原剂
电子
电子
氧化反应
化合价升高,失去电子
还原反应
得到电子,化合价降低
还原剂
氧化剂
①活泼的非金属单质如:Cl2、 O2等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:酸性KMnO4、MnO2、浓H2SO4、HNO3。
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C等。
③较低态的化合物:CO、SO2、H2S等。
常见的氧化剂有:
常见的还原剂有:
(氧化剂特点:价态较高)
(还原剂特点:价态较低)
下列反应中,哪些是氧化剂?哪些是还原剂?
〖做一做〗
氧化剂
还原剂
氧化剂
还原剂
既是氧化剂又是还原剂
哪是氧化产物?还原产物?
Cl2 + H2O = HCl + HClO
Zn + H2SO4 = ZnSO4 + H2↑
Cu + Cl2 = CuCl2
既是氧化产物,又是还原产物
氧化产物
还原产物
0
+2
失、升、氧
得、降、还
+1
0
0
0
+2
-1
0
-1
+1
[歧化反应]
氧化产物
还原产物
Fe + CuSO4 = FeSO4 + Cu
2HClO = 2HCl + O2 ↑
2H2S + SO2 = 3S + 2H2O
Cl2 + H2O = HCl + HClO
3Cu +8HNO3(稀)= 3Cu(NO3)2 + 2NO↑+ 4H2O
各种类型的氧化还原反应:
1.氧化剂,还原剂为不同种物质
2.氧化剂,还原剂为同种物质
4.部分氧化还原反应
3.同种元素既被氧化,又被还原
0
+2
+2
0
+1
-1
-2
0
-2
+4
0
[归中反应]
0
-1
+1
[歧化反应]
0
+2
+5
+2
[自身氧化还原反应]
8mol HNO3: 2mol作氧化剂, 6mol作酸性
判断正误:
1. 在氧化还原反应中,有一种物质被还原,
必然有另一种物质被氧化。
2. 在氧化还原反应中,参加反应的物质,不是氧化剂就是还原剂。
Cl2 + H2O = HCl + HClO
0
-1
+1
1.下列变化一定需要加入还原剂的是( )
A. Fe2O3 Fe B. C CO2
C. Na2CO3 CO2 D. KMnO4 MnO2
得、降、还
A
被还原的反应:
上述变化中发生氧化反应的的是( )
+3 0
0 +4
B
+7 +4
2.下列变化中,必须要加入氧化剂才能实现的是( )
A、KMnO4→O2 B、HCl→Cl2
C、HCl→H2 D、SO3→H2SO4
B
练习3.
④
①
Fe
FeCl2
需要加 剂?如:
氧化
HCl
、CuCl2
Fe3+
②
Fe
需要加 剂?
还原
③
HCl
H2
需要加 剂?如:
HCl
需要加 剂?
Cl2
HCl是 剂
氧化
还原
还原
Fe、Zn
4.已知G、Q、X、Y、Z均为含氯的化合物,我们不了解它们的化学式,但知道它们在一定条件下具有下列转化关系(未配平);
(1)G→Q+NaCl (2)Q+H2O→X+H2(电解)
(3)Y+NaOH→G+Q+H2O (4)Z+NaOH→Q+X+H2O
这五种化合物中氯元素的化合价由低到高的顺序是 。
GYQZX
