1.3.2 氧化还原反应(2)(共60张PPT)高一化学课件(人教版2019必修第一册)
文档属性
| 名称 | 1.3.2 氧化还原反应(2)(共60张PPT)高一化学课件(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 16:54:19 | ||
图片预览








文档简介
(共60张PPT)
新
教
材
第一章 物质及其变化
第2课时 双线桥和单线桥
氧化还原反应
第三节
1.掌握用双线桥和单线桥法表示氧化还原反应中的电子转移情况
2.了解氧化还原反应的应用。
学习目标
—— 双线桥法
二. 氧化还原反应中电子转移的表示方法
(1)双线桥法
单线桥法
书写步骤:
1.标变价
——标出反应前后有变化的元素化合价
CuO + H2 ==== Cu + H2O
+2
0
0
+1
2. 连双线
——由反应物中变价元素指向生成物中同种元素
3.注得失
——在线桥上标明得失电子数
得失e-数目表示方法:
变价原子个数×单个原子化合价变化数目e-
失 e-
2×
得 2e-
1×
1
化合价升高,被氧化
化合价降低,被还原
4.检查:得失电子总数是否相等
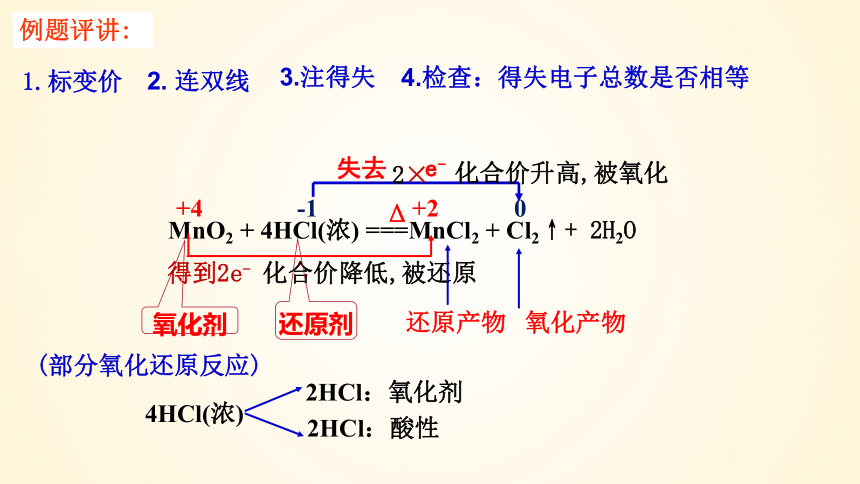
例题评讲:
+4 -1 +2 0
失去 e-
MnO2 + 4HCl(浓) ===MnCl2 + Cl2↑+ 2H2O
Δ
1.标变价
2. 连双线
3.注得失
4.检查:得失电子总数是否相等
2×
得到2e-
化合价升高,被氧化
化合价降低,被还原
氧化剂
还原剂
还原产物 氧化产物
(部分氧化还原反应)
4HCl(浓)
2HCl:氧化剂
2HCl:酸性
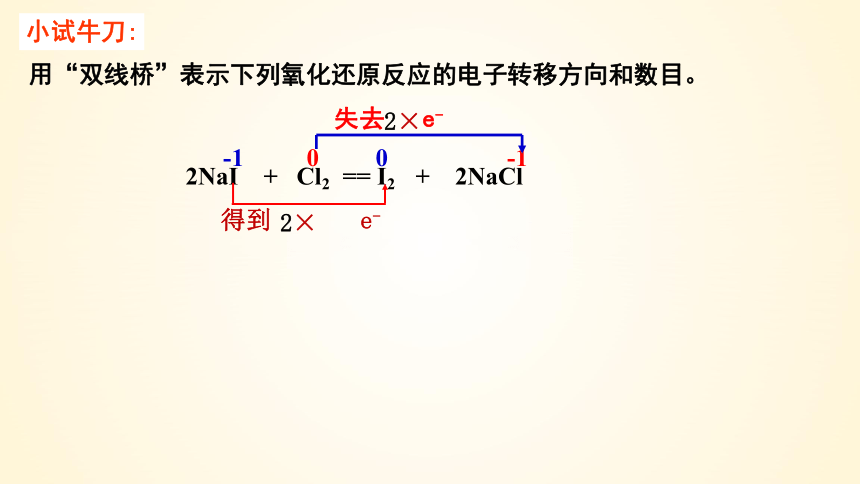
2NaI + Cl2 == I2 + 2NaCl
小试牛刀:
用“双线桥”表示下列氧化还原反应的电子转移方向和数目。
-1 0 0 -1
失去 e-
2×
得到 e-
2×
[ 判 断 ]下列用双线桥表示是否正确?
标的位置不对
箭头没有
上下各一条
得失错了
[ 判 断 ]下列用双线桥表示是否正确?
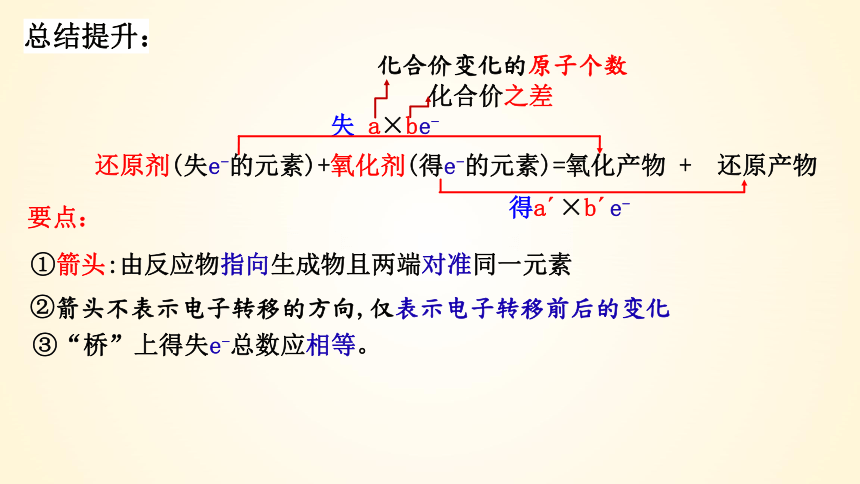
还原剂(失e-的元素)+氧化剂(得e-的元素)=氧化产物 + 还原产物
失 a×be-
得a ×b e-
要点:
①箭头:由反应物指向生成物且两端对准同一元素
②箭头不表示电子转移的方向,仅表示电子转移前后的变化
③“桥”上得失e-总数应相等。
化合价变化的原子个数
化合价之差
总结提升:
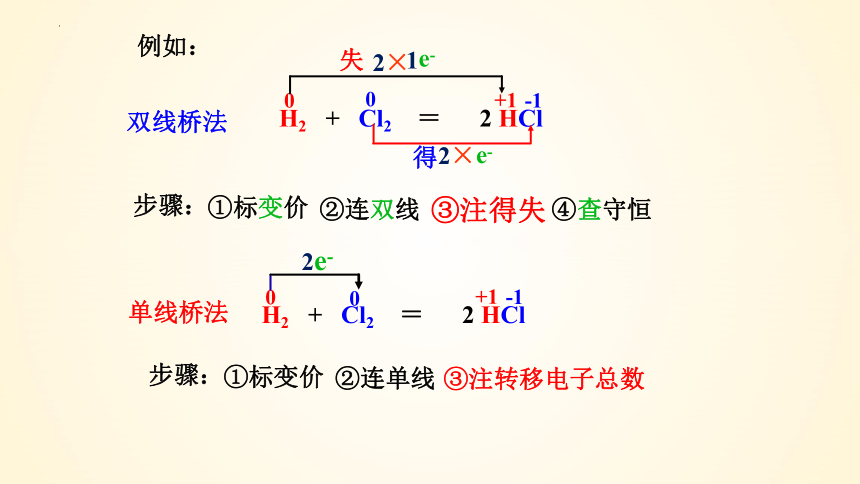
(2)单线桥法
单线桥法直观的表示氧化剂与还原剂之间电子转移的方向和总数
还原剂(失e-的元素)+氧化剂(得e-的元素)=氧化产物 + 还原产物
ne-
要点:
①箭头:由失电子元素指向得电子元素 {还原剂 → 氧化剂 }
②“桥”上不要注明“得/失”,仅需标明转移e-总数。
—— 双线桥法
二. 氧化还原反应中电子转移的表示方法
单线桥法
0
+1
0
-1
得
失
H2 + Cl2 = 2 HCl
步骤:
①标变价
②连双线
③注得失
③注转移电子总数
双线桥法
单线桥法
2e-
H2 + Cl2 = 2 HCl
例如:
e-
2×
e-
2×
1
④查守恒
步骤:
①标变价
②连单线
+1
-1
0
0
1) 是氧化剂, 是还原剂。
还原产物是 ,氧化产物是 。
2)每2 份 KMnO4参加反应,被氧化的HCl) :未被氧化HCl= 。
3)反应中转移的电子数 。
+7
-1
0
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
-1
Cl2
KMnO4
HCl
用双线桥法标出电子转移情况,按要求填空。
再如:
MnCl2
还原性
酸性
10e-
-1
+2
失
得
10:6
10×
2×
5e-
e-
{部分氧化还原反应}
单线桥法?
注意:得电子数=失电子数=转移的电子数
1) 是氧化剂, 是还原剂。
还原产物是 ,氧化产物是 。
2)每2 份 KMnO4参加反应,被氧化的HCl) :未被氧化HCl= 。
3)反应中转移的电子数 。
+7
-1
0
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
-1
Cl2
KMnO4
HCl
用双线桥法标出电子转移情况,按要求填空。
再如:
MnCl2
还原性
酸性
10e-
-1
+2
10:6
{部分氧化还原反应}
单线桥法?
注意:得电子数=失电子数=转移的电子数
10e-
①氧化剂 , 还原剂 , 氧化产物 , 还原产物 。
SiO2 + 3C = SiC + 2CO↑
{歧化反应}
练习1
失
得
0
+4
+2
-4
+4
②氧化剂与还原剂物质的量比为 。
1:2
C
C
CO
SiC
C
2C
用双线桥法标出电子转移情况,按要求填空。
1×
2×
2e-
4e-
单线桥法?
+2
-4
SiO2 + 3C = SiC + 2CO↑
4e-
2Na2O 2+ 2H2O=4NaOH+ O2↑
①氧化剂 ,还原剂 ,它们数目比为 。
② 每1个Na2O2反应,转移的电子数 。
Na2O2
Na2O2
1:1
化合价能不变,则不变原则
0
-1
-2
-2
失
2×
e-
得到2× e-
单线桥法?
2Na2O 2+ 2H2O=4NaOH+ O2↑
2e-
1e-
3S + 6KOH ==2K2S +K2SO3+3H2O
得到2×2e-
还原剂 :
氧化剂= .
失去4e-
+4
0
-2
练习2
用双线桥法标出电子转移情况。
1:2
△
2KClO3 == 2KCl + 3O2↑
①
②
0
+5
-2
-1
失去6×2e-
得到2×6e-
还原产物: .
氧化产物: .
KCl
O2
{自身氧化还原反应}
{歧化反应}
(1)双线桥法
KClO3+6HCl===KCl+3Cl2↑+3H2O
(2)单线桥法
KClO3+6HCl===KCl+3Cl2↑+3H2O
+5 -1 0
得到5e-
失去5×e-
5e-
思考:反应中氧化产物与还原产物之比是多少?
5:1
练习3:分别用双线桥法和单线桥法标出反应电子转移方向和数目
5Cl
Cl
-1
化合价能不变,则不变原则
{归中反应}
H2S + H2SO4(浓) == S ↓+SO2↑ + 2H2O
同种元素的不同价态反应遵循“只靠拢不相交”的归中原则
+6
-2
0
+4
+6
-2
0
+4
H2SO4
SO2
H2S
相交
靠拢
╳
S
练习4:分别用双线桥法和单线桥法标出反应电子转移方向和数目
分析:
H2S + H2SO4(浓) == S ↓+SO2↑ + 2H2O
+6
-2
0
+4
H2SO4
SO2
S
H2S
+6
-2
0
+4
得到2e-
失去2e-
相交
靠拢
╳
H2S + H2SO4(浓) = S↓+SO2↑+ 2H2O
2e-
单线桥法
练习4:分别用双线桥法和单线桥法标出反应电子转移方向和数目
分析:
同种元素的不同价态反应遵循“只靠拢不相交”的归中原则
归中规律
KClO3 +6HCl = KCl +3Cl2↑ + 3H2O
分析:
-1
+5
-1
0
4 FeS2 + 11 O2 == 8 SO2 + 2 Fe2O3
氧化产物 ;
元素被氧化;
反应中转移的电子数 。
氧化剂 ;
失8×5e-
得16×2e-
+4
+2
-1
-2
+3
-2
失4×e-
得6×2e-
Fe、
SO2、
S
Fe2O3
44e-
O2
还原产物 ;
SO2、
Fe2O3
练习5
用双线桥法标出电子转移情况,按要求填空。
练6.制取水处理剂ClO2的化学方程式为
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.KClO3在反应中得到电子
B.ClO2是还原产物
C.H2C2O4在反应中被氧化
D.每1个 KClO3参加反应有2 个电子转移
D
1个
+5
+3
+4
+4
的反应中,P元素发生的变化是( )
A. 被氧化. B. 被还原
C. 既被氧化又被还原 D.既未被氧化又未被还原
C
练7:在11P + 15CuSO4 + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4
11P + 15CuSO4 + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4
+1
-3
+5
+2
失6×5e-
得5×3e-
6P + 5P
问题: 1molCuSO4能氧化 mol的P ?
得15×e-
15CuSO4
P ?
能氧化
3
1/5
0
0
三. 物质氧化性、还原性及其强弱的判断
氧化性:
还原性:
物质失去电子的能力或性质。
物质得到电子的能力或性质。
还原剂具有还原性。
氧化剂具有氧化性。
+11
2 8 1
Na
+17
2 8 7
Cl
+1
1
H
极易失去最外层1个e-
,具有强 性
最外层极易得到1个e-
,具有强氧化性
氧化性、还原性均有
如何判断物质具有氧化性还是还原性呢?
还原
1. 物质氧化性、还原性的判断
思考: ①Na单质化合价能否降低?
③Fe2+的化合价呢?
②Na+的化合价能否升高?
不能。
它们处于元素的最低价,即只能 电子,表现出 性
还原
不能。
失去
它们处于元素的最高价,即只能 电子,表现出 性
能升能降
即能表现氧化性也能表现还原性
得到
氧化
Cl:
-1
0
+3
+1
+5
+7
Cl2
Cl-呢?
H+呢?
Cl2呢?
三. 物质氧化性、还原性及其强弱的判断
“价态规律”
元素处于最低价:只有还原性
元素处于最高价:只有氧化性
元素处于中间价态:既有氧化性,又有还原性
口 诀:“高价氧化低价还,中间价态两边走”
Fe、 Fe2+、 Fe3+
只有氧化性
只有还原性
既有氧化性,又有还原性
【明确】所谓最高价、最低价指处于该元素的最高价、最低价
三. 物质氧化性、还原性及其强弱的判断
1. 物质氧化性、还原性的判断
1、在Fe2+、Fe3+、S、I-、H+ 、Cl2、S2-、HCl、H2O中
只有氧化性的是 ,
只有还原性的是 ,
既有氧化性又有还原性的是 。
Fe 2+
H +
I -
Fe 3+
Cl2
S2-
HCl
H2O
+1
-1
+1
-2
还原性为主
S
氧化性为主
常见元素的化合价
[知识回顾]
H:+1
O:-2
特殊:
NaH
-1
特殊:
H2O2、Na2O2、
-1
-1
K Ca Na Mg Al Zn Fe …(H) Cu Hg Ag
+1
+2
+1
+2
+3
+2
+2
+3
+1
+2
+1
+2
+1
Cl:
-1
0
-2
+3
+1
+5
+7
HCl
HClO
HClO2
HClO3
HClO4
Cl2
N:
-3
0
+2
+1
+3
+4
NH3
N2O
NO
HNO2
N2O4
N2
+5
NO2
N2O5
HNO3
S:
0
+6
+4
CH4
SO2
S
C:
H2S
SO3
H2SO4
+6
-4
0
+2
+4
CO
CO2
注意:有机物中C往往算平均化合价
Na2S2O3
+2
平均价
特殊:
FeS2
-1
+2
CaH2
+2
-1
LiH
-1
C
2. 物质氧化性、还原性强弱的判断
问 题:Na和Al谁的还原性强?
Na易失1e-,Al易失3e-,但是还原性: Na > Al
注意:物质氧化性、还原性的强弱取决于物质得、失电子的难易程度,与得、失电子数目的多少无关。
如何判断物质氧化性、还原性的强弱呢?
三. 物质氧化性、还原性及其强弱的判断
1).根据化学方程式判断
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
氧化剂+还原剂→还原产物+氧化产物。
氧化剂
还原剂
Zn + H2SO4 = ZnSO4 + H2↑
氧化产物
还原产物
0
+2
+1
0
氧化性:
还原性:
H2SO4 > ZnSO4
(或者:H+ > Zn2+)
Zn > H2
2. 物质氧化性、还原性强弱的判断
“强”可以制“弱”
迁移练习:
1.某条件下,有反应:
(1)2 A3+ + 3B = 2A + 3B2+
(2)3D2+ + 2A = 2A3+ + 3D
(3) B2+ + C = C2+ + B
① 判定 A、B、C、D的还原性由强到弱的顺序( )
A.A >B >C >D B.D >C >B >A
C.C >B >A >D D.B >A >C >D
还原性 氧化性
(1)
(2)
(3)
B > A
A > D
C > B
A3+ > B2+
D2+ > A3+
B2+ > C2+
C
不能
② 该条件下,反应 B2+ + D = D2+ + B能进行吗?
“弱”不可以制“强”
2) 根据元素活动性顺序
(1)根据金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐↓ ,单质还原性逐渐↓
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+(H+) Cu2+ Hg2+ Ag+
对应阳离子得电子能力逐渐 ,氧化性逐渐
Fe3+
记住:氧化性
Fe2+ Cu2+ Fe3+ Ag+
<
<
<
例 Fe + CuSO4 = FeSO4 + Cu
反应Cu + 2FeCl3 =2FeCl2 + CuCl2
还原性:
Fe > Cu
还原性:
Cu > Fe2+
氧化性:
Fe3+ > Cu2+
说明还原性:Cu >Fe 吗?
金属单质还原性越强,其对应离子氧化性越弱
2. 物质氧化性、还原性强弱的判断
(2)根据非金属活动性顺序
氧化性:F > Cl > Br > I > S
还原性:F- < Cl- < Br- < I- < S2-
2. 物质氧化性、还原性强弱的判断
2) 根据元素活动性顺序
3)根据变价元素被氧化或被还原的程度判断
2Fe + 3Cl2 == 2FeCl3
△
△
Fe + S == FeS
+3
+2
氧化性:Cl2 > S
4)根据氧化还原反应进行的难易程度(反应条件)来判断
2KMnO4 +16HCl(浓) =2KCl +2MnCl2 +5Cl2↑+8 H2O
MnO2 + 4HCl(浓) ==MnCl2 + Cl2↑ + 2H2O
△
O2 + 4HCl(浓) === 2H2O + Cl2↑
高温
氧化性:
KMnO4 > MnO2 > O2
催化剂
2. 物质氧化性、还原性强弱的判断
【归纳小结】
(1)物质氧化性、还原性的强弱取决于物质得、失电子的难易程度,与得、失电子数目的多少无关。
(2)对同一元素而言,一般价态越高,氧化性越强;价态越低,氧化性越弱。
(3)氧化性或还原性还受下列因素的影响。
①温度:如热浓硫酸的氧化性比冷的浓硫酸的氧化性要强。
②浓度:如浓盐酸的还原性大于稀盐酸。
③酸碱性:如KMnO4的氧化性随溶液酸性的增强而增强。
判断正误:
①金属单质只有还原性
②非金属单质只有氧化性
③处于最高价态的元素一定具有强氧化性
④阳离子只有氧化性,阴离子只有还原性
⑤难失去电子的物质必然易得到电子。
⑥得电子越多的物质,其氧化性越强
⑦Fe比Cu还原性强,则Cu2+比Fe3+氧化性强
√
×
C、H2具有还原性
Na2CO3
×
+1
+4
×
×
Fe2+既有氧化性又有还原性
MnO4- 强氧化性
×
×
Fe2+ Cu2+ Fe3+
<
<
某元素处于最高价态时具有氧化性,但不一定有强氧化性,如Na+;
元素处于最低价态时只有还原性,但不一定有强还原性,如F-。
如稀有气体既难得电子也难失电子
Fe3+氧化I-
D
AgCl↓
Ag2SO4↓
强氧化性离子:
MnO4—、NO3—(H+) 、Cr2O72—、Fe3+
S2-、SO32—、I-、Fe2+、Br-
强还原性离子:
因发生氧化还原反应而不能大量共存(Fe3+与Fe2+、Br-除外)
四. 氧化还原反应中的基本规律
1.守恒规律
还原剂失电子总数=____________________
化合价降低的总数=____________________
氧化剂得电子总数
化合价升高的总数
例:每3个Na2SO3恰好与1个K2Cr2O7完全反应,则元素Cr在被还原的产物中的化合价为_____价。
↑(6-4 )×3 = ↓(6-x)×1 解得 x=3
+3
1.每3个锌原子加入到含2个MO2+的溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D.MO2+
B
2.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为 .
Na2 S x NaClO
-2/x
+6
+1
-1
5
解析:
①找出氧化剂、还原剂及相应的还原产物和氧化产物。
②根据得失电子守恒列出等式:
↑
1×
[6— (-2/x)] · x
↓
2
解得 x=5
=16×2
[6— (-2/x)] · x
→ xNa2SO4
→ NaCl
归纳总结:氧化还原反应的相关计算
1.计算的依据:
得失电子守恒
即:氧化剂得电子总数=还原剂失电子总数
说明: 利用守恒思想,可以抛开繁琐的反应过程,可不写化学方程式,不追究中间反应过程,只要把物质分为初态和终态,从得电子与失电子两个方面进行整体思维,便可迅速获得正确结果。
2.计算的思路:
(或化合价升降总数相等)
①找出:氧化剂 → 还原产物,还原剂 → 氧化产物
②分析注明:“1分子”氧化剂化合价降低总数
“1分子”还原剂化合价升高总数
③根据题中物质的物质的量和得失电子守恒列出等式。
四. 氧化还原反应中的基本规律
2.强弱规律
氧化剂 + 还原剂 = 还原产物 + 氧化产物
(较强氧化性) (较强还原性) (较弱还原性) (较弱氧化性)
练.常温下,在溶液中可发生以下反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O,
②2M2++R2=2M3++2R-,
③2R-+Z2=R2+2Z-,
由此判断下列说法错误的是( )
A.氧化性强弱顺序为:XO4-B.还原性强弱顺序为:X2+C.Z元素在反应①中被氧化,在反应③中被还原
D.常温下可发生反应:2M2++Z2 = 2M3++2Z-
A
3.先后规律
(1)多种还原剂与一种氧化剂作用时,还原性强的优先被氧化。
(2)多种氧化剂与一种还原剂作用时,氧化性强的优先被还原。
铁粉先与AgNO3(即Ag+)反应
Fe粉
Cu(NO3)2
AgNO3
AgNO3
Fe
Zn
AgNO3优先与Zn反应
四. 氧化还原反应中的基本规律
现有下列三个氧化还原反应:
2FeCl3+2KI=2FeCl2+2KCl+I2
2FeCl2+Cl2=2FeCl3
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是 ( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
氧化性:
KMnO4 > Cl2 >Fe3+>I2
C
4.价态规律
(1)高低规律
元素处于最高价态时,只有氧化性;元素处于最低价态时,只有还原性;元素处于中间价态时,既有氧化性又有还原性。
“高价氧化低价还,中间价态两边走”
(2)价态归中规律
同种元素相邻价态不发生氧化还原反应。
例:浓H2SO4与SO2不发生氧化还原反应
同种元素不同价态之间若发生氧化还原反应,则元素的化合价“只向中间靠拢不出现交叉”。
H2S + H2SO4(浓) == S ↓+SO2↑ + 2H2O
+6
-2
0
+4
得到2e-
失去2e-
四. 氧化还原反应中的基本规律
1.配平的原则:
五、氧化还原反应方程式配平的原则和步骤
化合价升降总数相等 [得失电子总数相等]
2.配平的步骤:
(1)标变价:
正确标出反应前后化合价有变化的元素的化合价。
S + HNO3 — H2SO4 + NO2 + H2O
0
+5
+6
+4
(2)列变化:
(3)求总数:
求元素化合价升高和降低的总数,
确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。
(即最小公倍数)
(4)配系数:用观察法配平其他各物质的化学计量数。
(依据电荷守恒和原子守恒)
(5)查守恒:即质量守恒、得失电子守恒、电荷守恒
列出元素化合价升高和降低的数值。
↑
↓
6
×1
×6
1
1
6
6
2
1
① S + HNO3 — H2SO4 + NO2 + H2O
(1)标变价
(2)列变化
(3)求总数
(4)配系数
(5)查守恒
0
+5
+6
+4
↑
↓
6
1
×1
×6
1
1
6
6
2
即最小公倍数
观察法配平
[总结]配平方程式
CO2 + K2SO4 + MnSO4 + H2O
② H2C2O4 + KMnO4 + H2SO4 —
(1)标变价
(2)列变化
(3)求总数
(4)配系数
(5)查守恒
+3
+7
+4
+2
↑
↓
2
5
×5
×2
5
10
2
2
1
即最小公倍数
观察法配平
找准1“分子”氧化剂化合价降低总数,1“分子”还原剂化合价升高总数
要点
3
8
[例1]配平下列方程式
强调:
“正向配平法”可以先不理会生成物中元素原子个数,
只管反应物“1分子”
③ FeS2 + O2 ―→ Fe2O3 + SO2
(1)标变价
(2)列变化
(3)求总数
(4)配系数
(5)查守恒
+2
-1
+3
+4
↑
↓
1
4
×4
×11
4
2
11
8
即最小公倍数
观察法配平
找准1“分子”氧化剂化合价降低总数,1“分子”还原剂化合价升高总数
要点
0
-2
-2
↑
10
总↑
11
整体法:
氧化剂(或还原剂)中的元素全部发生化合价的变化时,将物质当作一个整体进行配平的方法,叫整体法。
整体法
[例1]配平下列方程式
(8+ )
K2Cr2O7 + HCl(浓)—
[例2]
+ H2O
CrCl3
完成下列方程式并配平
+
……
Cl2↑
+ KCl
+6
-1
+3
0
↑
1
×6
6
↓
×1
1
2
6
3
2
7
(部分氧化还原反应)
强调:
“正向配平法”可以先不理会生成物中元素原子个数,
只管反应物“1分子”
KMnO4 + HCl(浓) —
[练习]
完成方程式并配平
MnCl2
+
Cl2↑
+ KCl
+ H2O
+7
+2
-1
0
↓
5
↑
1
×1
×5
1
1
5
5
2
1
(3+ )
4
2KMnO4 + 16HCl(浓) == 2MnCl2 + 5Cl2↑+ 2KCl + 8H2O
整理得:
(当然,上述两个反应也可以在HCl前面“先配2”处理)
3 8 3 2 4
③ FeS + HNO3(稀) — Fe(NO3)3 + H2SO4 + NO↑+ H2O
[练习1]配平下列方程式
① KMnO4 + K2S + H2SO4 — MnSO4 + K2SO4 + H2O
② Cu + HNO3(稀) — Cu(NO3)2 + NO↑+ H2O
8 5 12 8 9 12
1 6 1 1 3 2
1 2 3 2
② SO2 + H2S — S↓+ H2O
1 6 1 3 3
③ KClO3 + HCl(浓) — KCl + Cl2↑ + H2O
① H2SO4(浓)+ H2S — SO2↑+ S↓+ H2O
[练习2]配平下列方程式
(归中反应——正向配平)
1 1 1 1 2
3+3=
(2)___P4+___KOH+___H2O == ___K3PO4+___PH3
(1)___ S+___KOH== ___K2S+___K2SO3+___H2O
0
-2
+4
↑
↓
2
4
×2
×1
1
2
(2+1)
6
3
0
-3
+5
↓
3
5
×5
×3
↑
3
5
2
9
3
(3) P + CuSO4 + H2O = Cu3P + H3PO4 + H2SO4
0
+2
+1
+5
-3
↑
5
↓
3
↓
3
总↓
6
×5
×6
6
5
15
5+6=11
11
15
24
1.逆向配平类
:(歧化反应)
配平的方法和技巧
逆向配平类二
:自身氧化还原反应(分解)
(4) KClO3 — KCl + O2↑
0
+5
-1
-2
↑
↓
6
4
×2
×3
2
3
2
(分解反应)
(5) NH4NO3 — N2↑+ HNO3 + H2O
-3
+5
+5
0
(分解、归中反应)
正向配平
↑
3
↓
5
×5
×3
{技巧:就大不就小}
5
4
2
9
2.缺项配平:
配平方法:
②再根据质量守恒、电荷守恒确定所缺的物质的化学式(或离子)
③最后观察法配平其他物质系数。
某些反应物或生成物的化学式(或离子)未写出(缺项)
①先利用化合价升降法配平氧化剂、还原剂及还原产物与氧化产物;
(一般缺:H2O、酸、碱、H+、OH-等)
关键:
利用电荷守恒确定缺项物质是H2O、H+、OH-等。
→在酸性条件下,缺正电荷或多负电荷补H+;
→在碱性条件下,缺负电荷或多正电荷补OH-。
配平的方法和技巧
(1)__ClO-+__Fe(OH)3+_____===__Cl-+__FeO42-+__H2O
3 2 4OH- 3 2 5
(2)__MnO4-+__H2O2+____===__Mn2++__O2↑+__H2O
缺项配平类
2 5 6H+ 2 5 8
(一般缺:H2O、酸、碱、H+、OH-等)
自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平
1.全变从左边配:
配平的基本技能
3.缺项配平法:先使得失电子数配平,再观察两边电荷。
“正向配平法”
“逆向配平法”
4.当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
依据溶液酸碱性和电荷守恒,
加H2O、H+或OH-等进行两边电荷数配平
2.自变从右边配:
六、氧化还原反应在生产、生活中的重要作用
阅读: 24
食物防腐
炼钢
电池
生活实例
2H2+O2=2H2O
某些宇宙飞船上所使用的氢氧燃料电池,不仅能量转换率高,而且电池反应生成的水还可供宇航员饮用。
还原铁粉
4Fe + 3O2 + 6H2O = 4Fe(OH)3
食品包装袋内的脱氧剂。
氢氧燃料电池
隐形眼镜洗涤液的主要成分是双氧水。
生活实例
2H2O2 = O2↑+ 2H2O
炸药爆炸
2NH4NO3 ==== 2N2↑ + O2↑+ 4H2O
高温或高压
人体血液中葡萄糖与O2发生有氧呼吸作用:
C6H12O6 + 6O2 = 6CO2+6H2O
新
教
材
第一章 物质及其变化
第2课时 双线桥和单线桥
氧化还原反应
第三节
1.掌握用双线桥和单线桥法表示氧化还原反应中的电子转移情况
2.了解氧化还原反应的应用。
学习目标
—— 双线桥法
二. 氧化还原反应中电子转移的表示方法
(1)双线桥法
单线桥法
书写步骤:
1.标变价
——标出反应前后有变化的元素化合价
CuO + H2 ==== Cu + H2O
+2
0
0
+1
2. 连双线
——由反应物中变价元素指向生成物中同种元素
3.注得失
——在线桥上标明得失电子数
得失e-数目表示方法:
变价原子个数×单个原子化合价变化数目e-
失 e-
2×
得 2e-
1×
1
化合价升高,被氧化
化合价降低,被还原
4.检查:得失电子总数是否相等
例题评讲:
+4 -1 +2 0
失去 e-
MnO2 + 4HCl(浓) ===MnCl2 + Cl2↑+ 2H2O
Δ
1.标变价
2. 连双线
3.注得失
4.检查:得失电子总数是否相等
2×
得到2e-
化合价升高,被氧化
化合价降低,被还原
氧化剂
还原剂
还原产物 氧化产物
(部分氧化还原反应)
4HCl(浓)
2HCl:氧化剂
2HCl:酸性
2NaI + Cl2 == I2 + 2NaCl
小试牛刀:
用“双线桥”表示下列氧化还原反应的电子转移方向和数目。
-1 0 0 -1
失去 e-
2×
得到 e-
2×
[ 判 断 ]下列用双线桥表示是否正确?
标的位置不对
箭头没有
上下各一条
得失错了
[ 判 断 ]下列用双线桥表示是否正确?
还原剂(失e-的元素)+氧化剂(得e-的元素)=氧化产物 + 还原产物
失 a×be-
得a ×b e-
要点:
①箭头:由反应物指向生成物且两端对准同一元素
②箭头不表示电子转移的方向,仅表示电子转移前后的变化
③“桥”上得失e-总数应相等。
化合价变化的原子个数
化合价之差
总结提升:
(2)单线桥法
单线桥法直观的表示氧化剂与还原剂之间电子转移的方向和总数
还原剂(失e-的元素)+氧化剂(得e-的元素)=氧化产物 + 还原产物
ne-
要点:
①箭头:由失电子元素指向得电子元素 {还原剂 → 氧化剂 }
②“桥”上不要注明“得/失”,仅需标明转移e-总数。
—— 双线桥法
二. 氧化还原反应中电子转移的表示方法
单线桥法
0
+1
0
-1
得
失
H2 + Cl2 = 2 HCl
步骤:
①标变价
②连双线
③注得失
③注转移电子总数
双线桥法
单线桥法
2e-
H2 + Cl2 = 2 HCl
例如:
e-
2×
e-
2×
1
④查守恒
步骤:
①标变价
②连单线
+1
-1
0
0
1) 是氧化剂, 是还原剂。
还原产物是 ,氧化产物是 。
2)每2 份 KMnO4参加反应,被氧化的HCl) :未被氧化HCl= 。
3)反应中转移的电子数 。
+7
-1
0
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
-1
Cl2
KMnO4
HCl
用双线桥法标出电子转移情况,按要求填空。
再如:
MnCl2
还原性
酸性
10e-
-1
+2
失
得
10:6
10×
2×
5e-
e-
{部分氧化还原反应}
单线桥法?
注意:得电子数=失电子数=转移的电子数
1) 是氧化剂, 是还原剂。
还原产物是 ,氧化产物是 。
2)每2 份 KMnO4参加反应,被氧化的HCl) :未被氧化HCl= 。
3)反应中转移的电子数 。
+7
-1
0
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
-1
Cl2
KMnO4
HCl
用双线桥法标出电子转移情况,按要求填空。
再如:
MnCl2
还原性
酸性
10e-
-1
+2
10:6
{部分氧化还原反应}
单线桥法?
注意:得电子数=失电子数=转移的电子数
10e-
①氧化剂 , 还原剂 , 氧化产物 , 还原产物 。
SiO2 + 3C = SiC + 2CO↑
{歧化反应}
练习1
失
得
0
+4
+2
-4
+4
②氧化剂与还原剂物质的量比为 。
1:2
C
C
CO
SiC
C
2C
用双线桥法标出电子转移情况,按要求填空。
1×
2×
2e-
4e-
单线桥法?
+2
-4
SiO2 + 3C = SiC + 2CO↑
4e-
2Na2O 2+ 2H2O=4NaOH+ O2↑
①氧化剂 ,还原剂 ,它们数目比为 。
② 每1个Na2O2反应,转移的电子数 。
Na2O2
Na2O2
1:1
化合价能不变,则不变原则
0
-1
-2
-2
失
2×
e-
得到2× e-
单线桥法?
2Na2O 2+ 2H2O=4NaOH+ O2↑
2e-
1e-
3S + 6KOH ==2K2S +K2SO3+3H2O
得到2×2e-
还原剂 :
氧化剂= .
失去4e-
+4
0
-2
练习2
用双线桥法标出电子转移情况。
1:2
△
2KClO3 == 2KCl + 3O2↑
①
②
0
+5
-2
-1
失去6×2e-
得到2×6e-
还原产物: .
氧化产物: .
KCl
O2
{自身氧化还原反应}
{歧化反应}
(1)双线桥法
KClO3+6HCl===KCl+3Cl2↑+3H2O
(2)单线桥法
KClO3+6HCl===KCl+3Cl2↑+3H2O
+5 -1 0
得到5e-
失去5×e-
5e-
思考:反应中氧化产物与还原产物之比是多少?
5:1
练习3:分别用双线桥法和单线桥法标出反应电子转移方向和数目
5Cl
Cl
-1
化合价能不变,则不变原则
{归中反应}
H2S + H2SO4(浓) == S ↓+SO2↑ + 2H2O
同种元素的不同价态反应遵循“只靠拢不相交”的归中原则
+6
-2
0
+4
+6
-2
0
+4
H2SO4
SO2
H2S
相交
靠拢
╳
S
练习4:分别用双线桥法和单线桥法标出反应电子转移方向和数目
分析:
H2S + H2SO4(浓) == S ↓+SO2↑ + 2H2O
+6
-2
0
+4
H2SO4
SO2
S
H2S
+6
-2
0
+4
得到2e-
失去2e-
相交
靠拢
╳
H2S + H2SO4(浓) = S↓+SO2↑+ 2H2O
2e-
单线桥法
练习4:分别用双线桥法和单线桥法标出反应电子转移方向和数目
分析:
同种元素的不同价态反应遵循“只靠拢不相交”的归中原则
归中规律
KClO3 +6HCl = KCl +3Cl2↑ + 3H2O
分析:
-1
+5
-1
0
4 FeS2 + 11 O2 == 8 SO2 + 2 Fe2O3
氧化产物 ;
元素被氧化;
反应中转移的电子数 。
氧化剂 ;
失8×5e-
得16×2e-
+4
+2
-1
-2
+3
-2
失4×e-
得6×2e-
Fe、
SO2、
S
Fe2O3
44e-
O2
还原产物 ;
SO2、
Fe2O3
练习5
用双线桥法标出电子转移情况,按要求填空。
练6.制取水处理剂ClO2的化学方程式为
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.KClO3在反应中得到电子
B.ClO2是还原产物
C.H2C2O4在反应中被氧化
D.每1个 KClO3参加反应有2 个电子转移
D
1个
+5
+3
+4
+4
的反应中,P元素发生的变化是( )
A. 被氧化. B. 被还原
C. 既被氧化又被还原 D.既未被氧化又未被还原
C
练7:在11P + 15CuSO4 + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4
11P + 15CuSO4 + 24H2O = 5Cu3P + 6H3PO4 + 15H2SO4
+1
-3
+5
+2
失6×5e-
得5×3e-
6P + 5P
问题: 1molCuSO4能氧化 mol的P ?
得15×e-
15CuSO4
P ?
能氧化
3
1/5
0
0
三. 物质氧化性、还原性及其强弱的判断
氧化性:
还原性:
物质失去电子的能力或性质。
物质得到电子的能力或性质。
还原剂具有还原性。
氧化剂具有氧化性。
+11
2 8 1
Na
+17
2 8 7
Cl
+1
1
H
极易失去最外层1个e-
,具有强 性
最外层极易得到1个e-
,具有强氧化性
氧化性、还原性均有
如何判断物质具有氧化性还是还原性呢?
还原
1. 物质氧化性、还原性的判断
思考: ①Na单质化合价能否降低?
③Fe2+的化合价呢?
②Na+的化合价能否升高?
不能。
它们处于元素的最低价,即只能 电子,表现出 性
还原
不能。
失去
它们处于元素的最高价,即只能 电子,表现出 性
能升能降
即能表现氧化性也能表现还原性
得到
氧化
Cl:
-1
0
+3
+1
+5
+7
Cl2
Cl-呢?
H+呢?
Cl2呢?
三. 物质氧化性、还原性及其强弱的判断
“价态规律”
元素处于最低价:只有还原性
元素处于最高价:只有氧化性
元素处于中间价态:既有氧化性,又有还原性
口 诀:“高价氧化低价还,中间价态两边走”
Fe、 Fe2+、 Fe3+
只有氧化性
只有还原性
既有氧化性,又有还原性
【明确】所谓最高价、最低价指处于该元素的最高价、最低价
三. 物质氧化性、还原性及其强弱的判断
1. 物质氧化性、还原性的判断
1、在Fe2+、Fe3+、S、I-、H+ 、Cl2、S2-、HCl、H2O中
只有氧化性的是 ,
只有还原性的是 ,
既有氧化性又有还原性的是 。
Fe 2+
H +
I -
Fe 3+
Cl2
S2-
HCl
H2O
+1
-1
+1
-2
还原性为主
S
氧化性为主
常见元素的化合价
[知识回顾]
H:+1
O:-2
特殊:
NaH
-1
特殊:
H2O2、Na2O2、
-1
-1
K Ca Na Mg Al Zn Fe …(H) Cu Hg Ag
+1
+2
+1
+2
+3
+2
+2
+3
+1
+2
+1
+2
+1
Cl:
-1
0
-2
+3
+1
+5
+7
HCl
HClO
HClO2
HClO3
HClO4
Cl2
N:
-3
0
+2
+1
+3
+4
NH3
N2O
NO
HNO2
N2O4
N2
+5
NO2
N2O5
HNO3
S:
0
+6
+4
CH4
SO2
S
C:
H2S
SO3
H2SO4
+6
-4
0
+2
+4
CO
CO2
注意:有机物中C往往算平均化合价
Na2S2O3
+2
平均价
特殊:
FeS2
-1
+2
CaH2
+2
-1
LiH
-1
C
2. 物质氧化性、还原性强弱的判断
问 题:Na和Al谁的还原性强?
Na易失1e-,Al易失3e-,但是还原性: Na > Al
注意:物质氧化性、还原性的强弱取决于物质得、失电子的难易程度,与得、失电子数目的多少无关。
如何判断物质氧化性、还原性的强弱呢?
三. 物质氧化性、还原性及其强弱的判断
1).根据化学方程式判断
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
氧化剂+还原剂→还原产物+氧化产物。
氧化剂
还原剂
Zn + H2SO4 = ZnSO4 + H2↑
氧化产物
还原产物
0
+2
+1
0
氧化性:
还原性:
H2SO4 > ZnSO4
(或者:H+ > Zn2+)
Zn > H2
2. 物质氧化性、还原性强弱的判断
“强”可以制“弱”
迁移练习:
1.某条件下,有反应:
(1)2 A3+ + 3B = 2A + 3B2+
(2)3D2+ + 2A = 2A3+ + 3D
(3) B2+ + C = C2+ + B
① 判定 A、B、C、D的还原性由强到弱的顺序( )
A.A >B >C >D B.D >C >B >A
C.C >B >A >D D.B >A >C >D
还原性 氧化性
(1)
(2)
(3)
B > A
A > D
C > B
A3+ > B2+
D2+ > A3+
B2+ > C2+
C
不能
② 该条件下,反应 B2+ + D = D2+ + B能进行吗?
“弱”不可以制“强”
2) 根据元素活动性顺序
(1)根据金属活动性顺序
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
失电子能力逐渐↓ ,单质还原性逐渐↓
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+(H+) Cu2+ Hg2+ Ag+
对应阳离子得电子能力逐渐 ,氧化性逐渐
Fe3+
记住:氧化性
Fe2+ Cu2+ Fe3+ Ag+
<
<
<
例 Fe + CuSO4 = FeSO4 + Cu
反应Cu + 2FeCl3 =2FeCl2 + CuCl2
还原性:
Fe > Cu
还原性:
Cu > Fe2+
氧化性:
Fe3+ > Cu2+
说明还原性:Cu >Fe 吗?
金属单质还原性越强,其对应离子氧化性越弱
2. 物质氧化性、还原性强弱的判断
(2)根据非金属活动性顺序
氧化性:F > Cl > Br > I > S
还原性:F- < Cl- < Br- < I- < S2-
2. 物质氧化性、还原性强弱的判断
2) 根据元素活动性顺序
3)根据变价元素被氧化或被还原的程度判断
2Fe + 3Cl2 == 2FeCl3
△
△
Fe + S == FeS
+3
+2
氧化性:Cl2 > S
4)根据氧化还原反应进行的难易程度(反应条件)来判断
2KMnO4 +16HCl(浓) =2KCl +2MnCl2 +5Cl2↑+8 H2O
MnO2 + 4HCl(浓) ==MnCl2 + Cl2↑ + 2H2O
△
O2 + 4HCl(浓) === 2H2O + Cl2↑
高温
氧化性:
KMnO4 > MnO2 > O2
催化剂
2. 物质氧化性、还原性强弱的判断
【归纳小结】
(1)物质氧化性、还原性的强弱取决于物质得、失电子的难易程度,与得、失电子数目的多少无关。
(2)对同一元素而言,一般价态越高,氧化性越强;价态越低,氧化性越弱。
(3)氧化性或还原性还受下列因素的影响。
①温度:如热浓硫酸的氧化性比冷的浓硫酸的氧化性要强。
②浓度:如浓盐酸的还原性大于稀盐酸。
③酸碱性:如KMnO4的氧化性随溶液酸性的增强而增强。
判断正误:
①金属单质只有还原性
②非金属单质只有氧化性
③处于最高价态的元素一定具有强氧化性
④阳离子只有氧化性,阴离子只有还原性
⑤难失去电子的物质必然易得到电子。
⑥得电子越多的物质,其氧化性越强
⑦Fe比Cu还原性强,则Cu2+比Fe3+氧化性强
√
×
C、H2具有还原性
Na2CO3
×
+1
+4
×
×
Fe2+既有氧化性又有还原性
MnO4- 强氧化性
×
×
Fe2+ Cu2+ Fe3+
<
<
某元素处于最高价态时具有氧化性,但不一定有强氧化性,如Na+;
元素处于最低价态时只有还原性,但不一定有强还原性,如F-。
如稀有气体既难得电子也难失电子
Fe3+氧化I-
D
AgCl↓
Ag2SO4↓
强氧化性离子:
MnO4—、NO3—(H+) 、Cr2O72—、Fe3+
S2-、SO32—、I-、Fe2+、Br-
强还原性离子:
因发生氧化还原反应而不能大量共存(Fe3+与Fe2+、Br-除外)
四. 氧化还原反应中的基本规律
1.守恒规律
还原剂失电子总数=____________________
化合价降低的总数=____________________
氧化剂得电子总数
化合价升高的总数
例:每3个Na2SO3恰好与1个K2Cr2O7完全反应,则元素Cr在被还原的产物中的化合价为_____价。
↑(6-4 )×3 = ↓(6-x)×1 解得 x=3
+3
1.每3个锌原子加入到含2个MO2+的溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D.MO2+
B
2.Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1∶16,则x的值为 .
Na2 S x NaClO
-2/x
+6
+1
-1
5
解析:
①找出氧化剂、还原剂及相应的还原产物和氧化产物。
②根据得失电子守恒列出等式:
↑
1×
[6— (-2/x)] · x
↓
2
解得 x=5
=16×2
[6— (-2/x)] · x
→ xNa2SO4
→ NaCl
归纳总结:氧化还原反应的相关计算
1.计算的依据:
得失电子守恒
即:氧化剂得电子总数=还原剂失电子总数
说明: 利用守恒思想,可以抛开繁琐的反应过程,可不写化学方程式,不追究中间反应过程,只要把物质分为初态和终态,从得电子与失电子两个方面进行整体思维,便可迅速获得正确结果。
2.计算的思路:
(或化合价升降总数相等)
①找出:氧化剂 → 还原产物,还原剂 → 氧化产物
②分析注明:“1分子”氧化剂化合价降低总数
“1分子”还原剂化合价升高总数
③根据题中物质的物质的量和得失电子守恒列出等式。
四. 氧化还原反应中的基本规律
2.强弱规律
氧化剂 + 还原剂 = 还原产物 + 氧化产物
(较强氧化性) (较强还原性) (较弱还原性) (较弱氧化性)
练.常温下,在溶液中可发生以下反应:
①16H++10Z-+2XO4-=2X2++5Z2+8H2O,
②2M2++R2=2M3++2R-,
③2R-+Z2=R2+2Z-,
由此判断下列说法错误的是( )
A.氧化性强弱顺序为:XO4-
D.常温下可发生反应:2M2++Z2 = 2M3++2Z-
A
3.先后规律
(1)多种还原剂与一种氧化剂作用时,还原性强的优先被氧化。
(2)多种氧化剂与一种还原剂作用时,氧化性强的优先被还原。
铁粉先与AgNO3(即Ag+)反应
Fe粉
Cu(NO3)2
AgNO3
AgNO3
Fe
Zn
AgNO3优先与Zn反应
四. 氧化还原反应中的基本规律
现有下列三个氧化还原反应:
2FeCl3+2KI=2FeCl2+2KCl+I2
2FeCl2+Cl2=2FeCl3
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中含有Fe2+、Cl-和I-,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是 ( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
氧化性:
KMnO4 > Cl2 >Fe3+>I2
C
4.价态规律
(1)高低规律
元素处于最高价态时,只有氧化性;元素处于最低价态时,只有还原性;元素处于中间价态时,既有氧化性又有还原性。
“高价氧化低价还,中间价态两边走”
(2)价态归中规律
同种元素相邻价态不发生氧化还原反应。
例:浓H2SO4与SO2不发生氧化还原反应
同种元素不同价态之间若发生氧化还原反应,则元素的化合价“只向中间靠拢不出现交叉”。
H2S + H2SO4(浓) == S ↓+SO2↑ + 2H2O
+6
-2
0
+4
得到2e-
失去2e-
四. 氧化还原反应中的基本规律
1.配平的原则:
五、氧化还原反应方程式配平的原则和步骤
化合价升降总数相等 [得失电子总数相等]
2.配平的步骤:
(1)标变价:
正确标出反应前后化合价有变化的元素的化合价。
S + HNO3 — H2SO4 + NO2 + H2O
0
+5
+6
+4
(2)列变化:
(3)求总数:
求元素化合价升高和降低的总数,
确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。
(即最小公倍数)
(4)配系数:用观察法配平其他各物质的化学计量数。
(依据电荷守恒和原子守恒)
(5)查守恒:即质量守恒、得失电子守恒、电荷守恒
列出元素化合价升高和降低的数值。
↑
↓
6
×1
×6
1
1
6
6
2
1
① S + HNO3 — H2SO4 + NO2 + H2O
(1)标变价
(2)列变化
(3)求总数
(4)配系数
(5)查守恒
0
+5
+6
+4
↑
↓
6
1
×1
×6
1
1
6
6
2
即最小公倍数
观察法配平
[总结]配平方程式
CO2 + K2SO4 + MnSO4 + H2O
② H2C2O4 + KMnO4 + H2SO4 —
(1)标变价
(2)列变化
(3)求总数
(4)配系数
(5)查守恒
+3
+7
+4
+2
↑
↓
2
5
×5
×2
5
10
2
2
1
即最小公倍数
观察法配平
找准1“分子”氧化剂化合价降低总数,1“分子”还原剂化合价升高总数
要点
3
8
[例1]配平下列方程式
强调:
“正向配平法”可以先不理会生成物中元素原子个数,
只管反应物“1分子”
③ FeS2 + O2 ―→ Fe2O3 + SO2
(1)标变价
(2)列变化
(3)求总数
(4)配系数
(5)查守恒
+2
-1
+3
+4
↑
↓
1
4
×4
×11
4
2
11
8
即最小公倍数
观察法配平
找准1“分子”氧化剂化合价降低总数,1“分子”还原剂化合价升高总数
要点
0
-2
-2
↑
10
总↑
11
整体法:
氧化剂(或还原剂)中的元素全部发生化合价的变化时,将物质当作一个整体进行配平的方法,叫整体法。
整体法
[例1]配平下列方程式
(8+ )
K2Cr2O7 + HCl(浓)—
[例2]
+ H2O
CrCl3
完成下列方程式并配平
+
……
Cl2↑
+ KCl
+6
-1
+3
0
↑
1
×6
6
↓
×1
1
2
6
3
2
7
(部分氧化还原反应)
强调:
“正向配平法”可以先不理会生成物中元素原子个数,
只管反应物“1分子”
KMnO4 + HCl(浓) —
[练习]
完成方程式并配平
MnCl2
+
Cl2↑
+ KCl
+ H2O
+7
+2
-1
0
↓
5
↑
1
×1
×5
1
1
5
5
2
1
(3+ )
4
2KMnO4 + 16HCl(浓) == 2MnCl2 + 5Cl2↑+ 2KCl + 8H2O
整理得:
(当然,上述两个反应也可以在HCl前面“先配2”处理)
3 8 3 2 4
③ FeS + HNO3(稀) — Fe(NO3)3 + H2SO4 + NO↑+ H2O
[练习1]配平下列方程式
① KMnO4 + K2S + H2SO4 — MnSO4 + K2SO4 + H2O
② Cu + HNO3(稀) — Cu(NO3)2 + NO↑+ H2O
8 5 12 8 9 12
1 6 1 1 3 2
1 2 3 2
② SO2 + H2S — S↓+ H2O
1 6 1 3 3
③ KClO3 + HCl(浓) — KCl + Cl2↑ + H2O
① H2SO4(浓)+ H2S — SO2↑+ S↓+ H2O
[练习2]配平下列方程式
(归中反应——正向配平)
1 1 1 1 2
3+3=
(2)___P4+___KOH+___H2O == ___K3PO4+___PH3
(1)___ S+___KOH== ___K2S+___K2SO3+___H2O
0
-2
+4
↑
↓
2
4
×2
×1
1
2
(2+1)
6
3
0
-3
+5
↓
3
5
×5
×3
↑
3
5
2
9
3
(3) P + CuSO4 + H2O = Cu3P + H3PO4 + H2SO4
0
+2
+1
+5
-3
↑
5
↓
3
↓
3
总↓
6
×5
×6
6
5
15
5+6=11
11
15
24
1.逆向配平类
:(歧化反应)
配平的方法和技巧
逆向配平类二
:自身氧化还原反应(分解)
(4) KClO3 — KCl + O2↑
0
+5
-1
-2
↑
↓
6
4
×2
×3
2
3
2
(分解反应)
(5) NH4NO3 — N2↑+ HNO3 + H2O
-3
+5
+5
0
(分解、归中反应)
正向配平
↑
3
↓
5
×5
×3
{技巧:就大不就小}
5
4
2
9
2.缺项配平:
配平方法:
②再根据质量守恒、电荷守恒确定所缺的物质的化学式(或离子)
③最后观察法配平其他物质系数。
某些反应物或生成物的化学式(或离子)未写出(缺项)
①先利用化合价升降法配平氧化剂、还原剂及还原产物与氧化产物;
(一般缺:H2O、酸、碱、H+、OH-等)
关键:
利用电荷守恒确定缺项物质是H2O、H+、OH-等。
→在酸性条件下,缺正电荷或多负电荷补H+;
→在碱性条件下,缺负电荷或多正电荷补OH-。
配平的方法和技巧
(1)__ClO-+__Fe(OH)3+_____===__Cl-+__FeO42-+__H2O
3 2 4OH- 3 2 5
(2)__MnO4-+__H2O2+____===__Mn2++__O2↑+__H2O
缺项配平类
2 5 6H+ 2 5 8
(一般缺:H2O、酸、碱、H+、OH-等)
自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平
1.全变从左边配:
配平的基本技能
3.缺项配平法:先使得失电子数配平,再观察两边电荷。
“正向配平法”
“逆向配平法”
4.当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
依据溶液酸碱性和电荷守恒,
加H2O、H+或OH-等进行两边电荷数配平
2.自变从右边配:
六、氧化还原反应在生产、生活中的重要作用
阅读: 24
食物防腐
炼钢
电池
生活实例
2H2+O2=2H2O
某些宇宙飞船上所使用的氢氧燃料电池,不仅能量转换率高,而且电池反应生成的水还可供宇航员饮用。
还原铁粉
4Fe + 3O2 + 6H2O = 4Fe(OH)3
食品包装袋内的脱氧剂。
氢氧燃料电池
隐形眼镜洗涤液的主要成分是双氧水。
生活实例
2H2O2 = O2↑+ 2H2O
炸药爆炸
2NH4NO3 ==== 2N2↑ + O2↑+ 4H2O
高温或高压
人体血液中葡萄糖与O2发生有氧呼吸作用:
C6H12O6 + 6O2 = 6CO2+6H2O
