1.3.3 价态规律、强弱规律及应用(课件)(共30张PPT)高一化学(人教版2019必修第一册)
文档属性
| 名称 | 1.3.3 价态规律、强弱规律及应用(课件)(共30张PPT)高一化学(人教版2019必修第一册) |
|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-28 16:56:22 | ||
图片预览










文档简介
(共30张PPT)
必修第一册(人教版2019)
第一章 物质的分类及其变化
第三节 氧化还原反应
第3课时 价态规律、强弱规律及应用
目录
价态规律及应用
01
强弱规律及应用
02
习
学
目
标
1.掌握氧化还原反应的基本规律
2.能运用相关规律解决问题
NO.1
价态规律及应用
A.元素处于最高价,只有氧化性
(如Fe3+、KMnO4、H2SO4等);
B.元素处于最低价,只有还原性(如S2-、I-等);
C.元素处于中间价态,既有氧化性又有还原性。(如Fe2+、S等)
1.高低规律
(1)内容:元素在物质中所处的价态,决定该元素的氧化性或还原性,一般来说,
(2)应用:预测物质的氧化性和还原性。
价态规律(只针对同一元素)
[练习1]预测下列微粒的氧化性和还原性,并简单说明预测依据。
S2-、Fe2+、Fe3+、Mg2+、S、I-、H+
(1)Fe3+具有_____性,预测依据________________________________________
____________________。
(2)Mg2+、H+只有_____性,预测依据_______________________________。
(3)只有还原性的是________,预测依据_________________________________
_____________________________。
氧化
Fe3+是Fe元素的高价态,反应时可得电子,
化合价降为+2价或0价
氧化
元素处于最高价态时只具有氧化性
S2-、I-
二者分别是硫元素、碘元素的最低
价态,只能失去电子表现还原性
(4)既有氧化性又有还原性的是________,预测依据_______________________
__________________________________________________________________________________。
Fe2+、S
Fe2+既可以得电子降为
0价,也可以失电子升高到+3价,S可以得电子降为-2价,也可失电子升高到+4价或+6价
[练习2] 判断下列物质具有氧化性还是还原性
HCl MnO2
H的化合价可以由+1价降低,
Cl的化合价可以由-1价升高,
HCl既有氧化性又有还原性
Mn的化合价可以由+4价降低,
O的化合价可以由-2价升高,
MnO2既有氧化性又有还原性
MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O
MnO2是氧化剂,HCl是还原剂
MnO2和HCl都是既有氧化性又有还原性,为什么在此反应中MnO2是氧化剂而HCl是还原剂呢?
说明两者比较,HCl的还原性相对较强,MnO2的氧化性相对较强
【注意】根据物质中所含元素的化合价来预测物质的氧化性或还原性时,要从整体出发,分析物质所含的每一种元素价态。
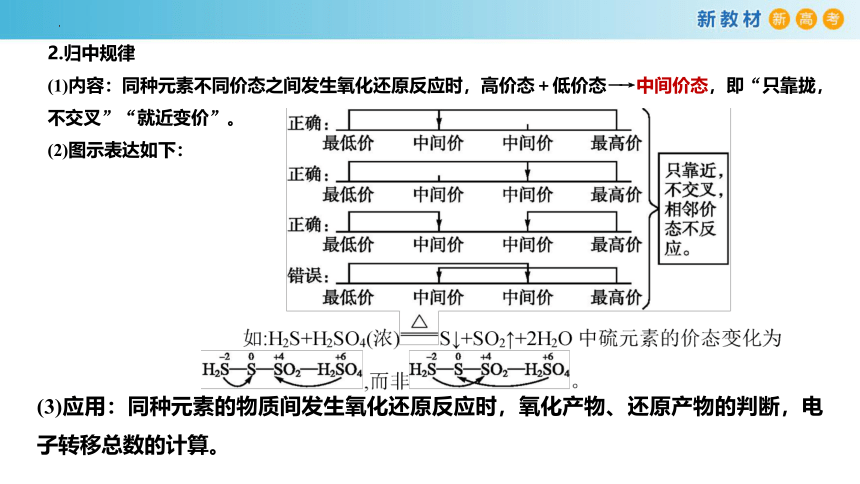
2.归中规律
(1)内容:同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”“就近变价”。
(2)图示表达如下:
(3)应用:同种元素的物质间发生氧化还原反应时,氧化产物、还原产物的判断,电子转移总数的计算。
[例1] 指出下列归中反应中的氧化产物和还原产物,用双线桥标出电子转移的方向和数目。
H2S+H2SO4(浓)===S↓+SO2↑+2H2O
答案 S是氧化产物,SO2是还原产物
H2S中S元素为-2价,与产物中的单质S的0价接近,浓硫酸中的硫为+6价,与SO2中+4价近。
[例2]请分析下列两种双线桥法,判断哪种表示方法正确。
(1) (2)
Cl2既是氧化产物又是还原产物
3.歧化规律
氧化还原反应中,有原子化合价升高,必然有原子化合价降低。
某物质发生歧化反应时:
元素的中间价态→该元素的高价化合物 + 该元素的低价化合物
例如:
Cl2+2NaOH=NaCl+NaClO+ H2O
0
-1
+1
得 1e-
失 1e-
2Na2O2 + 2CO2 = 2Na2CO3 + O2
-1
-2
0
[例3] 已知氯元素有-1、0、+1、+3、+5、+7等多种常见化合价,氯气跟氢氧化钾溶液在一定条件下发生如下反应:
(1)Cl2+KOH―→KX+KY+H2O(未配平)
(2)KX―→KY+KZ(氯元素歧化反应,未配平)。
KX、KY、KZ均是含氯元素的钾盐,Cl元素在①KX、②KY、③KZ中的价态由高到低的顺序是________(填序号)。
③①②
4.同种元素相邻价态不发生氧化还原反应规律
例如:Fe2+与Fe3+ 不反应
铁的+2价与+3价之间无化合价
H2SO4与SO2不反应
硫元素+4与+6之间也没有化合价
0 +2 +3
-2 0 +4 +6
1,下列微粒只有还原性的是
A.H+ B.Fe2+ C.Zn D.HCl
√
只有还原性的元素应处于最低价。金属单质0价就是最低价。HCl中虽然Cl元素为-1价,为最低价,但是H为+1价,为最高价,有氧化性。
课堂检测
2.已知氮元素有多种可变化合价,常见的有-3、+2、+3、+4、+5价等。某同学写出以下三个化学方程式(未配平):
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
根据价态规律,判断上述反应是否有可能实现,说明判断的理由。
答案 ①可能,反应物中的氮元素为+2价、+5价,生成物中为+3价,符合归中反应规律。
②不可能,反应物中的氮元素为-3价、+2价,生成物中为+3价,N元素的化合价只升不降。
③可能,反应物中的氮元素为+4价,生成物中为+3价、+5价,符合歧化反应规律。
NO.2
强弱规律及应用
强弱规律
(1)物质氧化性或还原性的强弱决定于得失电子的难易程度,与得失电子的数目无关。
(2)根据氧化还原反应方程式进行判断
还原剂 + 氧化剂=== 氧化产物 + 还原产物
(强还原性) (强氧化性) (弱氧化性) (弱还原性)
还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。
[例1] 现有下列几个离子反应:
②2Fe2++Br2===2Fe3++2Br-
下列有关性质的比较正确的是
C.还原性:SO2D.还原性:Cl->Cr3+>Fe2+
√
氧化剂的氧化性大于氧化产物的氧化性
还原剂的还原性大于还原产物的还原性
强弱规律的应用
(1)判断有氧化性和还原性的物质在一定条件下能否反应:
以Zn为例,Zn可以与Fe2+、Sn2+、H+、Cu2+等发生置换反应,但不能与Mg2+、Al3+等反应。
[例2.]已知下列反应:
①Cl2 + 2NaBr =2NaCl+Br2
②2KI + Br2= 2KBr + I2
③Na2S + I2 = 2NaI + S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是________________
(2)Cl2 、Br2、I2、S的氧化性由强到弱的顺序是________________
(3)判断Cl2与Na2S能否反应?__________________
(4)判断I2与NaCl能否共存?______________
还原性
Br- > Cl-
I- > Br-
S2- > I-
S2- > I->Br- > Cl-
氧化性
Cl2 > Br2
Br2 > I2
I2 > S
Cl2 > Br2>I2 > S
能
能
1.己知反应: 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl2 + Cl2 = 2FeCl3
SO2 + I2 + 2H2O = H2SO4 + 2HI
判断下列物质的还原能力由强到弱的顺序是( )
A. I- > Fe2+> Cl- >SO2 B. Cl-> Fe2+> SO2 > I-
C. Fe2+>I- > Cl- > SO2 D. SO2>I- > Fe2+> Cl-
D
2. 试判断下列物质Cl2、 Fe3+ 、I2 、SO2的氧化能力由强到弱的顺序是
Cl2 > Fe3+ > I2 > SO2
3.常温下,下列三个反应都能发生:
2D- + A2 = 2A- + D2 2B- + D2 = 2D- + B2 2A- + C2 = 2C- + A2
由此得出正确结论是( )
(A)A-、B-、C-、D-中C-还原性最强
(B)A2、B2、C2、D2中C2的氧化性最弱
(C)2C-+B2 = 2B-+ C2不能发生
(D)还原性A->B -
C
4. PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱,下列反应在水溶液中不可能发生的是
A.Cu+2Fe3+===Cu2++2Fe2+
C.2Fe2++Cl2===2Fe3++2Cl-
√
氧化剂氧化性:PbO2>KMnO4>Cl2>FeCl3>Cu2+
↓ ↓ ↓ ↓ ↓
还原产物的还原性:Pb2+<Mn2+<Cl-<Fe2+<Cu,
(2)同一氧化剂与多种还原剂混合时,还原性强的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,氯气的量不足时首先氧化I-。
同一还原剂与多种氧化剂混合时,氧化性强的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
结论:氧化还原反应中,强者优先。
[例3] 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先被置换出来的是
A.Mg B.Cu C.Ag D.H2
√
阳离子的氧化性强弱顺序为Ag+>Cu2+>H+>Zn2+>Mg2+,把锌粉加入Cu(NO3)2、Mg(NO3)2和AgNO3的混合溶液中,锌先与AgNO3反应置换出Ag,然后与Cu(NO3)2反应置换出Cu,锌粉不能与溶液中的Mg(NO3)2发生反应。
1.已知还原性:SO2>I->Fe2+,下列离子反应不正确的是
B.I2+2Fe2+===2I-+2Fe3+
D.少量Cl2通入FeI2溶液中:Cl2+2I-===2Cl-+I2
√
反应I2+2Fe2+===2I-+2Fe3+中,Fe2+为还原剂,I-为还原产物,还原性:Fe2+>I-,与题给信息相悖,反应不能发生,B错误。
课堂检测
2.已知下列反应: ①Cl2+2NaBr===2NaCl+Br2
②2KI+Br2===2KBr+I2 ③Na2S+I2===2NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是_________________。
S2->I->Br->Cl-
根据同一氧化还原反应中还原剂的还原性强于还原产物的还原性,由反应①知还原性:Br->Cl-,由反应②知还原性:I->Br-,由反应③知还原性:S2->I-,即还原性:S2->I->Br->Cl-。
Cl2>Br2>I2>S
根据同一氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,由①得氧化性:Cl2>Br2,由②得氧化性:Br2>I2,由③得氧化性:I2>S,故氧化性由强到弱的顺序为Cl2>Br2>I2>S。
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是_____________。
(3)判断Cl2与Na2S能否反应?____(填“能”或“否”)。
能
由(2)知氧化性:Cl2>S,故Cl2与Na2S能发生反应:Cl2+Na2S===2NaCl+S↓。
(4)判断I2与NaBr能否共存?____(填“能”或“否”)。
能
由(2)知氧化性:Br2>I2,故I2与NaBr不能反应,则I2与NaBr能共存。
3.在常温下发生下列反应:
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,下列结论错误的是
A.溶液中可发生反应:Z2+2A2+===2A3++2Z-
B.Z2在①③反应中均为还原剂
√
的氧化性强于Z2
B2的氧化性强于A3+
Z2的氧化性强于B2
4.在稀硫酸中几种离子的转化关系如图所示。下列说法正确的是
A.反应1中氧化剂为Mn3+
B.氧化性:Ce4+>Fe3+>I2>Mn3+
C.反应2的氧化剂为Mn3+,还原产物为Fe3+
D.推测可发生反应:2Mn3++2I-===I2+2Mn2+
√
反应1中,Mn2+转化为Mn3+,锰元素化合
价升高,Mn2+是还原剂,Mn3+是氧化产
物,A错误;
反应1中Ce4+是氧化剂,Mn3+是氧化产物,反应2中Mn3+是氧化剂,Fe3+是氧化产物,反应3中Fe3+是氧化剂,I2是氧化产物,而氧化剂的氧化性大于氧化产物的氧化性,则氧化性:Ce4+>Mn3+>Fe3+>I2,B错误;
氧化剂具有氧化性,元素化合价降低,得到还原产物,还原剂具有还原性,元素化合价升高,得到氧化产物,反应2的氧化剂为Mn3+,还原产物为Mn2+,C错误;
由选项B可知,氧化性:Ce4+>Mn3+>Fe3+>I2,推测可发生反应:2Mn3++2I-===I2+2Mn2+,D正确。
必修第一册(人教版2019)
第一章 物质的分类及其变化
第三节 氧化还原反应
第3课时 价态规律、强弱规律及应用
目录
价态规律及应用
01
强弱规律及应用
02
习
学
目
标
1.掌握氧化还原反应的基本规律
2.能运用相关规律解决问题
NO.1
价态规律及应用
A.元素处于最高价,只有氧化性
(如Fe3+、KMnO4、H2SO4等);
B.元素处于最低价,只有还原性(如S2-、I-等);
C.元素处于中间价态,既有氧化性又有还原性。(如Fe2+、S等)
1.高低规律
(1)内容:元素在物质中所处的价态,决定该元素的氧化性或还原性,一般来说,
(2)应用:预测物质的氧化性和还原性。
价态规律(只针对同一元素)
[练习1]预测下列微粒的氧化性和还原性,并简单说明预测依据。
S2-、Fe2+、Fe3+、Mg2+、S、I-、H+
(1)Fe3+具有_____性,预测依据________________________________________
____________________。
(2)Mg2+、H+只有_____性,预测依据_______________________________。
(3)只有还原性的是________,预测依据_________________________________
_____________________________。
氧化
Fe3+是Fe元素的高价态,反应时可得电子,
化合价降为+2价或0价
氧化
元素处于最高价态时只具有氧化性
S2-、I-
二者分别是硫元素、碘元素的最低
价态,只能失去电子表现还原性
(4)既有氧化性又有还原性的是________,预测依据_______________________
__________________________________________________________________________________。
Fe2+、S
Fe2+既可以得电子降为
0价,也可以失电子升高到+3价,S可以得电子降为-2价,也可失电子升高到+4价或+6价
[练习2] 判断下列物质具有氧化性还是还原性
HCl MnO2
H的化合价可以由+1价降低,
Cl的化合价可以由-1价升高,
HCl既有氧化性又有还原性
Mn的化合价可以由+4价降低,
O的化合价可以由-2价升高,
MnO2既有氧化性又有还原性
MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O
MnO2是氧化剂,HCl是还原剂
MnO2和HCl都是既有氧化性又有还原性,为什么在此反应中MnO2是氧化剂而HCl是还原剂呢?
说明两者比较,HCl的还原性相对较强,MnO2的氧化性相对较强
【注意】根据物质中所含元素的化合价来预测物质的氧化性或还原性时,要从整体出发,分析物质所含的每一种元素价态。
2.归中规律
(1)内容:同种元素不同价态之间发生氧化还原反应时,高价态+低价态―→中间价态,即“只靠拢,不交叉”“就近变价”。
(2)图示表达如下:
(3)应用:同种元素的物质间发生氧化还原反应时,氧化产物、还原产物的判断,电子转移总数的计算。
[例1] 指出下列归中反应中的氧化产物和还原产物,用双线桥标出电子转移的方向和数目。
H2S+H2SO4(浓)===S↓+SO2↑+2H2O
答案 S是氧化产物,SO2是还原产物
H2S中S元素为-2价,与产物中的单质S的0价接近,浓硫酸中的硫为+6价,与SO2中+4价近。
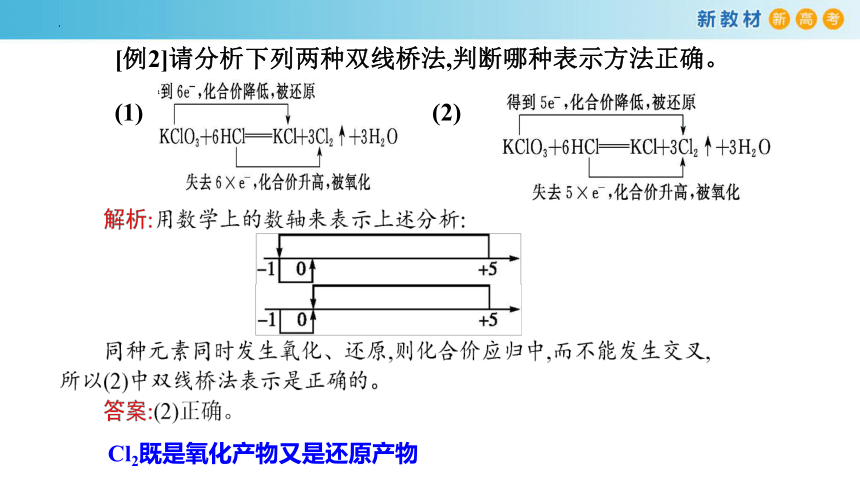
[例2]请分析下列两种双线桥法,判断哪种表示方法正确。
(1) (2)
Cl2既是氧化产物又是还原产物
3.歧化规律
氧化还原反应中,有原子化合价升高,必然有原子化合价降低。
某物质发生歧化反应时:
元素的中间价态→该元素的高价化合物 + 该元素的低价化合物
例如:
Cl2+2NaOH=NaCl+NaClO+ H2O
0
-1
+1
得 1e-
失 1e-
2Na2O2 + 2CO2 = 2Na2CO3 + O2
-1
-2
0
[例3] 已知氯元素有-1、0、+1、+3、+5、+7等多种常见化合价,氯气跟氢氧化钾溶液在一定条件下发生如下反应:
(1)Cl2+KOH―→KX+KY+H2O(未配平)
(2)KX―→KY+KZ(氯元素歧化反应,未配平)。
KX、KY、KZ均是含氯元素的钾盐,Cl元素在①KX、②KY、③KZ中的价态由高到低的顺序是________(填序号)。
③①②
4.同种元素相邻价态不发生氧化还原反应规律
例如:Fe2+与Fe3+ 不反应
铁的+2价与+3价之间无化合价
H2SO4与SO2不反应
硫元素+4与+6之间也没有化合价
0 +2 +3
-2 0 +4 +6
1,下列微粒只有还原性的是
A.H+ B.Fe2+ C.Zn D.HCl
√
只有还原性的元素应处于最低价。金属单质0价就是最低价。HCl中虽然Cl元素为-1价,为最低价,但是H为+1价,为最高价,有氧化性。
课堂检测
2.已知氮元素有多种可变化合价,常见的有-3、+2、+3、+4、+5价等。某同学写出以下三个化学方程式(未配平):
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
根据价态规律,判断上述反应是否有可能实现,说明判断的理由。
答案 ①可能,反应物中的氮元素为+2价、+5价,生成物中为+3价,符合归中反应规律。
②不可能,反应物中的氮元素为-3价、+2价,生成物中为+3价,N元素的化合价只升不降。
③可能,反应物中的氮元素为+4价,生成物中为+3价、+5价,符合歧化反应规律。
NO.2
强弱规律及应用
强弱规律
(1)物质氧化性或还原性的强弱决定于得失电子的难易程度,与得失电子的数目无关。
(2)根据氧化还原反应方程式进行判断
还原剂 + 氧化剂=== 氧化产物 + 还原产物
(强还原性) (强氧化性) (弱氧化性) (弱还原性)
还原性:还原剂>还原产物;
氧化性:氧化剂>氧化产物。
[例1] 现有下列几个离子反应:
②2Fe2++Br2===2Fe3++2Br-
下列有关性质的比较正确的是
C.还原性:SO2
√
氧化剂的氧化性大于氧化产物的氧化性
还原剂的还原性大于还原产物的还原性
强弱规律的应用
(1)判断有氧化性和还原性的物质在一定条件下能否反应:
以Zn为例,Zn可以与Fe2+、Sn2+、H+、Cu2+等发生置换反应,但不能与Mg2+、Al3+等反应。
[例2.]已知下列反应:
①Cl2 + 2NaBr =2NaCl+Br2
②2KI + Br2= 2KBr + I2
③Na2S + I2 = 2NaI + S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是________________
(2)Cl2 、Br2、I2、S的氧化性由强到弱的顺序是________________
(3)判断Cl2与Na2S能否反应?__________________
(4)判断I2与NaCl能否共存?______________
还原性
Br- > Cl-
I- > Br-
S2- > I-
S2- > I->Br- > Cl-
氧化性
Cl2 > Br2
Br2 > I2
I2 > S
Cl2 > Br2>I2 > S
能
能
1.己知反应: 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
2FeCl2 + Cl2 = 2FeCl3
SO2 + I2 + 2H2O = H2SO4 + 2HI
判断下列物质的还原能力由强到弱的顺序是( )
A. I- > Fe2+> Cl- >SO2 B. Cl-> Fe2+> SO2 > I-
C. Fe2+>I- > Cl- > SO2 D. SO2>I- > Fe2+> Cl-
D
2. 试判断下列物质Cl2、 Fe3+ 、I2 、SO2的氧化能力由强到弱的顺序是
Cl2 > Fe3+ > I2 > SO2
3.常温下,下列三个反应都能发生:
2D- + A2 = 2A- + D2 2B- + D2 = 2D- + B2 2A- + C2 = 2C- + A2
由此得出正确结论是( )
(A)A-、B-、C-、D-中C-还原性最强
(B)A2、B2、C2、D2中C2的氧化性最弱
(C)2C-+B2 = 2B-+ C2不能发生
(D)还原性A->B -
C
4. PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱,下列反应在水溶液中不可能发生的是
A.Cu+2Fe3+===Cu2++2Fe2+
C.2Fe2++Cl2===2Fe3++2Cl-
√
氧化剂氧化性:PbO2>KMnO4>Cl2>FeCl3>Cu2+
↓ ↓ ↓ ↓ ↓
还原产物的还原性:Pb2+<Mn2+<Cl-<Fe2+<Cu,
(2)同一氧化剂与多种还原剂混合时,还原性强的先被氧化。例如,已知还原性:I->Fe2+>Br-,当把氯气通入FeBr2溶液时,氯气的量不足时首先氧化Fe2+;把氯气通入FeI2溶液时,氯气的量不足时首先氧化I-。
同一还原剂与多种氧化剂混合时,氧化性强的先被还原。例如,在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性:Fe3+>Cu2+>H+,所以铁粉先与Fe3+反应,然后再依次与Cu2+、H+反应。
结论:氧化还原反应中,强者优先。
[例3] 在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先被置换出来的是
A.Mg B.Cu C.Ag D.H2
√
阳离子的氧化性强弱顺序为Ag+>Cu2+>H+>Zn2+>Mg2+,把锌粉加入Cu(NO3)2、Mg(NO3)2和AgNO3的混合溶液中,锌先与AgNO3反应置换出Ag,然后与Cu(NO3)2反应置换出Cu,锌粉不能与溶液中的Mg(NO3)2发生反应。
1.已知还原性:SO2>I->Fe2+,下列离子反应不正确的是
B.I2+2Fe2+===2I-+2Fe3+
D.少量Cl2通入FeI2溶液中:Cl2+2I-===2Cl-+I2
√
反应I2+2Fe2+===2I-+2Fe3+中,Fe2+为还原剂,I-为还原产物,还原性:Fe2+>I-,与题给信息相悖,反应不能发生,B错误。
课堂检测
2.已知下列反应: ①Cl2+2NaBr===2NaCl+Br2
②2KI+Br2===2KBr+I2 ③Na2S+I2===2NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是_________________。
S2->I->Br->Cl-
根据同一氧化还原反应中还原剂的还原性强于还原产物的还原性,由反应①知还原性:Br->Cl-,由反应②知还原性:I->Br-,由反应③知还原性:S2->I-,即还原性:S2->I->Br->Cl-。
Cl2>Br2>I2>S
根据同一氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,由①得氧化性:Cl2>Br2,由②得氧化性:Br2>I2,由③得氧化性:I2>S,故氧化性由强到弱的顺序为Cl2>Br2>I2>S。
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是_____________。
(3)判断Cl2与Na2S能否反应?____(填“能”或“否”)。
能
由(2)知氧化性:Cl2>S,故Cl2与Na2S能发生反应:Cl2+Na2S===2NaCl+S↓。
(4)判断I2与NaBr能否共存?____(填“能”或“否”)。
能
由(2)知氧化性:Br2>I2,故I2与NaBr不能反应,则I2与NaBr能共存。
3.在常温下发生下列反应:
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,下列结论错误的是
A.溶液中可发生反应:Z2+2A2+===2A3++2Z-
B.Z2在①③反应中均为还原剂
√
的氧化性强于Z2
B2的氧化性强于A3+
Z2的氧化性强于B2
4.在稀硫酸中几种离子的转化关系如图所示。下列说法正确的是
A.反应1中氧化剂为Mn3+
B.氧化性:Ce4+>Fe3+>I2>Mn3+
C.反应2的氧化剂为Mn3+,还原产物为Fe3+
D.推测可发生反应:2Mn3++2I-===I2+2Mn2+
√
反应1中,Mn2+转化为Mn3+,锰元素化合
价升高,Mn2+是还原剂,Mn3+是氧化产
物,A错误;
反应1中Ce4+是氧化剂,Mn3+是氧化产物,反应2中Mn3+是氧化剂,Fe3+是氧化产物,反应3中Fe3+是氧化剂,I2是氧化产物,而氧化剂的氧化性大于氧化产物的氧化性,则氧化性:Ce4+>Mn3+>Fe3+>I2,B错误;
氧化剂具有氧化性,元素化合价降低,得到还原产物,还原剂具有还原性,元素化合价升高,得到氧化产物,反应2的氧化剂为Mn3+,还原产物为Mn2+,C错误;
由选项B可知,氧化性:Ce4+>Mn3+>Fe3+>I2,推测可发生反应:2Mn3++2I-===I2+2Mn2+,D正确。
